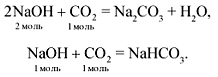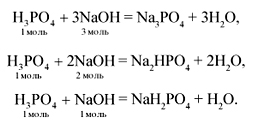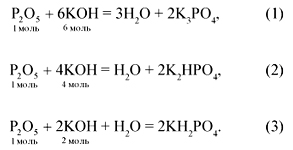Задачи на кислые и средние соли — это разновидность задач на альтернативные реакции, в которых в зависимости от соотношения количества вещества реагентов возможно протекание разных реакций и образование различных продуктов.
При взаимодействии щелочей с кислотными оксидами многоосновных кислот, либо с многоосновными кислотами возможно образование кислых или средних солей.
При избытке щелочи образуется средняя соль. При избытке кислоты или кислотного оксида образуется кислая соль. При этом возможно одновременное образование и кислой, и средней соли.
Рассмотрим взаимодействие углекислого газа и гидроксида натрия. При избытке гидроксида натрия образуется средняя соль и вода:
2NaOH(изб.) + CO2 = Na2CO3 + H2O (1)
При избытке углекислого газа образуется только кислая соль:
NaOH + CO2(изб.) = NaНCO3 (2)
Два варианта химических реакций, но пять возможных ситуаций расчетных задач с этими реакциями.
Отличительная особенность таких задач: при решении зачастую необходимо сравнить количества вещества реагентов, чтобы понять, какая именно (или какие) реакции протекают.
Ситуация 1. Избыток щелочи n(NaOH):n(CO2) > 2:1.
Например. Смешали 8 моль гидроксида натрия и 3 моль углекислого газа.
Соотношение n(NaOH):n(CO2) = 8:3 > 2:1
Количество вещества щелочи более чем в два раза больше, чем количество вещества углекислого газа. Тогда протекает реакция 1:
2NaOH(изб.) + CO2 = Na2CO3 + H2O
Гидроксид натрия в избытке, расчет ведем по недостатку, углекислому газу. В реакцию вступит 3 моль углекислого газа, и 6 моль гидроксида натрия:
nпрореаг.(NaOH) = 2n(CO2) = 6 моль
При этом образуются карбонат натрия и вода:
n(Na2CO3) = n(СO2) = 3 моль
При этом остается гидроксид натрия:
nост.(NaOH) = 8 — 6 = 2 моль
Таким образом, после полного протекания реакции в системе присутствуют:
n(Na2CO3) = n(H2O) = 3 моль, n(NaOH) = 2 моль
Ситуация 2. Эквимолярное соотношение гидроксида натрия и углекислого газа n(NaOH):n(CO2) = 2:1
Например. Смешали 6 моль гидроксида натрия и 3 моль углекислого газа.
Соотношение n(NaOH):n(CO2) = 2:1
Количество вещества щелочи ровно в два раза больше, чем количество вещества углекислого газа. Тогда протекает реакция 1:
2NaOH(изб.) + CO2 = Na2CO3 + H2O
При эквимолярном соотношении реагентов оба реагента вступают в реакцию полностью. То есть ни один из реагентов ни в избытке, ни в недостатке. При этом образуются карбонат натрия и вода:
n(Na2CO3) = n(H2O) = n(СO2) = 1/2n(NaOH) = 3 моль
Таким образом, после полного протекания реакции в системе присутствуют:
n(Na2CO3) = n(H2O) = 3 моль
Ситуация 3. Избыток углекислого газа n(NaOH):n(CO2) > 1:1.
Например. Смешали 3 моль гидроксида натрия и 4 моль углекислого газа.
Соотношение n(NaOH):n(CO2) = 3:4 > 1:1
Количество вещества углекислого газа больше, чем количество вещества щелочи. Тогда протекает реакция 2:
NaOH + CO2(изб.) = NaHCO3
Углекислый газ в избытке, расчет ведем по недостатку, по гидроксиду натрия. В реакцию вступит 3 моль гидроксида натрия, и 3 моль углекислого газа:
nпрореаг.(СО2) = n(NaOH) = 3 моль
При этом образуется гидрокарбонат натрия:
n(NaHCO3) = n(NaOH) = 3 моль
При этом остается углекислый газ:
nост.(СО2) = 4 — 3 = 1 моль
Таким образом, после полного протекания реакции в системе присутствуют:
n(NaHCO3) = 3 моль, n(СO2) = 1 моль
Ситуация 4. Эквимолярное соотношение гидроксида натрия и углекислого газа n(NaOH):n(CO2) = 1:1
Например. Смешали 3 моль гидроксида натрия и 3 моль углекислого газа.
Соотношение n(NaOH):n(CO2) = 1:1
Количество вещества щелочи равно количеству вещества углекислого газа. Тогда протекает реакция 2:
NaOH + CO2(изб.)= NaHCO3
При эквимолярном соотношении реагентов оба реагента вступают в реакцию полностью. То есть ни один из реагентов ни в избытке, ни в недостатке. При этом образуется гидрокарбонат натрия:
n(NaHCO3) = n(СO2) = (NaOH) = 3 моль
Таким образом, после полного протекания реакции в системе присутствует:
n(NaHCO3) = 3 моль
Ситуации 1-4 — довольно стандартные. И, по сути, отличаются от обычных расчетных задач на избыток-недостаток только тем, что нужно определить, какая именно из двух реакций протекает. Ситуация 5 принципиально отличается.
Ситуация 5. Соотношение 1:1 < n(NaOH):n(CO2) < 2:1.
Например. Смешали 4 моль гидроксида натрия и 3 моль углекислого газа.
Соотношение n(NaOH):n(CO2) = 4:3, 1:1 < 4:3 < 2:1.
В такой ситуации образуются и карбонат натрия, и гидрокарбонат.
Решить такую задачу можно двумя способами — расчет через последовательно протекающие реакции и расчет через параллельно идущие реакции.
Метод последовательных реакций:
Пусть протекает реакция 1:
2NaOH + CO2 = Na2CO3 + H2O
Углекислый газ в избытке, расчет ведем по недостатку, по гидроксиду натрия. В реакцию вступит 4 моль гидроксида натрия, и 2 моль углекислого газа:
nпрореаг.(СО2) = 1/2n(NaOH) = 2 моль
При этом образуются карбонат натрия и вода:
n(Na2CO3) = 1/2n(NaOH) = 2 моль
Остается углекислый газ:
nост.(СО2) = 3 — 2 = 1 моль
Таким образом, после полного протекания реакции (1) в системе присутствуют:
n(Na2CO3) = n(H2O) = 2 моль, n(СO2) = 1 моль
Однако, оставшиеся вещества вступают в реакцию с образованием кислой соли:
Na2CO3 + H2O + СО2 = 2NaHCO3
При этом углекислый газ в недостатке, карбонат натрия в избытке. В реакцию вступают карбонат натрия:
nпрореаг.(Na2СО3) = n(CO2) = 1 моль
Образуется гидрокарбонат натрия:
n(NaHCO3) = 2n(CO2) = 2 моль,
Остается карбонат натрия:
nост.(Na2СО3) = 2 — 1 = 1 моль
Таким образом, после полного протекания последней реакции в системе присутствуют:
n(Na2CO3) = 1 моль, n(NaHСO3) = 2 моль
Метод параллельно идущих реакций:
Пусть одновременно протекают реакции (1) и (2):
2NaOH + CO2 = Na2CO3 + H2O (1)
NaOH + CO2 = NaНCO3 (2)
Пусть в первую реакцию вступает х моль СО2, во вторую реакцию у моль СО2.
Тогда в первую реакцию вступают 2х моль гидроксида натрия, во вторую реакцию у моль гидроксида натрия.
Получаем систему уравнений:
2х + y = 4
x + y = 3
Отсюда: x = 1 моль, у = 2 моль
n(Na2CO3) = 1/2n1(NaOH) = n1(CO2) = 1 моль
n(NaHCO3) = n2(NaOH) = n2(CO2) = 2 моль
Как видно, ответ не зависит от выбранного способа решения.
Примеры задач на кислые и средние соли из ЕГЭ по химии.
1. Через 228 г 3%-ного раствора гидроксида бария пропустили 1,21 л углекислого газа (н.у.), при этом углекислый газ поглотился полностью. Выпавший осадок отделили, а к оставшемуся раствору добавили 49 г 5%-ного раствора серной кислоты. Найдите массовую долю кислоты в образовавшемся растворе.
CO2 + Ba(OH)2 = BaCO3 + H2O
BaCO3 + CO2 + H2O = Ba(HCO3)2
Ba(HCO3)2 + H2SO4 = BaSO4 + 2CO2 + 2H2O
Ответ: w(H2SO4) = 0,4%
2. Газ, образовавшийся при гидролизе 36,4 г фосфида кальция, сожгли. К образовавшемуся при этом продукту последовательно добавили 100 мл воды и 50 мл раствора гидроксида натрия с массовой долей 25% и плотностью 1,28 г/см3. Определите состав образовавшейся соли и её массовую долю в растворе.
Ca3P2 + 6H2O = 3Ca(OH)2 + 2PH3
PH3 + 2O2 = H3PO4
H3PO4 + NaOH = NaH2PO4 + H2O
Ответ: w(NaH2PO4) = 23,6%
3. При растворении 9,4 г оксида калия в воде получили раствор с массовой долей вещества 20%. К этому раствору добавили 98 г 20%-ного раствора серной кислоты. Определите массовую долю соли в полученном растворе.
K2O + H2O = 2KOH
KOH + H2SO4 = KHSO4 + H2O
Ответ: w(KHSO4) = 17,66%
4. При растворении 30,6 г оксида бария в воде получили раствор с массовой долей вещества 5%. К этому раствору добавили 98 г 40%-ного раствора ортофосфорной кислоты. Определите массовую долю соли в полученном растворе.
BaO + H2O = Ba(OH)2
Ba(OH)2 + 2H3PO4 = Ba(H2PO4)2 + 2H2O
Ответ: w(Ba(H2PO4)2) = 8,465%
5. Газ, выделившийся при гидролизе 21 г нитрида лития, поглотили 545 мл 10%-ного раствора серной кислоты (плотностью 1,08 г/мл). Определите массовую долю соли в полученном растворе.
Li3N + 3H2O = 3LiOH + NH3
NH3 + H2SO4 = NH4HSO4
Ответ: w(NH4HSO4) = 11,52%
6. При растворении пероксида лития Li2O2 в тёплой воде выделяется кислород. Определите массовую долю гидроксида лития в растворе, полученном растворением 2,3 г пероксида лития в 62 г воды. Какой максимальный объём углекислого газа (н.у.) может быть поглощён получившейся щёлочью?
2Li2O2 + 2H2O = 4LiOH + O2
LiOH + CO2 = LiHCO3
Ответ: w(LiOH) = 3,8%, V(CO2) = 2,24 л
7. В 880 г 4%-ной серной кислоты растворили 16 г оксида серы(VI). К полученному раствору добавили 11,2 г гидроксида калия. Определите массу образовавшейся соли.
SO3 + H2O = H2SO4
H2SO4 + KOH = KHSO4 + H2O
Ответ: m(KHSO4) = 27,2 г
8. Серу массой 6,4 г сожгли в избытке кислорода. Полученный газ пропустили через 138 мл 8%-ного раствора гидроксида натрия (плотностью 1,087 г/мл). Определите массовые доли солей в полученном растворе.
S + O2 = SO2
SO2 + 2NaOH = Na2SO3 + H2O
Na2SO3 + SO2 + H2O = 2NaHSO3
Ответ: w(Na2SO3) = 7,74%, w(NaHSO3) = 6,39%
9. Фосфор массой 1,55 г сожгли в избытке кислорода. Образовавшееся при этом вещество растворили в воде и полученный раствор прокипятили. К полученному раствору добавили 3,7 л 0,1%-ного раствора гидроксида кальция (плотностью 1 г/мл). Определите массу образовавшейся соли.
4P + 5O2 = 2P2O5
P2O5 + 3H2O = 2H3PO4
H3PO4 + Ca(OH)2 = CaHPO4 + 2H2O
Ответ: m(CaHPO4) = 6,8 г
10. Технический сульфат аммония массой 2,04 г, содержащий 3% примесей, нагревают с твёрдым гидроксидом натрия массой 1,6 г. Выделившийся в результате газ поглотили 29,4 г раствора с массовой долей фосфорной кислоты 10%. Вычислите массовую долю соли в образовавшемся растворе.
(NH4)2SO4 + 2NaOH = 2NH3 + Na2SO4 + 2H2O
H3PO4 + NH3 = NH4H2PO4
Ответ: w(NH4H2PO4) = 11,53%
11. В 250 мл воды растворили 13,8 г натрия, затем добавили 50 г 59%-ного раствора ортофосфорной кислоты. Определите массовую долю соли в полученном растворе.
2Na + 2H2O = 2NaOH + H2
H3PO4 + 2NaOH = Na2HPO4 + 2H2O
Ответ: w(Na2HPO4) = 13,6%
12. Оксид фосфора(V) массой 2,84 г растворили в 120 г раствора ортофосфорной кислоты с массовой долей 9% и полученный раствор прокипятили. К полученному раствору добавили 30 г 20%-ного раствора гидроксида натрия. Вычислите массовую долю соли в конечном растворе.
P2O5 + 3H2O = 2H3PO4
H3PO4 + NaOH = NaH2PO4 + H2O
Ответ: w(NaH2PO4) = 11,8%
13. При растворении пероксида лития Li2O2 в тёплой воде образуется гидроксид лития и выделяется газ. Раствором, полученным при действии 2,3 г пероксида лития на 62 г воды, поглотили 2,24 л (н.у.) углекислого газа. Вычислите массовую долю соли в полученном растворе.
2Li2O2 + 2H2O = 4LiOH + O2
LiOH + CO2 = LiHCO3
Ответ: w(LiHCO3) = 10,01%
14. Газ, выделившийся при гидролизе 16 г карбида кальция, сожгли. Газообразный продукт сгорания пропустили через 200 г 7%-ного раствора гидроксида калия. Найдите массу образовавшейся соли.
CaC2 + 2H2O = Ca(OH)2 + C2H2
2C2H2 + 5O2 = 4CO2 + 2H2O
CO2 + KOH = KHCO3
Ответ: m(KHCO3) = 25 г
15. 19,6 г оксида углерода(II) сожгли. Продукт сгорания полностью поглотили 420 г 10,5%-ного раствора гидроксида натрия. Найдите массовую долю веществ в полученном растворе.
2CO + O2 = 2CO2
CO2 + 2NaOH = Na2CO3 + H2O
Na2CO3 + CO2 + H2O = 2NaHCO3
Ответ: w(Na2CO3) = 9,4%, w(NaHCO3) = 5,6%
16. Образец натрия массой 0,92 г растворили в воде. Какую массу 10%‑ного раствора ортофосфорной кислоты нужно добавить к образовавшемуся раствору для получения гидроортофосфата натрия?
2Na + 2H2O = 2NaOH + H2
2NaOH + H3PO4 = Na2HPO4 + 2H2O
Ответ: m(раствора H3PO4) = 19,6 г
17. Смешали 120 г 4,1%-ного раствора ортофосфорной кислоты и 28 г 10%-ного раствора гидроксида калия. Найдите массу образовавшейся соли.
H3PO4 + KOH = KH2PO4 + H2O
Ответ: m(KH2PO4) = 6,8 г
18. Углекислый газ объёмом 560 мл (н.у.) полностью поглотили 1000 г раствора гидроксида кальция с массовой долей 0,15%. Найдите массу образовавшегося осадка и массовую долю соли в растворе.
Ca(OH)2 + CO2 = CaCO3 + H2O
CaCO3 + H2O + CO2 = Ca(HCO3)2
Ответ: m(CaCO3) = 1,5 г, w(Ca(HCO3)2) = 0,08%
19. В избытке кислорода сожгли 8 г серы. Полученный газ пропустили через 200 г 8%-ного раствора гидроксида натрия. Определите массовые доли солей в полученном растворе.
S + O2 = SO2
SO2 + 2NaOH = Na2SO3 + H2O
Na2SO3 + SO2 + H2O = 2NaHSO3
Ответ: w(NaHSO3) = 4,8%, w(Na2SO3) = 8,75%
- Задачи на растворимость:
- Базовые знания (2 шт)
- Безводные соли (3 шт)
- Кристаллогидраты (4 шт)
- Задачи на кислые соли:
- Задачи (6 шт)
- Задачи на кристаллогидраты:
- Задача 1.
- Задача 2.
- Задача 3.
- Задача 4.
- Задачи на массовую долю и избыток-недостаток:
- Задача 1.
- Задача 2.
Задача 1. 16 г оксида серы (VI) растворили в 50 г 19,6% -ного раствора серной кислоты. В полученный раствор прибавили 16 г гидроксида натрия. Определите массу образовавшейся соли (солей).
Источник: В.Н, Доронькин, Неорганическая Химия, Тренировочная тетрадь, стр. 29.
Ответ: m(NaHSO4) = 24 г, m(Na2SO4) = 14,2 г.
Решение (pdf файл)
Задача 2. Газ, полученный при взаимодействии 17,6 г сульфида железа (II) с избытком раствора серной кислоты, без остатка прореагировал с 138 мл 8% -ного раствора NaOH (плотность 1,087 г/мл). Определите состав полученного раствора и рассчитайте массовые доли веществ в этом растворе.
Источник: В.Н, Доронькин, Неорганическая Химия, Тренировочная тетрадь, стр. 28.
Ответ: w(NaHS) = 3,57% и w(Na2S) = 4,97%.
Решение (pdf файл)
Задача 3. Углекислый газ объемом 5,6 л (н.у.) пропустили через 164 мл 20%-ного раствора гидроксида натрия (плотность 1,22 г/мл). Определите состав и массовые доли веществ в полученном растворе.
Источник: Я сдам ЕГЭ, Типовые задания, 2018 г, А.А. Каверина, стр. 207.
Ответ: w(Na2CO3) = 12,6%, w(NaOH) = 9,48%.
Решение (pdf файл)
Задача 4. В 250 мл воды растворили 13,8 г натрия, затем добавили 50 г 59%-ного раствора ортофосфорной кислоты. Определите массовую долю соли в полученном растворе.
Источник: Я сдам ЕГЭ. Типовые задания, 2018 г, А.А. Каверина, стр. 207.
Ответ: w(Na2HPO4) = 13,6%.
Решение (pdf файл)
Задача 5. При гидролизе 7,28 г фосфида кальция образовался газ, который сожгли в избытке кислорода. Полученный оксид растворили в 41,65 мл 20% гидроксида калия (плотность 1,21 г/мл). Определите массы веществ (за исключением воды) в образующемся растворе.
Источник: В.Н. Доронькин, «Неорганическая химия», Тренировочная тетрадь, стр. 48.
Ответ: m(K2HPO4) = 10,44 г, m(K3PO4) = 4,24 г.
Решение (pdf файл)
Задача 6. Оксид фосфора (V) массой 2,84 г растворили в 60 г 18%-ной ортофосфорной кислоты и полученный раствор прокипятили. Какая соль и в каком количестве образуется, если к полученному раствору добавить 30 г гидроксида натрия?
Источник: В.Н. Доронькин, «Неорганическая химия», Тренировочная тетрадь, стр. 49.
Ответ: m(Na3PO4) = 24,6 г.
Решение (pdf файл)
Пройти тестирование по этим заданиям
Вернуться к каталогу заданий
Версия для печати и копирования в MS Word
1
Задания Д23 № 90
Установите соответствие между названием соли и ее отношением к гидролизу: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Название соли
А) Бромид хрома (III)
Б) Карбонат лития
В) Сульфат железа (II)
Г) Ацетат алюминия
Отношение к гидролизу
1) Гидролизуется по катиону
2) Гидролизуется по аниону
3) Гидролизуется и по катиону, и по аниону
4) Не гидролизуется
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Источник: Яндекс: Тренировочная работа ЕГЭ по химии. Вариант 1.
2
Задания Д23 № 133
Установите соответствие между формулой соли и типом ее гидролиза в водном растворе: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Тип гидролиза
1) Не гидролизуется
2) Гидролизуется по катиону
3) Гидролизуется по аниону
4) Гидролизуется и по катиону, и по аниону
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Источник: Яндекс: Тренировочная работа ЕГЭ по химии. Вариант 2.
3
Задания Д23 № 219
Установите соответствие между названием соли и отношением её к гидролизу: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
НАЗВАНИЕ СОЛИ
A) нитрат натрия
Б) фосфат натрия
B) сульфид калия
Г) нитрат алюминия
ОТНОШЕНИЕ К ГИДРОЛИЗУ
1) гидролизуется по катиону
2) гидролизуется по аниону
3) гидролизуется по катиону и аниону
4) не гидролизуется
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
4
Задания Д23 № 262
Установите соответствие между формулой соли и отношением ее к гидролизу: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ОТНОШЕНИЕ К ГИДРОЛИЗУ
1) гидролизуется по катиону
2) гидролизуется по аниону
3) гидролизуется по катиону и аниону
4) не гидролизуется
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
5
Задания Д23 № 305
Установите соответствие между солью и её отношением к гидролизу: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ОТНОШЕНИЕ К ГИДРОЛИЗУ
1) гидролизуется по катиону
2) гидролизуется по аниону
3) гидролизуется по катиону и аниону
4) не гидролизуется
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Пройти тестирование по этим заданиям
Тематический тест на химические свойства солей.
Задание №1
Из предложенного списка соединений выберите те, которые относятся к солям. Число верных ответов может быть любым.
- 1. KOH
- 2. NaBr
- 3. ZnO
- 4. KHCO3
- 5. NaHS
Решение
Ответ: 245
Задание №2
Из предложенного списка соединений выберите те, которые не относятся к солям. Число верных ответов может быть любым.
- 1. Ba(ClO)Cl
- 2. Fe(OH)SO4
- 3. Cu2O
- 4. (CuOH)2CO3
- 5. BeSO4
Решение
Ответ: 3
Задание №3
Из предложенного списка соединений выберите те, которые относятся к солям. Число верных ответов может быть любым.
- 1. ZnS
- 2. Cr(OH)Cl2
- 3. K2CrO4
- 4. CrO3
- 5. BaO
Решение
Ответ: 123
Задание №4
Из предложенного списка соединений выберите те, которые не относятся к солям. Число верных ответов может быть любым.
- 1. LiNO3
- 2. K2[Zn(OH)4]
- 3. NaAlO2
- 4. Al2O3
- 5. Na[Al(OH)4]
Решение
Ответ: 4
Задание №5
Из предложенного списка соединений выберите те, которые относятся к солям. Число верных ответов может быть любым.
- 1. KFe(SO4)2
- 2. Cr(OH)3
- 3. H2SO4
- 4. CsFeO2
- 5. PbO2
Решение
Ответ: 14
Задание №6
Из предложенного списка солей выберите те, которые реагируют с соляной кислотой. Число верных ответов может быть любым.
- 1. AgNO3
- 2. KBr
- 3. ZnS
- 4. FeI2
- 5. K2SO4
Решение
Ответ: 13
Задание №7
Из предложенного списка солей выберите те, которые реагируют с разбавленной серной кислотой. Число верных ответов может быть любым.
- 1. Fe(NO3)3
- 2. CaCO3
- 3. K2SO3
- 4. BaCl2
- 5. RbNO3
Решение
Ответ: 234
Задание №8
Из предложенного списка солей выберите те, которые реагируют с сероводородной кислотой. Число верных ответов может быть любым.
- 1. CuCl2
- 2. FeCl2
- 3. Pb(NO3)2
- 4. AgF
- 5. ZnSO4
Решение
Ответ: 134
Задание №9
Из предложенного списка солей выберите те, которые реагируют с иодоводородной кислотой. Число верных ответов может быть любым.
- 1. FeCO3
- 2. Pb(NO3)2
- 3. KHCO3
- 4. NaBr
- 5. K2SO4
Решение
Ответ: 123
Задание №10
Из предложенного списка солей выберите те, которые реагируют с азотной кислотой. Число верных ответов может быть любым.
- 1. BaSO3
- 2. AgCl
- 3. KCl
- 4. Fe(NO3)3
- 5. CuSO4
Решение
Ответ: 1
[adsp-pro-3]
Задание №11
Из предложенного списка солей выберите те, которые реагируют с серебром. Число верных ответов может быть любым.
1) сульфат меди
2) нитрат ртути (II)
3) хлорид золота (III)
4) бромид бария
5) сульфат цинка
Решение
Ответ: 3
Задание №12
Из предложенного списка солей выберите те, которые не реагируют с медью. Число верных ответов может быть любым.
1) хлорид железа(II)
2) нитрат серебра
3) хлорид железа(III)
4) сульфид калия
5) нитрат цинка
Решение
Ответ: 145
Задание №13
Из предложенного списка солей выберите те, которые реагируют с железом. Число верных ответов может быть любым.
1) бромид меди(II)
2) хлорид железа(III)
3) нитрат серебра
4) нитрат свинца
5) сульфит натрия
Решение
Ответ: 1234
Задание №14
Из предложенного списка солей выберите те, которые не реагируют с цинком. Число верных ответов может быть любым.
1) нитрит калия
2) бромид железа (III)
3) хлорид золота (III)
4) сульфат меди
5) карбонат цезия
Решение
Ответ: 15
Задание №15
Из предложенного списка солей выберите те, которые реагируют с магнием. Число верных ответов может быть любым.
1) сульфат цинка
2) хлорид бария
3) нитрат висмута
4) сульфид лития
5) фторид калия
Решение
Ответ: 13
Задание №16
Из предложенного списка солей выберите две, которые разлагаются при нагревании с выделением газа.
- 1. K2SO4
- 2. NH4HCO3
- 3. NaCl
- 4. KI
- 5. CaCO3
Решение
Ответ: 25
Задание №17
Из предложенного списка солей выберите две, которые разлагаются при нагревании с выделением газа.
- 1. (NH4)2Cr2O7
- 2. BaBr2
- 3. ZnS
- 4. FeCO3
- 5. PbS
Решение
Ответ: 14
Задание №18
Из предложенного списка солей выберите две, которые разлагаются при нагревании с выделением газа.
- 1. NH4NO3
- 2. Na2SO4
- 3. FeBr2
- 4. K3PO4
- 5. NaHCO3
Решение
Ответ: 15
Задание №19
Из предложенного списка солей выберите две, которые разлагаются при нагревании с выделением газа.
- 1. BaCO3
- 2. K2CO3
- 3. NH4NO2
- 4. CsCl
- 5. FeCl2
Решение
Ответ: 13
Задание №20
Из предложенного списка солей выберите две, которые разлагаются при нагревании с выделением газа.
- 1. SrS
- 2. ZnCO3
- 3. K2SO4
- 4. CrBr3
- 5. (CuOH)2CO3
Решение
Ответ: 25
[adsp-pro-3]
Задание №21
Из предложенного списка солей выберите две, которые реагируют с гидроксидом стронция.
- 1. NaCl
- 2. K2SO4
- 3. NaF
- 4. ZnCO3
- 5. BaCl2
Решение
Ответ: 23
Задание №22
Из предложенного списка солей выберите две, которые реагируют с гидроксидом цезия.
- 1. NH4Cl
- 2. K2SO4
- 3. Cr(NO3)3
- 4. BaSO4
- 5. FeS
Решение
Ответ: 13
Задание №23
Из предложенного списка солей выберите две, которые реагируют с гидроксидом рубидия.
- 1. KI
- 2. ZnSO4
- 3. AgCl
- 4. CaCO3
- 5. NH4F
Решение
Ответ: 25
Задание №24
Из предложенного списка солей выберите две, которые реагируют с гидроксидом лития.
- 1. K2SO4
- 2. Pb(NO3)2
- 3. CaBr2
- 4. Na3PO4
- 5. Ag2S
Решение
Ответ: 24
Задание №25
Из предложенного списка солей выберите две, которые реагируют с гидроксидом бария.
- 1. CuSO4
- 2. NaCl
- 3. MgSO4
- 4. SrSO4
- 5. RbI
Решение
Ответ: 13
Задание №26
Из предложенного списка веществ выберите два, которые реагируют с гидрокарбонатом натрия.
1) едкое кали
2) сульфид цинка
3) хлорид железа(III)
4) кальцинированная сода
5) сульфат калия
Решение
Ответ: 13
Задание №27
Из предложенного списка веществ выберите два, которые реагируют с гидрокарбонатом калия.
1) хлорид аммония
2) кислород
3) соляная кислота
4) иодид алюминия
5) оксид углерода (II)
Решение
Ответ: 34
Задание №28
Из предложенного списка веществ выберите два, которые реагируют с гидрокарбонатом аммония.
1) гидроксид цезия
2) сульфат хрома (III)
3) хлорид калия
4) углекислый газ
5) водород
Решение
Ответ: 12
Задание №29
Из предложенного списка веществ выберите два, которые реагируют с гидросульфидом лития.
1) сероводород
2) соляная кислота
3) хлорид калия
4) гидроксид калия
5) угарный газ
Решение
Ответ: 24
Задание №30
Из предложенного списка веществ выберите два, которые реагируют с гидрокарбонатом кальция.
1) оксид азота(II)
2) гашеная известь
3) сульфат бария
4) нитрат железа(III)
5) оксид азота(I)
Решение
Ответ: 24
[adsp-pro-3]
Задание №31
Из предложенного списка веществ выберите два, которые реагируют с тетрагидроксоалюминатом лития.
- 1. NO
- 2. CO
- 3. CO2
- 4. K3PO4
- 5. SiO2
Решение
Ответ: 34
Задание №32
Из предложенного списка веществ выберите два, которые реагируют с тетрагидроксоцинкатом натрия.
- 1. H2S
- 2. KOH
- 3. LiCl
- 4. BaSO4
- 5. CO2
Решение
Ответ: 15
Задание №33
Из предложенного списка веществ выберите два, которые реагируют с гексагидроксохроматом(III) калия.
- 1. Fe(OH)3
- 2. KOH
- 3. SO2
- 4. CO
- 5. CO2
Решение
Ответ: 35
Задание №34
Из предложенного списка веществ выберите два, которые реагируют с тетрагидроксоцинкатом бария.
- 1. KOH
- 2. Na2SO4
- 3. SrSO4
- 4. HNO3
- 5. FeO
Решение
Ответ: 24
Задание №35
Из предложенного списка веществ выберите два, которые реагируют с тетрагидроксоалюминатом цезия.
- 1. BeO
- 2. H2SO4
- 3. SiO2
- 4. H2
- 5. SO2
Решение
Ответ: 25
Задание №36
Из приведенного перечня выберите пару реагентов, между которыми возможно химическое взаимодействие
1) нитрат свинца + углекислый газ
2) нитрат аммония + едкий натр
3) нитрат калия + сульфат аммония
4) нитрат серебра + платина
5) нитрат цинка + карбонат бария
Впишите в поле ответа уравнение происходящей реакции, используя в качестве разделителя левой и правой частей знак равенства
Решение
Ответ: NH4NO3 + NaOH = NaNO3 + NH3 + H2O
Задание №37
Из приведенного перечня выберите пару реагентов, между которыми возможно химическое взаимодействие
1) хлорид калия + нитрат натрия
2) бромид лития + цинк
3) иодид свинца + гидроксид калия
4) фторид аммония + гидроксид лития
5) хлорид серебра + сульфид натрия
Впишите в поле ответа уравнение происходящей реакции, используя в качестве разделителя левой и правой частей знак равенства
Решение
Ответ: NH4F + LiOH = LiF + NH3 + H2O
Задание №38
Из приведенного перечня выберите пару реагентов, между которыми возможно химическое взаимодействие
1) карбонат цинка + едкое кали
2) гидрокарбонат натрия + гидроксид натрия
3) карбонат аммония + сульфат натрия
4) гидрокарбонат кальция + углекислый газ
5) карбонат свинца + угарный газ
Впишите в поле ответа уравнение происходящей реакции, используя в качестве разделителя левой и правой частей знак равенства
Решение
Ответ: NaHCO3 + NaOH = Na2CO3 + H2O
Задание №39
Из приведенного перечня выберите пару реагентов, между которыми возможно химическое взаимодействие
1) сульфид натрия + соляная кислота
2) сульфид свинца + бромоводородная кислота
3) сульфид серебра + разбавленная серная кислота
4) сульфит натрия + гидроксид калия
5) сульфат цинка + нитрат меди
Впишите в поле ответа уравнение происходящей реакции, используя в качестве разделителя левой и правой частей знак равенства
Решение
Ответ: Na2S + 2HCl = 2NaCl + H2S
Задание №40
Из приведенного перечня выберите пару реагентов, между которыми возможно химическое взаимодействие
1) тетрагидроксоалюминат калия + угарный газ
2) тетрагидроксоцинкат натрия + веселящий газ
3) тетрагидроксоалюминат лития + сероводород
4) тетрагидроксоцинкат цезия + водород
5) тетрагидроксоалюминат рубидия + кислород
Впишите в поле ответа уравнение происходящей реакции, используя в качестве разделителя левой и правой частей знак равенства
Решение
Ответ: Li[Al(OH)4] + H2S = LiHS + Al(OH)3 + H2O
[adsp-pro-3]
Задание №41
В заданной схеме превращений
Fe(NO3)2 FeS
FeCl2
веществами X и Y, необходимыми для последовательного осуществления превращений, являются соответственно
- 1. H2S
- 2. Na2S
- 3. KCl
- 4. PbCl2
- 5. HCl
Решение
Ответ: 25
Задание №42
В заданной схеме превращений
K2SO4 KCl
KNO3
веществами X и Y, необходимыми для последовательного осуществления превращений, являются соответственно
- 1. BaCl2
- 2. NaCl
- 3. LiNO3
- 4. AgNO3
- 5. Fe(NO3)3
Решение
Ответ: 14
Задание №43
В заданной схеме превращений
Pb(NO3)2 PbS
PbSO4
веществами X и Y, необходимыми для последовательного осуществления превращений, являются соответственно
- 1. H2O
- 2. H2O2
- 3. S
- 4. SO2
- 5. H2S
Решение
Ответ: 52
Задание №44
В заданной схеме превращений
Na[Al(OH)4] AlCl3
Al(NO3)3
веществами X и Y, необходимыми для последовательного осуществления превращений, являются соответственно
- 1. KCl
- 2. HCl
- 3. Cl2
- 4. HNO3
- 5. AgNO3
Решение
Ответ: 25
Задание №45
В заданной схеме превращений
KHCO3 K2CO3
KBr
веществами X и Y, необходимыми для последовательного осуществления превращений, являются соответственно
- 1. O2
- 2. KOH
- 3. KCl
- 4. RbBr
- 5. SrBr2
Решение
Ответ: 25
Задание №46
Запишите уравнение реакции, происходящей при смешении раствора карбоната калия и избытка азотной кислоты. Используйте в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: K2CO3 + 2HNO3 = 2KNO3 + CO2 + H2O
Задание №47
Запишите уравнение реакции, происходящей при смешении раствора питьевой соды и избытка соляной кислоты. Используйте в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: NaHCO3 + HCl = NaCl + CO2 + H2O
Задание №48
Запишите уравнение реакции, происходящей при смешении раствора сульфида лития и избытка соляной кислоты. Используйте в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: Li2S + 2HCl = 2LiCl + H2S
Задание №49
Запишите уравнение реакции, происходящей при смешении раствора гидросульфида аммония и избытка иодоводородной кислоты. Используйте в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: NH4HS + HI = NH4I + H2S
Задание №50
Запишите уравнение реакции, происходящей при смешении раствора гидрофосфата калия и избытка азотной кислоты. Используйте в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: K2HPO4 + 2HNO3 = 2KNO3 + H3PO4
[adsp-pro-3]
Задание №51
Запишите уравнение реакции, происходящей при смешении раствора медного купороса и цинкового порошка. Используйте в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: CuSO4 + Zn = ZnSO4 + Cu
Задание №52
Запишите уравнение реакции, происходящей при смешении раствора хлорного железа и медного порошка. Используйте в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: 2FeCl3 + Cu = 2FeCl2 + CuCl2
Задание №53
Запишите уравнение реакции, происходящей при смешении раствора нитрата серебра и алюминиевой стружки. Используйте в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: 3AgNO3 + Al = Al(NO3)3 +3Ag
Задание №54
Запишите уравнение реакции, происходящей при смешении раствора бромида железа(III) и железных опилок. Используйте в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: 2FeBr3 + Fe = 3FeBr2
Задание №55
Запишите уравнение реакции, происходящей при смешении раствора нитрата свинца и цинкового порошка. Используйте в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: Pb(NO3)2 + Zn = Zn(NO3)2 + Pb
Задание №56
Запишите уравнение реакции, происходящей при термическом разложении питьевой соды. Используйте в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: 2NaHCO3 = Na2CO3 + CO2 + H2O
Задание №57
Запишите уравнение реакции, происходящей при термическом разложении нитрата калия. Используйте в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: 2KNO3 = 2KNO2 + O2
Задание №58
Запишите уравнение реакции, происходящей при термическом разложении нитрата железа(III). Используйте в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: 4Fe(NO3)3 = 2Fe2O3 + 12NO2 + 3O2
Задание №59
Запишите уравнение реакции, происходящей при термическом разложении нитрата меди. Используйте в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: 2Cu(NO3)2 = 2CuO + 4NO2 + O2
Задание №60
Запишите уравнение реакции, происходящей при термическом разложении нитрата серебра. Используйте в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: 2AgNO3 = 2Ag + 2NO2 + O2
[adsp-pro-3]
Задание №61
Запишите уравнение реакции, происходящей при термическом разложении нитрата ртути(II). Используйте в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: Hg(NO3)2 = Hg + 2NO2 + O2
Задание №62
Запишите уравнение реакции, происходящей при термическом разложении нитрата аммония. Используйте в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: NH4NO3 = N2O + 2H2O
Задание №63
Запишите уравнение реакции, происходящей при термическом разложении дихромата аммония. Используйте в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: (NH4)2Cr2O7 = N2 + Cr2O3 + 4H2O
Задание №64
Запишите уравнение реакции, происходящей при термическом разложении нитрита аммония. Используйте в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: NH4NO2 = N2 + 2H2O
Задание №65
Запишите уравнение реакции, происходящей при термическом разложении карбоната магния. Используйте в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: MgCO3 = MgO + CO2
Задание №66
Запишите уравнение реакции, происходящей при пропускании избытка углекислого газа через раствор тетрагидроксоалюмината калия. Используйте в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: K[Al(OH)4] + CO2 = KHCO3 + Al(OH)3
Задание №67
Запишите уравнение реакции, происходящей при пропускании избытка углекислого газа через раствор тетрагидроксоцинката натрия. Используйте в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: Na2[Zn(OH)4] + 2CO2 = 2NaHCO3 + Zn(OH)2
Задание №68
Запишите уравнение реакции, происходящей при пропускании избытка сернистого газа через раствор тетрагидроксоалюмината калия. Используйте в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: K[Al(OH)4] + SO2 = KHSO3 + Al(OH)3
Задание №69
Запишите уравнение реакции, происходящей при пропускании избытка сернистого газа через раствор тетрагидроксоцинката натрия. Используйте в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: Na2[Zn(OH)4] + 2SO2 = 2NaHSO3 + Zn(OH)2
Задание №70
Запишите уравнение реакции, происходящей при пропускании избытка сероводорода через раствор тетрагидроксоалюмината калия. Используйте в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: K[Al(OH)4] + H2S = KHS + Al(OH)3 + H2O
[adsp-pro-3]
Задание №71
Запишите уравнение реакции, происходящей при пропускании избытка сероводорода через раствор тетрагидроксоцинката натрия. Используйте в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: Na2[Zn(OH)4] + 3H2S = 2NaHS + ZnS + 4H2O
Задание №72
Запишите уравнение реакции, происходящей при смешении избытка соляной кислоты и раствора тетрагидроксоалюмината калия. Используйте в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: K[Al(OH)4] + 4HCl = KCl + AlCl3 + 4H2O
Задание №73
Запишите уравнение реакции, происходящей при смешении избытка азотной кислоты и раствора тетрагидроксоцинката натрия. Используйте в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: Na2[Zn(OH)4] + 4HNO3 = 2NaNO3 + Zn(NO3)2 + 4H2O
Задание №74
Запишите уравнение реакции, происходящей при сплавлении поташа с оксидом алюминия. Используйте в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: K2CO3 + Al2O3 = 2KAlO2 + CO2
Задание №75
Запишите уравнение реакции, происходящей при сплавлении кальцинированной соды с оксидом железа(III). Используйте в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: Na2CO3 + Fe2O3 = 2NaFeO2 + CO2
Задание №76
Установите соответствие между веществом и набором реагентов, с каждым из которых оно может взаимодействовать.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
|
А) сульфид натрия Б) нитрат железа(II) В) нитрат серебра |
1) карбонат натрия, гидроксид натрия, азотная кислота 2) водород, кислород, оксид азота(IV) 3) сероводород, соляная кислота, перекись водорода 4) соляная кислота, едкий натр, медь |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 314
Задание №77
Установите соответствие между веществом и набором реагентов, с каждым из которых оно может взаимодействовать.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
|
А) оксид меди (II) Б) сульфат меди В) оксид меди (I) |
1) водород, кислород, соляная кислота 2) водород, медь, иодоводородная кислота 3) магний, гидроксид калия, сероводород 4) цинк, сероводород, серебро |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 231
Задание №78
Установите соответствие между веществом и набором реагентов, с каждым из которых оно может взаимодействовать.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
|
А) гидрокарбонат калия Б) сульфат натрия В) оксид железа (II) |
1) углекислый газ, соляная кислота, вода 2) иодоводородная кислота, водород, угарный газ 3) едкое кали, бромоводородная кислота, гашеная известь 4) хлорид бария, нитрат стронция, иодид кальция |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 342
Задание №79
Установите соответствие между веществом и набором реагентов, с каждым из которых оно может взаимодействовать.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
|
А) азотная кислота Б) тетрагидроксоалюминат натрия В) оксид алюминия |
1) соляная кислота, сероводород, сернистый газ 2) бромоводородная кислота, серная кислота, негашеная известь 3) сера, цинк, оксид бария 4) серная кислота, вода, железо |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 312
Задание №80
Установите соответствие между веществом и набором реагентов, с каждым из которых оно может взаимодействовать.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
|
А) оксид фосфора(III) Б) фосфат калия В) гидроксид цинка |
1) гидроксид натрия, соляная кислота, гидроксид цезия 2) гидроксид рубидия, едкое кали, азот 3) гидроксид калия, перекись водорода, оксид натрия 4) гидроксид лития, нитрат серебра, серная кислота |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 341
[adsp-pro-3]
Задание №81
Установите соответствие между веществом и набором реагентов, с каждым из которых оно может взаимодействовать.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
|
А) угарный газ Б) кальцинированная сода В) хлорное железо |
1) O2, Cu2O, Ag 2) CuO, FeO, O2 3) KOH, Cu, Zn 4) Pb(NO3)2, BaCl2, CaCl2 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 243
Задание №82
Установите соответствие между веществом и набором реагентов, с каждым из которых оно может взаимодействовать.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
|
А) сернистый газ Б) сульфид натрия В) серная кислота |
1) Zn, H2, NO 2) O2, Na2SO3, H2O2 3) HCl, HBr, H2S 4) Zn, CuO, Fe2O3 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 234
Задание №83
Установите соответствие между веществом и набором реагентов, с каждым из которых оно может взаимодействовать.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
|
А) оксид цинка Б) нитрат меди В) бромид калия |
1) AgNO3, Cl2, Pb(NO3)2 2) K2CO3, Cs2S, Zn 3) AgF, H2, Ni 4) HCl, KOH, H2 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 421
Задание №84
Установите соответствие между веществом и набором реагентов, с каждым из которых оно может взаимодействовать.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
|
А) хлорид бария Б) хлорное железо В) оксид железа (II) |
1) серная кислота, бромид калия, сульфид цинка 2) бромоводородная кислота, водород, кислород 3) серная кислота, нитрат серебра, карбонат калия 4) йодоводородная кислота, железо, медь |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 342
Задание №85
Установите соответствие между веществом и набором реагентов, с каждым из которых оно может взаимодействовать.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
|
А) сульфид меди(II) Б) иодид натрия В) бромоводородная кислота |
1) хлор, поташ, оксид алюминия 2) бром, соляная кислота, иодоводородная кислота 3) азотная кислота, кислород, перекись водорода 4) хлорид железа(III), сульфат меди, бром |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 341
Задание №86
Установите соответствие между веществом и набором реагентов, с каждым из которых оно может взаимодействовать.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
|
А) Na2[Zn(OH)4] Б) K3PO4 В) BeO |
1) H2SO4, LiCl, BaCl2 2) HI, RbOH, Cs2O 3) HCl, CO2, H2S 4) HBr, HNO3, H2O |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 312
Задание №87
Установите соответствие между веществом и набором реагентов, с каждым из которых оно может взаимодействовать.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
|
А) Fe(NO3)3 Б) Li2S В) Zn(OH)2 |
1) HCl, AgNO3, K3PO4 2) HBr, HNO3, KOH 3) HNO3, H2, K2SO4 4) K2CO3, Cu, KI |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 412
Задание №88
Установите соответствие между веществом и набором реагентов, с каждым из которых оно может взаимодействовать.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
|
А) FeSO4 Б) Be(OH)2 В) CaCl2 |
1) поташ, нитрат серебра, сульфат калия 2) едкое кали, соляная кислота, плавиковая кислота 3) оксид железа(II), сульфат цинка, фторид натрия 4) гидроксид натрия, хлорид бария, серная кислота (конц.) |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 421
Задание №89
Установите соответствие между веществом и набором реагентов, с каждым из которых оно может взаимодействовать.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
|
А) Ba(OH)2 Б) CuSO4 В) HCl |
1) гидроксид натрия, сульфид цинка, оксид железа(II) 2) фторид натрия, хлорид цезия, фосфат калия 3) хлорид кальция, сероводород, нитрат бария 4) углекислый газ, бромоводородная кислота, йодоводородная кислота |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 431
Задание №90
Установите соответствие между веществом и набором реагентов, с каждым из которых оно может взаимодействовать.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
|
А) оксид меди (I) Б) азотная кислота (конц.) В) нитрат серебра |
1) азотная кислота, угарный газ, водород 2) соляная кислота, сульфид железа, нитрат цинка 3) оксид меди (II), сульфид меди (II), медь 4) хлороводородная кислота, бромид калия, йодид рубидия |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 134
[adsp-pro-3]
Задание №91
Определите массу твердого остатка, образовавшегося при прокаливании навески питьевой соды массой 21 г. Ответ приведите в граммах и округлите до сотых.
В поле ответа введите только число (без единиц измерения).
Решение
Ответ: 13,25
Задание №92
Вычислите массовую долю соли в растворе, полученном при смешении 23 г сульфида лития и 200 г 18,25%-ного раствора соляной кислоты. Ответ приведите в процентах и округлите до сотых.
В поле ответа введите только число (без единиц измерения).
Решение
Ответ: 20,63
Задание №93
Рассчитайте объем газа, который можно получить при взаимодействии 100 г горячего 10%-ного раствора нитрита калия с равной массой 10%-ного раствора хлорида аммония. Ответ приведите в литрах и округлите до десятых.
В поле ответа введите только число (без единиц измерения).
Решение
Ответ: 2,6
Задание №94
Определите массу осадка, который образуется при взаимодействии 100 г 20%-ного раствора едкого натра и 20 г хлорида алюминия. Ответ приведите в граммах и округлите до десятых.
В поле ответа введите только число (без единиц измерения).
Решение
Ответ: 7,8
Задание №95
Вычислите объем углекислого газа, который может поглотить 100 мл 10%-ного раствора кальцинированной соды (плотность 1,06 г/см3). Ответ приведите в литрах и округлите до сотых.
В поле ответа введите только число (без единиц измерения).
Решение
Ответ: 2,24
Задание №96
Рассчитайте массу сероводорода, необходимую для полного разложения смеси 11,8 г тетрагидроксоалюмината натрия и 21,1 г тетрагидроксоцинката калия. Ответ приведите в граммах и округлите до десятых.
В поле ответа введите только число (без единиц измерения).
Решение
Ответ: 13,6
Задание №97
Навеску нитрата магния частично разложили при нагревании. Полученный твердый остаток может прореагировать со 100 г 18,25%-ного раствора соляной кислоты или с 50 г 10%-ного раствора едкого натра. Определите массу исходной навески. Ответ приведите в граммах и округлите до сотых.
В поле ответа введите только число (без единиц измерения).
Решение
Ответ: 46,25
Задание №98
Навеску смеси карбонатов цинка и калия прокалили до постоянной массы. После обработки полученного твердого остатка избытком раствора гидроксида калия в образовавшийся раствор пропустили углекислый газ до прекращения поглощения. Масса выпавшего при этом осадка составила 9,7 г. Определите массу исходной навески, если массовая доля карбоната калия в ней составляла 25%. Ответ приведите в граммах и округлите до сотых.
В поле ответа введите только число (без единиц измерения).
Решение
Ответ: 16,33
Задание №99
Навеску нитрата свинца разложили при нагревании. Выделившийся газ может прореагировать с 80 мл 25% раствора едкого кали (плотность 1,12 г/см3). Определите массу исходной навески. Ответ приведите в граммах и округлите до десятых.
В поле ответа введите только число (без единиц измерения).
Решение
Ответ: 66,2
Задание №100
При нагревании навески мела массой 40 г вещество частично разложилось. При добавлении избытка соляной кислоты к твердому остатку выделилось 6,72 л газа. Определите объем воды, который может прореагировать с такой же массой твердого остатка. Ответ приведите в миллилитрах и округлите до десятых.
В поле ответа введите только число (без единиц измерения).
Решение
Ответ: 1,8
[adsp-pro-10]
ЭКЗАМЕНЫ НЕ ЗА ГОРАМИ
Подготовка к ЕГЭ по химии
Кислые соли
Задания на применение знаний о кислых
солях встречаются в вариантах работ ЕГЭ
на разных уровнях сложности (А, В и С). Поэтому при
подготовке учащихся к сдаче ЕГЭ
нужно рассмотреть следующие вопросы.
1. Определение и номенклатура.
Кислые соли – это продукты неполного
замещения атомов водорода многоосновных кислот
на металл. Номенклатура кислых солей отличается
от средних только добавлением приставки
«гидро…» или «дигидро…» к названию соли,
например: NaHCO3 – гидрокарбонат
натрия, Са(Н2РО4)2 – дигидрофосфат
кальция.
2. Получение.
Кислые соли получаются при взаимодействии
кислот с металлами, оксидами металлов,
гидроксидами металлов, солями, аммиаком, если
кислота в избытке.
Например:
Zn + 2H2SO4 = H2 + Zn(HSO4)2,
CaO + H3PO4 = CaHPO4 + H2O,
NaOH + H2SO4 = H2O + NaHSO4,
Na2S + HCl = NaHS + NaCl,
NH3 + H3PO4 = NH4H2PO4,
2NH3 + H3PO4 = (NH4)2HPO4.
Также кислые соли получаются при
взаимодействии кислотных оксидов со щелочами,
если оксид в избытке. Например:
CO2 + NaOH = NaHCO3,
2SO2 + Ca(OH)2 = Ca(HSO3)2.
3. Взаимопревращения.
Средняя соль кислая
соль; например:
K2СО3 KНСО3.
Чтобы из средней соли получить кислую, нужно
добавить избыток кислоты или соответствующего
оксида и воды:
K2СО3 + Н2О + СО2 =
2KНСО3.
Чтобы из кислой соли получить среднюю, нужно
добавить избыток щелочи:
KНСО3 + KОН = K2СО3 + Н2О.
Гидрокарбонаты разлагаются с образованием
карбонатов при кипячении:
2KНСО3 K2СО3
+ Н2О + СО2.
4. Свойства.
Кислые соли проявляют свойства кислот,
взаимодействуют с металлами, оксидами металлов,
гидроксидами металлов, солями.
Например:
2KНSO4 + Mg = H2 + MgSO4 + K2SO4,
2KHSO4 + MgO = H2O + MgSO4 + K2SO4,
2KHSO4 + 2NaOH = 2H2O + K2SO4
+ Na2SO4,
2KHSO4 + Cu(OH)2 = 2H2O + K2SO4
+ CuSO4,
2KHSO4 + MgCO3 = H2O + CO2 + K2SO4 + MgSO4,
2KHSO4 + BaCl2 = BaSO4 + K2SO4 + 2HCl.
5. Задачи на кислые соли. Образование одной
соли.
При решении задач на избыток и недостаток нужно
помнить о возможности образования кислых солей,
поэтому сначала составляют уравнения всех
возможных реакций. После нахождения количеств
реагирующих веществ делают вывод о том, какая
соль получится, и решают задачу по
соответствующему уравнению.
З а д а ч а 1. Через раствор, содержащий 60 г NaOH,
пропустили 44,8 л СО2. Найти массу
образовавшейся соли.
| Дано: | Найти: m(соли). |
| m(NaOH) = 60 г, | |
| V(CO2) = 44,8 л. |
Р е ш е н и е
(NaOH) = m/M =
60 (г)/40 (г/моль) = 1,5 моль;
(СО2) = V/Vm
= 44,8 (л)/22,4 (л/моль) = 2 моль.
Поскольку (NaOH) :
(CO2) = 1,5 : 2 = 0,75 : 1,
то делаем вывод, что СО2 в избытке,
следовательно, получится кислая соль:
NaOH + CO2 = NaHCO3.
Количество вещества образовавшейся соли равно
количеству вещества прореагировавшего
гидроксида натрия:
(NaHCO3)
= 1,5 моль.
m(NaHCO3) = M • = 84 (г/моль)•1,5 (моль) = 126 г.
Ответ: m(NaHCO3) = 126 г.
З а д а ч а 2. Оксид фосфора(V) массой 2,84 г
растворили в 120 г 9%-й ортофосфорной кислоты.
Полученный раствор прокипятили, затем к нему
добавили 6 г гидроксида натрия. Найти массу
полученной соли.
| Дано: | Найти: m(соли). |
| m(P2O5) = 2,84 г, | |
| m(р-ра)(H3PO4) = 120 г, |
|
| m(NaOH) = 6 г. |
Р е ш е н и е
(P2O5)
= m/M = 2,84 (г)/142 (г/моль) = 0,02 моль,
следовательно, 1(H3PO4
получ.) = 0,04 моль.
m(H3PO4) = m(р-ра)• = 120 (г)•0,09 = 10,8 г.
2(H3PO4)
= m/M = 10,8 (г)/98 (г/моль) = 0,11 моль,
(H3PO4)
= 1 +
2 = 0,11 + 0,04 = 0,15
моль.
(NaOH) = m/M
= 6 (г)/40 (г/моль) = 0,15 моль.
Поскольку
(H3PO4)
: (NaOH) = 0,15 : 0,15 = 1 : 1,
то получится дигидрофосфат натрия:
(NaH2PO4)
= 0,15 моль,
m(NaH2PO4) = M• = 120 (г/моль)•0,15 (моль) = 18 г.
Ответ: m(NaH2PO4) = 18 г.
З а д а ч а 3. Сероводород объемом 8,96 л пропустили
через 340 г 2%-го раствора аммиака. Назовите соль,
получившуюся в результате реакции, и определите
ее массу.
Ответ: гидросульфид аммония,
m(NH4HS) = 20,4 г.
З а д а ч а 4. Газ, полученный при сжигании 3,36 л
пропана, прореагировал с 400 мл 6%-го раствора
гидроксида калия (
= 1,05 г/мл). Найти состав полученного раствора и
массовую долю соли в полученном растворе.
Ответ: (KНСО3) = 10,23 %.
З а д а ч а 5. Весь углекислый газ, полученный при
сжигании 9,6 кг угля, пропустили через раствор,
содержащий 29,6 кг гидроксида кальция. Найти массу
полученной соли.
Ответ: m(Ca(HCO3)2) = 64,8 кг.
З а д а ч а 6. В 9,8 кг 20%-го раствора серной кислоты
растворили 1,3 кг цинка. Найти массу полученной
соли.
Ответ: m(ZnSO4) = 3,22 кг.
6. Задачи на кислые соли. Образование смеси
двух солей.
Это более сложный вариант задач на кислые соли.
В зависимости от количества реагирующих веществ
возможно образование смеси двух солей.
Например, при нейтрализации оксида фосфора(V)
щелочью в зависимости от молярного соотношения
реагентов могут образоваться следующие
продукты:
P2O5 + 6NaOH = 2Na3PO4 + 3H2O,
(P2O5):
(NaOH) = 1:6;
P2O5 + 4NaOH = 2Na2HPO4 + H2O,
(P2O5):
(NaOH) = 1:4;
P2O5 + 2NaOH + H2O = 2NaH2PO4,
(P2O5):
(NaOH) = 1:2.
Следует помнить, что при неполной
нейтрализации возможно образование смеси двух
соединений. При взаимодействии 0,2 моль Р2О5
с раствором щелочи, содержащим 0,9 моль NaOH,
молярное соотношение находится между 1:4 и 1:6. В
этом случае образуется смесь двух солей: фосфата
натрия и гидрофосфата натрия.
Если раствор щелочи будет содержать 0,6 моль NaOH,
то молярное соотношение будет другим: 0,2:0,6 = 1:3,
оно находится между 1:2 и 1:4, поэтому получится
смесь двух других солей: дигидрофосфата и
гидрофосфата натрия.
Эти задачи можно решать разными способами. Мы
будем исходить из предположения, что
одновременно происходят две реакции.
А л г о р и т м р е ш е н и я
1. Составить уравнения всех возможных
реакций.
2. Найти количества реагирующих веществ и по
их соотношению определить уравнения двух
реакций, которые происходят одновременно.
3. Обозначить количество одного из
реагирующих веществ в первом уравнении как х
моль, во втором – у моль.
4. Выразить через х и у количества
другого реагирующего вещества согласно молярным
соотношениям по уравнениям.
5. Составить систему уравнений с двумя
неизвестными.
З а д а ч а 1. Оксид фосфора(V), полученный при
сжигании 6,2 г фосфора, пропустили через 200 г 8,4%-го
раствора гидроксида калия. Какие вещества и в
каких количествах получаются?
Р е ш е н и е
(P) = m/M
= 6,2 (г)/31 (г/моль) = 0,2 моль,
следовательно, (P2O5)
= 0,1 моль.
m(KOH) = •m(р-ра)
= 0,084•200 (г) = 16,8 г,
(KOH) = m/M
= 16,8 (г)/56 (г/моль) = 0,3 моль.
Уравнения возможных реакций:
(Р2О5):
(KОН) = 0,1:0,3 = 1:3,
следовательно, получится смесь двух солей –
гидрофосфата и дигидрофосфата калия (уравнения 2
и 3).
Обозначим (Р2О5)
в уравнении (2) как х моль, а (Р2О5) в уравнении (3)
как у моль, тогда потребуется: (KОН) = 4х + 2у.
Составим систему уравнений:
х = 0,1 – у,
4(0,1 – у) + 2у = 0,3,
0,4 – 4у + 2у = 0,3,
2у = 0,1, у = 0,05,
х = 0,1 – 0,05 = 0,05.
Поскольку количество вещества образующейся
соли вдвое больше количества вещества
вступившего в реакцию оксида фосфора(V), то
получится по 0,1 моль гидро- и дигидрофосфата
калия:
(P2O5)2
= 0,05 моль —> (K2НРО4)
= 0,1 моль,
(Р2О5)3
= 0,05 моль —> (KН2РО4)
= 0,1 моль.
Ответ: (K2НРО4) = 0,1 моль,
( KН2РО4)
= 0,1 моль.
З а д а ч а 2. Найти массы и массовые доли солей,
полученных при растворении 22,4 л углекислого газа
в 480 г 10%-го раствора гидроксида натрия.
Ответ: m(Na2CO3) = 21,2 г, (Na2CO3) = 4,05%
m(NaHCO3) = 67,2 г, (NaHCO3) = 12,82 %.
З а д а ч а 3. Найти массовые доли солей в
растворе, полученном при пропускании 100 м3 аммиака
через 500 кг 50%-го раствора фосфорной кислоты.
Ответ. ((NH4)2HPO4) = 43,8 %,
(NH4H2PO4)
= 12,8 %.
З а д а ч а 4. К 50 г раствора ортофосфорной
кислоты с массовой долей 11,76 % прибавили 150 г
раствора гидроксида калия с массовой долей
5,6 %. Найти состав остатка, полученного при
выпаривании раствора.
Ответ: m(K3PO4) = 6,36 г,
m(K2HPO4) = 5,22 г.
З а д а ч а 5. Сожгли 5,6 л бутана (н.у.) и
образовавшийся углекислый газ пропустили через
раствор, содержащий 102,6 г гидроксида бария. Найти
массы полученных солей.
Ответ: m(BaCO3) = 39,4 г,
m(Ba(HCO3)2) = 103,6 г.
Г.С.ОСНОВСКАЯ,
учитель химии средней школы № 7
(г. Великие Луки, Псковская обл.)
Кислые соли.
Задания на применение знаний о кислых солях встречаются в вариантах работ ЕГЭ на разных уровнях сложности А, Б и С. Поэтому при подготовке учащихся к сдаче ЕГЭ нужно рассмотреть следующие вопросы:
-
Определение и номенклатура.
Кислые соли – это продукты неполного замещения атомов водорода многоосновных кислот на металл. Номенклатура кислых солей отличается от средних только добавлением приставки «гидро…» или «дигидро…» к названию соли:
NaHCO3 – гидрокарбонат натрия, Са(Н2РО4)2 – дигидрофосфат кальция.
2) Получение.
Кислые соли получаются при взаимодействии кислот с металлами, оксидами металлов, гидроксидами металлов, солями, аммиаком, если кислота в избытке.
Например: Zn + 2H2SO4 = H2 + Zn(HSO4)2
NaOH + H2SO4 = H2O + NaHSO4
Na2S + HCl = NaHS + NaCl
NH3 + H3PO4 = NH4H2PO4
2NH3 + H3PO4 = (NH4)2HPO4
А также кислые соли получаются при взаимодействии кислотных оксидов со щелочами, если оксид в избытке. Например:
CO2 + NaOH = NaHCO3
2SO2 + Ca(OH)2 = Ca(HSO3)2
3) Взаимопревращения:
средняя соль = кислая соль К2СО3 = КНСО3
-
Чтобы из средней соли получить кислую, нужно добавить избыток кислоты:
К2СО3 + Н2О + СО2 = 2КНСО3
-
Чтобы из кислой соли получить среднюю, нужно добавить избыток щелочи:
КНСО3 + КОН = К2СО3 + Н2О
Гидрокарбонаты разлагаются с образованием карбонатов при кипячении:
2КНСО3 = К2СО3 + Н2О + СО2
4) Свойства.
Кислые соли проявляют свойства кислот, взаимодействуют с металлами, оксидами металлов, гидроксидами металлов, солями.
Например:
2КНSO4 + Mg = H2 + MgSO4 + K2SO4
2KHSO4 + MgO = H2O + MgSO4 + K2SO4
2KHSO4 + 2NaOH = 2H2O + K2SO4 + Na2SO4
KHSO4 + 2NaOH = H2O + Na2SO4 + KOH
2KHSO4 + Cu(OH)2 = 2H2O + K2SO4 + CuSO4
KHSO4 + Cu(OH)2 = H2O + CuSO4 + KOH
2KHSO4 + MgCO3 = H2O + CO2 + K2SO4 MgSO4
2KHSO4 + BaCl2 = BaSO4 + K2SO4 + 2HCl
5) Задачи на кислые соли.
При решении задач на избыток и недостаток нужно помнить о возможности образования кислых солей.
При решении таких задач составляют уравнения всех возможных реакций.
После нахождения количеств реагирующих веществ делают вывод о том, какая соль получится, и решают задачу по соответствующему уравнению.
Задача 1: Через раствор, содержащий 60г NaOH, пропустили 44,8л СО2. Какая соль и какой массы получилась?
Д
m р-ра(NaOH) = 60г 2NaOH + CO2 = Na2CO3 + H2O
V
NaOH + CO2 = NaHCO3
m(соли) = ? 1 моль 1 моль
(NaOH) = m / M = 60г / 40г/моль = 1,5 моль
(СО2) = V / Vm = 44,8л / 22,4л/моль = 2 моль
Так как (NaOH) (CO2) = 1,5 2 моль = 0,75 1 СО2 в избытке, получится кислая соль.
NaOH + CO2 = NaHCO3
1 моль 1 моль 1 моль
(NaOH) = 1,5 моль (NaHCO3) = 1,5 моль
m(NaHCO3) = M = 84г/моль 1,5 моль = 126г
Ответ: m(NaHCO3) = 126г.
Задача 2: Оксид фосфора (V) массой 2,84г растворили в 120г 9% — ной ортофосфорной кислоты и полученный раствор прокипятили, затем к нему добавили 6г гидроксида натрия. Найти массу полученной соли.
Д
m(P2O5) = 2,84г P2O5 + 3H2O = 2H3PO4
m р-ра1(H3PO4) = 120г 1 моль 2 моль
р.в.1(H3PO4) = 9 % (P2O5) = m / M = 2,84г / 142 г/моль = 0,02 моль
m
m (соли) = ? m р.в.1(H3PO4) = m р-ра1 р.в.1 = 120г 0,09 = 10,8г
р.в.1(H3PO4) = m / M = 10,8г / 98г/моль = 0,11 моль
р.в.2(H3PO4) = р.в.1 + получ. = 0,11 + 0,04 = 0,15 моль
H3PO4 + 3NaOH = Na3PO4 + 3H2O 1 моль 3 моль
H3PO4 + 2NaOH = Na2HPO4 + 2H2O
1моль 2 моль
H3PO4 + NaOH = NaH2PO4 + H2O
1 моль 1 моль
(NaOH) = m / M = 65 / 40г/моль = 0,15 моль
Так как (H3PO4) (NaOH) = 0,15 0,15 = 1 1 получится дигидрофосфат натрия.
H3PO4 + NaOH = NaH2PO4 + H2O
1 моль 1 моль 1 моль
(NaH2PO4) = 0,15 моль
m(NaH2PO4) = M = 120г/моль 0,15 моль = 18г
Ответ: m(NaH2PO4) = 18г
Задача 3:
Сероводород объёмом 8,96л пропустили через 340г 2% — ного раствора аммиака. Назовите соль, получившуюся в результате реакции, и определите её массу.
Ответ: m(NH4HS) = 20,4г.
Задача 4:
Газ, полученный при сжигании 3,36л пропана, прореагировал с 400мл 6% — ного раствора гидроксида калия ( = 1,05г/мл). Найти состав полученного раствора и массовую долю соли в этом растворе. Ответ: (КНСО3) = 10,23 %.
Задача 5:
Весь углекислый газ, полученный при сжигании 9,6 кг угля, пропустили через раствор, содержащий 29,6 кг гидроксида кальция. Найти массу полученной соли.
Ответ: m(Ca(HCO3)2 = 64,8 кг.
Задача 6:
В 9,8 кг 20% — ного раствора серной кислоты растворили 1,3 кг цинка. Найти массу полученной соли.
Ответ: m(ZnSO4) = 5,18 кг.
6) Задачи на кислые соли: промежуточный случай или образование смеси двух солей.
Это более сложный вариант задач на кислые соли. В зависимости от количества реагирующих веществ возможно образование смеси двух солей.
Например, при нейтрализации оксида фосфора (V) щелочью в зависимости от молярного соотношения образуются следующие продукты:
P2O5 + 6NaOH = 2Na3PO4 + 3H2O (P2O5) / (NaOH) = 1/6
P2O5 + 4NaOH = 2Na2HPO4 + H2O (P2O5) / (NaOH) = 1/4
P2O5 + 2NaOH + H2O = 2NaH2PO4 (P2O5) / (NaOH) = 1/2
Следует помнить, что при неполной нейтрализации образуются смеси двух соединений. Так, при взаимодействии 0,2 моль Р2О5 с раствором щелочи, содержащим 0,9 моль NaOH, молярное соотношение находится между 1/4 и 1/6.
В этом случае образуется смесь двух солей: фосфата натрия и гидрофосфата натрия. Если раствор щелочи будет содержать 0,6 моль NaOH, то молярное соотношение будет другим: 0,2/0,6 = 1/3, оно находится между 1/2 и 1/4, поэтому получится смесь двух солей дигидрофосфата и гидрофосфата натрия.
Эти задачи можно решать разными способами. При более простом будем исходить из предположения, что одновременно происходят две реакции.
Алгоритм решения:
-
Составить уравнения всех возможных реакций.
-
Найти количества реагирующих веществ и по их соотношению определить уравнения двух реакций, которые происходят одновременно.
-
Обозначить количество одного из реагирующих веществ в первом уравнении –
х моль, во втором – у моль.
4. Выразить через х и у количество другого реагирующего вещества согласно мо лярным соотношениям по уравнениям.
5. Составить систему уравнений с двумя неизвестными.
Задача № 1.Оксид фосфора (V), полученный при сжигании 6,2 г фосфора, пропустили через 200 г 8,4 % раствора гидроксида калия. Какие вещества и в каком количестве получаются?
Д
m (P) = 6,2 г
4Р + 5О2 = 2Р2О5
m р – ра (КОН) = 200 г 4 моль 2 моль

в – в = ? (Р2О5) = 0,1 моль
m р.в.(КОН) = р.в. m р – ра = 0,084 200г = 16,8г
(КОН) = m / M = 16,2г / 56 г/моль = 0,3 моль
Уравнения возможных реакций:
-
Р2О5 + 6КОН = 3Н2О + 2К3РО4
1 моль 6 моль
х моль 4х моль
2. Р2О5 + 4КОН = 2Н2О + 2К2НРО4
1 моль 4 моль
у моль 2у моль
3. Р2О5 + 2КОН + Н2О = Н2О + 2КН2РО4
1 моль 2 моль
(Р2О5) (КОН) = 0,1 0,3 = 1 3 получится смесь двух солей –
гидрофосфата и дигидрофосфата калия.
Обозначим (Р2О5)2 = х моль, а (Р2О5)3 = у моль (КОН)2 = 4х , (КОН)3 = 2у
С
х + у = 0,1 х = 0,1 – у
4х + 2у = 0,3 4(0,1 – у) + 2у = 0,3
0,4 – 4у + 2у = 0,32у = 0,1 у = 0,05
х = 0,1 – 0,05 = 0,05
(P2O5)2 = 0,05 моль (К2НРО4) = 0,1 моль
(Р2О5)3 = 0,05 моль (КН2РО4) = 0,1 моль
Ответ: (К2НРО4) = 0,1 моль, (КН2РО4) = 0,1 моль
Задача 2:
Найти массы и массовые доли солей, полученных при растворении 22,4л углекислого газа в 480г 10 % — го раствора гидроксида натрия.
Ответ: m(Na2CO3) = 21,2г, р.в.(Na2CO3) = 4%, m(NaHCO3) = 67,2г р.в.(NaHCO3) = 13%
Задача 3:
Найти массовые доли солей в растворе, полученном при пропускании 100 м3 аммиака через 500 кг 50% — го раствора фосфорной кислоты.
Ответ: р.в.((NH4)2HPO4) = 43,8%, р.в.(NH4H2PO4) = 12,7%
Задача 4:
К 50г раствора ортофосфорной кислоты с массовой долей 11,76% прибавили 150г раствора гидроксида калия с массовой долей 5,6%. Найти состав остатка, полученного при выпаривании раствора.
Ответ: m(K3PO4) = 6,36г, m(K2HPO4) = 5,22г
Задача 5:
Сожгли 5,6л бутана (н.у.), и образовавшийся углекислый газ пропустили через раствор, содержащий 102,6г гидроксида бария. Найти массы полученных солей.
Ответ: m(BaCO3) = 39,4г
m(BaHCO3) = 103,6г
Чтобы поделиться, нажимайте
Задачи на тему Образование кислых и средних солей.
Предлагаем вашему вниманию задачи по теме Образование кислых и средних солей с подробными видео-объяснениями (даны сразу после условий задания) и ответами (приведены в конце страницы).
Составитель — репетитор по химии в Skype или Zoom — Александр Владимирович Коньков (подробнее здесь)
-
Какой максимальный объём (л) углекислого газа (н.у.) может поглотить раствор гидроксида калия объёмом 200 мл с плотностью 1,02 г/мл и массовой долей КОН 22%?
-
Каким минимальным объёмом (см3) раствора гидроксида натрия с массовой долей NaOH 10% и плотностью 1,25 г/cм3 можно поглотить оксид углерода (IV) объёмом 4,48 дм3.
-
Рассчитайте массовую долю (%) соли, полученной при поглощении углекислого газа объёмом 33,6 дм3 раствором гидроксида натрия объёмом 900 мл с массовой долей растворённого вещества 6% и плотностью 1,111 г/мл.
-
Сернистый газ, полученный при сжигании 22,4 л сероводорода (н.у.), пропущен через 362 мл раствора гидроксида калия с массовой долей КОН 14% (плотность 1,105 г/мл). Вычислите массовую долю (%) соли в конечном растворе.
-
Рассчитайте суммарное химическое количество (ммоль) всех солей, содержащихся в растворе, полученном добавлением к раствору, содержащему фосфорную кислоту химическим количеством 0,218 моль, гидроксида натрия массой 20 г.
-
Рассчитайте суммарное химическое количество (ммоль) солей, которые образуются при растворении оксида фосфора (V) химическим количеством 5 ммоль в растворе гидроксида калия объёмом 50 см3 с молярной концентрацией КОН 500 ммоль/дм3.
-
Укажите суммарную массу (г) солей, полученных при пропускании 16,8 л сероводорода (н.у.) в раствор гидроксида калия, содержащий 59,92 г КОН.
-
Газ, образовавшийся в результате действия избытка соляной кислоты на раствор карбоната калия массой 50 г с массовой долей соли 10,35%, пропустили через раствор, содержащий гидроксид кальция массой 2,22 г. Осадок какой массы (г) образовался при этом?
-
Аммиак объёмом 4,48 дм3 (н.у.) пропустили через раствор фосфорной кислоты массой 62,5 г с массовой долей 20%. Рассчитайте химическое количество (ммоль) дигидрофосфата аммония.
-
К раствору, содержащему H3PO4 массой 34,3 г, добавили раствор, содержащий КОН массой 42 г. Укажите химическое количество (ммоль) гидрофосфата калия в образовавшемся растворе.
Ответы:
- 18
- 64
- 12
- 26
- 218
- 10
- 66
- 2
- 56
- 300
В случае, если вы нашли ошибку или опечатку, просьба сообщать об этом автору проекта в контакте https://vk.com/id30891697 или на электронную почту yoursystemeducation@gmail.com
Посмотреть видео-объяснения каждого задания ЦТ, РТ и ДРТ всех лет, а также получить условия всех пробных, тренеровочных и реальных вариантов ЕГЭ, вы можете получив полный доступ к сайту кликнув здесь «Получить все материалы сайта»
А также:
- Посмотреть видео-объяснения решений всех типов задач по химии
- Просмотреть все тесты по органической химии с видео-объяснениями
- Просмотреть все тесты по неорганической химии с видео-объяснениями
- Посмотреть пробные варианты ЦТ вы можете здесь,
- Посмотреть пробные и реальные варианты ЕГЭ
- Посмотреть все видео-уроки по различным разделам школьного курса
- Больше заданий РТ с видео-объяснениями
- Больше заданий ЦТ с видео-объяснениями
- Больше заданий ЕГЭ с ответами и видео-объяснениями
- Все видео-объяснения вы можете найти на YouTube канале