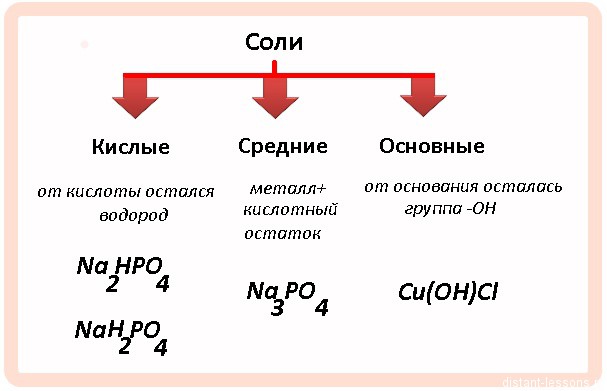
Задачи на кислые и средние соли — это разновидность задач на альтернативные реакции, в которых в зависимости от соотношения количества вещества реагентов возможно протекание разных реакций и образование различных продуктов.
При взаимодействии щелочей с кислотными оксидами многоосновных кислот, либо с многоосновными кислотами возможно образование кислых или средних солей.
При избытке щелочи образуется средняя соль. При избытке кислоты или кислотного оксида образуется кислая соль. При этом возможно одновременное образование и кислой, и средней соли.
Рассмотрим взаимодействие углекислого газа и гидроксида натрия. При избытке гидроксида натрия образуется средняя соль и вода:
2NaOH(изб.) + CO2 = Na2CO3 + H2O (1)
При избытке углекислого газа образуется только кислая соль:
NaOH + CO2(изб.) = NaНCO3 (2)
Два варианта химических реакций, но пять возможных ситуаций расчетных задач с этими реакциями.
Отличительная особенность таких задач: при решении зачастую необходимо сравнить количества вещества реагентов, чтобы понять, какая именно (или какие) реакции протекают.
Ситуация 1. Избыток щелочи n(NaOH):n(CO2) > 2:1.
Например. Смешали 8 моль гидроксида натрия и 3 моль углекислого газа.
Соотношение n(NaOH):n(CO2) = 8:3 > 2:1
Количество вещества щелочи более чем в два раза больше, чем количество вещества углекислого газа. Тогда протекает реакция 1:
2NaOH(изб.) + CO2 = Na2CO3 + H2O
Гидроксид натрия в избытке, расчет ведем по недостатку, углекислому газу. В реакцию вступит 3 моль углекислого газа, и 6 моль гидроксида натрия:
nпрореаг.(NaOH) = 2n(CO2) = 6 моль
При этом образуются карбонат натрия и вода:
n(Na2CO3) = n(СO2) = 3 моль
При этом остается гидроксид натрия:
nост.(NaOH) = 8 — 6 = 2 моль
Таким образом, после полного протекания реакции в системе присутствуют:
n(Na2CO3) = n(H2O) = 3 моль, n(NaOH) = 2 моль
Ситуация 2. Эквимолярное соотношение гидроксида натрия и углекислого газа n(NaOH):n(CO2) = 2:1
Например. Смешали 6 моль гидроксида натрия и 3 моль углекислого газа.
Соотношение n(NaOH):n(CO2) = 2:1
Количество вещества щелочи ровно в два раза больше, чем количество вещества углекислого газа. Тогда протекает реакция 1:
2NaOH(изб.) + CO2 = Na2CO3 + H2O
При эквимолярном соотношении реагентов оба реагента вступают в реакцию полностью. То есть ни один из реагентов ни в избытке, ни в недостатке. При этом образуются карбонат натрия и вода:
n(Na2CO3) = n(H2O) = n(СO2) = 1/2n(NaOH) = 3 моль
Таким образом, после полного протекания реакции в системе присутствуют:
n(Na2CO3) = n(H2O) = 3 моль
Ситуация 3. Избыток углекислого газа n(NaOH):n(CO2) > 1:1.
Например. Смешали 3 моль гидроксида натрия и 4 моль углекислого газа.
Соотношение n(NaOH):n(CO2) = 3:4 > 1:1
Количество вещества углекислого газа больше, чем количество вещества щелочи. Тогда протекает реакция 2:
NaOH + CO2(изб.) = NaHCO3
Углекислый газ в избытке, расчет ведем по недостатку, по гидроксиду натрия. В реакцию вступит 3 моль гидроксида натрия, и 3 моль углекислого газа:
nпрореаг.(СО2) = n(NaOH) = 3 моль
При этом образуется гидрокарбонат натрия:
n(NaHCO3) = n(NaOH) = 3 моль
При этом остается углекислый газ:
nост.(СО2) = 4 — 3 = 1 моль
Таким образом, после полного протекания реакции в системе присутствуют:
n(NaHCO3) = 3 моль, n(СO2) = 1 моль
Ситуация 4. Эквимолярное соотношение гидроксида натрия и углекислого газа n(NaOH):n(CO2) = 1:1
Например. Смешали 3 моль гидроксида натрия и 3 моль углекислого газа.
Соотношение n(NaOH):n(CO2) = 1:1
Количество вещества щелочи равно количеству вещества углекислого газа. Тогда протекает реакция 2:
NaOH + CO2(изб.)= NaHCO3
При эквимолярном соотношении реагентов оба реагента вступают в реакцию полностью. То есть ни один из реагентов ни в избытке, ни в недостатке. При этом образуется гидрокарбонат натрия:
n(NaHCO3) = n(СO2) = (NaOH) = 3 моль
Таким образом, после полного протекания реакции в системе присутствует:
n(NaHCO3) = 3 моль
Ситуации 1-4 — довольно стандартные. И, по сути, отличаются от обычных расчетных задач на избыток-недостаток только тем, что нужно определить, какая именно из двух реакций протекает. Ситуация 5 принципиально отличается.
Ситуация 5. Соотношение 1:1 < n(NaOH):n(CO2) < 2:1.
Например. Смешали 4 моль гидроксида натрия и 3 моль углекислого газа.
Соотношение n(NaOH):n(CO2) = 4:3, 1:1 < 4:3 < 2:1.
В такой ситуации образуются и карбонат натрия, и гидрокарбонат.
Решить такую задачу можно двумя способами — расчет через последовательно протекающие реакции и расчет через параллельно идущие реакции.
Метод последовательных реакций:
Пусть протекает реакция 1:
2NaOH + CO2 = Na2CO3 + H2O
Углекислый газ в избытке, расчет ведем по недостатку, по гидроксиду натрия. В реакцию вступит 4 моль гидроксида натрия, и 2 моль углекислого газа:
nпрореаг.(СО2) = 1/2n(NaOH) = 2 моль
При этом образуются карбонат натрия и вода:
n(Na2CO3) = 1/2n(NaOH) = 2 моль
Остается углекислый газ:
nост.(СО2) = 3 — 2 = 1 моль
Таким образом, после полного протекания реакции (1) в системе присутствуют:
n(Na2CO3) = n(H2O) = 2 моль, n(СO2) = 1 моль
Однако, оставшиеся вещества вступают в реакцию с образованием кислой соли:
Na2CO3 + H2O + СО2 = 2NaHCO3
При этом углекислый газ в недостатке, карбонат натрия в избытке. В реакцию вступают карбонат натрия:
nпрореаг.(Na2СО3) = n(CO2) = 1 моль
Образуется гидрокарбонат натрия:
n(NaHCO3) = 2n(CO2) = 2 моль,
Остается карбонат натрия:
nост.(Na2СО3) = 2 — 1 = 1 моль
Таким образом, после полного протекания последней реакции в системе присутствуют:
n(Na2CO3) = 1 моль, n(NaHСO3) = 2 моль
Метод параллельно идущих реакций:
Пусть одновременно протекают реакции (1) и (2):
2NaOH + CO2 = Na2CO3 + H2O (1)
NaOH + CO2 = NaНCO3 (2)
Пусть в первую реакцию вступает х моль СО2, во вторую реакцию у моль СО2.
Тогда в первую реакцию вступают 2х моль гидроксида натрия, во вторую реакцию у моль гидроксида натрия.
Получаем систему уравнений:
2х + y = 4
x + y = 3
Отсюда: x = 1 моль, у = 2 моль
n(Na2CO3) = 1/2n1(NaOH) = n1(CO2) = 1 моль
n(NaHCO3) = n2(NaOH) = n2(CO2) = 2 моль
Как видно, ответ не зависит от выбранного способа решения.
Примеры задач на кислые и средние соли из ЕГЭ по химии.
1. Через 228 г 3%-ного раствора гидроксида бария пропустили 1,21 л углекислого газа (н.у.), при этом углекислый газ поглотился полностью. Выпавший осадок отделили, а к оставшемуся раствору добавили 49 г 5%-ного раствора серной кислоты. Найдите массовую долю кислоты в образовавшемся растворе.
CO2 + Ba(OH)2 = BaCO3 + H2O
BaCO3 + CO2 + H2O = Ba(HCO3)2
Ba(HCO3)2 + H2SO4 = BaSO4 + 2CO2 + 2H2O
Ответ: w(H2SO4) = 0,4%
2. Газ, образовавшийся при гидролизе 36,4 г фосфида кальция, сожгли. К образовавшемуся при этом продукту последовательно добавили 100 мл воды и 50 мл раствора гидроксида натрия с массовой долей 25% и плотностью 1,28 г/см3. Определите состав образовавшейся соли и её массовую долю в растворе.
Ca3P2 + 6H2O = 3Ca(OH)2 + 2PH3
PH3 + 2O2 = H3PO4
H3PO4 + NaOH = NaH2PO4 + H2O
Ответ: w(NaH2PO4) = 23,6%
3. При растворении 9,4 г оксида калия в воде получили раствор с массовой долей вещества 20%. К этому раствору добавили 98 г 20%-ного раствора серной кислоты. Определите массовую долю соли в полученном растворе.
K2O + H2O = 2KOH
KOH + H2SO4 = KHSO4 + H2O
Ответ: w(KHSO4) = 17,66%
4. При растворении 30,6 г оксида бария в воде получили раствор с массовой долей вещества 5%. К этому раствору добавили 98 г 40%-ного раствора ортофосфорной кислоты. Определите массовую долю соли в полученном растворе.
BaO + H2O = Ba(OH)2
Ba(OH)2 + 2H3PO4 = Ba(H2PO4)2 + 2H2O
Ответ: w(Ba(H2PO4)2) = 8,465%
5. Газ, выделившийся при гидролизе 21 г нитрида лития, поглотили 545 мл 10%-ного раствора серной кислоты (плотностью 1,08 г/мл). Определите массовую долю соли в полученном растворе.
Li3N + 3H2O = 3LiOH + NH3
NH3 + H2SO4 = NH4HSO4
Ответ: w(NH4HSO4) = 11,52%
6. При растворении пероксида лития Li2O2 в тёплой воде выделяется кислород. Определите массовую долю гидроксида лития в растворе, полученном растворением 2,3 г пероксида лития в 62 г воды. Какой максимальный объём углекислого газа (н.у.) может быть поглощён получившейся щёлочью?
2Li2O2 + 2H2O = 4LiOH + O2
LiOH + CO2 = LiHCO3
Ответ: w(LiOH) = 3,8%, V(CO2) = 2,24 л
7. В 880 г 4%-ной серной кислоты растворили 16 г оксида серы(VI). К полученному раствору добавили 11,2 г гидроксида калия. Определите массу образовавшейся соли.
SO3 + H2O = H2SO4
H2SO4 + KOH = KHSO4 + H2O
Ответ: m(KHSO4) = 27,2 г
8. Серу массой 6,4 г сожгли в избытке кислорода. Полученный газ пропустили через 138 мл 8%-ного раствора гидроксида натрия (плотностью 1,087 г/мл). Определите массовые доли солей в полученном растворе.
S + O2 = SO2
SO2 + 2NaOH = Na2SO3 + H2O
Na2SO3 + SO2 + H2O = 2NaHSO3
Ответ: w(Na2SO3) = 7,74%, w(NaHSO3) = 6,39%
9. Фосфор массой 1,55 г сожгли в избытке кислорода. Образовавшееся при этом вещество растворили в воде и полученный раствор прокипятили. К полученному раствору добавили 3,7 л 0,1%-ного раствора гидроксида кальция (плотностью 1 г/мл). Определите массу образовавшейся соли.
4P + 5O2 = 2P2O5
P2O5 + 3H2O = 2H3PO4
H3PO4 + Ca(OH)2 = CaHPO4 + 2H2O
Ответ: m(CaHPO4) = 6,8 г
10. Технический сульфат аммония массой 2,04 г, содержащий 3% примесей, нагревают с твёрдым гидроксидом натрия массой 1,6 г. Выделившийся в результате газ поглотили 29,4 г раствора с массовой долей фосфорной кислоты 10%. Вычислите массовую долю соли в образовавшемся растворе.
(NH4)2SO4 + 2NaOH = 2NH3 + Na2SO4 + 2H2O
H3PO4 + NH3 = NH4H2PO4
Ответ: w(NH4H2PO4) = 11,53%
11. В 250 мл воды растворили 13,8 г натрия, затем добавили 50 г 59%-ного раствора ортофосфорной кислоты. Определите массовую долю соли в полученном растворе.
2Na + 2H2O = 2NaOH + H2
H3PO4 + 2NaOH = Na2HPO4 + 2H2O
Ответ: w(Na2HPO4) = 13,6%
12. Оксид фосфора(V) массой 2,84 г растворили в 120 г раствора ортофосфорной кислоты с массовой долей 9% и полученный раствор прокипятили. К полученному раствору добавили 30 г 20%-ного раствора гидроксида натрия. Вычислите массовую долю соли в конечном растворе.
P2O5 + 3H2O = 2H3PO4
H3PO4 + NaOH = NaH2PO4 + H2O
Ответ: w(NaH2PO4) = 11,8%
13. При растворении пероксида лития Li2O2 в тёплой воде образуется гидроксид лития и выделяется газ. Раствором, полученным при действии 2,3 г пероксида лития на 62 г воды, поглотили 2,24 л (н.у.) углекислого газа. Вычислите массовую долю соли в полученном растворе.
2Li2O2 + 2H2O = 4LiOH + O2
LiOH + CO2 = LiHCO3
Ответ: w(LiHCO3) = 10,01%
14. Газ, выделившийся при гидролизе 16 г карбида кальция, сожгли. Газообразный продукт сгорания пропустили через 200 г 7%-ного раствора гидроксида калия. Найдите массу образовавшейся соли.
CaC2 + 2H2O = Ca(OH)2 + C2H2
2C2H2 + 5O2 = 4CO2 + 2H2O
CO2 + KOH = KHCO3
Ответ: m(KHCO3) = 25 г
15. 19,6 г оксида углерода(II) сожгли. Продукт сгорания полностью поглотили 420 г 10,5%-ного раствора гидроксида натрия. Найдите массовую долю веществ в полученном растворе.
2CO + O2 = 2CO2
CO2 + 2NaOH = Na2CO3 + H2O
Na2CO3 + CO2 + H2O = 2NaHCO3
Ответ: w(Na2CO3) = 9,4%, w(NaHCO3) = 5,6%
16. Образец натрия массой 0,92 г растворили в воде. Какую массу 10%‑ного раствора ортофосфорной кислоты нужно добавить к образовавшемуся раствору для получения гидроортофосфата натрия?
2Na + 2H2O = 2NaOH + H2
2NaOH + H3PO4 = Na2HPO4 + 2H2O
Ответ: m(раствора H3PO4) = 19,6 г
17. Смешали 120 г 4,1%-ного раствора ортофосфорной кислоты и 28 г 10%-ного раствора гидроксида калия. Найдите массу образовавшейся соли.
H3PO4 + KOH = KH2PO4 + H2O
Ответ: m(KH2PO4) = 6,8 г
18. Углекислый газ объёмом 560 мл (н.у.) полностью поглотили 1000 г раствора гидроксида кальция с массовой долей 0,15%. Найдите массу образовавшегося осадка и массовую долю соли в растворе.
Ca(OH)2 + CO2 = CaCO3 + H2O
CaCO3 + H2O + CO2 = Ca(HCO3)2
Ответ: m(CaCO3) = 1,5 г, w(Ca(HCO3)2) = 0,08%
19. В избытке кислорода сожгли 8 г серы. Полученный газ пропустили через 200 г 8%-ного раствора гидроксида натрия. Определите массовые доли солей в полученном растворе.
S + O2 = SO2
SO2 + 2NaOH = Na2SO3 + H2O
Na2SO3 + SO2 + H2O = 2NaHSO3
Ответ: w(NaHSO3) = 4,8%, w(Na2SO3) = 8,75%
- Задачи на растворимость:
- Базовые знания (2 шт)
- Безводные соли (3 шт)
- Кристаллогидраты (4 шт)
- Задачи на кислые соли:
- Задачи (6 шт)
- Задачи на кристаллогидраты:
- Задача 1.
- Задача 2.
- Задача 3.
- Задача 4.
- Задачи на массовую долю и избыток-недостаток:
- Задача 1.
- Задача 2.
Задача 1. 16 г оксида серы (VI) растворили в 50 г 19,6% -ного раствора серной кислоты. В полученный раствор прибавили 16 г гидроксида натрия. Определите массу образовавшейся соли (солей).
Источник: В.Н, Доронькин, Неорганическая Химия, Тренировочная тетрадь, стр. 29.
Ответ: m(NaHSO4) = 24 г, m(Na2SO4) = 14,2 г.
Решение (pdf файл)
Задача 2. Газ, полученный при взаимодействии 17,6 г сульфида железа (II) с избытком раствора серной кислоты, без остатка прореагировал с 138 мл 8% -ного раствора NaOH (плотность 1,087 г/мл). Определите состав полученного раствора и рассчитайте массовые доли веществ в этом растворе.
Источник: В.Н, Доронькин, Неорганическая Химия, Тренировочная тетрадь, стр. 28.
Ответ: w(NaHS) = 3,57% и w(Na2S) = 4,97%.
Решение (pdf файл)
Задача 3. Углекислый газ объемом 5,6 л (н.у.) пропустили через 164 мл 20%-ного раствора гидроксида натрия (плотность 1,22 г/мл). Определите состав и массовые доли веществ в полученном растворе.
Источник: Я сдам ЕГЭ, Типовые задания, 2018 г, А.А. Каверина, стр. 207.
Ответ: w(Na2CO3) = 12,6%, w(NaOH) = 9,48%.
Решение (pdf файл)
Задача 4. В 250 мл воды растворили 13,8 г натрия, затем добавили 50 г 59%-ного раствора ортофосфорной кислоты. Определите массовую долю соли в полученном растворе.
Источник: Я сдам ЕГЭ. Типовые задания, 2018 г, А.А. Каверина, стр. 207.
Ответ: w(Na2HPO4) = 13,6%.
Решение (pdf файл)
Задача 5. При гидролизе 7,28 г фосфида кальция образовался газ, который сожгли в избытке кислорода. Полученный оксид растворили в 41,65 мл 20% гидроксида калия (плотность 1,21 г/мл). Определите массы веществ (за исключением воды) в образующемся растворе.
Источник: В.Н. Доронькин, «Неорганическая химия», Тренировочная тетрадь, стр. 48.
Ответ: m(K2HPO4) = 10,44 г, m(K3PO4) = 4,24 г.
Решение (pdf файл)
Задача 6. Оксид фосфора (V) массой 2,84 г растворили в 60 г 18%-ной ортофосфорной кислоты и полученный раствор прокипятили. Какая соль и в каком количестве образуется, если к полученному раствору добавить 30 г гидроксида натрия?
Источник: В.Н. Доронькин, «Неорганическая химия», Тренировочная тетрадь, стр. 49.
Ответ: m(Na3PO4) = 24,6 г.
Решение (pdf файл)
1. Задачи на «тип соли» к вопросу 34 по спецификации ЕГЭ-2019
Доронькин В.Н.
2.
Вопрос 34
Расчёты массы (объёма, количества вещества) продуктов
реакции, если одно из веществ дано в избытке (имеет
примеси). Расчёты с использованием понятия «массовая
доля вещества в растворе».
Расчёты массовой или объёмной доли выхода продукта
реакции от теоретически возможного.
Расчёты массовой доли (массы) химического соединения в
смеси
2
3.
Комплект пособий для подготовки
к ЕГЭ по химии
(В.Н. Доронькин, А.Г. Бережная, Т.В. Сажнева, В.А. Февралева)
Полный ассортимент пособий на сайте www.legionr.ru
3
4.
Пример 1. Продукты полного сгорания 33,6 л (н.у.) сероводорода
пропустили через 250 мл 25%-ного раствора едкого натра плотностью 1,28
г/мл. Какая соль и в каком количестве образуется?
Дано:
V(H2S) = 33,6 л (н.у.)
Vр-ра(NaOH) = 250 мл
(NaOH) = 25% = 0,25
= 1,28 г/мл
соль — ?
Анализ и решение:
Основные формулы для расчёта:
n = mв-ва/Мв-ва
nг = VГ/VM
= mв-ва/mр-ра
= m/V
4
5.
Пример 1. Продукты полного сгорания 33,6 л (н.у.) сероводорода пропустили через
250 мл 25%-ного раствора едкого натра плотностью 1,28 г/мл. Какая соль и в каком
количестве образуется?
А) Проводим анализ условия.
1-й фрагмент: «… Продукты полного сгорания 44,8 л (н.у.)
сероводорода…»
Составляем уравнение реакции:
2H2S + 3O2 = 2SO2 + 2H2O (1)
2-й фрагмент: «.. Продукты полного сгорания 33,6л (н.у.) сероводорода
(SO2) пропустили через 250 мл 25%-ного раствора едкого натра.,..»
Уравнение этой реакции
SO2 + 2NaOH = Na2SO3 + H2O (2), и если SO2 – в избытке, то
SO2 + H2O + Na2SO3 = 2NaHSO3 (3)
3-й фрагмент: «… Какая соль и в каком количестве образуется?»
Химических превращений нет.
Очевидно, что могут образоваться Na2SO3, NaHSO3 или их смесь
5
6.
Пример 1. Продукты полного сгорания 33,6 л (н.у.) сероводорода пропустили через
250 мл 25%-ного раствора едкого натра плотностью 1,28 г/мл. Какая соль и в каком
количестве образуется?
2H2S + 3O2 = 2SO2 + 2H2O (1)
SO2 + 2NaOH = Na2SO3 + H2O (2)
SO2 + H2O + Na2SO3 = 2NaHSO3 (3)
Б) Устанавливаем логические связи.
1) 3-й фрагмент: «… Какая соль и в каком количестве образуется?»
Очевидно, что могут образоваться Na2SO3, NaHSO3 или их смесь
2) Количество вещества NaHSO3 связано с количеством SO2 и Na2SO3
(уравнение (3)).
Na2SO3 связан с SO2 и NaOH (уравнение (2)).
SO2 связан с H2S (уравнение (1))
6
7.
Пример 1. Продукты полного сгорания 33,6 л (н.у.) сероводорода пропустили через
250 мл 25%-ного раствора едкого натра плотностью 1,28 г/мл. Какая соль и в каком
количестве образуется?
В) План решения задачи.
2H2S + 3O2 = 2SO2 + 2H2O (1)
SO2 + 2NaOH = Na2SO3 + H2O (2)
SO2 + H2O + Na2SO3 = 2NaHSO3 (3)
1) Найти количество вещества сероводорода H2S и гидроксида натрия NaOH.
2) Найти количество оксида серы(IV) SO2 по уравнению (1).
3) Найти количество Na2SO3 по уравнению (2).
4) Найти количество NaHSO3 по уравнению (3).
7
8.
Пример 1. Продукты полного сгорания 33,6 л (н.у.) сероводорода пропустили через
250 мл 25%-ного раствора едкого натра плотностью 1,28 г/мл. Какая соль и в каком
количестве образуется?
2H2S + 3O2 = 2SO2 + 2H2O (1)
SO2 + 2NaOH = Na2SO3 + H2O (2)
SO2 + H2O + Na2SO3 = 2NaHSO3 (3)
Решение
1) Рассчитываем количество вещества H2S и NaOH.
а) n( H2S) = 33,6/22,4 = 1,5 моль
б) mр-раNaOH) = 1,28·250 = 320 г,
m(NaOH)чист. = 0,25·320 = 80 г
M(NaOH) = 40 г/моль, n(NaOH) = 80/40 = 2 моль
2) По уравнению (1).
2H2S + 3O2 = 2SO2 + 2H2O (1)
n(SO2) = n(H2S) = 1,5 моль
3) По уравнению (2).
SO2 + 2NaOH = Na2SO3 + H2O (2)
Проверяем «избыток-недостаток»
имеется SO2 – 1,5 моль
прореагирует SO2 – (1·2/1) = 1 моль
останется SO2 – (1,5 – 1) = 0,5 моль (избыток), расчёт по NaOH – по
недостатку)
8
9.
Пример 1. Продукты полного сгорания 33,6л (н.у.) сероводорода пропустили через
250 мл 25%-ного раствора едкого натра плотностью 1,28 г/мл. Какая соль и в каком
количестве образуется?
2H2S + 3O2 = 2SO2 + 2H2O (1)
SO2 + 2NaOH = Na2SO3 + H2O (2)
SO2 + H2O + Na2SO3 = 2NaHSO3 (3)
Решение
4) По уравнению (2).
n(Na2SO3) = 0,5n(NaOH) = 0,5·2 = 1 моль
5) По уравнению (3):
SO2 + H2O + Na2SO3 = 2NaHSO3 (3)
Проверяем «избыток-недостаток»
имеется Na2SO3 – 1 моль
прореагирует Na2SO3 – (1·0,5/1) = 0,5 моль
останется Na2SO3 – (1 – 0,5) = 0,5 моль (в избытке), расчёт по SO2 – по
недостатку)
n(NaHSO3) = 2n(SO2) = 2·0,5 = 1 моль
M(NaHSO3) = 104 г/моль, m(NaHSO3) = 2·104 = 208 г
6) Состав полученных веществ:
n(Na2SO3) = 0,5 моль,
n(NaHSO3) = 1,5 моль
9
10.
Пример 2. В 196 г 5%-ной серной кислоты растворили 24 г оксиды серы(VI) и к
полученному раствору добавили 22,4 г гидроксида калия. Определите
массовые доли веществ в полученном растворе и укажите реакцию среды в
нём.
Дано:
mр-ра(H2SO4) = 196г
(H2SO4) = 5% = 0,05
m(SO3) = 24 г
m(KOH) = 22,4 г
ω(веществ) — ?
среда — ?
Анализ и решение:
Основные формулы для расчёта:
n = mв-ва/Мв-ва
= mв-ва/mр-ра
10
11.
Пример 2. В 196г 5%-ной серной кислоты растворили 24 г оксиды серы(VI) и к полученному
раствору добавили 22,4 г гидроксида калия. Определите массовые доли веществ в полученном
растворе и укажите реакцию среды в нём.
А) Проводим анализ условия.
1-й фрагмент: В 196 г 5%-ной серной кислоты растворили 24 г оксиды серы(VI)»
Составляем уравнение реакции:
SO3 + H2SO4(р-р) ≠
SO3 + H2O = H2SO4 (1)
2-й фрагмент: «В 196 г 5%-ной серной кислоты растворили 24 г оксиды
серы(VI) и к полученному раствору добавили 22,4 г гидроксида калия. »
H2SO4 + KOH = KHSO4 + H2O (2), и если KOH – в избытке, то
KHSO4 + KOH = K2SO4 (3)
3-й фрагмент: «… Определите массовые доли веществ в полученном
растворе и укажите реакцию среды в нём.»
Химических превращений нет.
ω(соль) = m(соль)/mр-ра(соль)
Понятно, что mр-ра = mр-ра(H2SO4) + m(SO3) + m(KOH)
11
12.
Пример 2. В 196г 5%-ной серной кислоты растворили 24 г оксиды серы(VI) и к полученному
раствору добавили 22,4 г гидроксида калия. Определите массовые доли веществ в полученном
растворе и укажите реакцию среды в нём.
SO3 + H2SO4(р-р) ≠
SO3 + H2O = H2SO4 (1)
H2SO4 + KOH = KHSO4 + H2O (2)
KHSO4 + KOH = K2SO4 (3)
Б) Устанавливаем логические связи.
1) 3-й фрагмент: «Определите массовые доли веществ в полученном
растворе и укажите реакцию среды в нём»
Очевидно, что могут образоваться KHSO4, K2SO4 или их смесь в зависимости от
соотношения реагентов
2) Количество вещества K2SO4 связано с количеством KHSO4 и KOH (ур-е (3)).
3) KHSO4 связан с H2SO4 и KOH (ур-е (2)).
3) H2SO4 связана с SO3 (ур-е (1)) и H2SO4(чист.) в исходном растворе
12
13.
Пример 2. В 196г 5%-ной серной кислоты растворили 24 г оксиды серы(VI) и к полученному
раствору добавили 22,4 г гидроксида калия. Определите массовые доли веществ в полученном
растворе и укажите реакцию среды в нём.
SO3 + H2SO4(р-р) ≠
SO3 + H2O = H2SO4 (1)
H2SO4 + KOH = KHSO4 + H2O (2)
В) План решения задачи.
KHSO4 + KOH = K2SO4 (3)
1) Найти количество вещества SO3, H2SO4(чист.) и KOH.
2) Найти количество H2SO4 по уравнению (1).
3) Найти общее количество H2SO4 в полученном растворе.
4) Найти количество KHSO4 по уравнению (2).
5) Найти количество K2SO4 по уравнению (3).
6) Указать реакцию среды.
6) Вычислить ω(веществ) в растворе
13
14.
Пример 2. В 196г 5%-ной серной кислоты растворили 24 г оксиды серы(VI) и к полученному
раствору добавили 22,4 г гидроксида калия. Определите массовые доли веществ в полученном
растворе и укажите реакцию среды в нём.
SO3 + H2SO4(р-р) ≠
SO3 + H2O = H2SO4 (1)
H2SO4 + KOH = KHSO4 + H2O (2)
Решение
KHSO4 + KOH = K2SO4 (3)
1) Рассчитываем количество вещества SO3, H2SO4(чист) и KOH.
а) m(SO3) = 80 г/моль, n(SO3) = 24/80 = 0,3 моль
б) m(H2SO4)чист. = 0,05·196 = 9,8 г
M(H2SO4) = 98 г/моль, n(H2SO4) = 9,8 /98 = 0,1 моль
в) M(KOH) = 56 г/моль, n(KOH) = 22,4/56 = 0,4 моль
2) По уравнению (1).
SO3 + H2O = H2SO4 (1)
n(H2SO4)= n(SO2) = 0,3 моль
3) n(H2SO4)общее = 0,1 + 0,3 = 0,4 моль
14
15.
Пример 2. В 196г 5%-ной серной кислоты растворили 24 г оксиды серы(VI) и к полученному
раствору добавили 22,4 г гидроксида калия. Определите массовые доли веществ в полученном
растворе и укажите реакцию среды в нём.
SO3 + H2SO4(р-р) ≠
SO3 + H2O = H2SO4 (1)
H2SO4 + KOH = KHSO4 + H2O (2)
Решение
KHSO4 + KOH = K2SO4 (3)
4) По уравнению (2).
H2SO4 + KOH = KHSO4 + H2O (2)
Проверяем «избыток-недостаток»
имеется H2SO4 – 0,4 моль
прореагирует H2SO4 – (0,4·1/1) = 0,4 моль
останется H2SO4 – (0,4 – 0,4) = 0 моль (вещества прореагируют без остатка, по
уравнению (3) реакция не происходит)
n(KHSO4) = n(H2SO4) = n(KOH) = 0,4 моль
m(KHSO4) = 136 г/моль, m(K2SO4) = 0,4·136 = 54,4 г
15
16.
Пример 2. В 196г 5%-ной серной кислоты растворили 24 г оксиды серы(VI) и к полученному
раствору добавили 22,4 г гидроксида калия. Определите массовые доли веществ в полученном
растворе и укажите реакцию среды в нём.
SO3 + H2SO4(р-р) ≠
SO3 + H2O = H2SO4 (1)
H2SO4 + KOH = KHSO4 + H2O (2)
Решение
KHSO4 + KOH = K2SO4 (3)
5) Раствор имеет кислую реакцию, потому что KHSO4 – кислая соль сильной
кислоты H2SO4 и при диссоциации образует большое количество H+
KHSO4 = K+ + HSO4HSO4- = H+ + SO426) Находим массовые доли веществ в растворе:
состав раствора: KHSO4 = 54,4 г,
вода – остальное
mр-ра(KHSO4) = 196 + 24 + 22,4 = 242,4
ω(KHSO4) = 54,4/242,4 ≈ 0,2244, или 22,44%
ω(H2O) = 100 – 22,44 = 77,56%
16
Пройти тестирование по этим заданиям
Вернуться к каталогу заданий
Версия для печати и копирования в MS Word
1
Задания Д23 № 90
Установите соответствие между названием соли и ее отношением к гидролизу: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Название соли
А) Бромид хрома (III)
Б) Карбонат лития
В) Сульфат железа (II)
Г) Ацетат алюминия
Отношение к гидролизу
1) Гидролизуется по катиону
2) Гидролизуется по аниону
3) Гидролизуется и по катиону, и по аниону
4) Не гидролизуется
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Источник: Яндекс: Тренировочная работа ЕГЭ по химии. Вариант 1.
2
Задания Д23 № 133
Установите соответствие между формулой соли и типом ее гидролиза в водном растворе: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Тип гидролиза
1) Не гидролизуется
2) Гидролизуется по катиону
3) Гидролизуется по аниону
4) Гидролизуется и по катиону, и по аниону
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Источник: Яндекс: Тренировочная работа ЕГЭ по химии. Вариант 2.
3
Задания Д23 № 219
Установите соответствие между названием соли и отношением её к гидролизу: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
НАЗВАНИЕ СОЛИ
A) нитрат натрия
Б) фосфат натрия
B) сульфид калия
Г) нитрат алюминия
ОТНОШЕНИЕ К ГИДРОЛИЗУ
1) гидролизуется по катиону
2) гидролизуется по аниону
3) гидролизуется по катиону и аниону
4) не гидролизуется
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
4
Задания Д23 № 262
Установите соответствие между формулой соли и отношением ее к гидролизу: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ОТНОШЕНИЕ К ГИДРОЛИЗУ
1) гидролизуется по катиону
2) гидролизуется по аниону
3) гидролизуется по катиону и аниону
4) не гидролизуется
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
5
Задания Д23 № 305
Установите соответствие между солью и её отношением к гидролизу: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ОТНОШЕНИЕ К ГИДРОЛИЗУ
1) гидролизуется по катиону
2) гидролизуется по аниону
3) гидролизуется по катиону и аниону
4) не гидролизуется
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Пройти тестирование по этим заданиям
Задачи
на определение типа солей
1. 28,4
г оксида фосфора (V) растворили в 400
мл 3,95% -ного раствора едкого натра, имеющего плотность 1,02 г/см3.
Рассчитайте массовую долю соли в полученном растворе.
2. 327,8
мл 20%-ного раствора гидроксида натрия с плотностью раствора 1, 22 г/см3
полностью поглотили 11.2 л (н.у.) углекислого газа. Определите массовые доли
веществ в полученном растворе.
3. 288.4
мл 10%-ного раствора гидроксида натрия с плотностью раствора 1, 11 г/мл
полностью поглотили 4,48 л (н.у.) сероводорода. Рассчитайте массовую долю соли
в полученном растворе.
4. К
200г раствора ортофосфорной кислоты с массовой долей 9.8% прилили 430,8 мл
5%-ного раствора едкого кали, имеющего плотность 1,04 г/см3.
Рассчитайте массовую долю соли в полученном растворе.
5. Через
2 кг 9,8%-ного раствора серной кислоты пропустили 67,2 л (н.у.) аммиака. Определите
массовые доли солей в полученном растворе.
6. Продукты
полного сгорания 44,8 л (н.у.) сероводорода пропустили через 250 мл 25%-ного
раствора едкого натра плотностью 1,28 г/см3. Рассчитайте массовую
долю соли в полученном растворе.
7. Аммиак
объемом 8,96 л (н.у.) пропустили через 500 г 4,95% -ного раствора ортофосфорной
кислоты. Определите массовые доли солей в полученном растворе.
8. Для
восстановления железа из оксида железа (III)
было использовано 22.4 л (н.у.) угарного газа. Образовавшийся после реакции
газ пропустили через 1 л 3,15%-ного раствора едкого натра плотностью 1,033 г/см3.
Определите массовые доли солей в полученном растворе.
9. При
сгорании бутана образовалось 11.2 л (н. у.) углекислого газа. Определите объем
сожженного бутана и массовые доли веществ в растворе, образующемся при
пропускании продуктов горения через 500 мл 6,1%-ного раствора гидроксида калия
с плотностью раствора 1, 1 г/мл.
10. При
гидролизе 7.28 г фосфида кальция образовался газ, который сожгли в избытке
кислорода. Полученный оксид растворили в 41,65 мл 20%-ного раствора гидроксида
калия с плотностью 1,21 г/мл. Определите массы веществ (за исключением воды) в
полученном растворе.
11. Оксид
фосфора (V) массой 2,84 г
растворили в 60 г 18%-ой ортофосфорной кислоты и полученный раствор
прокипятили. Какая соль и в каком количестве образуется, если к полученному
раствору добавить 30 г едкого натра?
12. Газ,
полученный при взаимодействии 17.6 г сульфида железа (II)
с избытком серной кислоты, без остатка прореагировал с 138 мл 8% — ного
раствора гидроксида натрия с плотностью 1, 087 г/мл. Определите массовые доли
веществ в растворе после реакции.
13. 16
г оксида серы(VI) растворили в 50 г 19,6
%-ного раствора серной кислоты. В полученный раствор прибавили 16 г гидроксида
натрия. Определите массу образовавшейся соли.
14. Аммиак
объемом 4,48 л (н.у.) пропустили через 200 г 4,95% — ного раствора
ортофосфорной кислоты. Определите массовые доли солей в полученном растворе.
15. Оксид
фосфора (V) массой 5,68 г
растворили в 240 г 9 %-ной ортофосфорной кислоты и полученный раствор
прокипятили. Какая соль и в каком количестве образуется, если к полученному
раствору добавить 84 г едкого кали?
16. 32
г оксида серы(VI) растворили в 440 г 8
%-ного раствора серной кислоты. В полученный раствор прибавили 16 г гидроксида
натрия. Определите массу образовавшейся соли.
17. Газ,
полученный при сжигании 19.2 г серы, без остатка прореагировал с 682,5 мл 5%
-ного раствора гидроксида натрия с плотностью 1, 055 г/мл. Определите массовые
доли веществ в растворе после реакции.
18. 200
мл 7,4%-ного раствора гидроксида натрия с плотностью раствора 1, 08 г/см3
полностью поглотили 9.25 л (н.у.) сернистого газа. Определите массовые доли
веществ в полученном растворе.
Кислые и средние соли
09-Дек-2014 | комментария 4 | Лолита Окольнова
Задания на соли встречаются в ЕГЭ не только в части А, но и в части С.
Давайте разберем основные примеры задач на
кислые и средние соли
1. Определите, какое вещество, и в каком количестве образуется, если прореагировали (н.у.):
а) 0,2 моль Н2S и 0,2 моль КОН;
б) 2,24 л SO2 и 4 г NaOH;
в) 4,48 л СО2 и 7,4 г Са(ОН)2;
г) 4,48 л аммиака и 19,6 г серной кислоты;
д) 0,3 моль гидроксида натрия и 0,3 моль фосфорной кислоты;
е) 4,48 л аммиака и 100 г 9,8 %-ного раствора фосфорной кислоты;
ж) 14,2 г Р2О5 и 0,4 моль КОН;
з) 5,6 г оксида кальция и 0,2 моль серной кислоты.
Итак, как образуются кислые и средние соли?
Обычно это взаимодействие основного оксида или основания с кислотой или кислотным оксидом.
Какая соль образуется — зависит от соотношения реагентов
LiOH + H2SO3 = LiHSO3 + H2O (образовалась кислая соль)
(1 моль щелочи : 1 моль кислоты)
2LiOH + H2SO4 = Li2SO4 + 2H2O (образовалась средняя соль)
(2 моль щелочи : 1 моль кислоты)
Вывод:
- если в избытке основание, то образуется средняя соль;
- при эквимолярном соотношении — кислая соль
Обратите внимание — сравнивать нужно именно количества веществ — моли!
В нашем задании:
а) соотношение сероводорода и гидроксида калия 1:1, значит, получится кислая соль KHS;
б) 0,1 моль SO2 и 0,1 моль NaOH (формулы: n=mMr и т=VV м). Соль — NaHSO3
в) 0,2 моль CO2 и 0,1 моль Ca(OH)2:
CO2 + Ca(OH)2 = CaCO3 + H2O
Т.к. реагируют двухвалентный кальций и кислотный остаток имеет заряд -2, то образуется карбонат кальция — средняя соль
г) 0,2 моль NH3 и 0.2 моль H2SO4. Соотношение 1:1, значит, получится соль — NH4HSO4 — гидросульфат аммония;
д) NaOH и H3PO4. Соотношение 1:1. Получится NaH2PO4 — дигидрофосфат натрия — кислая соль;
e) 0.2 моль NH3 и 0.1 моль (см. формулу массовой доли ω). Аммиак в избытке, значит, получится средняя соль — (NH4)2SO4
ж) 0.1 моль P2O5 и 0,4 моль КОН
3KOH + H3PO4 = K3PO4 + 3H2O
Гидроксид калия дан в значительном избытке, значит, получится фософат калия — средняя соль
з) 0.1 моль CaO и 0.2 моль H2SO4
CaO + 2H2SO4 = Ca(НSO4)2 + H2O
2. Определить количества растворенных веществ в растворе, полученном пропусканием через 200 г 4 %-ного раствора гидроксида натрия при н.у.:
а) 1,12 л углекислого газа;
б) 2,24 л сернистого газа;
в) 3,36 л сероводорода;
г) 4,48 л углекислого газа;
д) 20 г SO3.
n(NaOH)=m(раствора)*ω Mr = 200 г*0.04 40 гмоль = 0.2 моль
Выпишем все уравнения:
CO2 + 2NaOH = Na2CO3 + H2O
0,05 0.2 —> 0,05 моль
SO2 + 2NaOH = Na2SO3 + H2O
0.1 0.2 —> 0.1 моль
H2S + NaOH = NHS + H2O
0,15 0.2 моль —> 0,15 моль
CO2 + NaOH = NaHCO3
0.2 0.2 —> 0.2 моль
SO3 + NaOH = NaHSO4
0.25 0.2 —> 0.2 моль
Количества вещества продукта реакции находим традиционно по недостатку.
Обсуждение: «Кислые и средние соли»
(Правила комментирования)
Подготовка к ЕГЭ
Расчёты по уравнениям реакций, происходящих в растворах
Общие принципы решения расчётных задач:
1.Составить уравнения реакций тех превращений, которые упоминаются в условии
2.Рассчитать количества и массы «чистых» веществ
3.Установить причинно-следственные связи между реагирующими веществами, то есть определить — количество какого вещества требуется найти, и по какому из реагирующих веществ будет производиться
расчёт
4. Произвести расчёты по уравнению(-ям) реакций, то есть рассчитать количество искомого вещества, после чего найти его массу (или объём).
5. Ответить на дополнительные вопросы, сформулированные в условии.
Массовая доля показывает отношение массы растворённого вещества к массе раствора:
р.в. = m р.в. / m р-ра Производные формулы:
m р.в. = m р-ра р.в. m р-ра = m р.в. / р.в.
Если в условии задачи указан объём раствора с определённой плотностью, то прежде всего находят массу раствора:
m р-ра = V р-ра , затем – массу растворённого вещества: m р.в. = m р-ра р.в.
Количество вещества находят по массе растворённого вещества:
= m р.в. / М
Рассмотрим некоторые типы задач с расчётами по уравнениям реакций, происходящих в растворах.
Нахождение массовых долей
растворённых веществ в растворе после реакции
•Найти количества реагирующих веществ
•Если задача на избыток и недостаток, то количества продуктов реакции находят по веществу, которое дано в недостатке.
•Один из важных моментов – это нахождение массы раствора после реакции (массы полученного раствора)
•Если вещество взаимодействует с веществом, находящимся в растворе, то складывают массу вещества и массу раствора; в случае, когда оба реагирующих вещества даны в виде растворов, складывают массы двух растворов. Если в результате реакции образуется осадок или газ, то из полученной суммы отнимают массу вещества, ушедшего из раствора в виде осадка или газа.
m р-ра получ. = m в. + m р-ра1 – m осадка (газа)
mр-ра получ. = m р-ра1 + m р-ра2 – m осадка (газа)
•При решении задач на избыток и недостаток нужно помнить о том, что в растворе после реакции будет находиться в растворённом виде не только продукт реакции, но и вещество, которое было дано в избытке.
•Чтобы найти количество вещества – избытка, нужно от исходного количества вещества отнять количество прореагировавшего вещества:
изб. = исх. — прор.
•Затем найти его массу и массовую долю в растворе полученном после реакции.

Примеры решения задач

Задачи для самостоятельного решения
•Задача 3: Карбонат кальция массой 10г растворили при нагревании в 150 мл хлороводородной кислоты ( = 1,04 г/мл) с массовой долей 9 %. Какова массовая доля хлороводорода в получившемся растворе?
Ответ: р.в. (HCl) = 4,2 %.
•Задача 4: 5,6г железа растворили в 100 мл 10 % — го раствора соляной кислоты ( = 1,05г/мл). Вычислите массовую долю хлороводорода в полученном растворе. Ответ: р.в.(HCl) = 2,9 %.
•Задача 5: 5,6г железа растворили в 200 мл раствора соляной кислоты ( = 1,05 г/мл) с массовой долей 10 %. Найти массовую долю соли в полученном растворе.
Ответ: р.в. (FeCl2) = 5,9 %.
•Задача 6: Смешали 110,4г раствора карбоната калия с концентрацией 25 % и 111г раствора хлорида кальция с концентрацией 20 %. Найти концентрацию вещества в полученном растворе.
Ответ: р.в. (KCl) = 14,8 %.
•Задача 7: Смешали 320г раствора сульфата меди (II) с концентрацией 5 % и 120 г раствора гидроксида натрия с концентрацией 10 %. Найти концентрации веществ в полученном растворе.
Ответ: р.в.(Na2SO4) = 3,3 %,
р.в. (NaOH) = 0,9 %.
•Задача 8: Раствор соляной кислоты объёмом 150 мл (w(HCl) = 16%, ρ = 1,08 г/мл) нейтрализовали твёрдым гидроксидом кальция. Определите массовую долю хлорида кальция в образовавшемся растворе.
Ответ: (CaCl2) = 20,9 %,
Определение состава продукта реакции (задачи на «тип соли»)
Определяем количества реагирующих веществ и соотношение этих веществ в реакции. Если в избытке кислота – образуется кислая соль, если щелочь – средняя соль.
•Задача 9: В избытке кислорода сожгли 8г серы. Полученный газ пропустили через 200г 8% раствора гидроксида натрия. Определите массовую долю солей в полученном растворе.
Ответ: (Na2SO3) = 8,75 %, (NaНSO3) = 4,8 %.
•Задача 10: Оксид фосфора(V) массой 1,42г растворили в 60г 8,2% ортофосфорной кислоты и полученный раствор прокипятили. Какая соль и в каком количестве образуется, если к полученному раствору добавить 3,92г гидроксида калия.
Ответ: n (KH2PO4) = 0,07моль.
•Задача 11: Аммиак объёмом 4,48л (н.у.) пропустили через 200г 4,9% раствора ортофосфорной кислоты. Назовите соль, образующуюся в результате реакции, и определите её массу.
Ответ: m((NH4)2HPO4) = 13,2г
Задачи на нахождение массы или объёма вещества, которое
нужно добавить к раствору другого вещества для того, чтобы изменилась его концентрация в результате произошедшей реакции.
В этом случае:
1)Нужно обозначить за x количество добавленного вещества – реагента.
2)Выразить через х количества прореагировавшего с ним вещества
иполученного в результате реакции газа или осадка.
3)Найти количество растворённого вещества в исходном растворе и его количество, оставшееся после реакции: оставш. = 1 — прор.
4)Выразить через х массы реагента, оставшегося в растворе вещества и осадка (газа).
5)Найти массу раствора, полученного после реакции:
m р-ра получ. = m реаг. + m р-ра1 – m осадка (газа)
mр-ра получ. = m р-ра1 + m р-ра2 – m осадка (газа).
6)Все данные подставить в формулу:
р.в.2 = m оставш. / m р-ра получ.
Найти количество вещества – реагента, его массу или объём.

Примеры решения задач

Соседние файлы в папке Вещества
- #
- #
- #
- #
- #
- #
- #