Задания
Версия для печати и копирования в MS Word
Установите соответствие между парами веществ и реагентом, с помощью которого их можно различить: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
РЕАГЕНТ
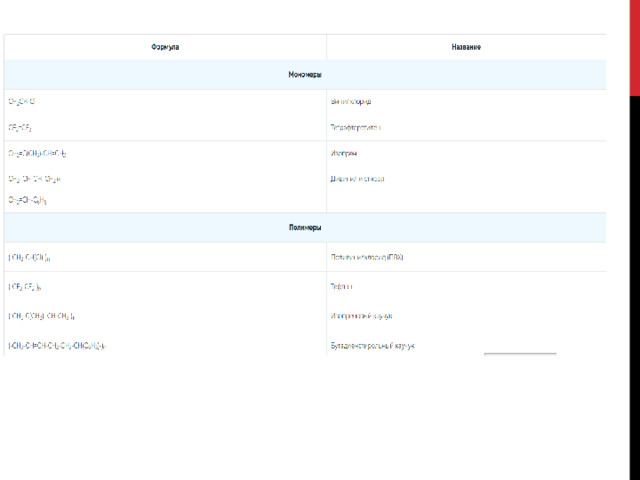
1)
2)
3) фенолфталеин
4)
5) (спирт. р-р)
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Спрятать решение
Решение.
Установим соответствие.
А) и
: из насыщенных карбоновых кислот только муравьиная окисляется перманганатом калия. (4.)
Б) и
: амины дают щелочную реакцию среды, фенолфталеин станет малиновым. (3.)
В) и
: только уксусная кислота будет реагировать с гидрокарбонатом натрия. (2.)
Г) и
: толуол и другие алкилбензолы, имеющие хотя бы один атом водорода при альфа-углеродном атоме заместителя, могут быть окислены до бензойной кислоты при помощи подкисленного раствора перманганата калия. (4.)
Ответ: 4324.
Общепринятые форматы листов бумаги обозначают буквой А и цифрой: А0, А1, А2 и так далее. Лист формата А0 имеет форму прямоугольника, площадь которого равна 1 кв. м. Если лист формата А0 разрезать пополам параллельно меньшей стороне, получается два равных листа формата А1. Если лист А1 разрезать так же пополам, получается два листа формата А2. И так далее.
Отношение большей стороны к меньшей стороне листа каждого формата одно и то же, поэтому листы всех форматов подобны. Это сделано специально для того, чтобы пропорции текста и его расположение на листе сохранялись при уменьшении или увеличении шрифта при изменении формата листа.
1. В таблице даны размеры (с точностью до мм) четырёх листов, имеющих форматы А0, А1, А3 и А4.
| Номер листа | Длина (мм) | Ширина (мм) |
|---|---|---|
| 1 | 297 | 210 |
| 2 | 420 | 297 |
| 3 | 1189 | 841 |
| 4 | 841 | 594 |
Установите соответствие между форматами и номерами листов. Заполните таблицу. В ответе запишите последовательность четырёх чисел без пробелов и других разделительных символов.
| Формат | A0 | A1 | A3 | A4 |
|---|---|---|---|---|
| Номер |
2. Сколько листов формата А3 получится из одного листа формата А2?
3. Найдите площадь (в см2) листа бумаги формата А1.
4. Найдите отношение длины большей стороны листа формата А2 к меньшей. Ответ округлите до сотых.
5. Бумагу формата А5 упаковали в пачки по 500 листов. Найдите массу (в граммах) пачки, если плотность бумаги равна 80 г/м2.
Чтобы поделиться, нажимайте
Реальный ЕГЭ по химии 2020. Задание 31
Представляем вашему вниманию задание 31 из реального ЕГЭ 2020 (основная волна и резервные дни — 16 июля 2020 года, 24 июля 2020) с подробными текстовыми решениями и ответами.
Реальный ЕГЭ 2020. Задание 31. Вариант 1
- Для выполнения задания используйте следующий перечень веществ: хромат калия, сернистый газ, нитрит калия, хлор, ацетат серебра (I), хлорид кальция. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите вещество, раствор которого окрашен. Запишите молекулярное, полное и сокращённое ионное уравнения реакции обмена с участием выбранного вещества, которая сопровождается выпадением осадка.
Развернуть/свернуть решение
K2CrO4 + 2CH3COOAg = 2CH3COOK + Ag2CrO4↓
2K+ + CrO42- + 2CH3COO— + 2Ag+ = 2CH3COO— + 2K+ + Ag2CrO4↓
CrO42- + 2Ag+ = Ag2CrO4↓
Реальный ЕГЭ 2020. Задание 31. Вариант 2
- Для выполнения задания используйте следующий перечень веществ: дигидрофосфат натрия, перманганат калия, азотная кислота, фосфин, сульфид меди (II), гидроксид стронция. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите два вещества, реакция ионного обмена между которыми приводит к образованию осадка. Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
Развернуть/свернуть решение
3NaH2PO4 + 3Sr(OH)2 = Sr3(PO4)2↓ + Na3PO4 + 6H2O
3Na+ + 3H2PO4— + 3Sr2+ + 6OH— = Sr3(PO4)2↓ + 3Na+ + PO43- + 6H2O
3H2PO4— + 3Sr2+ + 6OH— = Sr3(PO4)2↓ + PO43- + 6H2O
или
2NaH2PO4 + 3Sr(OH)2 = Sr3(PO4)2↓ + 2NaOH + 4H2O
2Na+ + 2H2PO4— + 3Sr2+ + 6OH— = Sr3(PO4)2↓ + 2Na+ + 2OH— + 4H2O
2H2PO4— + 3Sr2+ + 4OH— = Sr3(PO4)2↓ + 4H2O
Реальный ЕГЭ 2020. Задание 31. Вариант 3
- Для выполнения задания используйте следующий перечень веществ: азотная кислота, оксид меди (I), сероводород, ацетат аммония, оксид железа (III), оксид хрома (VI). Допустимо использование водных растворов веществ.
Из предложенного перечня выберите два вещества, реакция ионного обмена между которыми протекает без выделения газа и без выпадения осадка. Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
Развернуть/свернуть решение
HNO3 + CH3COONH4 = CH3COOH + NH4NO3
H+ + NO3— + CH3COO— + NH4+ = CH3COOH + NH4+ + NO3—
H+ + CH3COO— = CH3COOH
Реальный ЕГЭ 2020. Задание 31. Вариант 4
- Для выполнения задания используйте следующий перечень веществ: силикат натрия, нитрит калия, дихромат калия, серная кислота, иодид калия, ацетат аммония. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите два вещества, реакция ионного обмена между которыми протекает с выпадением осадка. Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
Развернуть/свернуть решение
Na2SiO3 + H2SO4 = H2SiO3↓ + Na2SO4
2Na+ + SiO32- + 2H+ + SO42- = H2SiO3↓ + 2Na+ + SO42-
2H+ + SiO32- = H2SiO3↓
Реальный ЕГЭ 2020. Задание 31. Вариант 5
- Для выполнения задания используйте следующий перечень веществ: перманганат калия, гидроксид калия, гидрокарбонат кальция, пероксид водорода, серная кислота, иодид калия. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите два вещества, реакция ионного обмена между которыми протекает с выпадением осадка, но без выделения газа. Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
Развернуть/свернуть решение
2KOH + Ca(HCO3)2 = CaCO3↓ + K2CO3 + 2H2O
2K+ + 2OH— + Ca2+ + 2HCO3— = CaCO3↓ + 2K+ + CO32- + 2H2O
2OH— + Ca2+ + 2HCO3— = CaCO3↓ + CO32- + 2H2O
Реальный ЕГЭ 2020. Задание 31. Вариант 6
- Для выполнения задания используйте следующий перечень веществ: перманганат калия, гидроксид хрома (III), хлор, сульфит аммония, бромоводород, гидроксид бария. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите два вещества, реакция ионного обмена между которыми протекает с выделением газа, но без выпадения осадка. Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
Развернуть/свернуть решение
(NH4)2SO3 + 2HBr = 2NH4Br + SO2↑ + H2O
2NH4+ + SO32- + 2H+ + 2Br— = 2NH4+ + 2Br— + SO2↑ + H2O
SO32- + 2H+ = SO2↑ + H2O
Реальный ЕГЭ 2020. Задание 31. Вариант 7
- Для выполнения задания используйте следующий перечень веществ: перманганат калия, гидроксид железа (II), пероксид водорода, дигидрофосфат магния, серная кислота, гидроксид калия. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите два вещества, реакция ионного обмена между которыми протекает с выпадением осадка. Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
Развернуть/свернуть решение
3Mg(H2PO4)2 + 12KOH = Mg3(PO4)2↓ + 4K3PO4 + 12H2O
3Mg2+ + 6H2PO4— + 12K+ + 12OH— = Mg3(PO4)2↓ + 12K+ + 4PO43- + 12H2O
3Mg2+ + 6H2PO4— + 12OH— = Mg3(PO4)2↓ + 4PO43- + 12H2O
Как ни странно, была защитана реакция с образованием осадка гидроксида магния и дигидрофосфата калия (что на самом деле маловероятно в щелочной среде). Поэтому привожу вам эту реакцию:
Mg(H2PO4)2 + 2KOH = Mg(OH)2↓ + 2KH2PO4
Mg2+ + 2H2PO4— + 2K+ + 2OH— = Mg(OH)2↓ + 2K+ + 2H2PO4—
Mg2+ + 2OH— = Mg(OH)2↓
Реальный ЕГЭ 2020. Задание 31. Вариант 8
- Для выполнения задания используйте следующий перечень веществ: азотная кислота, гидроксид железа (II), хлорат калия, ацетат серебра (I), оксид хрома (III), сероводород. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите два вещества, реакция ионного обмена между которыми протекает без видимых признаков. Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
Развернуть/свернуть решение
HNO3 + CH3COOAg = AgNO3 + CH3COOH
H+ + NO3— + CH3COO— = Ag+ + NO3— + CH3COOH
H+ + CH3COO— = CH3COOH
Реальный ЕГЭ 2020. Задание 31. Вариант 9
- Для выполнения задания используйте следующий перечень веществ: серная кислота, гидрокарбонат бария, сульфат калия, оксид меди (I), оксид марганца (IV), гидроксид калия. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите два вещества одного класса, реакция ионного обмена между которыми протекает с выпадением белого осадка и без выделения газа. Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
Развернуть/свернуть решение
Ba(HCO3)2 + K2SO4 = BaSO4↓ + 2KHCO3
Ba2+ + 2HCO3— + 2K+ + SO42- = BaSO4↓ + 2K+ + 2HCO3—
Ba2+ + SO42- = BaSO4↓
Реальный ЕГЭ 2020. Задание 31. Вариант 10
- Для выполнения задания используйте следующий перечень веществ: ацетат бария, гидросульфат натрия, оксид железа (II), пероксид водорода, гидроксид хрома (III), серная кислота. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите два вещества, реакция ионного обмена между которыми протекает с выпадением белого осадка, а одним из реагентов является кислая соль. Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
Развернуть/свернуть решение
1) 2NaHSO4 + (CH3COO)2Ba = BaSO4↓ + Na2SO4 + 2CH3COOH
2Na+ + 2HSO4— + 2CH3COO— + Ba2+ = BaSO4↓ + 2Na+ + SO42- + 2CH3COOH
2HSO4— + 2CH3COO— + Ba2+ = BaSO4↓ + SO42- + 2CH3COOH
или
2) NaHSO4 + (CH3COO)2Ba = BaSO4↓ + CH3COONa + CH3COOH
Na+ + HSO4— + 2CH3COO— + Ba2+ = BaSO4↓ + CH3COO— + Na+ + CH3COOH
HSO4— + CH3COO— + Ba2+ = BaSO4↓ + CH3COOH
Диссоциацию аниона HSO4— допустимо (хотя на мой взгляд, не желательно) записывать в виде H+ + SO42- (другие кислые ионы так расписывать НЕЛЬЗЯ). С учётом этого, можно было записать эти уравнения по-другому:
1) 2NaHSO4 + (CH3COO)2Ba = BaSO4↓ + Na2SO4 + 2CH3COOH
2Na+ + 2H+ + 2SO42- + 2CH3COO— + Ba2+ = BaSO4↓ + 2Na+ + SO42- + 2CH3COOH
2H+ + SO42- + 2CH3COO— + Ba2+ = BaSO4↓ + 2CH3COOH
или
2) NaHSO4 + (CH3COO)2Ba = BaSO4↓ + CH3COONa + CH3COOH
Na+ + H+ + SO42- + 2CH3COO— + Ba2+ = BaSO4↓ + CH3COO— + Na+ + CH3COOH
H+ + SO42- + CH3COO— + Ba2+ = BaSO4↓ + CH3COOH
Реальный ЕГЭ 2020. Задание 31. Вариант 11
- Для выполнения задания используйте следующий перечень веществ: гидроксид бария, сульфит калия, аммиак, нитрат серебра (I), перманганат калия, дигидрофосфат калия. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите два вещества, реакция ионного обмена между которыми протекает с выпадением белого осадка, а одним из реагентов является кислая соль. Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
Развернуть/свернуть решение
3KH2PO4 + 3Ba(OH)2 = Ba3(PO4)2↓ + K3PO4 + 6H2O
3K+ + 3H2PO4— + 3Ba2+ + 6OH— = Ba3(PO4)2↓ + 3K+ + PO43- + 6H2O
3H2PO4— + 3Ba2+ + 6OH— = Ba3(PO4)2↓ + PO43- + 6H2O
или
2KH2PO4 + 3Ba(OH)2 = Ba3(PO4)2↓ + 2KOH + 4H2O
2K+ + 2H2PO4— + 3Ba2+ + 6OH— = Ba3(PO4)2↓ + 2K+ + 2OH— + 4H2O
2H2PO4— + 3Ba2+ + 4OH— = Ba3(PO4)2↓ + 4H2O
Реальный ЕГЭ 2020. Задание 31. Вариант 12
- Для выполнения задания используйте следующий перечень веществ: гидрокарбонат магния, сульфит калия, сульфат железа (II), дихромат калия, фосфат кальция, серная кислота. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите два вещества, реакция ионного обмена между которыми протекает с выделением газа, но без выпадения осадка, а одним из реагентов является кислая соль. Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
Развернуть/свернуть решение
Mg(HCO3)2 + H2SO4 = MgSO4 + 2CO2↑ + 2H2O
Mg2+ + 2HCO3— + 2H+ + SO42- = Mg2+ + SO42- + 2CO2↑ + 2H2O
HCO3— + H+ = CO2↑ + H2O
Реальный ЕГЭ 2020. Задание 31. Вариант 13
- Для выполнения задания используйте следующий перечень веществ: перманганат калия, иодоводород, гидроксид бария, серная кислота, сульфит аммония, гидрофосфат натрия. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите два вещества, реакция ионного обмена между которыми протекает с выпадением осадка, а одним из реагентов является кислая соль. Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
Развернуть/свернуть решение
2Na2HPO4 + 3Ba(OH)2 = Ba3(PO4)2↓ + 4NaOH + 2H2O
4Na+ + 2HPO42- + 3Ba2+ + 6OH— = Ba3(PO4)2↓ + 4Na+ + 4OH— + 2H2O
2HPO42- + 3Ba2+ + 2OH— = Ba3(PO4)2↓ + 2H2O
или
6Na2HPO4 + 3Ba(OH)2 = Ba3(PO4)2↓ + 4Na3PO4 + 6H2O
12Na+ + 6HPO42- + 3Ba2+ + 6OH— = Ba3(PO4)2↓ + 12Na+ + 4PO43- + 6H2O
6HPO42- + 3Ba2+ + 6OH— = Ba3(PO4)2↓ + 4PO43- + 6H2O
Реальный ЕГЭ 2020. Задание 31. Вариант 14
- Для выполнения задания используйте следующий перечень веществ: хромат натрия, бромид натрия, нитрит натрия, серная кислота, ацетат серебра (I), хлорид аммония. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите вещество, раствор которого окрашен. Запишите молекулярное, полное и сокращённое ионное уравнения реакции обмена с участием выбранного вещества, которая сопровождается выпадением осадка.
Развернуть/свернуть решение
Na2CrO4 + 2CH3COOAg = 2CH3COONa + Ag2CrO4↓
2Na+ + CrO42- + 2CH3COO— + 2Ag+ = 2CH3COO— + 2Na+ + Ag2CrO4↓
CrO42- + 2Ag+ = Ag2CrO4↓
Реальный ЕГЭ 2020. Задание 31. Вариант 15
- Для выполнения задания используйте следующий перечень веществ: перманганат калия, гидроксид лития, бром, сульфит аммония, хлороводород, нитрат кальция. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите два вещества, реакция ионного обмена между которыми приводит к образованию слабого основания. Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
Развернуть/свернуть решение
2LiOH + (NH4)2SO3 = Li2SO3 + 2NH3∙H2O
2Li+ + 2OH— + 2NH4+ + SO32- = 2Li+ + SO32- + 2NH3∙H2O
NH4+ + OH— = NH3∙H2O
Реальный ЕГЭ 2020. Задание 31. Вариант 16
- Для выполнения задания используйте следующий перечень веществ: ацетат аммония, гидроксид натрия, перманганат натрия, хлороводород, нитрит натрия, оксид марганца (IV). Допустимо использование водных растворов веществ.
Из предложенного перечня выберите два вещества, реакция ионного обмена между которыми приводит к образованию слабого основания. Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
Развернуть/свернуть решение
CH3COONH4 + NaOH = CH3COONa + NH3∙H2O
CH3COO— + NH4+ + Na+ + OH— = CH3COO— + Na+ + NH3∙H2O
NH4+ + OH— = NH3∙H2O
Реальный ЕГЭ 2020. Задание 31. Вариант 17
- Для выполнения задания используйте следующий перечень веществ: ацетат бария, нитрит магния, сульфат железа (II), хромат калия, гидроксид меди (II), серная кислота. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите два вещества, реакция ионного обмена между которыми протекает без видимых изменений. Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
Развернуть/свернуть решение
H2SO4 + Mg(NO2)2 = MgSO4 + 2HNO2
2H+ + SO42- + Mg2+ + 2NO2— = Mg2+ + SO42- + 2HNO2
H+ + NO2— = HNO2
Реальный ЕГЭ 2020. Задание 31. Вариант 18
- Для выполнения задания используйте следующий перечень веществ: нитрат бария, сульфид калия, соляная кислота, нитрит натрия, перманганат калия, ацетат железа(II). Допустимо использование водных растворов веществ.
Из предложенного перечня выберите два вещества, реакция ионного обмена между которыми протекает с образованием осадка. Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
Развернуть/свернуть решение
K2S + (CH3COO)2Fe = FeS↓ + 2CH3COOK
2K+ + S2- + 2CH3COO— + Fe2+ = FeS↓ + 2CH3COO— + 2K+
Fe2+ + S2- = FeS↓
Реальный ЕГЭ 2020. Задание 31. Вариант 19
- Для выполнения задания используйте следующий перечень веществ: пероксид водорода, сульфид цинка, гидроксид калия, гидроксид хрома(III), сульфат аммония, хлорид бария. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите два вещества, реакция ионного обмена между которыми протекает с образованием слабого основания. Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
Развернуть/свернуть решение
2KOH + (NH4)2SO4 = K2SO4 + 2NH3∙H2O
2K+ + 2OH— + 2NH4+ + SO42- = 2K+ + SO42- + 2NH3∙H2O
NH4+ + OH— = NH3∙H2O
Реальный ЕГЭ 2020. Задание 31. Вариант 20
- Для выполнения задания используйте следующий перечень веществ: перманганат натрия, соляная кислота, сульфит натрия, хлорид бария, гидросульфат калия, бром. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите два вещества, реакция ионного обмена между которыми протекает без выделение газа, причём одно из реагирующих веществ является кислой солью. Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
Развернуть/свернуть решение
1) KHSO4 + BaCl2 = BaSO4↓ + KCl + HCl
K+ + HSO4— + Ba2+ + 2Cl— = BaSO4↓ + K+ + H+ + 2Cl—
HSO4— + Ba2+ = BaSO4↓ + H+
или
2) 2KHSO4 + BaCl2 = K2SO4 + BaSO4↓ + 2HCl
2K+ + 2HSO4— + Ba2+ + 2Cl— = 2K+ + SO42- + BaSO4↓ + 2H+ + 2Cl—
2HSO4— + Ba2+ = SO42- + BaSO4↓ + 2H+
Диссоциацию аниона HSO4— допустимо (хотя на мой взгляд, не желательно) записывать в виде H+ + SO42- (другие кислые ионы так расписывать НЕЛЬЗЯ). С учётом этого, можно было записать эти уравнения по-другому:
1) KHSO4 + BaCl2 = BaSO4↓ + KCl + HCl
K+ + H+ + SO42- + Ba2+ + 2Cl— = BaSO4↓ + K+ + H+ + 2Cl—
SO42- + Ba2+ = BaSO4↓
2) 2KHSO4 + BaCl2 = K2SO4 + BaSO4↓ + 2HCl
2K+ + 2H+ + 2SO42- + Ba2+ + 2Cl— = 2K+ + SO42- + BaSO4↓ + 2H+ + 2Cl—
SO42- + Ba2+ = BaSO4↓
Реальный ЕГЭ 2020. Задание 31. Вариант 21
- Для выполнения задания используйте следующий перечень веществ: сульфид железа(II), гидроксид калия, перманганат калия, серная кислота, нитрит калия, гидрокарбонат бария. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите два вещества, реакция ионного обмена между которыми протекает с выделением газа и без образования осадка. Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
Развернуть/свернуть решение
FeS + H2SO4 = FeSO4 + H2S↑
FeS + 2H+ + SO42- = Fe2+ + SO42- + H2S↑
FeS + 2H+ = Fe2+ + H2S↑
Реальный ЕГЭ 2020. Задание 31. Вариант 22
- Для выполнения задания используйте следующий перечень веществ: серная кислота, дихромат калия, сульфид меди(II), фосфин, гидроксид бария, ацетат аммония. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите два вещества, реакция ионного обмена между которыми протекает с выделением газа и без образования осадка. Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
Развернуть/свернуть решение
2CH3COONH4 + Ba(OH)2 = (CH3COO)2Ba + 2NH3↑ + 2H2O
2CH3COO— + 2NH4+ + Ba2+ + 2OH— =2CH3COO— + Ba2+ + 2NH3↑ + 2H2O
NH4+ + OH— =NH3↑ + H2O
Реальный ЕГЭ 2020. Задание 31. Вариант 23
- Для выполнения задания используйте следующий перечень веществ: сульфид меди(II), сера, цинк, азотная кислота, гидрокарбонат аммония, ацетат кальция. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите два вещества, реакция ионного обмена, если известно, что в реакцию вступает кислая соль. Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
Развернуть/свернуть решение
NH4HCO3 + HNO3 =NH4NO3 + CO2↑ + H2O
NH4+ + HCO3— + H+ + NO3— = NH4+ + NO3— + CO2↑ + H2O
H+ + HCO3— = CO2↑ + H2O
Резерв
Реальный ЕГЭ 2020 (резервные дни). Задание 31. Вариант 1
- Для выполнения задания используйте следующий перечень веществ: силикат калия, нитрит натрия, дихромат натрия, серная кислота, бромид натрия, ацетат аммония. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите два вещества, реакция ионного обмена между которыми протекает с образованием осадка. Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
Развернуть/свернуть решение
K2SiO3 + H2SO4 = H2SiO3↓ + K2SO4
2K+ + SiO32- +2H+ + SO42- = H2SiO3↓ + 2K+ + SO42-
2H+ + SiO32- = H2SiO3↓
Реальный ЕГЭ 2020 (резервные дни). Задание 31. Вариант 2
- Для выполнения задания используйте следующий перечень веществ: нитрит калия, перманганат калия, серная кислота, гидроксид калия, нитрат аммония, сульфид железа(II). Допустимо использование водных растворов веществ.
Из предложенного перечня выберите два вещества, реакция ионного обмена между которыми протекает с образованием слабого основания. Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
Развернуть/свернуть решение
NH4NO3 + KOH = KNO3 + NH3∙H2O
NH4+ + NO3— + K+ + OH— = K+ + NO3— + NH3∙H2O
NH4+ + OH— = NH3∙H2O
Реальный ЕГЭ 2020 (резервные дни). Задание 31. Вариант 3
- Для выполнения задания используйте следующий перечень веществ: перманганат калия, соляная кислота, сульфит калия, нитрат бария, гидросульфат аммония, йод. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите два вещества, реакция ионного обмена, если известно, что в реакцию вступает кислая соль, а в результате реакции газ не образуется. Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
Развернуть/свернуть решение
NH4HSO4 + Ba(NO3)2 = BaSO4↓ + NH4NO3 + HNO3
NH4+ + HSO4— + Ba2+ + 2NO3— = BaSO4↓ + NH4+ + NO3— + H+ + NO3—
HSO4— + Ba2+ = BaSO4↓ + H+
Реальный ЕГЭ 2020 (резервные дни). Задание 31. Вариант 4
- Для выполнения задания используйте следующий перечень веществ: сульфит бария, гидроксид натрия, перманганат натрия, серная кислота, нитрит натрия, гидрокарбонат магния. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите два вещества, реакция ионного обмена между которыми протекает с выделением газа, но без образования осадка. Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
Развернуть/свернуть решение
Mg(HCO3)2 + H2SO4 = MgSO4 + 2H2O + 2CO2↑
Mg2+ + 2HCO3— + 2H+ + SO42- = Mg2+ + SO42- + 2H2O + 2CO2↑
H+ + HCO3— = H2O + CO2↑
Реальный ЕГЭ 2020 (резервные дни). Задание 31. Вариант 5
- Для выполнения задания используйте следующий перечень веществ: оксид серы(IV), пероксид натрия, гидрофосфат натрия, аммиак, йодоводород, гидроксид натрия. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите два вещества, реакция ионного обмена, если известно, что в реакцию вступает кислая соль. Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
Развернуть/свернуть решение
Na2HPO4 + NaOH = Na3PO4 + H2O
2Na+ + HPO42- + Na+ + OH— = 3Na+ + PO43- + H2O
HPO42- + OH— = PO43- + H2O
Реальный ЕГЭ 2020 (резервные дни). Задание 31. Вариант 6
- Для выполнения задания используйте следующий перечень веществ: гидроксид бария, сероводород, аммиак, оксид серы(IV), перманганат натрия, дигидрофосфат натрия. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите два вещества, реакция ионного обмена, если известно, что в реакцию вступает кислая соль, а в результате реакции образуется белый осадок. Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
Развернуть/свернуть решение
2NaH2PO4 + 3Ba(OH)2 = Ba3(PO4)2↓ + 2NaOH + 4H2O
2Na+ + 2H2PO4— + 3Ba2+ + 6OH— = Ba3(PO4)2↓ + 2Na+ + 2OH— + 4H2O
2H2PO4— + 3Ba2+ + 4OH— = Ba3(PO4)2↓ + 4H2O
Реальный ЕГЭ 2020 (резервные дни). Задание 31. Вариант 7
- Для выполнения задания используйте следующий перечень веществ: гидрокарбонат магния, оксид кремния, нитрат аммония, серная кислота, графит, фосфин. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите два вещества, реакция ионного обмена, если известно, что в реакцию вступает кислая соль. Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
Развернуть/свернуть решение
Mg(HCO3)2 + H2SO4 = MgSO4 + 2H2O + 2CO2↑
Mg2+ + 2HCO3— + 2H+ + SO42- = Mg2+ + SO42- + 2H2O + 2CO2↑
H+ + HCO3— = H2O + CO2↑
Реальный ЕГЭ 2020 (резервные дни). Задание 31. Вариант 8
- Для выполнения задания используйте следующий перечень веществ: азотная кислота, оксид меди (I), оксид марганца (IV), хлорид железа (III), сера, фторид аммония. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите два вещества, реакция ионного обмена между которыми протекает с образованием осадка. Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
Развернуть/свернуть решение
FeCl3 + 3NH4F = FeF3↓ + 3NH4Cl
Fe3+ + 3Cl— + 3NH4+ + 3F— = FeF3↓ + 3NH4+ + 3Cl—
Fe3+ + 3F— = FeF3↓
Реальный ЕГЭ 2020 (резервные дни). Задание 31. Вариант 9
- Для выполнения задания используйте следующий перечень веществ: перманганат калия, гидрокарбонат натрия, сульфит натрия, сульфат бария, гидроксид калия, пероксид водорода. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите два вещества, реакция ионного обмена, если известно, что в реакцию вступает кислая соль. Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
Развернуть/свернуть решение
2NaHCO3 + 2KOH = Na2CO3 + K2CO3 + 2H2O
2Na+ + 2HCO3— + 2K+ + 2OH— = 2Na+ + CO32- + 2K+ + CO32- + 2H2O
HCO3— + OH— = CO32- + H2O
или
NaHCO3 + 2KOH = NaOH + K2CO3 + H2O
Na+ + HCO3— + 2K+ + 2OH— = Na+ + OH— + 2K+ + CO32- + H2O
HCO3— + OH— = CO32- + H2O
Также предлагаем вам плейлист видео-уроков и видео-объяснений заданий на эту тему:
А также вы можете получить доступ ко всем видео-урокам, заданиям реального ЕГЭ с подробными видео-объяснениями, задачам и всем материалам сайта кликнув:
- Посмотреть видео-объяснения решений всех типов задач вы можете здесь, нажав на эту строку
- Просмотреть задания ЕГЭ всех лет вы можете здесь, нажав на эту строку
- Посмотреть все видео-уроки вы можете здесь, нажав на эту строку
- Прочитать всю теорию для подготовки к ЕГЭ и ЦТ вы можете здесь, нажав на эту строку
- Все видео-объяснения вы можете найти на YouTube канале, нажав на эту строку
57 практических тренировочных заданий реакции ионного обмена задание №30 ЕГЭ 2022 из открытого источника ФИПИ по химии для 11 класса с ответами для подготовки к экзамену. Обсуждаем задания ниже в комментариях.
Скачать задания с ответами
Ответы опубликованы в конце файла.
Решу ЕГЭ 2022 по химии задание №30:
1)Из предложенного перечня веществ выберите вещества, между которыми протекает реакция ионного обмена. В ходе этой реакции наблюдается растворение осадка. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с использованием выбранных веществ. Перечень веществ: сера, гидроксид цинка, азотная кислота, гидроксид натрия, нитрат бария, хромат калия. Допустимо использование водных растворов.
2)Из предложенного перечня выберите вещества, между которыми протекает реакция ионного обмена. В ходе этой реакции образуется сильная кислота. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с использованием выбранных веществ. Перечень веществ: цинк, серная кислота, ацетат свинца, азотная кислота, карбонат калия, хлорид бария. Допустимо использование водных растворов.
3)Из предложенного перечня выберите вещества, между которыми протекает реакция ионного обмена c образованием осадка. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с использованием выбранных веществ. Перечень веществ: фторид натрия, дихромат калия, хлороводород, серная кислота, иодид лития, гидроксид железа (II). Допустимо использование водных растворов.
4)Из предложенного перечня выберите соль бескислородной кислоты и вещество, между которыми протекает реакция ионного обмена c образованием осадка. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с использованием выбранных веществ. Перечень веществ: ацетат стронция, гидроксид хрома (III), гипохлорит калия, сульфид натрия, гидроксид натрия, сульфат железа (III). Допустимо использование водных растворов.
5)Из предложенного перечня выберите слабый электролит и вещество, между которыми протекает реакция ионного обмена c образованием осадка. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с использованием выбранных веществ. Перечень веществ: фосфин, гидроксид железа (II), фторид натрия, концентрированная серная кислота, сульфат алюминия, аммиак. Допустимо использование водных растворов.
6)Из предложенного перечня выберите вещества, между которыми протекает реакция ионного обмена c образованием осадка. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с использованием выбранных веществ. Перечень веществ: оксид меди (I), нитрат цинка, серная кислота, перманганат калия, гидроксид натрия, иодоводоводород. Допустимо использование водных растворов.
7)Из предложенного перечня выберите вещества, между которыми протекает реакция ионного обмена c образованием сильной кислоты. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с использованием выбранных веществ. Перечень веществ: сернистый газ, оксид меди (II), серная кислота, перманганат калия, нитрат стронция, фторид калия. Допустимо использование водных растворов.
8)Из предложенного перечня выберите одноосновную кислоту и вещество, между которыми протекает реакция ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с использованием выбранных веществ. Перечень веществ: серная кислота, иодоводород, ацетат бария, нитрит калия, хлорид натрия, гидроксид железа (III). Допустимо использование водных растворов.
9)Из предложенного перечня выберите два вещества, между которыми протекает реакция ионного обмена с образованием слабого основания. Осадок в ходе этой реакции не образуется. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с использованием выбранных веществ. Перечень веществ: дихромат калия, серная кислота, гидроксид натрия, сульфит аммония, сульфат железа (II), гидроксид меди (II). Допустимо использование водных растворов.
10)Из предложенного перечня выберите два вещества, между которыми протекает реакция ионного обмена с выпадением осадка. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с использованием выбранных веществ. Перечень веществ: иодид калия, оксид меди (I), бромид серебра, перманганат калия, карбонат лития, нитрат кальция. Допустимо использование водных растворов.
11)Из предложенного перечня выберите кислую соль и вещество, между которыми протекает реакция ионного обмена. В ходе этой реакции выделяется газ. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с использованием выбранных веществ. Перечень веществ: фосфат натрия, хромат калия, азотная кислота, гидрокарбонат стронция, гидроксид натрия, графит. Допустимо использование водных растворов.
12)Из предложенного перечня выберите слабый электролит и соль, между которыми протекает реакция ионного обмена с выпадением в осадок гидроксида. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с использованием выбранных веществ. Перечень веществ: хромит калия, хлорид железа (II), аммиак, концентрированная серная кислота, бромоводород, гидроксид стронция. Допустимо использование водных растворов.
13)Из предложенного перечня выберите слабый электролит и вещество, между которыми протекает реакция ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с использованием выбранных веществ. Перечень веществ: фтороводород, гипохлорит калия, фосфин, гидроксид калия, нитрат серебра, сульфат бария. Допустимо использование водных растворов.
14)Из предложенного перечня выберите вещества, между которыми протекает реакция ионного обмена с образованием двух солей. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с использованием выбранных веществ. Перечень веществ: сернистый газ, хлорид меди (II), фосфор, серная кислота, ацетат калия, нитрат серебра. Допустимо использование водных растворов.
15)Из предложенного перечня выберите вещества, между которыми протекает реакция ионного обмена. В ходе этой реакции наблюдается растворение осадка. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с использованием выбранных веществ. Перечень веществ: гидросульфид бария, дихромат калия, гидроксид железа (III), азотная кислота, фторид калия, хлорид серебра. Допустимо использование водных растворов.
16)Из предложенного перечня выберите вещества, между которыми протекает реакция ионного обмена. В ходе этой реакции образуются нерастворимая соль и сильный электролит. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с использованием выбранных веществ. Перечень веществ: пероксид натрия, гидроксид калия, сульфат железа (II), ацетат бария, разбавленная серная кислота, углекислый газ. Допустимо использование водных растворов.
17)Из предложенного перечня выберите слабый электролит и вещество, между которыми протекает реакция ионного обмена. В ходе этой реакции образуются нерастворимая соль и сильный электролит. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с использованием выбранных веществ. Перечень веществ: концентрированная серная кислота, хлорид меди (II), карбонат кальция, сероводород, гидроксид железа (II), фторид аммония. Допустимо использование водных растворов.
18)Из предложенного перечня выберите вещества, между которыми протекает реакция ионного обмена. В ходе этой реакции образуются газ с резким запахом. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с использованием выбранных веществ. Перечень веществ: пероксид водорода, гидроксид натрия, хлорноватая кислота, оксид меди (I), сернистый газ, карбонат аммония. Допустимо использование водных растворов.
19)Из предложенного перечня выберите кислоту и вещество, между которыми протекает реакция ионного обмена. В ходе этой реакции в осадок выпадает гидроксид. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с использованием выбранных веществ. Перечень веществ: гидроксид калия, бромид натрия, силикат натрия, серная кислота, дихромат натрия, нитрат серебра. Допустимо использование водных растворов.
20)Из предложенного перечня выберите два вещества, между растворами которых протекает реакция ионного обмена. В ходе этой реакции осаждается гидроксид. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с использованием выбранных веществ. Перечень веществ: сульфит калия, тетрагидроксоцинкат натрия, серная кислота, перманганат калия, хлор, бромид бария. Допустимо использование водных растворов.
Другие тренировочные варианты ЕГЭ 2022 по химии:
Задание №2 ЕГЭ 2022 по химии 11 класс практика с ответами
Задание №1 ЕГЭ 2022 по химии практика с ответами
ПОДЕЛИТЬСЯ МАТЕРИАЛОМ
Задание 30. Реакция ионного обмена. ЕГЭ 2023 по химии
За это задание ты можешь получить 2 балла. На решение дается около 15 минут. Уровень сложности: высокий.
Средний процент выполнения: 54.9%
Ответом к заданию 30 по химии может быть развернутый ответ (полная запись решения с обоснованием выполненных действий).
Разбор сложных заданий в тг-канале
Задачи для практики
Задача 1
Для выполнения задания используйте следующий перечень веществ: цинк, пиросерная кислота, сульфат бария, сульфид калия, нитрат цинка. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите среднюю соль и вещество, которое вступает с ней в реакцию ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
Решение
$K_2S + Zn(NO_3)_2 = 2KNO_3 + ZnS$
$2K^{+} + S^{2–} + Zn^{2+} + 2NO_3^{–} = 2K^{+} + 2NO_3^{–} + ZnS$
$Zn^{2+} + S^{2–} = ZnS$
Ответ:
Задача 2
Для выполнения задания используйте следующий перечень веществ: хромит калия, хлор, гидроксид калия, хлорид калия, нитрат серебра. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите среднюю соль и вещество, которое вступает с ней в реакцию ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
Решение
$AgNO_3 + KCl = KNO_3 + AgCl$
$Ag^{+} + NO_3^{–} + K^{+} + Cl^{–} = K^{+} + NO_3^{–} + AgCl$
$Ag^{+} + Cl^{–} = AgCl$
Ответ:
Задача 3
Для выполнения задания используйте следующий перечень веществ: сульфид натрия, концентрированная азотная кислота, сульфат натрия, хлорид цинка, нитрат калия. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите среднюю соль и вещество, которое вступает с ней в реакцию ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
Решение
$Na_2S + ZnCl_2 = 2NaCl + ZnS$
$2Na^{+} + S^{2–} + Zn^{2+} + 2Cl^{–} = 2Na^{+} + 2Cl^{–} + ZnS$
$Zn^{2+} + S^{2–} = ZnS$
Ответ:
Задача 4
Для выполнения задания используйте следующий перечень веществ: нитрат натрия, йодид натрия, хлорид бария, серная кислота, йод. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите среднюю соль и вещество, которое вступает с ней в реакцию ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
Решение
$H_2SO_4 + BaCl_2 = 2HCl + BaSO_4$
$2H^{+} + SO_4^{2–} + Ba^{2+} + 2Cl^{–} = 2H^{+} + 2Cl^{–} + BaSO_4$
$Ba^{2+} + SO_4^{2–} = BaSO_4$
Ответ:
Задача 5
Для выполнения задания используйте следующий перечень веществ: карбонат калия, оксид марганца(IV), гидроксид калия, хлорид кальция, нитрат калия. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите среднюю соль и вещество, которое вступает с ней в реакцию ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
Решение
$K_2CO_3 + CaCl_2 = 2KCl + CaCO_3$
$2K^{+} + CO_3^{2–} + Ca^{2+} + 2Cl^{–} = 2K^{+} + 2Cl^{–} + CaCO_3$
$Ca^{2+} + CO_3^{2–} = CaCO_3$
Ответ:
Задача 6
Для выполнения задания используйте следующий перечень веществ: гипохлорит калия, оксид азота(II), едкое кали, хлорид цинка, нитрат калия. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите среднюю соль и вещество, которое вступает с ней в реакцию ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
Решение
$2KOH + ZnCl_2 = 2KCl + Zn(OH)_2$
$2K^{+} + 2OH^{–} + Zn^{2+} + 2Cl^{–} = 2K^{+} + 2Cl^{–} + Zn(OH)_2$
$Zn^{2+} + 2OH^{–} = Zn(OH)_2$
Ответ:
Задача 7
Для выполнения задания используйте следующий перечень веществ: сульфит натрия, йодат натрия, серная кислота, сульфат натрия, сульфид серебра. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите среднюю соль и вещество, которое вступает с ней в реакцию ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
Решение
$H_2SO_4 + Na_2SO_3 = Na_2SO_4 + H_2O + SO_2$
$2H^{+} + SO_4^{2–} + 2Na^{+} + SO_3^{2–} = 2Na^{+} + SO_4^{2–} + H_2O + SO_2$
$2H^{+} + SO_3^{2–} = H_2O + SO_2$
Ответ:
Задача 8
Для выполнения задания используйте следующий перечень веществ: перманганат калия, сульфат марганца(II), сернистый газ, гидроксид калия, сульфид серебра. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите среднюю соль и вещество, которое вступает с ней в реакцию ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
Решение
$2KOH + MnSO_4 = Mn(OH)_2↓ + K_2SO_4$
$2K^{+} + 2OH^{–} + Mn^{2+} + SO_4^{2–} = Mn(OH)_2 + 2K^{+} + SO_4^{2–}$
$Mn^{2+} + 2OH^{–} = Mn(OH)_2$
Ответ:
Задача 9
Для выполнения задания используйте следующий перечень веществ: аммиак, феррат натрия, серная кислота, гидроксокарбонат меди(II), сульфат натрия. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите оснóвную соль и вещество, которое вступает с ней в реакцию ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
Решение
$2H_2SO_4 + (CuOH)_2CO_3 = 3H_2O + CO_2↑ + 2CuSO_4$
$4H^{+} + 2SO_4^{2–} + (CuOH)_2CO_3= 3H_2O + CO_2 + 2Cu^{2+} + 2SO_4^{2–}$
$4H^{+} + (CuOH)_2CO_3= 3H_2O + CO_2 + 2Cu^{2+}$
Ответ:
Задача 10
Для выполнения задания используйте следующий перечень веществ: фосфор, нитрат натрия, хлорноватая кислота, гидрокарбонат натрия, сульфат бария. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите кислую соль и вещество, которое вступает с ней в реакцию ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
Решение
$HClO_3 + NaHCO_3 = NaClO_3 + H_2O + CO_2$
$H^{+} + ClO_3^{–} + Na^{+} + HCO_3^{–} = Na^{+} + ClO_3^{–} + H_2O + CO_2$
$H^{+} + HCO_3^{–} = H_2O + CO_2$
Ответ:
Задача 11
Для выполнения задания используйте следующий перечень веществ: гипохлорит натрия, аммиак, гидроксид натрия, хлорид алюминия, хлорид натрия. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите среднюю соль и вещество, которое вступает с ней в реакцию ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
Решение
$AlCl_3 + 3NaOH_{(недост.)} = Al(OH)_3 + 3NaCl$
$Al^{3+} + 3Cl^{–} + 3Na^{+} + 3OH^{–} = Al(OH)_3 + 3Na^{+} + 3Cl^{–}$
$Al^{3+} + 3OH^{–} = Al(OH)_3$
или
$AlCl_3 + 4NaOH_{(изб.)} = Na[Al(OH)_4] + 3NaCl$
$Al^{3+} + 3Cl^{–} + 4Na^{+} + 4OH^{–} = Na^{+} + [Al(OH)_4]^{–} + 3Na^{+} + 3Cl^{–}$
$Al^{3+} + 4OH^{–} = [Al(OH)_4]^{–}$
или
$AlCl_3 + 3NH_4OH = Al(OH)_3 + 3NaCl$
$Al^{3+} + 3Cl^{–} + 3NH_4OH = Al(OH)_3 + 3NH_4^{+} + 3Cl^{–}$
$Al^{3+} + 3NH_4OH = Al(OH)_3 + 3NH_4^{+}$
Ответ:
Задача 12
Для выполнения задания используйте следующий перечень веществ: сульфат хрома(III), гидроксид натрия, перекись водорода, сульфат свинца(II), карбонат кальция. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите среднюю соль и вещество, которое вступает с ней в реакцию ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
Решение
$Cr_2(SO_4)_3 + 6NaOH = 3Na_2SO_4 + 2Cr(OH)_3$
$2Cr^{3+} + 3SO_4^{2–} + 6Na^{+} + 6OH^{–} = 6Na^{+} + 3SO_4^{2–} + 2Cr(OH)_3$
$Cr^{3+} + 3OH^{–} = Cr(OH)_3$
Ответ:
Задача 13
Для выполнения задания используйте следующий перечень веществ: сульфат железа(II), серная кислота, азотная кислота, кремниевая кислота, гидроксид натрия. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите среднюю соль и вещество, которое вступает с ней в реакцию ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
Решение
$FeSO_4 + 2NaOH = Fe(OH)_2 + Na_2SO_4$
$Fe^{2+} + SO_4^{2–} + 2Na^{+} + 2OH^{–} = Fe(OH)_2 + 2Na^{+} + SO_4^{2–}$
$Fe^{2+} + 2OH^{–} = Fe(OH)_2$
Ответ:
Задача 14
Для выполнения задания используйте следующий перечень веществ: сульфит натрия, оксид кремния(IV), ортофосфат кальция, перманганат калия, нитрат бария. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите среднюю соль и вещество, которое вступает с ней в реакцию ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
Решение
$Na_2SO_3 + Ba(NO_3)_2 = 2NaNO_3 + BaSO_3$
$2Na^{+} + SO_3^{2–} + Ba^{2+} + 2NO_3^{–} = 2Na^{+} + 2NO_3^{–} + BaSO_3$
$Ba^{2+} + SO_3^{2–} = BaSO_3$
Ответ:
Задача 15
Для выполнения задания используйте следующий перечень веществ: йодид натрия, концентрированная серная кислота, карбонат калия, нитрат калия, сернистый газ. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите среднюю соль и вещество, которое вступает с ней в реакцию ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
Решение
$K_2CO_3 + H_2SO_4 = K_2SO_4 + H_2O + CO_2↑$
$2K^{+} + CO_3^{2–} + 2H^{+} + SO_4^{2–} = 2K^{+} + SO_4^{2–} + H_2O + CO_2$
$2H^{+} + CO_3^{2–} = H_2O + CO_2$
Ответ:
Задача 16
Для выполнения задания используйте следующий перечень веществ: нитрит калия, оксид хрома(VI), серная кислота, нитрат кальция, хлорид алюминия. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите среднюю соль и вещество, которое вступает с ней в реакцию ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
Решение
$Ca(NO_3)_2 + H_2SO_4 = CaSO_4 + 2HNO_3$
$Ca^{2+} + 2NO_3^{–} + 2H^{+} + SO_4^{2–} = CaSO_4 + 2H^{+} + 2NO_3^{–}$
$Ca^{2+} + SO_4^{2–} = CaSO_4$
Ответ:
Задача 17
Для выполнения задания используйте следующий перечень веществ: оксид хрома(III), нитрат калия, карбонат калия, гидросульфат натрия, хлорид натрия. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите среднюю соль и вещество, которое вступает с этой солью в реакцию ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
Решение
$K_2CO_3 + 2NaHSO_4 = K_2SO_4 + Na_2SO_4 + H_2O + CO_2$
$2K^{+} + CO_3^{2–} + 2Na^{+} + 2H^{+} + 2SO_4^{2–} = 2K^{+} + SO_4^{2–} + 2Na^{+} + SO_4^{2–} + H_2O + CO_2$
$2H^{+} + CO_3^{2–} = H_2O + CO_2$
Ответ:
Задача 18
Для выполнения задания используйте следующий перечень веществ: нитрат натрия, щавелевая кислота, серная кислота, нитрат бария, перманганат калия. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите кислоту и вещество, которое вступает с этой кислотой в реакцию ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
Решение
$H_2SO_4 + Ba(NO_3)_2 = 2HNO_3 + BaSO_4$
$2H^{+} + SO_4^{2–} + Ba^{2+} + 2NO_3^{–} = 2H^{+} + 2NO_3^{–} + BaSO_4$
$Ba^{2+} + SO_4^{2–} = BaSO_4$
Ответ:
Задача 19
Для выполнения задания используйте следующий перечень веществ: нитрит натрия, сульфат кальция, серная кислота, хлорид железа(II), нитрат бария. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите среднюю соль и вещество, которое вступает с этой солью в реакцию ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
Решение
$H_2SO_4 + Ba(NO_3)_2 = 2HNO_3 + BaSO_4$
$2H^{+} + SO_4^{2–} + Ba^{2+} + 2NO_3^{–} = 2H^{+} + 2NO_3^{–} + BaSO_4$
$Ba^{2+} + SO_4^{2–} = BaSO_4$
Ответ:
Задача 20
Для выполнения задания используйте следующий перечень веществ: нитрат натрия, гидроксид натрия, сульфид меди(II), сульфат цинка, оксид хрома(III). Допустимо использование водных растворов веществ.
Из предложенного перечня выберите среднюю соль и вещество, которое вступает с этой солью в реакцию ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
Решение
$2NaOH + ZnSO_4 = Zn(OH)_2↓ + Na_2SO_4$
$2Na^{+} + 2OH^{–} + Zn^{2+} + SO_4^{2–} = Zn(OH)_2 + 2Na^{+} + SO_4^{2–}$
$2OH^{–} + Zn^{2+} = Zn(OH)_2$
Ответ:
Рекомендуемые курсы подготовки
На уроке рассмотрено решение 25 задания ЕГЭ по информатике: дается подробное объяснение и разбор заданий демонстрационных вариантов и досрочных экзаменов
Содержание:
- Объяснение задания 25 ЕГЭ по информатике
- Алгоритмизация и программирование
- Решение 25 заданий ЕГЭ по информатике
- Делители числа
- Простые числа
- Задания прошлых лет для тренировки (до 2021)
- Задачи с поэлементной обработкой массива
- Задачи на обработку элементов массива с последующей заменой
- Задачи на обработку пар элементов массива (два подряд идущих)
- Задачи на обработку трёх подряд идущих элементов массива (тройки элементов массива)
- Задачи на поиск максимума, минимума элементов массива и другие
- Решение 25 заданий ЕГЭ по информатике: более сложные задания
25-е задание: «Программная обработка целочисленной информации»
Уровень сложности
— высокий,
Требуется использование специализированного программного обеспечения
— да,
Максимальный балл
— 2,
Примерное время выполнения
— 20 минут.
Проверяемые элементы содержания: Умение создавать собственные программы (10–20 строк) для обработки целочисленной информации
Рекомендации по выполнению:
«В этом задании требуется написать фрагмент программы, реализующий простую обработку целочисленного массива. У экзаменуемых, хорошо освоивших технику программирования, это задание обычно не вызывает серьёзных затруднений, поскольку алгоритм обработки массива не относится к сложным»
Типичные ошибки и рекомендации по их предотвращению:
«Часто бывает, что увлекшись написанием решения, экзаменуемый совершает ошибки в простых ситуациях: организация ввода-вывода, описание и инициализация переменных, обработка массива (выход за границу) и т.д. Эти ошибки могут стоить Вам нескольких баллов, старайтесь их не допускать»
ФГБНУ «Федеральный институт педагогических измерений»
Алгоритмизация и программирование
Для решения задания требуется вспомнить темы:
- Одномерные массивы.
- Двумерные массивы.
Решение 25 заданий ЕГЭ по информатике
Плейлист видеоразборов задания на YouTube:
Задание демонстрационного варианта 2022 года ФИПИ
Делители числа
25_7:
Напишите программу, которая ищет среди целых чисел, принадлежащих числовому отрезку [126849; 126871], числа, имеющие ровно 4 различных делителя.
Выведите эти четыре делителя для каждого найденного числа в порядке возрастания.
✍ Решение:
-
✎ Решение (неоптимизированный вариант, метод полного перебора):
- Будем использовать оптимизированный вариант программы, подходящий для «медленных» компьютеров. Для этого перебор делителей для числа
nбудем выполнять от2до√n, округлив его до ближайшего целого числа (не включая точный квадратный корень, если он существует):
PascalABC.net:
|
||
Python:
|
||
| С++: |
✎ Решение (оптимизированный вариант):
вместо диапазона делителей [1; число] использовать диапазон [1; округл(√n)]
n), то в список делителей добавлять будем только сам делитель, если нет – то добавляем пару делителей (делитель и n // делитель):Пример: число 8 = 2 * 4 Достаточно рассмотреть цикл от 2 до округл(√8) (=2) если 8 делится на 2 и 8/2 не равно 2, то делители: 2 и 4 (8/2)
PascalABC.net:
|
||
Python:
|
||
| С++: |
✎ Решение: Генерация списка делителей.
Общая идея:
| PascalABC.net: |
Python:
for n in range(126849, 126871+1): divs = [d for d in range(1, n+1) if n % d == 0] if len(divs) == 4: print( *divs ) |
| С++: |
Ответ:
1 3 42283 126849 1 47 2699 126853 1 5 25373 126865 1 293 433 126869
25_8:
Напишите программу, которая ищет среди целых чисел, принадлежащих числовому отрезку [164700; 164752], числа, имеющие ровно 6 различных делителей.
Выведите эти делители для каждого найденного числа в порядке возрастания.
✍ Решение:
-
✎ Решение (оптимизированный вариант):
- Для каждого числа указанного диапазона генерируем список делителей.
- Если длина списка равна четырем, выводим его.
PascalABC.net:
|
||
Python:
|
||
| С++: |
✎ Решение: Генерация списка делителей.
Общая идея:
| PascalABC.net: |
Python:
for n in range(164700, 164752+1): divs = [d for d in range(1, n+1) if n % d == 0] if len(divs) == 6: print( *divs ) |
| С++: |
Ответ:
1 2 4 41177 82354 164708 1 3 9 18301 54903 164709 1 2 4 41179 82358 164716 1 2 4 41183 82366 164732
25_9:
Напишите программу, которая ищет среди целых чисел, принадлежащих числовому отрезку [190201; 190230], числа, имеющие ровно 4 различных делителя.
Выведите эти четыре делителя для каждого найденного числа в порядке убывания.
✍ Решение:
-
✎ Решение (неоптимизированный вариант, метод полного перебора):
- Для каждого числа указанного диапазона генерируем список делителей.
- Если длина списка равна четырем, выводим его.
PascalABC.net:
|
||
Python:
|
||
| С++: |
✎ Решение (оптимизированный вариант):
PascalABC.net:
|
||
Python:
|
||
| С++: |
✎ Решение: Генерация списка делителей.
Общая идея:
| PascalABC.net: |
Python:
for n in range(190201, 190230+1): divs = [d for d in range(1, n+1) if n % d == 0] if len(divs) == 4: divs.reverse() # реверсируем (по убыванию) print( *divs ) |
| С++: |
Ответ:
190201 17291 11 1 190202 95101 2 1 190214 95107 2 1 190219 853 223 1 190222 95111 2 1 190223 17293 11 1 190227 63409 3 1 190229 14633 13 1
Видеоразбор задания:
📹 YouTube здесь
📹 Видеорешение на RuTube здесь
25_10:
Напишите программу, которая ищет среди целых чисел, принадлежащих числовому отрезку [190201; 190280], числа, имеющие ровно 4 различных ЧЁТНЫХ делителя.
Выведите эти четыре делителя для каждого найденного числа в порядке убывания.
✍ Решение:
-
✎ Решение (неоптимизированный вариант, метод полного перебора):
- Для каждого числа указанного диапазона генерируем список делителей.
- Если длина списка равна четырем, выводим его.
PascalABC.net:
|
||
Python:
|
||
| С++: |
✎ Решение: Генерация списка делителей.
Общая идея:
| PascalABC.net: |
Python:
for n in range(190201, 190280+1): divs = [d for d in range(1, n+1) if n % d == 0 and d % 2 == 0] if len(divs) == 4: divs.reverse() print( *divs ) |
| С++: |
Ответ:
190226 838 454 2 190234 17294 22 2 190238 2606 146 2 190252 95126 4 2 190258 758 502 2 190274 27182 14 2 190276 95138 4 2
25_11:
Напишите программу, которая ищет среди целых чисел, принадлежащих числовому отрезку [394441; 394505], числа, имеющие максимальное количество различных делителей. Если таких чисел несколько, то найдите минимальное из них.
Выведите количество делителей найденного числа и два наибольших делителя в порядке убывания.
✍ Решение:
-
✎ Решение (неоптимизированный вариант, метод полного перебора):
PascalABC.net:
|
||
Python:
|
||
| С++: |
✎ Решение (Генерация списка делителей):
| PascalABC.net: | ||
Python:
|
||
| С++: |
Ответ: 48 394450 197225
Видео
Простые числа
25_12:
Напишите программу, которая ищет среди целых чисел, принадлежащих числовому отрезку [3532000; 3532160], простые числа.
Выведите все найденные простые числа в порядке убывания, слева от каждого числа выведите его номер по порядку.
✍ Решение:
-
✎ Решение (неоптимизированный вариант, метод полного перебора):
PascalABC.net:
|
||
Python:
|
||
| С++: |
✎ Решение (оптимизированный вариант):
PascalABC.net:
|
||
Python:
|
||
| С++: |
Ответ:
1 3532147 2 3532121 3 3532103 4 3532091 5 3532049 6 3532033 7 3532021 8 3532019 9 3532007
Задания прошлых лет для тренировки (до 2021)
Задачи с поэлементной обработкой массива
25_1: ЕГЭ по информатике 2017 года (один из вариантов со слов выпускника):
Дан целочисленный массив из 20 элементов. Элементы массива могут принимать целые значения от 0 до 10 000 включительно. Опишите на естественном языке или на одном из языков программирования алгоритм, позволяющий найти и вывести количество элементов массива НЕ кратных 3.
Исходные данные объявлены так, как показано ниже. Запрещается использовать переменные, не описанные ниже, но использовать все описанные переменные не обязательно.
1 2 3 4 5 6 7 8 |
const N = 20; var i,j,k:integer; a:array [1..N] of integer; begin for i:=1 to N do readln(a[i]); … end. |
✍ Решение:
Рассмотрим заданный фрагмент решения:
- в цикле со счетчиком i запрашиваются значения элементов массива, т.е. формируется массив;
- из постановки задания видим, что необходимо найти количество чего-то, это значит, что нужно использовать переменную счетчик;
- объявлены три целочисленных переменных: i, j, k; переменная i использована в первом цикле, значит для счетчика можно взять переменную k;
- счетчик всегда нужно обнулять, поэтому следующим оператором будет:
- определим, количество чего нам необходимо считать: количество элементов массива не кратных 3. Кратность можно определить через остаток от деления: если значение элемента массива при делении на 3 в остатке не возвращает 0, значит элемент не кратен трем;
- остаток при делении в паскале — оператор mod. Поскольку необходимо просмотреть каждый элемент массива, то это нужно делать в цикле for;
- переменная i уже использована в первом цикле for, значит, для очередного цикла возьмем неиспользованную переменную j:
- если условие истинно (т.е. нашелся элемент массива, не кратный трем), то увеличиваем счетчик:
- после цикла остается вывести значение счетчика, т.е. вывести количество элементов массива не кратных 3:
for j:=1 to N do if a[j] mod 3 <> 0 then
Результат:
k:=0; for j:=1 to N do if a[j] mod 3 <> 0 then inc(k); writeln(k);
Смотрите видео с подробным объяснением и разбором данного 25 задания:
📹 YouTube здесь
📹 Видеорешение на RuTube здесь
Задачи на обработку элементов массива с последующей заменой
25_3: Решение 25 задания ЕГЭ по информатике Демоверсия 2018:
Дан целочисленный массив из 30 элементов. Элементы массива могут принимать целые значения от 0 до 10000 включительно. Опишите на одном из языков программирования алгоритм, который находит количество элементов массива, больших 100 и при этом кратных 5, а затем заменяет каждый такой элемент на число, равное найденному количеству. Гарантируется, что хотя бы один такой элемент в массиве есть. В качестве результата необходимо вывести измененный массив, каждый элемент массива выводится с новой строчки.
Например, для массива из шести элементов: 4 115 7 195 25 106
программа должна вывести числа 4 2 7 2 25 106
Исходные данные объявлены так, как показано ниже на примерах для некоторых языков программирования. Запрещается использовать переменные, не описанные ниже, но разрешается не использовать некоторые из описанных переменных.
Паскаль:
1 2 3 4 5 6 7 8 9 10 |
const N = 30; var a: array [1..N] of longint; i, j, k: longint; begin for i := 1 to N do readln(a[i]); ... end. |
В качестве ответа Вам необходимо привести фрагмент программы, который должен находиться на месте многоточия. Вы можете записать решение также на другом языке программирования (укажите название и используемую версию языка программирования, например Free Pascal 2.6). В этом случае Вы должны использовать те же самые исходные данные и переменные, какие были предложены в условии.
Похожие задания для тренировки
✍ Решение:
-
Решение на языке Паскаль:
1 2 3 4 5 6 7 8 9 |
k := 0; for i := 1 to N do if (a[i] > 100) and (a[i] mod 5 = 0) then k:=k+1; for i := 1 to N do begin if (a[i] > 100) and (a[i] mod 5 = 0) then a[i] := k; writeln(a[i]) end |
25_6:
Дан массив, содержащий неотрицательные целые числа. Необходимо вывести:
Например, для массива из шести элементов: 4 6 12 17 3 8
ответом будет 12 — наибольшее чётное число, поскольку чётных чисел в этом массиве больше
Исходные данные объявлены так, как показано ниже. Запрещается использовать переменные, не описанные ниже, но разрешается не использовать некоторые из описанных переменных.
Python:
1 2 3 4 5 6 |
# допускается также использовать # целочисленные переменные j, k, m a = [] n = 2000 // менять значение n нельзя for i in range(0, n): a.append(int(input())) |
✍ Решение:
-
Решение на языке Python:
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 |
a = [] n = 2000 // менять значение n нельзя for i in range(0, n): a.append(int(input())) j = 0 k = 0 m = 0 for i in range(0, n): if a[i]%2 == 0: j+=1 else: k+=1 if k>j: j = 0 for i in range(0, n): if a[i]>j and a[i] % 2 != 0: j = a[i] print(j) else: for i in range(0, n): if a[i]>m and a[i] % 2 == 0: m = a[i] print(m) |
Задачи на обработку пар элементов массива (два подряд идущих)
25_4:
Дан целочисленный массив из 40 элементов. Элементы массива могут принимать целые значения от 0 до 10 000 включительно. Опишите на естественном языке или на одном из языков программирования алгоритм, позволяющий найти и вывести количество пар элементов массива, в которых одно из чисел двузначное. В данной задаче под парой подразумевается два подряд идущих элемента массива.
Например, для массива из семи элементов: 13; 323; 12; 33; 117 — ответ: 4.
Исходные данные объявлены так, как показано ниже. Запрещается использовать переменные, не описанные ниже, но разрешается не использовать некоторые из описанных переменных.
1 2 3 4 5 6 7 8 9 10 |
const N = 40; var a: array [1..N] of integer; i, j, k: integer; begin for i := 1 to N do readln(a[i]); ... end. |
✍ Решение:
1 2 3 4 5 |
k := 0; for i := 1 to N - 1 do if ((a[i] < 100) and (a[i] > 9)) or ((a[i + l] < 100) and (a[i + 1] > 9)) then inc(k); writeln(k); |
25_5:
Дан целочисленный массив из 20 элементов. Элементы массива могут принимать целые значения от -10 000 до 10 000 включительно. Опишите алгоритм, позволяющий найти и вывести количество пар элементов массива, в которых сумма элементов делится на 2, но не делится на 4. В данной задаче под парой подразумевается два подряд идущих элемента массива.
Исходные данные объявлены так, как показано ниже. Запрещается использовать переменные, не описанные ниже, но разрешается не использовать некоторые из описанных переменных.
Python:
1 2 3 4 5 6 7 |
# допускается также использовать # две целочисленные переменные # j и k a = [] n = 20 for i in range(0, n): a.append(int(input())) |
✍ Решение:
-
Проанализируем данный фрагмент кода на языке Python:
- В первой строчке кода объявляется список а. Дальше, идет объявление переменной n = 20, она отвечает за размер массива.
- Ниже мы видим инициализацию списка а. Мы должны дописать код дальнейшей программы, который последует после заполнения списка пользователем.
- Итак, по условию мы должны находить пары элементов, сумма которых делится на 2, но не делится на 4, причем парами считаются соседние элементы, например:
a[0]иa[1],a[1]иa[2]. - Мы можем узнать, делится ли данный элемент на число, если остаток от деления на него равен 0, и не делится — в противном случае. Тогда сумма соседних элементов при делении на 2 должна давать остаток 0, а при делении на 4 наоборот — отличный от 0.
- Введем цикл, который будет перебирать все элементы массива, считать сумму соседей и проверять истинность условия.
- Когда мы определились с условием, за счетчик возьмем переменную
k, которую допустимо брать исходя из комментариев к программе. - Мы добавили допустимую переменную
j, чтобы условный оператор выглядел компактнее. - Однако задача еще не решена. Во-первых, мы должны до цикла инициализировать счетчик
k = 0. Так как иначе Python выдаст ошибку. - Кроме того, добавим вывод результата после цикла.
- Таким образом, правильный вариант с учетом доработок:
При решении такого рода задач, необходимо помнить, что массив в Python — это список и это динамический тип данных. Кроме того, нумерация элементов массива начинается с 0.
for i in range(0, n-1): j = a[i] + a[i+1] if j%2 == 0 and j%4 != 0:
Так как мы рассматриваем элемент a[i + 1], значит, цикл должен работать до n — 1, чтобы не выйти за границы диапазона массива.
... if j%2 == 0 and j%4 != 0: k+=1
Дело в том, что мы пытаемся присвоить переменной k его же значение, но на 1 больше, но интерпретатор «не встречал» раньше переменной k, из-за чего возникает ошибка.
a = [] n = 20 for i in range(0, n): a.append(int(input())) k = 0 for i in range(0, n - 1): j = a[i] + a[i + 1] if j%2 == 0 and j%4 != 0: k += 1 print(k)
Задачи на обработку трёх подряд идущих элементов массива (тройки элементов массива)
25_2:
Дан целочисленный массив из 40 элементов. Элементы массива могут принимать целые значения от 0 до 10 000 включительно. Опишите на естественном языке или на одном из языков программирования алгоритм, позволяющий найти и вывести количество троек элементов массива, состоящих из равных между собой чисел. В данной задаче под тройкой подразумевается три подряд идущих элемента массива.
Например, для массива из семи элементов: 2; 2; 2; 4; 4; 4; 4 — ответ: 3.
Исходные данные объявлены так, как показано ниже. Запрещается использовать переменные, не описанные ниже, но разрешается не использовать некоторые из описанных переменных.
1 2 3 4 5 6 7 8 9 10 |
const N=40; var a: array[1..N] of integer; i, j, k:integer; begin for i:=1 to N do readln(a[i]); ... end. |
✍ Решение:
- из постановки задания видим, что необходимо искать количество чего-то, это значит, что нужно использовать переменную счетчик; возьмем для нее объявленную переменную k;
- счетчик всегда нужно сначала обнулять, поэтому следующим оператором будет:
- определим, количество чего нам необходимо считать: количество троек элементов массива, состоящих из равных между собой чисел. Т.е. необходимо сравнивать между собой каждые три подряд идущих элемента массива, например так:
- inc(k) — оператор, увеличивающий счетчик k на единицу;
- условие необходимо выполнять в цикле, так как нужно проверить все элементы массива; цикл со счетчиком необходимо организовать от 1 до N-2, в противном случае индексы элементов a[i+2] выйдут за границы диапазона массива (например, при i = 40, получим … a[40+2], а 42-го элемента массива не существует, поэтому цикл надо делать до i = 38, т.е. N-2).
if (a[i]=a[i+1]) and (a[i]=a[i+2]) then inc(k);
Результат:
for i:=1 to N-2 do if (a[i]=a[i+1]) and (a[i]=a[i+2]) then inc(k); writeln(k);
Более подробное объяснение предлагаем посмотреть на видео:
📹 YouTube здесь
📹 Видеорешение на RuTube здесь
Задачи на поиск максимума, минимума элементов массива и другие
ЕГЭ по химии задание 25
План
Правила работы в лаборатории. Лабораторная посуда и оборудование. Правила безопасности при работе с едкими, горючими и токсичными веществами, средствами бытовой химии
Научные методы исследования химических веществ и превращений. Методы разделения смесей и очистки веществ
Понятие о металлургии: общие способы получения металлов
Общие научные принципы химического производства (на примере промышленного получения аммиака, серной кислоты, метанола). Химическое загрязнение окружающей среды и его последствия
Природные источники углеводородов, их переработка
Высокомолекулярные соединения. Реакции полимеризации и поликонденсации. Полимеры. Пластмассы, волокна, каучуки
Применение изученных неорганических и органических веществ
Правила работы в лаборатории. Лабораторная посуда и оборудование. Правила безопасности при работе с едкими, горючими и токсичными веществами, средствами бытовой химии
Правила работы в лаборатории. Лабораторная посуда и оборудование. Правила безопасности при работе с едкими, горючими и токсичными веществами, средствами бытовой химии
Правила работы в лаборатории
Лабораторная посуда и оборудование
Правила безопасности при работе с едкими, горючими и токсичными веществами, средствами бытовой химии
Правила работы в лаборатории. Лабораторная посуда и оборудование. Правила безопасности при работе с едкими, горючими и токсичными веществами, средствами бытовой химии
Химия — полезный предмет, который любят многие школьники благодаря интересным опытам. Однако, попав в лабораторию, многие не придают значения установленным правилам, касающимся техники безопасности. Устроившись на работу в лабораторию, каждый молодой специалист желает показать более опытным коллегам свою осведомленность и серьезное отношение к новым обязанностям. И, если какие-то пробелы школьных знаний можно восполнить в процессе работы, то несоблюдение элементарных требований безопасности часто ведет к плачевным результатам.
Поэтому необходимо знать, как правильно вести себя в лаборатории, как обращаться с оборудованием, лабораторной посудой, химическими веществами.
Правила работы в лаборатории
- Приступая к работе, надеть халат, застегнув все пуговки. Это необходимо для защитить от испарений и мельчайших брызг, которые образуются в процессе работы. С этой же целью надевается закрытая обувь, собираются в пучок длинные волосы, используются защитные очки, маски, перчатки. (только при работе с токсичными, огнеопасными веществами)
- Соблюдать порядок и чистоту, строго придерживаться правил техники безопасности на рабочем месте
- Избегать употребления и хранения пищевых продуктов, питьевой воды.
- Избегать проведения анализов с использованием неисправного оборудования, треснувшей или грязной посуды: посуда для проведения опытов с использованием горелок должна быть из огнеупорного стекла, на пробирке должен находиться знак с отметкой о термической устойчивости посуды.
- Прикреплять этикетки с названиями и формулами реактивов ко всей имеющейся посуде.
- Осторожно обращаться с веществами и растворами: переливать из склянки в пробирку нужно только при соприкосновении горлышка склянки и горлышка пробирки. Пересыпать твердое вещество в пробирку или ступку необходимо в строго определенном отмеренном количестве и при помощи мерной ложечки.
- Не направлять горлышко емкости с химическими веществами в сторону другого человека во время их нагревания: направлять горлышко пробирки при нагревании нужно от себя и от соседа.
- Прогревание сначала осуществляется по всей длине пробирки и только затем в месте, где находится вещество Обеспечить свободный доступ к аптечке со средствами, предназначенными для оказания первой помощи.
- Обеспечить свободный доступ к противопожарным средствам — ящику с песком и лопаткой, противопожарному войлочному или асбестовому одеялу, исправному огнетушителю.
- Избегать попадания химических веществ на слизистые оболочки, открытые участки тела: при попадании вещества в зависимости от состава необходимо незамедлительно промыть раствором щелочи, перекиси водорода и большим количеством проточной воды.
- Обратиться в медпункт.
- Опыты с использованием ядовитых и вредных веществ проводить только во включенном вытяжном шкафу под наблюдением старшего лаборанта или учителя
- По окончанию работы следует тщательно помыть всю посуду под проточной водой.
- Запрещается пробовать химические вещества на вкус. Чтобы понюхать его, следует легким движением руки направить к себе газы из сосуда.
- Наклоняться над сосудом и заглядывать в него сверху нельзя, чтобы не получить травму при случайном выбросе горячего препарата.
Нужно помнить, что для утилизации концентрированных щелочей и кислот, органических растворителей предусмотрены специальные бутыли, которыми оснащается любая лаборатория. Для хранения бутылей используется вытяжной шкаф. Выливать такие средства в раковину категорически запрещено, поскольку это ведет к загрязнению окружающей среды, а также образованию ядовитых побочных продуктов, которые могут выбрасываться из раковины в виде паров или капель жидкости
Лабораторная посуда и оборудование
Лабораторная тара изготавливается из фарфора или термоустойчивого стекла. Применять какие-либо другие емкости, не предусмотренные для использования в лабораторных условиях, запрещено.
К лабораторной посуде относятся:
Исследование небольших объемов веществ осуществляется в пробирках, при работе с которыми запрещается использовать собственные пальцы для закрытия пробирки во время ее встряхивания. Нельзя проводить анализы в не помытой после предыдущего опыта пробирке.
Большие объемы препаратов помещаются для исследования в колбу или стакан. При работе с данными емкостями необходимо:
- Осуществлять перемешивание содержимого путем совершения круговых движений, или используя специальную стеклянную палочку. Чтобы она не повреждала стенки стеклянной емкости, на ее конец надевают кусочек резиновой трубки.
- Переливание химических растворов из сосудов с широким горлышком в емкости с узким горлышком осуществляется с использованием воронки.
- Фильтрование реактивов необходимо проводить в воронке, на дно которой помещается предварительно смоченный водой бумажный фильтр. Раствор выливают на фильтр тонкой струйкой, направляя ее на стеклянную палочку, расположенную у стенки воронки.
- Выпаривание жидкостей осуществляется в выпарительных чашах, надежно закрепленных на кольце штатива. Держать их в руках во время нагрева категорически запрещено. Для нагревания чаш используется пламя спиртовки. Наклоняться над чашей во время ее нагревания нельзя.
- Если процесс исследования вещества предполагает выделение каких-либо газов, их отводят из используемой посуды газоотводной трубкой, герметично соединенной с горлышком емкости.
Лабораторный штатив, при помощи которого закрепляется посуда пи проведении опытов, представляет собой подставку со стержнем, оснащенным кольцом, лапкой и муфтой. Последняя выполняет функцию перемещения лапки и кольца по стержню и регулировки их высоты. Для их фиксации применяются специальные винты. Колбы и пробирки, закрепляются в лапке, должны смотреть отверстием кверху и располагаться вертикально.
Спиртовка, с помощью которой нагреваются реактивы, представляет собой сосуд, заполненный спиртом. В сосуде имеется колпачок и фитиль, прикрепленный к металлической трубочке с диском. Перед проведением опыта колпачок снимают и проверяют плотность прилегания диска к отверстию емкости. Для поджигания спиртовки допускается использовать только горящую спичку.
Нагревание реактивов также можно осуществлять при помощи горелки, которая выполнена в виде металлической трубочки с двумя отверстиями. На подставке имеется боковая трубка со шлангом, присоединенным к газовому крану. Поступающий в горелку газ смешивается с воздухом, проникающим сквозь боковые отверстия. Верхняя, средняя и нижняя части пламени отличаются разной температурой. Наиболее высокая температура в верхней зоне пламени. Использовать для нагревания сосудов во время проведения опытов допускается только данную зону.
Правила безопасности при работе с едкими, горючими и токсичными веществами, средствами бытовой химии
Манипуляции с препаратами бытовой химии, легковоспламеняющимися, едкими и токсичными средствами требуют соблюдения определенных правил, позволяющих избежать неприятных ситуаций в ходе проведения опытов.
- При возникновении необходимости разбавить кислоту водой, кислоту вливают в воду как можно медленнее, тонкой струйкой.
- Для растворения щелочей допускается использовать только фарфоровую посуду. Для захвата кусочков твердого щелочного материала используется пинцет или щипцы. Растворение щелочи в фарфоровой емкости осуществляется путем добавления в воду небольших порций вещества. Во время выполнения данных манипуляций нужно постоянно помешивать раствор.
- При случайном проливе щелочи или кислоты на рабочую столешницу нужно как можно скорее насыпать на загрязненное место сухой песок. Смесь вытекшего вещества на стол с песком требуется постоянно перемешивать до тех пор, пока песок полностью поглотит всю жидкость. Далее осуществляется немедленная уборка загрязненного песка в стеклянную емкость с его последующим промыванием и нейтрализацией.
- В случае попадания щелочи или кислоты на открытые участки кожи их немедленно стряхивают и промывают кожу под краном с сильным напором холодной воды. Затем пораженное место обрабатывается раствором соды (3%), и смазывается вазелином.
- Переливая растворы из тары нужно следить, чтобы этикетка с наименованием вещества находилась сверху.
- При работе с агрессивными средствами бытовой химии (стиральными порошками, препаратами для чистки сантехники, отбеливателями) нужно использовать защитные перчатки.
- Работа с сильно пахучими веществами должна проводиться в хорошо проветриваемом помещении.
- При хранении бытовой химии необходимо следить, чтобы все емкости были плотно закрыты. Все реактивы следует хранить в прохладном месте, защищенном от прямых солнечных лучей.
Каждое химическое вещество и средство бытовой химии отличается своими свойствами и особенностями взаимодействия с другими препаратами. Прежде, чем приступать к проведению лабораторных анализов, надо изучить всю информацию, касающуюся безопасного обращения с препаратами. При работе следует неукоснительно соблюдать требования и инструкции, касающиеся особенностей веществ, сроков их годности и прочих данных.
Научные методы исследования химических веществ и превращений. Методы разделения смесей и очистки веществ
Смесь — система, включающая в себя два или более веществ, которые не реагируют между собой.
Типы смесей:
Гетерогенные или неоднородные (механические смеси). Это такие смеси, в которых невооружённым глазом, в редких случаях при помощи увеличительного прибора, можно отчётливо наблюдать границы между молекулами разных веществ. Для примера можно привести суспензии, смесь порошков, эмульсии, дым.
Гомогенные или однородные (растворы). Это такие смеси, в которых невозможно наблюдать границы между молекулами, даже при сильном увеличении, так как молекулы веществ сильно перемешаны друг с другом. Для примера можно привести жидкие (смесь спирта с водой), твёрдые (сплавы) и газовые (смесь газов, не реагирующих друг с другом) растворы.
Методы разделения смесей
- Метод отстаивания. Этот метод основан на разности плотностей различных веществ. Для этого смесь, которую необходимо разделить, помещают в воду, вещества с низкой плотностью поднимаются на верху, а вещества с большей – опускаются на дно посуды. Чтобы ускорить этот процесс в лаборатории используется метод центрифугирования. Он основан на центробежной силе, которая зависит от скорости вращения центрифуги. Для разделения различных веществ существуют индивидуальная скорость вращения в секунду, благодаря которой смесь разделяется.
- Метод декантации. После отстаивания жидкостей, образовавшиеся слои можно разделить при помощи делительной воронки. Суть метода можно увидеть в следующем рисунке.
- Метод фильтрации. Суть метода заключается в способности фильтра задерживать твёрдые частички и пропускать жидкость. . В случае использования отстаивания для разделения веществ разных агрегатных состояний, завершающим этапом является фильтрация.
Методы разделения смесей
- Метод магнитной сепарация. Основан на магнитных свойствах веществ, под действием магнитного поля. Для примера можно привести смесь серы и порошка железы. Железо, обладающие магнитными свойствами притягивается к магниту, а сера остаётся в посуде.
- Метод выпаривания. Используется для разделения тугоплавкого вещества и жидкости. Скорость выпаривание регулируется температурой, давлением, площади поверхности испарения.
- Метод перегонки (дистилляция). Этот метод используется для разделения веществ с приблизительно одинаковыми температурами кипения, а так же используется для разделения летучих веществ от нелетучих. Суть в том, что при закипании смеси быстрее улетучиваются жидкости с более низкой температурой кипения. Пары конденсируются и стекают в приёмник.
- Метод хроматографии. Этот метод основан на разности скоростей поглощения одних частиц другими. В стеклянную трубку насыпается порошок мела и смачивается бензолом. Сверху вливают раствор, который необходимо разделить. Все молекулы из-за разного строения и состава по-разному сорбируются, могут прочно крепиться или более слабо, меньше находиться в растворе и больше в связанном состоянии. На следующей иллюстрации можно наблюдать хроматографию хлорофилла.
- Метод адсорбции. Суть метода в том, что твёрдый компонент (адсорбент) всей поверхностью тела поглощает газовый компонент в результате реакции. Вещество, образованное на адсорбенте, можно отделить от него путём десорбции. Адсорбент используется повторно, а отделённое вещество по назначению. В качестве адсорбентов обычно служат пористые твердые вещества, имеющие большую удельную поверхность.
Понятие о металлургии
Металлургия — получение металлов из руд — один из древнейших видов человеческой деятельности. Еще во втором тысячелетии до н. э. в Египте умели выплавлять железо из железной руды. Так называемый железный век пришел на смену бронзовому, тот, в свою очередь, наступил после каменного.
Получают металлы из рудных полезных ископаемых. Например, халькопирит или медный колчедан — сырье для производства железа, меди и серы (Рис. 1). Химическая формула минерала CuFeS2. Металлы в составе других руд находятся в виде оксидов или солей неорганических кислот, химически связанных катионов.
Суть металлургического процесса заключается в восстановлении положительных ионов до свободных атомов металла. Используют в качестве источников электронов углерод и его соединения, водород, металлы. В процессе восстановления катионы получают недостающие электроны. Происходит восстановление электронных оболочек металла. Схема процесса:
Ме+n + ne- → Me, где
Ме+n — металл в окисленной форме;
+n — степень окисления;
ne- — количество присоединяемых электронов;
Ме — металл в восстановленной форме.
Способы получения металлов
В зависимости от того, кокой восстановитель используют в металлургическом процессе различают: пиро — , гидро, электро — и биометаллургию.
Наиболее распространенные способы получения металлов: пирометаллургический и электрометаллургический. Большинство реакций восстановления протекают при высоких температурах. Так как металлическая связь обладает повышенной прочностью, то выделение металлов в чистом виде из природных соединений проводят при высоких температурах.
Пирометаллургический способ
Пирометаллургия — получение металлов из руд при высоких температурах при участии восстановителей. В переводе с греческого «пирос» означает «огненный». Используют в качестве восстановителей кокс, диоксид углерода, водород. Применяют активные металлы для получения менее активных.
Пирометаллургия подразделяется на
карботермия,
водородотермия,
металлотермию.
Карботермия: перевод сульфида металла путем обжига в оксид и дальнейшим восстановлением углем до чистого состояния.
2ZnS + 3O2 = 2ZnO + 2 SO2
ZnO + C = CO + Zn
Руды, состоящие из оксидов и сульфидов железа, подвергают карботермии. Проводят восстановление коксом или диоксидом углерода (угарным газом). Получают сплавы железа — чугун и сталь. Первый содержит больше углерода, а также оксидов серы, фосфора и кремния. Углерод снижает твердость и другие характерные для металлов качества.
Химические реакции, лежащие в основе выплавки чугуна:
C + O 2 = CO 2 ↑,
CO 2 + C ↔ 2CO↑,
3Fe 2 O 3 + CO = 2Fe 3 O 4 + CO 2 ↑,
Fe 3 O 4 + CO = 3FeO + CO 2 ↑,
FeO + CO = Fe + CO 2 ↑.
Сталь выплавляют в специальных печах
Сталь выплавляют в специальных печах — электрических, конвертерных, мартеновских. При продувании обогащенного кислородом воздуха выгорает избыточный углерод, его содержание уменьшается до 2% и ниже. Этот способ является более экономически применим, т.к. при помощи него получают сталь и чугун, которые широко используются в современной промышленности.
Восстановлением углем можно получить железо, медь, цинк, кадмий, германий, олово, свинец и другие металлы. В качестве сырья используют медную (Cu 2 O), оловянную (SnO 2 ) , марганцевую (MnO 2 ) руды.
Металлы можно извлечь из сульфидных руд. Сначала проводят обжиг, затем — восстановление полученного оксида углем. Схемы обжига цинковой обманки и получение цинка:
2ZnS +3O 2 = 2ZnO + 2SO 2 ↑;
ZnO + C = Zn + CO↑.
Карбонаты тоже прокаливают с углем для получения оксидов и последующего восстановления углем. Схемы обжига сидерита и восстановления оксида железа:
FeCO 3 = FeO + CO 2 ↑;
FeO + C = Fe + CO↑.
Водородотермия — производство металлов восстановлением водородом
Достоинством этого металлургического метода является получение очень чистых металлов. Восстановление меди из оксида CuO — пример восстановительных свойств водорода из школьного курса неорганической химии. Схема протекания реакции
Водородом восстанавливают из оксидов тугоплавкие металлы молибден и вольфрам.
Металлотермия
Проводят восстановление одного металла другим, более химически активным. Этот способ применяют для получения металлов из оксидов и галогенидов.
В зависимости от природы металла-восстановителя различают алюминотермию, или алюмотермию, — восстановление алюминием и магнийтермию — восстановление магнием.
Силикотермия — восстановление металлов кремнием. Процесс протекает согласно схеме: 2MgO + Si → 2Mg + SiO 2 .
Гидрометаллургический способ
Гидрометаллургия — способ получения благородных, цветных, редких металлов. Например, оксид меди сначала переводят в сульфат с помощью серной кислоты. Медь вытесняют из раствора железом. Протекает следующая реакция замещения: CuSO 4 + Fe = Cu + FeSO 4 . Либо медь извлекают из раствора электролизом. Пропускают электрический ток, ионы Cu 2+ осаждаются на катоде.
Преимущество гидрометаллургического способа — возможность получать металлы из бедных руд. Еще один плюс метода — снижение газообразных выбросов в атмосферу. Большое количество вредных газов и сажи поступает в воздух при обжиге руды и пирометаллургии.
Электролиз
Электролиз расплавов оксидов, солей и гидроксидов проводят для получения металлов, расположенных в ряду активности от лития до марганца. Электролиз водных растворов служит для производства менее активных металлов.
Электролиз расплавов
Катодные (восстановительные) процессы . На катоде происходит восстановление катионов металлов и водорода или молекул воды.
Для растворов кислот: К(-) Н + + 2 е — ⟶H 2 0 ↑.
Для растворов солей или щелочей: К(-) M n+ , H 2 O.
Характер восстановительного процесса зависит от значения стандартного потенциала металла:
Схема электролиза расплава хлорида натрия: 2NaCl (эл. ток) → 2Na + Cl 2 ↑.
Схема электролиза сульфата марганца в растворе: 2MnSO 4 + 2H 2 O (эл. ток) → 2Mn + O 2 ↑+2H 2 SO 4 .
Способ термического разложения
Железо с диоксидом углерода при повышенных давлении и температуре образует пентакарбонил Fe(CO)5. Эту жидкую субстанцию перегоняют для очистки от примесей, затем нагревают. Карбонил разлагается с образованием порошка железа. Дальнейшее нагревание в вакууме или атмосфере водорода приводит к получению очень чистого железа. Схема процесса: Fe(CO)5 → Fe + 5CO↑.
Биометаллургия
Способ, основанный на биохимических процессах с участием микроорганизмов. Метод получил распространение на Западе, так как позволяет меньше загрязнять окружающую среду. Биометаллургия служит для получения меди, серебра, никеля, свинца, урана, рения и ряда других металлов.
общие способы получения металлов
Кроме собственно добычи металла из природных соединений (руд), металлургия включает в себя вторичную переработку сплавов и металлических изделий. Минеральные ресурсы Земли огромны, но конечны, а переплавка бывших в употреблении изделий бывает выгоднее и проще. Иногда обработку металлов тоже относят к металлургии, поэтому можно сказать, что это действительно одна из самых крупных областей промышленности.
Общие научные принципы химического производства (на примере промышленного получения аммиака, серной кислоты, метанола). Химическое загрязнение окружающей среды и его последствия
Научные принципы химического производства
Производство аммиака
Производство серной кислоты
Производство метанола
Химическое загрязнение окружающей среды и его последствия
Научные принципы химического производства
Производство аммиака
Первый шаг – получение из азота и водорода азотоводородной смеси. Азот получается посредством фракционной перегонки жидкого воздуха. Источником водорода выступает процесс паровой природного газа или угля.
Турбокомпрессор сжимает смесь, пока не будет получено давление в 25*10 6 Па. Температура для протекания требуемых химических реакций находится в диапазоне: 400-500 °С. Для ускорения используется катализатор – пористое железо, содержащее примеси K 2 O и Al 2 O 3 .
Данный химический процесс является равновесным: при изменении условий происходит изменение количество продукта реакции, поэтому при проведении данного процесса нужно следить за внешними факторами, которые влияют на протекание химического процесса.
Создаваемый аммиак отделяют от непрореагировавшего водорода и азота в холодильнике процессом сжижения. Непрореагировавшая смесь возвращается в колонну синтеза. Процесс циркулирует непрерывно, пока не будет истрачен требуемый исходный материал. Применяется получаемый аммиак для производства взрывчатых веществ, азотных удобрений, пластических масс и ещё ряда продукции химического производства.
Производство серной кислоты
Серная кислота относится к числу сильных кислот. Для получения используется очищенный измельченный влажный пирит (другое название – серный колчедан). Сырьё сверху засыпается в печь, чтобы обжечь вещество. Снизу, по принципу противотока, пропускается воздух, обогащенный кислородом.
Результат обжига в печи: SO 2 , пары воды и мельчайшие частицы оксида железа (огарок). Газ очищается от примесей. Твёрдые частицы задерживает электрофильтр и циклон. Для водных паров предусматривается сушильная башня.
Контактный аппарат окисляет сернистый газ с помощью катализатора пятиокиси ванадия. Процесс окисления обратим, для чего подбирают оптимальные условия, способствующие протеканию прямой реакции: повышается давление и поддерживается температура на свыше отметки в 500 °С.
Производство метанола
Для производства метанола используется реакция взаимодействия угарного газа и водорода. Технологическая цепочка практически повторяет ту, что используется для получения аммиака. Схожесть обусловлена частичным сходством проходимых реакций. И аммиак, и метанол – это экзотермические, обратимые, каталитические реакции, процесс протекания которых предусматривает уменьшение объема газообразных веществ.
Для синтеза метанола используются следующие приёмы:
Применение в колонне синтеза катализатора.
Использование высокого давления, повышающего уровень выхода продукта.
Принципы теплообмена и циркуляции.
Для увеличения скорости реакции используется высокая температура.
Химическое загрязнение окружающей среды и его последствия
Недостаток химического производства – загрязнение окружающей среды, вредоносное влияние на здоровье и жизнь человека и местной флоры с фауной. Негативные последствия накапливаются, приводя к ухудшению самочувствия. При размещении химического предприятия окружающая обстановка может кратно ухудшиться. Падает уровень жизни и удовлетворенность.
Чтобы не допустить этого, с химическим загрязнением окружающей среды борются. Это достигается с помощью следующих мер:
Создание новых технологий и технических объектов, ориентированных на ресурсосбережение и малоотходность.
Получение наибольшего объема продукции требуемого качества с наименьшими вложениями.
Стремление к полному использованию исходного сырья.
Поддержание экологической безопасности на предприятии.
Государство заинтересовано в поддержания благоприятной экологической обстановки. Для стимулирования уменьшения химического загрязнения окружающей среды и последствий используется налоговая экологическая политика, привязанная к объему выбросов и уровню опасности.
Природные источники углеводородов, их переработка
Природные источники углеводородов
Их переработка
Обработка попутного нефтяного газа
Природные источники углеводородов
Нефть – это природная маслянистая горючая жидкость, обладающая специфическим запахом, темно-коричневого (черного, красного, синего, белого) цвета или бесцветная, состоящая из сложной смеси углеводородов различной молекулярной массы (алканов, циклоалканов, аренов) и ряда других химических соединений.
Различают два вида нефти, в зависимости от плотности и содержания серы:
Легкая – извлекается насосами или фонтанным способом. Массовая доля серы – незначительно, вследствие чего ценность продукта выше. Используется для производства горючих продуктов — бензина и керосина.
Тяжелая – добывается шахтным способом. Из-за содержания примесей данный вид горючего ископаемого требует дополнительной очистки. Применяется для изготовления различных масел, мазута.
К преимуществам применения топлива можно отнести – простоту, дешевизну добычи и беспроблемность транспортировки.
К недостаткам – низкую ресурсообеспеченность, то есть соотношение между количеством ресурсов и размерами их использования.
Природный газ
Природный газ — это смесь газов, образовавшихся в недрах земли посредством анаэробного разложения органических веществ. Содержание углеводородов в природном ресурсе низкое, 80- 97% составляет метан и незначительный процент – пропан, бутан, этан.
Преимущества данного вида топлива – простота добычи и транспортировки, экономичность.
Недостатки – сложность межконтинентальной транспортировки с помощью дорогостоящих танкеров.
Природный газ не имеет запаха, но для обнаружения протечек вещества в быту, в него добавляют специальные компоненты – меркаптаны. Это связано с тем, что смесь метана с воздухом взрывоопасна, небольшая искра способна спровоцировать происшествие.
Попутный нефтяной газ
Попутный нефтяной газ – это смесь газообразных углеводородов, содержащихся в нефти и выделяющихся при ее добыче и подготовке. Чем ниже молекулярная масса алкана, тем выше его концентрация в природном ресурсе.
Смесь бутана и пропана образует сжиженный газ, который применяется в качестве бытового топлива.
В зависимости от содержания углеводорода попутный газ делится на следующие группы:
- чистый (95–100%);
- углеводородный с примесью углекислого газа 4-20%;
- углеводородный с примесью азота 3-15%;
- углеводородно-азотный, содержанием примесей до 50% соответственно.
Каменный уголь
Данный вид горючего ископаемого относится к твердым, и представляет собой многокомпонентную смесь углеводородов, азота, серы, кислорода и неорганических веществ. Доля углерода составляет 80 %, остальные 20% — органические и неорганические компоненты. Чем выше содержание газа, тем большей теплотворностью обладает вещество, чем ниже – тем дольше уголь может храниться.
Образование данного вида горючего ископаемого проходит в два этапа:
Появление торфа из остатков растений и живых организмов.
Формирование твердого угля.
Данный вид топлива является достаточно перспективным для получения ряда химических продуктов и энергии.
Их переработка
Полезные ископаемые требуют переработки для дальнейшего использования и получения необходимых продуктов.
Переработка нефти
В сыром виде данный ресурс не применяется. Переработка может быть первичной и вторичной.
1. Первичная переработка – заключается в ректификации нефти, путем ее нагревания, не приводящая к химическим изменениям вещества. В процессе повышения температуры улетучиваются сначала легкокипящие элементы, затем требующие более высокой температуры.
На подготовительном этапе требуется очитка нефти от воды, солей и твердых механических частиц. Далее вещество поступает в трубчатую печь, где подвергается нагреванию до 350 °С. Горячий состав перемещается в нижнюю часть ректификационной колонны, в которой осуществляется испарение отдельных фракций на разные уровни, в зависимости отих температуры кипения:
ректификационные газы (верхняя часть, температура кипения не более 40 о С);
бензиновая фракция (35 -200 о С);
лигроиновая фракция (150 — 250 о С);
керосиновая фракция (190 — 300 о С);
дизельную фракцию (200 -300 о С);
мазут (нижняя часть колонны, температура кипения более 350 о С).
2. Вторичная: крекинг и риформинг – необходимы для повышения выхода после переработки более дорогих и качественных фракций.
Крекинг – способ обработки мазута путем нагревания с совместным воздействием катализатора, для увеличения выхода бензиновой фракции.
Риформинг – направлен на улучшение качественных характеристик бензиновой фракции путем реакций дегидроциклизации.
Переработка природного газа
Содержание примесей в природном газе затрудняет его дальнейшую транспортировку и использование. В связи с этим он подвергается переработке:
Сушке – для удаления серы и воды.
Переработка производственным методом в целях придания товарного вида:
- термохимическим способом – при высокой температуре и давлении; физико-энергетическим – охлаждением или нагреванием ресурса для его сжатия и деления; химико-каталитическим – методом парциального окисления или паровой, углекислой конверсии.
- термохимическим способом – при высокой температуре и давлении;
- физико-энергетическим – охлаждением или нагреванием ресурса для его сжатия и деления;
- химико-каталитическим – методом парциального окисления или паровой, углекислой конверсии.
В результате процессов образуются вещества: источники энергии и химические продукты (аммиак, уксусная кислота, метонол и др.).
Обработка попутного нефтяного газа
Концентрация продуктов нефтепереработки негативно влияет на экологию и здоровье населения. В связи с этим возникла необходимость в переработке ПНГ и практическом применении.
Существуют несколько способов утилизации и переработки:
Фракционный метод – основан на разделении газа на компоненты.
Закачка в пласт нефти, для повышения давления и увеличения объемов добычи.
Мембранная очистка с дальнейшим сжижением и использованием для получения топлива и нефтехимического сырья.
Переработка в сжиженный газ.
Переработка каменного угля
Переработка данного вида ресурса называется коксованием, которое осуществляется путем накаливания угля до 900-1100°С без доступа воздуха.
В результате получаются следующие продукты:
кокс с высоким содержанием углерода;
коксовый газ;
каменноугольная смола.
Более 90% всей энергии, потребляемой человечеством в настоящее время, добывается из ископаемых природных органических соединений. ПО своим свойствам газ превосходит нефть.
Высокомолекулярные соединения. Реакции полимеризации и поликонденсации
Реакции полимеризации
Реакции поликонденсации
Характеристика полимеров
Высокомолекулярные соединения
Высокомолекулярные соединения – это полимеры, у которых молекулярная масса больше 10000. Полимер – это соединение, состоящее из большого числа звеньев – мономеров (низкомолекулярных веществ), которые повторяются в полимерной цепи большое количество раз .
Число n показывает, из скольких мономеров состоит полимер, и называется степенью полимеризации. Молекулярная масса иногда достигает нескольких миллионов.
Высокомолекулярные соединения классифицируются по характеру мономеров:
гомополимеры – вещества, состоящие из одинаковых мономеров. Например, пропилен CH 2 =CH-CH 3 – это мономер полипропилена (-CH(CH 3 )-CH 2 -) n ;
гетерополимеры – вещества, состоящие из двух разных мономеров. Например, при взаимодействии 1,3-дивинила и стирола получается стирольный каучук.
n CH 2 =CH-CH=CH 2 + n C 6 H 5 -CH=CH 2 → (-CH 2 -CH=CH-CH 2 -CH(C 6 H 5 )-CH 2 -) n
Полимеры получают с помощью:
реакции полимеризации;
реакции поликонденсации.
Реакции полимеризации
Реакции полимеризации заключаются в объединении большого количества низкомолекулярных соединений, количество которых определяется степенью полимеризации. Общее уравнение реакции:
n X → (-X-) n
Самой распространенной реакций полимеризации является реакция получения полиэтилена:
nC 2 H 4 = (CH 2 – CH 2 ) n
реакции полимеризации вступают непредельные соединения. Это могут быть молекулы одного мономера, либо разных. В первой ситуации реакцию называют гомополимеризацией, во второй – сополимеризацией.
I. Гомополимеризация
К этим реакциям относят получение полиэтилена, полипропилена поливинилхлорида и т.д. Например, получение полипропилена из пропена под действием ультрафиолетовых лучей:
n CH 2 =CH-CH 3 → (CH 2 -CH(CH 3 )-) n
II. Сополимеризация
К этим реакциям относят получение сополимера этилена и пропилена:
n CH 2 =CH 2 + n CH 2 =CH-CH 3 → [(-CH 2 -CH 2 -) x – (-CH 2 -CH(CH 3 )-) y ] n , где 1
Полимеры, которые получают в результате реакций полимеризации
Реакции поликонденсации
Реакции поликонденсации заключаются в образовании полимера из мономеров, а также выделении побочного низкомолекулярного вещества. В этих уравнениях исходные реактивы — молекулы мономера с функциональными группами.
I. Гомополиконденсация
К данным реакциям относят получение полимера из одного мономера с выделением конденсата. Например, получение полисахарида из глюкозы – этот процесс происходит в природе.
n C6H12O6 → (-C6H10O5-)n + n H2O
Синтетическое волокно получают в промышленности из аминоэнантовой кислоты под воздействием температуры, давления и катализатора в виде молекулярного азота.
n NH2-(CH2)6-COOH → (-NH-(CH2)6-CO)n + n H2O
II. Сополиконденсация
К данным реакциям относят получение полимера из нескольких мономеров с выделением конденсата. Например, получение фенолформальдегидной смолы из фенола и формальдегида в щелочной или подкисленной среде.
n C6H5-OH + n H-CHO → (-C6H4(OH)-CH2-)n + n H2O
С помощью реакций сополиконденсации в промышленности получают полиэфиры, полиамины, полиакрил и т.д.
Характеристика полимеров
Полимеры – это соединения, которые имеют особые свойства и множество классификаций.
Классификация полимеров
Полимеры
По способу получения высокомолекулярные вещества делятся на:
- природные (целлюлоза, крахмал, белки);
- искусственные (эфиры целлюлозы);
- синтетические (капрон, полиэтилен, тефлон).
Также по форме макромолекул:
- линейные (волокна, полиэтилен низкого давления);
- разветвленные (крахмал, полиэтилен высокого давления);
- пространственные (резина, кварц).
А еще по свойствам и применению:
- пластмассы;
- каучуки;
- волокна.
Все полимеры активно используются в отраслях жизнедеятельности человека.
Пластмассы
Пластик (пластические массы) – полезные материалы, которые способны под воздействием температур или давления плавиться и при застывании оставлять заданную форму. Этот процесс сопровождается переходом из вязкотекучего в стеклообразное состояние. Главный компонент пластмассы – полимер, а остальные части – это наполнители, пластификаторы, красители и т.д.
Каучуки
Эластомеры – это высокомолекулярные соединения, которые обладают высокоэластичными свойствами. Каучуки используют для изготовления автомобильных шин, промышленных товаров и медицинских препаратов. Натуральный каучук получают из латекса (млечный сок каучуконосных растений). Получают по методу С.В. Лебедева с помощью полимеризации дивинила при действии металлического натрия.
n CH2=CH-CH=CH2 → (-CH2-CH(CH=CH2)-…-CH2-CH=CH-CH2-)n
Волокна
Волокна – это высокомолекулярные соединения, для которых характерна строгая упорядоченность молекул и используется в изготовлении нитей. Существует три типа волокон, которые разделяются еще на несколько подтипов.
- Натуральные.
- Искусственного происхождения. Животного происхождения. Минерального происхождения.
- Искусственного происхождения.
- Животного происхождения.
- Минерального происхождения.
- Искусственные. Ацетатное волокно. Вискозное волокно.
- Ацетатное волокно.
- Вискозное волокно.
- Синтетические. Полиамидное волокно. Полиэфирное волокно.
- Полиамидное волокно.
- Полиэфирное волокно.
Полимеры – это соединения, с помощью которых человечество способно изготавливать высокопрочные материалы и довольствоваться благами технологий.
Применение изученных неорганических и органических веществ
Применение неорганических веществ
Применение органических веществ
Применение неорганических веществ
К неорганическим относят соединения, которые не содержат углерод, а также углеродосодержащие вещества, традиционно относящиеся к неорганическим (карбиды, оксиды и др.).
Применение данных соединений достаточно распространено в повседневной деятельности человека, и без них невозможно полноценное ведение хозяйства, лечение, производство и т.п.
Пищевая сода
Гидрокарбонат натрия (NaHCO 3 ) – представляет собой мелкий порошок белого цвета, без запаха, растворимый в воде. Используется преимущественно в кулинарии, для выпечки. Это обусловлено тем, что во время нагревания сода легко разлагается с выделением углекислого газа.
2NaHCO 3 → Na 2 CO 3 + H 2 O + CO 2 .
Кроме этого гидрокарбонат натрия используется для придания пышности омлету, смягчения мяса, усиления аромата чая или кофе, добавления сладости плодам фруктов, очищения продуктов от нитратов и т.д.
Кальцинированная сода
Na 2 CO 3 — применяется для бытовых нужд:
мытья посуды (из фаянса, фарфора, керамики в том числе);
чистки раковин, ванн, плитки;
стирки (замачивание, кипячение натуральных тканей);
смягчения жесткой воды;
удобрения кислых дерново-подзолистых почв.
Для использования необходимо развести раствор от 10 до 100 °С.
Соль
Поваренная соль (NaCl) – незаменимая приправа при приготовлении первых, вторых блюд, консервации и даже выпечки. Суточная норма натрия для организма человека составляет 1 г, но употребление значительно превышает эту норму (4-6 г). Осторожнее к потреблению данного продукта следует относиться людям, страдающим повышенным давлением, склонным к появлению отеков.
Серная кислота
Сильная двуосновная кислота (H 2 SO 4 ) представляет собой бесцветную тяжелую маслянистую жидкость, не обладающую запахом. Широко распространено использование средства в различных отраслях промышленности:
сельском хозяйстве (производство минеральных удобрений);
химической (изготовление красителей, химволокна, взрывчатых веществ);
пищевой (пищевая добавка E513)$
металлообрабатывающей;
в промышленном органическом синтезе (реакции дегидратации, гидратации, сульфирования, алкилирования).
Так же соединения серы используется в качестве электролита в свинцовых аккумуляторах.
Оксид цинка
Цинковые белила (ZnO) – представляет собой белый порошок, меняющий цвет при нагревании. Применение продукта известно в медицине, химической промышленности в качестве наполнителя или пигмента:
при производстве красок и эмалей;
при изготовлении бумаги, резины, пластмассы, косметики и парфюмерии;
в составе мазей и присыпок.
Данное соединение обладает фотокаталитической активностью, что нашло свое применение при изготовлении самоочищающихся поверхностей, бактерицидных покрытий для помещений больниц и подобных учреждений.
Медный купорос
Сульфат меди II (CuSO4) – бесцветное кристаллическое соединение, растворимое в воде. При реакции с воздухом или водой образуется голубой пентагидрат.
Применяется вещество как основа для других соединений или в качестве индикатора влажности помещения. Медный купорос – эффективное средство в борьбе с вредителями, грибковыми заболеваниями. Но есть и безвредное применение — изготовление минеральных красок, меднение ванн, пищевые добавки (консервант).
Применение органических веществ
Органические вещества – это класс химических соединений, объединяющий все вещества, в состав которых входит углерод.
Алканы
Предельные (насыщенные) углеводороды, атомами водорода: СН 4 – метан (основа природного газа), С 2 Н 6 – этан, С 3 Н 8 – пропан, С 8 Н 18 – октан (основа бензина).
Применяются в качестве топлива: бензин, дизельное, авиационное, пропан-бутановая смесь для бытовых плит.
Вазелин – незаменим в медицине, парфюмерии, косметологии.
Входят в состав смазочных масел.
Хладагент для холодильников.
Петролейный эфир и циклогексан используются в качестве растворителя.
Метан незаменимый компонент при производстве шин.
Широко распространено применение данной группы органических соединений в химической промышленности (для производства пластмасс, синтетических волокон и т.д.) и медицине.
Алкены
Соединения служат исходными веществами для получения ряда готовых продуктов:
растворителей (спиртов, дихлорэтана, эфира);
полимеров (полиэтилена, поливинилхлорида, полиизобутилена);
Этилен (Н 2 С=С Н 2 ) используется для получения, тефлона, этилового спирта, уксусного альдегида, галогенопроизводных и многих других органических соединений.
Алкены применяются и для ускорения процесс созревания фруктов.
Алкины (ацетиленовые углеводороды)
Ацетилен – необходим в качестве исходного продукта в органическом синтезе при производстве:
полимеров (каучука, поливинилхлорида и др.);
растворителей (1,1,2,2-тетрахлорэтана , 1,1,2-трихлорэтена);
уксусной кислоты.
Температура пламени вещества достигает 3150°С, что нашло свое применение при резке металла и в сварке.
Спирты
Алкоголи – производные углеводородов, в которых один или несколько атомов водорода замещены на гидроксильную группу ОН.
Метанол (СН 3 ОН) –применяется в производстве муравьиной кислоты и формальдегида. Рассматривается как вариант для применения в качестве моторного топлива.
Этанол (С 2 Н 5 ОН)- востребован в виде исходного соединения для получения уксусной кислоты, сложных эфиров, карбоновых кислот. Вещество служит основой производства спиртосодержащей продукции и антисептических средств.
Этиленгликоль – компонент необходимый в производстве пластмасс, антифризов, органическом синтезе.
Глицерин – незаменим в разных отраслях промышленности, в том числе текстильной, пищевой, фармакологии.
Фенолы
Основное использование соединений приходится на химическую промышленность, медицину (производство синтетических смол, красителей, антисептиков, взрывчатых веществ и т.д.).
Альдегиды
Метаналь – используется при получении фенолформальдегидных и карбамидных смол, синтезе лекарственных средств, как дезинфицирующее средство.
Этаналь — нашел свое применение в органическом синтезе.
Карбоновые кислоты
Соединения, карбоксильной группы –СООН.
Муравьиная кислота (НСООН) –применяется в фармацевтической и пищевой промышленности. Уксусная кислота (СН 3 СООН) — востребована для производства искусственных волокон на основе целлюлозы и в пищевой промышленности.
Бензойная кислота (С 6 Н 5 СООН) – незаменима в фармацевтике для синтеза душистых веществ и красителей, а также в качестве консерванта для пищевых продуктов.
Сложные эфиры
Применяются в пищевой и парфюмерной отраслях в качестве отдушек. А также обеспечивают эластичность и пластичность пластмасс и резины.
Также широко распространено в пищевой промышленности, медицине применение глюкозы, аминов, аминокислот. Целлюлоза основной компонент при изготовлении бумаги, пленок, искусственных волокон и т.д.
Много соединений еще не изучено до конца, и возможно, благодаря науке человек сможет заменить натуральные продукты на искусственные, органических соединений природного происхождения применяется все меньше.
Задание для подготовки к егэ
Ответ: 4235.
Пояснение
Установим соответствие.
A) Аммиак широко используется как исходное азотсодержащее вещество в производстве удобрений (4).
Б) Одно из основных применений метана — в качестве топлива (2).
В) Изопрен — исходный мономер при получении каучука (3).
Г) Этилен может использоваться для различных целей, но из представленных вариантов наиболее подходящий — получение пластмасс (5).
Ответ: 4235.
Задание для подготовки к егэ
Ответ: 5412.
Пояснение
Установим соответствие.
А) Перегонка (фракционирование) сжиженного воздуха используется для получения легких газов (азот, кислород) (5).
Б) Прокаливание фосфатов кальция с углем и диоксидом кремния — получение белого фосфора (4).
В) Крекинг нефтепродуктов — получение бензина (1).
Г) Каталитическое окисление диоксида серы в триоксид — одна из стадий получения серной кислоты (2).
Ответ: 5412.
Домашняя работа
Вариант № 5511119
Ссылка — https:// chem-ege.sdamgia.ru/test?id=5511119
Задание 25 в ЕГЭ-2021 по химии: качественные реакции органических веществ. Признаки протекания реакций с участием органических веществ
Вебинар от издательства Легион.
Ведущий: Доронькин Владимир Николаевич
Презентация к вебинару:
→ предварительный просмотр
→ скачать презентацию
Качественные реакции – это реакции, позволяющие доказать наличие того или иного вещества (иона) в среде или присутствие функциональной группы в веществе. Анализируемые вещества могут находиться в различных агрегатных состояниях (твёрдом, жидком и газообразном). С точки зрения наблюдаемых эффектов все реакции обнаружения можно разделить на несколько групп:
1) образование характерных осадков,
2) растворение вещества,
3) появление (изменение) окраски,
4) выделение газов,
5) изменение запаха,
6) окрашивание пламени.
Различить вещества — это значит провести превращения, которые отличаются признаками протекания реакций или свойствами продуктов реакции. Для решения подобных заданий недостаточно знать только качественные реакции, необходимо учитывать химические и физические свойства веществ.
Вывод:
1) Необходимо знать химические свойства веществ (уметь составлять уравнения реакций)
2) Необходимо знать физические свойства изучаемых веществ (растворимость, цвет, запах, …)
3) Необходимо знать качественные реакции
Примеры заданий:
Пример 1. Установите соответствие между реагирующими веществами и признаком протекающей между ними реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) пропановая кислота и литий
Б) пропанол-2 и калий
В) гидроксид цинка и уксусная кислота
Г) бромная вода и ацетилен
ПРИЗНАК РЕАКЦИИ
1) растворение осадка
2) образование осадка
3) видимые признаки реакции отсутствуют
4) выделение газа
5) обесцвечивание раствора
Анализ и решение.
Вывод: Необходимо составить уравнения реакций и отметить наблюдаемые изменения (признаки). Далее решение смотрите в презентации
Смотрите также:
За это задание ты можешь получить 1 балл. На решение дается около 7 минут. Уровень сложности: базовый.
Средний процент выполнения: 66.8%
Ответом к заданию 25 по химии может быть последовательность цифр, чисел или слов. Порядок записи имеет значение.
Разбор сложных заданий в тг-канале
Задачи для практики
Задача 1
Установите соответствие между мономером, используемым в реакции полимеризации, и схемой реакции его получения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| МОНОМЕР | СХЕМА РЕАКЦИИ |
| А) $CH_2=CH–CH=CH_2$ Б) $CH_2=C(Cl)–CH=CH_2$ В) $CH_2=CHCl$ |
1) $CH_2=CH–C≡CH + HCl →$ 2) $C_2H_5OH {→}↙{катализатор}↖{t°}$ 3) $C_2H_2 + HCl →$ 4) $CH_2=CH–CH=CH_2 + HCl →$ 5) $CH_2=CH_2 + HCl →$ |
Запишите выбранные цифры под соответствующими буквами.
Решение
А) Бутадиен синтезируется пропусканием этилового спирта через катализатор из оксидов металлов при температуре 400—450 °C.
Б) Хлоропрен получается в реакции винилацетилена с хлороводородом.
В) Винилхлорид получается в реакции ацетилена с хлороводородом.
Ответ: 213
Задача 2
Установите соответствие между реагирующими веществами и изменениями, которые наблюдаются в ходе реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ИСТОЧНИК | ПРОДУКТ ПЕРЕРАБОТКИ |
| А) нефть Б) древесина В) природный газ |
1) глицерин 2) метан 3) мазут 4) этиловый спирт |
Запишите выбранные цифры под соответствующими буквами.
Решение
А: Мазут – один из видов топлива, фракция нефти.
Б: Благодаря брожению продуктов древесины получаются сахаро-подобные вещества, за счет гидролиза которых образуется этанол.
В: Метан – главный продукт переработки природного газа.
Ответ: 342
Задача 3
Установите соответствие между аппаратом, который используется в химическом производстве, и технологическим процессом, происходящим в этом аппарате: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| АППАРАТ | ТЕХНОЛОГИЧЕСКИЙ ПРОЦЕСС |
| А) контактный аппарат Б) компрессор В) поглотительная башня |
1) синтез аммиака 2) обжиг пирита 3) получение олеума 4) окисление диоксида серы |
Запишите выбранные цифры под соответствующими буквами.</
Решение
А) Контактный аппарат используется для окисления диоксида серы кислородом в присутствии катализатора.
Б) Компрессор используется для производства аммиака, потому что смесь газов в процессе производства должны быть под давлением.
В) Поглотительная башня используется для получения олеума. В нее подается оксид серы (VI) и 98% серная кислота, а выходит олеум.
Ответ: 413
Задача 4
Установите соответствие между веществом и схемой его получения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ВЕЩЕСТВО | СХЕМА ПОЛУЧЕНИЯ |
| А) дивиниловый каучук Б) фенолформальдегидная смола В) нейлон |
1) nCH2=CH–CH=CH2 → 2) nCH2=C(CH3)–CH=CH2 → 3) nC6H5OH + nCH2O → 4) nHOOC–(CH2)4–COOH + nH2N–(CH2)6–NH2 → 5) nCH2(OH)–CH2OH + nHOOC–C6H4–COOH → |
Запишите выбранные цифры под соответствующими буквами.
Решение
А) Дивиниловый(бутадиеновый) каучук получается путем полимеризации бутадиена ($CH_2 =CH–CH=CH_2$).
Б) Фенолформальдегидные смолы – продукты поликонденсации фенола $C_6H_5OH$ с формальдегидом $CH_2=O$.
В) Нейлон синтезируется поликонденсацией адипиновой кислоты ($HOOC–(CH_2)_4 –COOH$) и гексаметилендиамина ($H_2N–(CH_2)_6 –NH_2$).
Ответ: 134
Задача 5
Установите соответствие между лабораторным оборудованием и его применением: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ОБОРУДОВАНИЕ | ПРИМЕНЕНИЕ |
| А) ступка Б) стеклянная воронка В) шпатель |
1) отбор твёрдых веществ 2) измельчение веществ 3) разделение несмешивающихся жидкостей 4) разделение осадка от раствора |
Запишите выбранные цифры под соответствующими буквами.
Решение
А) Ступка используется для измельчения веществ.
Б) Воронка используется для фильтрования (в неё помещают фильтровальную бумагу, через которую пропускают фильтруемую жидкость).
В) Шпатель используется для отбора твёрдых веществ.
Ответ: 241
Задача 6
Установите соответствие между веществом и областью его применения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ВЕЩЕСТВО | ОБЛАСТЬ ПРИМЕНЕНИЯ |
| А) изопропилбензол Б) этанол В) триолеин |
1) получение полиэфиров 2) получение ацетона 3) производство маргарина 4) получение дивинила |
Запишите выбранные цифры под соответствующими буквами.
Решение
А) Изопропилбензол (кумол) является сырьём для получения ацетона.
Б) Этанол используют для получения дивинила (бутена-1,3): $2CH_3CH_2OH = CH_2=CH−CH=CH_2 + 2H_2O + H_2$
В) Триолеин — жир, используемый для получения маргарина
Ответ: 243
Задача 7
Установите соответствие между получаемым в промышленности веществом и сырьём, используемым для его получения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ВЕЩЕСТВО | ИСПОЛЬЗУЕМОЕ СЫРЬЁ |
| А) аммиак Б) азотная кислота В) водород |
1) раствор поваренной соли 2) атмосферный азот 3) нитрат аммония 4) аммиак |
Запишите выбранные цифры под соответствующими буквами.
Решение
А) Аммиак получают реакцией соединения водорода и азота, азот дешевле всего получать из атмосферы, так как он составляет бо́льшую её часть.
Б) Азотная кислота может быть получена в несколько стадий из аммиака.
В) Водород выделяется при электролизе растворов солей активных металлов, в том числе раствора поваренной соли (хлорида натрия).
Ответ: 241
Задача 8
Установите соответствие между аппаратом, который используется в химическом производстве, и процессом, происходящим в этом аппарате: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| АППАРАТ | ПРОЦЕСС |
| А) печь для обжига Б) компрессор В) ректификационная колонна |
1) получение сернистого газа 2) синтез метанола 3) переработка нефти 4) дегидрирование метана |
Запишите выбранные цифры под соответствующими буквами.
Решение
А) В печи для обжига протекает первая стадия получения серной кислоты — сжигание пирита до сернистого газа.
Б) Компрессор увеличивает давление газов, что является необходимым условием для проведения реакции синтеза метанола из синтез-газа — смеси СО и $Н_2$.
В) В ректификационной колонне нефть делят на фракции, это одна из основных стадий переработки нефти.
Ответ: 123
Задача 9
Установите соответствие между осуществляемым в промышленности процессом и оборудованием, которое используется в производстве: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ПРОЦЕСС | ОБОРУДОВАНИЕ |
| А) получение сернистого газа Б) получение олеума В) получение оксида серы(VI) |
1) окислительная башня 2) печь «кипящего слоя» 3) контактный аппарат 4) поглотительная башня |
Запишите выбранные цифры под соответствующими буквами.
Решение
А: Для получения сернистого газа используют печь кипящего слоя, в ней происходит обжиг пирита.
Б: Для получения олеума используют поглотительную башню, в которой серная кислота поглощает $SO_3$.
В: Оксид серы (VI) можно получить в контактном аппарате, где, при помощи катализатора, оксид серы (IV) реагирует с кислородом.
Ответ: 243
Задача 10
Установите соответствие между веществом и способом его получения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ВЕЩЕСТВО | СПОСОБ ПОЛУЧЕНИЯ |
| А) сернистый газ Б) анилин В) натрий |
1) электролиз расплава поваренной соли 2) обжиг пирита в «кипящем слое» 3) восстановление нитробензола 4) электролиз раствора хлорида натрия |
Запишите выбранные цифры под соответствующими буквами.
Решение
А) сернистый газ является промежуточным продуктом при получении серной кислоты в промышленности, он образуется при обжиге пирита в «кипящем слое».
Б) анилин (фениламин) $С_6Н_5-NH_2$ получают реакцией Зинина — восстановлением нитробензола $С_6Н_5-NO_2$.
В) Натрий — очень активный металл, поэтому получают его электролизом расплавов солей, например, поваренной соли (хлорида натрия). При электролизе раствора на катоде выделяется водород.
Ответ: 231
Задача 11
Установите соответствие между веществом и основной областью его применения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ВЕЩЕСТВО | ОБЛАСТЬ ПРИМЕНЕНИЯ |
| А) криолит Б) пирит В) метилметакрилат |
1) производство антифриза 2) получение алюминия 3) производство серной кислоты 4) получение органического стекла |
Запишите выбранные цифры под соответствующими буквами.
Решение
А: Криолит – гексафторалюминат натрия, из него электролитически получают алюминий.
Б: Из пирита можно получить оксид серы (IV), который позже окисляют и получают серную кислоту.
В: Из метилметакрилата получает полиметилметакрилат путем поликонденсации, а это и есть органическое стекло.
Ответ: 234
Задача 12
Установите соответствие между металлом и веществом, которое используется для получения металла в промышленности, или способом промышленного получения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| МЕТАЛЛ | ВЕЩЕСТВО/СПОСОБ ПОЛУЧЕНИЯ |
| А) железо Б) алюминий В) натрий |
1) красный железняк 2) электролиз раствора оксида в криолите 3) электролиз раствора поваренной соли 4) электролиз расплава поваренной соли |
Запишите выбранные цифры под соответствующими буквами.
Решение
Красный железняк (гематит) — $Fe_2O_3$, используется для получения железа. В природе алюминий больше всего встречается в составе оксида $Al_2O_3$, из которого и получают металлический алюминий. Поваренная соль — NaCl используется для получения металлического натрия. Активные металлы удается получить только электролизом расплава соли (при электролизе раствора на катоде будет восстанавливаться водород).
Ответ: 124
Задача 13
Установите соответствие между аппаратом, который используется в химическом производстве, и процессом, происходящим в этом аппарате: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| АППАРАТ | ПРОЦЕСС |
| А) печь кипящего слоя Б) колонна синтеза В) поглотительная башня |
1) взаимодействие водорода и азота 2) окисление окcида азота(IV) 3) получение олеума 4) получение оксида серы(IV) |
Запишите выбранные цифры под соответствующими буквами.
Решение
А) В печи кипящего слоя обжигают пирит, получая сернистый газ.
$4FeS_2 +11O_2 = 2Fe_2O_3 + 8SO_2$
Это первая стадия производства серной кислоты.
Б) Колонна синтеза — основной реактор производства аммиака, в нём протекает реакция соединения водорода и азота.
$3H_2 + N_2 = 2 NН_3$
В) В поглотительной башне протекает последняя стадия производства серной кислоты — взаимодействие оксида серы 6 с концентрированным раствором серной кислоты, в результате которого получают олеум.
Ответ: 413
Задача 14
Установите соответствие между веществом и способом его получения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ВЕЩЕСТВО | СПОСОБ ПОЛУЧЕНИЯ |
| А) полипропилен Б) фторопласт В) бутадиенстирольный каучук |
1) вулканизация 2) полимеризация 3) поликонденсация 4) сополимеризация |
Запишите выбранные цифры под соответствующими буквами.
Решение
Вещества А и Б являются полимерами, а полимеры получаются в результате полимеризации.
В: Как мы видим по названию, это полимер двух веществ: бутадиен и стирол, значит нужно использовать сополимеризацию.
Ответ: 224
Задача 15
Установите соответствие между органическим веществом и способом его промышленного получения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ВЕЩЕСТВО | СПОСОБ ПОЛУЧЕНИЯ |
| А) метан Б) бензол В) метанол |
1) ароматизация продуктов перегонки нефти 2) получение из синтез-газа 3) выделяют из природного газа 4) димеризация ацетилена |
Запишите выбранные цифры под соответствующими буквами.
Решение
Метан — одна из основных составляющих природного газа, из которого его и получают.
Самое дешёвое сырьё для получения бензола — продукты перегонки нефти, из которых его получают реакцией ароматизации алифатических соединений.
Реакция синтеза метанола: $CO + 2H_2 = CH_3OH$.
Смесь угарного газа и водорода называется синтез-газом.
Ответ: 312
Задача 16
Установите соответствие между процессом и технологическим приёмом/оборудованием, который(-ое) используется при осуществлении этого процесса: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ПРОЦЕСС | ТЕХНОЛОГИЧЕСКИЙ ПРИЁМ / ОБОРУДОВАНИЕ |
| А) получение олеума Б) обжиг пирита В) очистка обжигового газа |
1) циркуляционный процесс 2) циклон 3) контактный аппарат 4) принцип противотока |
Запишите выбранные цифры под соответствующими буквами.
Решение
А: При получении олеума кислота распыляется сверху, а оксид серы (VI) поступает снизу.
Б: Обжиг пирита происходит в кипящем слое, а это принцип противотока.
В: Циклон используется для очистки газа после обжига от крупных пылинок.
Ответ: 442
Рекомендуемые курсы подготовки
Назовём маской числа последовательность цифр, в которой также могут встречаться следующие символы:
– символ «?» означает ровно одну произвольную цифру;
– символ «*» означает любую последовательность цифр произвольной длины; в том числе «*» может задавать и пустую последовательность.
Например, маске (123*4?5) соответствуют числа (123405) и (12300405).
Среди натуральных чисел, не превышающих (10^{9}), найдите все числа, соответствующие маске (2*5443?1), делящиеся на (23) без остатка. В ответе запишите в первом столбце таблицы все найденные числа в порядке возрастания, а во втором столбце – соответствующие им результаты деления этих чисел на (23). Количество строк в таблице для ответа избыточно.
Решение:
Python
for n in range(2):
for k in range(10**n):
for j in range(10):
z = 2 * 10**(6+n) + k * 10**6 + 5443 * 100 + j * 10 + 1
if z % 23 == 0:
print(z, z//23)
Ответ:
(22544301) (980187)
(23544341) (1023667)
(24544381) (1067147)
(28544311) (1241057)
(29544351) (1284537)

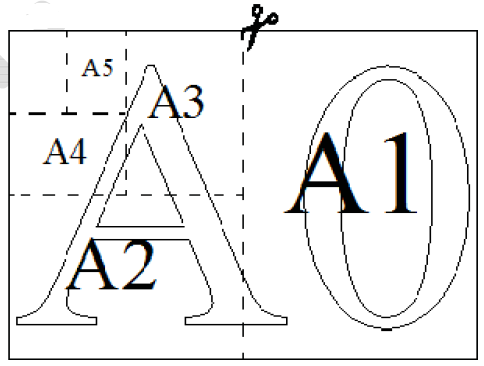














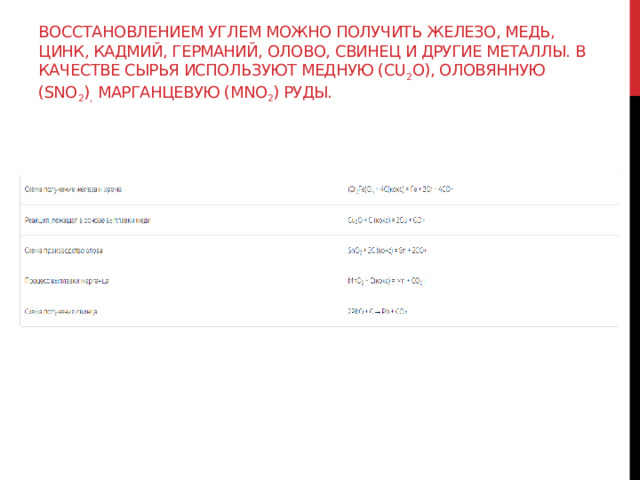

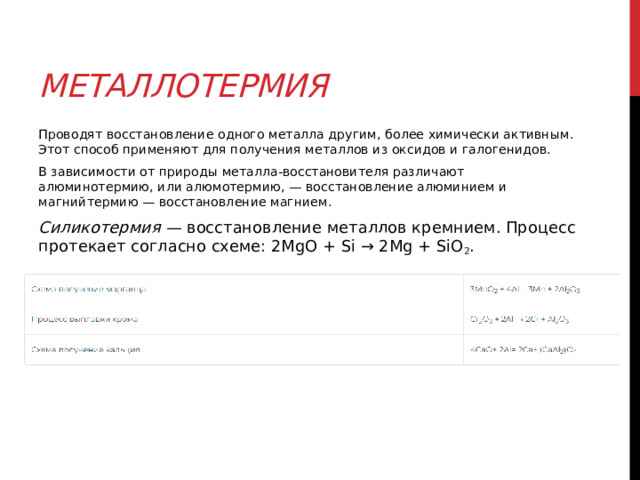



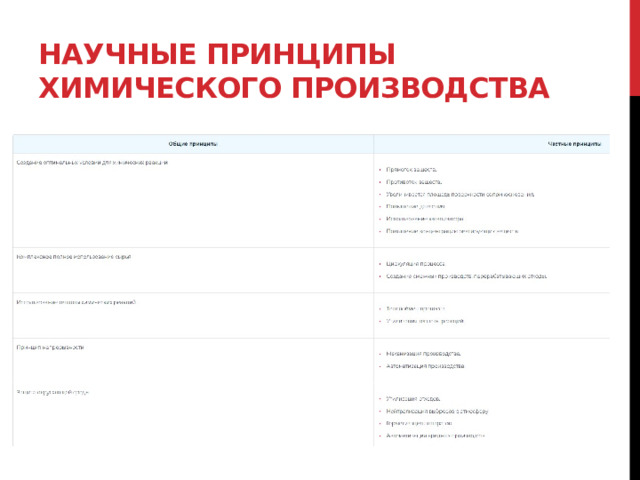

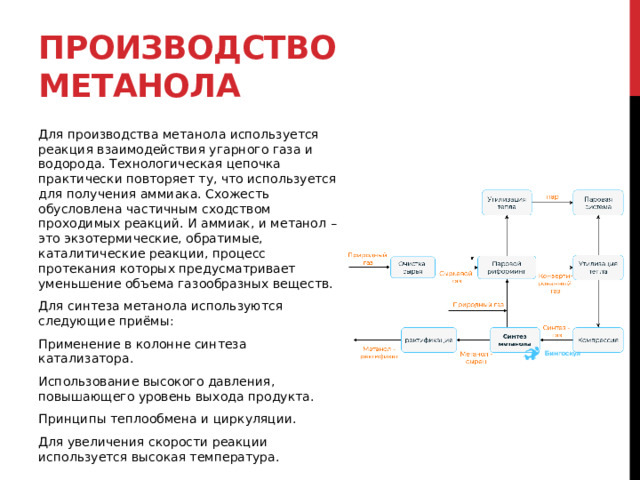

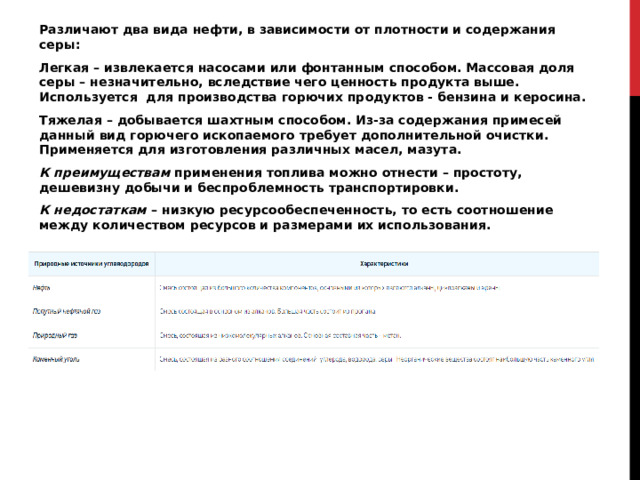








![Реакции полимеризации Реакции полимеризации заключаются в объединении большого количества низкомолекулярных соединений, количество которых определяется степенью полимеризации. Общее уравнение реакции: n X → (-X-) n Самой распространенной реакций полимеризации является реакция получения полиэтилена: nC 2 H 4 = (CH 2 – CH 2 ) n реакции полимеризации вступают непредельные соединения. Это могут быть молекулы одного мономера, либо разных. В первой ситуации реакцию называют гомополимеризацией, во второй – сополимеризацией. I. Гомополимеризация К этим реакциям относят получение полиэтилена, полипропилена поливинилхлорида и т.д. Например, получение полипропилена из пропена под действием ультрафиолетовых лучей: n CH 2 =CH-CH 3 → (CH 2 -CH(CH 3 )-) n II. Сополимеризация К этим реакциям относят получение сополимера этилена и пропилена: n CH 2 =CH 2 + n CH 2 =CH-CH 3 → [(-CH 2 -CH 2 -) x – (-CH 2 -CH(CH 3 )-) y ] n , где 1Полимеры, которые получают в результате реакций полимеризации](https://fsd.multiurok.ru/html/2022/07/17/s_62d3ba5b4efd3/img43.jpg)