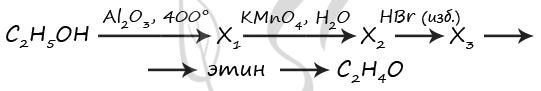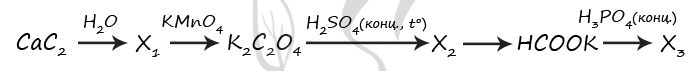Тренажер задания 31 из ЕГЭ по химии марганца, задачи на неорганическую химию (мысленный эксперимент) из экзамена ЕГЭ по химии, задания 31 по химии марганца с текстовыми решениями и ответами.
- Нитрат марганца (II) прокалили, к полученному твердому бурому веществу прилили концентрированную хлороводородную кислоту. Выделившийся газ пропустили через сероводородную кислоту. Образовавшийся раствор образует осадок с хлоридом бария. Напишите уравнения описанных реакций.
Mn(NO3)2 → MnO2 + 2NO2
MnO2 + 4HCl = MnCl2 + Cl2 ↑ + 2H2O
4Cl2 + H2S + 4H2O = 8HCl + H2SO4
H2SO4 + BaCl2 = BaSO4 + 2HCl
- Бурый осадок, полученный при взаимодействии сульфита натрия с водным раствором перманганата калия, отфильтровали и обработали концентрированной серной кислотой. Выделяющийся газ при нагревании реагирует с алюминием, а образующееся вещество – с раствором соляной кислоты. Напишите уравнения описанных реакций.
3Na2SO3 + 2KMnO4 + H2O = 3Na2SO4 + 2MnO2 + 2KOH
2MnO2 + 2H2SO4(конц.) = 2MnSO4 + O2↑ + 2H2O
3O2 + 4Al = 2Al2O3
2Al2O3 + 6HCl = 2AlCl3 + 3H2O
- Твердое вещество, которое образуется при нагревании фосфора и пятихлористого фосфора, растворили в большом количестве воды. Часть полученного раствора добавили в подкисленный серной кислотой раствор перманганата калия, при этом последний обесцветился. Напишите уравнения описанных реакций.
2P + 3PCl5 = 5PCl3
PCl3 + 3H2O = H3PO3 + 3HCl↑
5H3PO3 + 2KMnO4 + 3H2SO4 = 5H3PO4 + K2SO4 + 2MnSO4 + 3H2O
2KMnO4 + 16HCl = 2MnCl2 + 2KCl + 5Cl2↑ + 8H2O
1) 2KMnO4 → K2MnO4 + MnO2 + O2
2) MnO2 + 4HCl = MnCl2 + Cl2 + 2H2O
3) MnCl2 + 2NaOH = Mn(OH)2 + 2NaCl
4) Mn(OH)2 + 4KMnO4 + 6KOH = 5K2MnO4 + 4H2O
5) 2K2MnO4 + Cl2 = 2KMnO4 + 2KCl
6) 2KMnO4 + 3KNO2 + H2O = 2MnO2 + 3KNO3 + 2KOH
7) 3MnO2 + 4Al → 3Mn + 2Al2O3
- K2MnO4 + 4HNO2 = 2KNO2 + Mn(NO3)2 + 2H2O
- 4KMnO4 + Mn(OH)2 + 6KOH = 5K2MnO4 + 4H2O
- MnCl2 + 2NaOH = Mn(OH)2↓ + 2NaCl
- MnCl2 + AgNO3 = Mn(NO3)2 + 2AgCl↓
- 2KMnO4 + 3CH2 = CH2 + 4H2O → 3CH2(OH) − CH2(OH) + 2MnO2↓ + 2H2O
- 2KMnO4 + 5H2O2 + 3H2SO4 = 2MnSO4 + K2SO4 + 5O2↑ + 8H2O
- Mn + H2SO4((разб.) = MnSO4 + H2↑
- 3MnO2 + 4Al → 3Mn + 2Al2O3
- 2MnO2 + 4HNO2 = Mn(NO3)2 + Mn(NO2)2 + 2H2O
- 2KMnO4 + H2O2 + 2KOH = 2K2MnO4 + O2↑ + 2H2O
- MnSO4 + 2NaOH = Mn(OH)2↓ + Na2SO4
- 3MnCl2 + 2Al → 3Mn + 2AlCl2
- MnO2 + 4HCl = MnCl2 + Cl2 + 2H2O
- MnCl2 + 2CH3COOAg = (CH3COO)2Mn + 2AgCl↓
- (CH3COO)2Mn + 2NaOH = Mn(OH)2↓ + 2CH3COONa
- Mn(OH)2 + 2HBr = MnBr2 + 2H2O
- MnBr2 + 2AgNO3 = Mn(NO3)2 + 2AgBr↓
- Mn(NO3)2 → MnO2 + 2NO2
- 2KMnO4 → K2MnO4 + MnO2 + O2
- K2MnO4 + 8HCl = MnCl2 + 2KCl + 2Cl2 + 4H2O
- MnCl2 + 2NaOH = Mn(OH)2↓ + 2NaCl
- 2Mn(OH)2 + O2 + 2H2O = 2Mn(OH)4
- MnO2 + SO2 = MnSO4
- 2MnSO4 + 8HNO3 + 5PbO = 2HMnO4 + 4Pb(NO3)2 + 2H2O + Pb(HSO4)2
- CH2Br – СHBr − CH3 + Mg → MgBr2 + CH2=CH−CH3
- 3CH2=CH−CH3 + 2KMnO4 + 4H2O → 3CH2OH – CHOH − CH3 + 2KOH + 2MnO2
- CH2Br – СHBr − CH3 + 2KOH(спиртовой) → CH≡C –CH3 + 2KBr + 2H2O
- 5CH ≡ C – CH3 + 8KMnO4 + 12H2SO4 → 5CO2 + 5CH3COOH + 8MnSO4 + 4K2SO4 + 12H2O
Марганец растворили в разбавленной серной кислоте. Через полученный раствор пропускали воздух и одновременно добавляли раствор гидроксида натрия. Выпавший коричневый осадок отфильтровали и растворили в концентрированной соляной кислоте, а выделившийся при этом газ собрали в колбу, в которую затем внесли нагретый фосфор. Напишите уравнения четырёх описанных реакций.
Спрятать решение
Решение.
Вариант ответа.
Ответ включает в себя четыре уравнения возможных реакций, соответствующих описанным превращениям:
1)
2)
3)
4) или
Спрятать критерии
Критерии проверки:
| Критерии оценивания выполнения задания | Баллы |
|---|---|
| Правильно записаны четыре уравнения реакций | 4 |
| Правильно записаны три уравнения реакций | 3 |
| Правильно записаны два уравнения реакций | 2 |
| Правильно записано одно уравнение реакции | 1 |
| Все уравнения реакций записаны неверно | 0 |
| Максимальный балл | 4 |
15 мая 2022
В закладки
Обсудить
Жалоба
Подборка заданий прошлых лет.
Формулировка задания: «Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения. При написании уравнений реакций указывайте преимущественно образующиеся продукты, используйте структурные формулы органических веществ».
32_reshenia.pdf
32_zadania.pdf
Источник: vk.com/examtop
Чтобы поделиться, нажимайте
Реальный ЕГЭ по химии 2020. Задание 32
Представляем вашему вниманию задание 32 из реального ЕГЭ 2020 (основная волна и резервные дни — 16 июля 2020 года, 24 июля 2020) с подробными текстовыми решениями и ответами.
Реальный ЕГЭ 2020. Задание 32. Вариант 1
- Дигидрофосфат кальция растворили в избытке раствора гидроксида калия. Полученное соединение кальция отделили и высушили, а затем сплавили с оксидом кремния (IV) и углеродом. Полученное простое вещество прореагировало с хлоратом калия. Образовавшуюся соль растворили в воде и провели электролиз полученного раствора. Напишите уравнения четырёх описанных реакций.
Развернуть/свернуть решение
1) 3Ca(H2PO4)2 + 12KOH = 4K3PO4 + Ca3(PO4)2↓ + 12H2O
2) Ca3(PO4)2 + 5C + 3SiO2 = 2P + 3CaSiO3 + 5CO (сплавление)
или 2Ca3(PO4)2 + 10C + 6SiO2 = P4 + 6CaSiO3 + 10CO (сплавление)
3) 5KClO3 + 6P = 5KCl + 3P2O5
или 10KClO3 + 12P = 10KCl + 3P4O10
или 10KClO3 + 3P4 = 3P4O10 + 10KCl
или 10KClO3 + 3P4 = 6P2O5 + 10KCl
4) 2KCl + 2H2O = H2↑ + Cl2↑ + 2KOH (электролиз)
Реальный ЕГЭ 2020. Задание 32. Вариант 2
- К раствору сульфата хрома (III) прилили раствор сульфита натрия. В результате реакции выделился газ и выпал осадок. Полученный газ пропустили через раствор перманганата калия. А осадок, полученный в первой реакции, отделили и добавили к раствору пероксида водорода подщелоченного гидроксидом натрия. Затем к образовавшемуся раствору прилили избыток раствора разбавленной серной кислоты. Напишите уравнения четырёх описанных реакций.
Развернуть/свернуть решение
1) Cr2(SO4)3 + 3Na2SO3 + 3H2O = 2Cr(OH)3↓ + 3SO2↑ + 3Na2SO4
2) 5SO2 + 2KMnO4 + 2H2O = 2MnSO4 + K2SO4 + 2H2SO4
3) 2Cr(OH)3 + 3H2O2 + 4NaOH = 2Na2CrO4 + 8H2O
4) 2Na2CrO4 + H2SO4 = Na2SO4 + Na2Cr2O7 + H2O
Реальный ЕГЭ 2020. Задание 32. Вариант 3
- Железную окалину растворили в разбавленной серной кислоте. В полученный раствор добавили раствор дихромата калия, подкисленный серной кислотой. Хромосодержащее вещество, полученное в результате реакции, выделили и добавили его к раствору карбоната натрия. Полученный осадок отделили и растворили в горячем растворе хлората калия и гидроксида калия. Напишите уравнения четырёх описанных реакций.
Развернуть/свернуть решение
1) Fe3O4 + 4H2SO4 = FeSO4 + Fe2(SO4)3 + 4H2O
2) 6FeSO4 + K2Cr2O7 + 7H2SO4 = 3Fe2(SO4)3 + K2SO4 + Cr2(SO4)3 + 7H2O
3) Cr2(SO4)3 + 3Na2CO3 + 3H2O = 2Cr(OH)3↓ + 3CO2↑ + 3Na2SO4
4) 2Cr(OH)3 + KClO3 + 4KOH = KCl + 2K2CrO4 + 5H2O (нагревание)
Реальный ЕГЭ 2020. Задание 32. Вариант 4
- Натрий нагрели с кислородом. Полученное твёрдое вещество обработали подкисленным серной кислотой раствором перманганата калия. Газ, образовавшийся в ходе реакции, прореагировал с пиритом при нагревании. Полученное твёрдое вещество растворили в растворе иодоводорода. Напишите уравнения четырёх описанных реакций.
Развернуть/свернуть решение
1) 2Na + O2 = Na2O2
2) 5Na2O2 + 2KMnO4 + 8H2SO4 = 5Na2SO4 + K2SO4 + 2MnSO4 + 5O2↑ + 8H2O
3) 4FeS2 + 11O2 = 2Fe2O3 + 8SO2 (нагревание)
4) Fe2O3 + 6HI = 2FeI2 + I2↓ + 3H2O
Реальный ЕГЭ 2020. Задание 32. Вариант 5
- Провели электролиз раствора нитрата серебра (I). Полученный на аноде газ прореагировал с раскалённым железом. Образовавшееся твёрдое вещество чёрного цвета растворили в растворе иодоводородной кислоты. Полученное простое вещество отделили и растворили при нагревании в растворе гидроксида натрия. Напишите уравнения четырёх описанных реакций.
Развернуть/свернуть решение
1) 4AgNO3 + 2H2O = 4Ag↓ + O2↑ + 4HNO3 (электролиз)
2) 3Fe + 2O2 = Fe3O4 (нагревание)
3) Fe3O4 + 8HI = 3FeI2 + I2↓ + 4H2O
4) 3I2 + 6NaOH = NaIO3 + 5NaI + 3H2O (нагревание)
Реальный ЕГЭ 2020. Задание 32. Вариант 6
- К фосфиду алюминия добавили соляную кислоту. Затем к получившемуся раствору добавили раствор сульфита калия, в результате чего образовался белый осадок и бесцветный газ. Выделившийся газ разделили на две части. Первую часть пропустили через раствор дихромата натрия, подкисленный серной кислотой. Вторую часть газа пропустили через концентрированную азотную кислоту. Напишите уравнения четырёх описанных реакций.
Развернуть/свернуть решение
1) AlP + 3HCl = AlCl3 + PH3↑
2) 2AlCl3 + 3K2SO3 + 3H2O = 2Al(OH)3↓ + 3SO2↑ + 6KCl
3) Na2Cr2O7 + 3SO2 + H2SO4 = Na2SO4 + Cr2(SO4)3 + H2O
4) SO2 + 2HNO3 = H2SO4 + 2NO2↑
Реальный ЕГЭ 2020. Задание 32. Вариант 7
- Смешали растворы хлорной кислоты и гидроксида натрия. Полученную соль выделили и сплавили с оксидом хрома (III) и гидроксидом натрия. Соль, содержащую хром, отделили и добавили к избытку разбавленного раствора серной кислоты. Затем через полученный кислый раствор пропустили сероводород. Напишите уравнения четырёх описанных реакций.
Развернуть/свернуть решение
1) HClO4 + NaOH = NaClO4 + H2O
2) 3NaClO4 + 4Cr2O3 + 16NaOH = 8Na2CrO4 + 3NaCl + 8H2O (сплавление)
3) 2Na2CrO4 + H2SO4 = Na2Cr2O7 + Na2SO4 + H2O
4) 3H2S + Na2Cr2O7 + 4H2SO4 = 3S + Cr2(SO4)3 + Na2SO4 + 7H2O
или 3H2S + 4Na2Cr2O7 + 13H2SO4 = 4Cr2(SO4)3 + 4Na2SO4 + 16H2O
Реальный ЕГЭ 2020. Задание 32. Вариант 8
- К раствору сульфата цинка добавили избыток раствора гидроксида калия. Через образовавшийся раствор пропустили сероводород, образовавшийся белый осадок растворили в концентрированной азотной кислоте и наблюдали выделение бурого газа. Выделившийся бурый газ пропустили через раствор гидроксида бария. Запишите уравнения четырёх описанных реакций.
Развернуть/свернуть решение
1) ZnSO4 + 4KOH = K2SO4 + K2[Zn(OH)4]
2) K2[Zn(OH)4] + 3H2S = ZnS↓ + 2KHS + 4H2O
или K2[Zn(OH)4] + 2H2S = ZnS↓ + K2S + 4H2O
3) ZnS + 8HNO3 = ZnSO4 + 8NO2↑ + 4H2O
или ZnS + 10HNO3 = Zn(NO3)2 + 8NO2↑ + H2SO4 + 4H2O
или ZnS + 4HNO3 = Zn(NO3)2 + S↓ + 2NO2↑ +2H2O
4) 4NO2 + 2Ba(OH)2 = Ba(NO2)2 + Ba(NO3)2 + 2H2O
Реальный ЕГЭ 2020. Задание 32. Вариант 9
- Алюминий добавили к раствору гидроксида калия. Через полученный прозрачный раствор пропустили газ, получившийся при взаимодействии магния с концентрированной серной кислотой. Образовавшийся осадок отделили, а в оставшийся раствор добавили раствор перманганата калия, в результате чего в осадок перешло простое вещество. Напишите уравнения четырёх описанных реакций.
Развернуть/свернуть решение
1) 2Al + 2KOH + 6H2O = 2K[Al(OH)4] + 3H2↑
2) 4Mg + 5H2SO4 (конц.) = 4MgSO4 + H2S↑ + 4H2O
3) 2K[Al(OH)4] + H2S = 2Al(OH)3↓ + K2S + 2H2O
или K[Al(OH)4] + H2S → KHS + Al(OH)3↓ + H2O
4) 3K2S + 2KMnO4 + 4H2O = 3S↓ + 2MnO2↓ + 8KOH
или 3KHS + 2KMnO4 + H2O = 5KOH + 2MnO2↓ + 3S↓
Реальный ЕГЭ 2020. Задание 32. Вариант 10
- Оксид хрома (VI) обработали избытком раствора гидроксида натрия. К полученному жёлтому раствору прилили серную кислоту. Затем раствор снова подкислили серной кислотой и пропустили через него фосфин. Полученную соль хрома выделили и добавили к ней раствор карбоната калия. Напишите уравнения четырёх описанных реакций.
Развернуть/свернуть решение
1) CrO3 + 2NaOH = Na2CrO4 + H2O
2) 2Na2CrO4 + H2SO4 = Na2Cr2O7 + Na2SO4 + H2O
3) 4Na2Cr2O7 + 16H2SO4 + 3PH3 = 4Cr2(SO4)3 + 4Na2SO4 + 3H3PO4 + 16H2O
4) Cr2(SO4)3 + 3K2CO3 + 3H2O = 2Cr(OH)3↓ + 3CO2↑ + 3K2SO4
Реальный ЕГЭ 2020. Задание 32. Вариант 11
- Оксид меди (I) растворили в концентрированной азотной кислоте. Образовавшуюся соль выделили, высушили и прокалили. Через полученный твёрдый остаток при нагревании пропустили газ, полученный при сливании известковой воды и раствора гидрофосфата аммония. Напишите уравнения четырёх описанных реакций.
Развернуть/свернуть решение
1) Cu2O + 6HNO3 (конц.) = 2Cu(NO3)2 + 2NO2 + 3H2O
2) 2Cu(NO3)2 = 2CuO + 4NO2↑ + O2↑ (прокаливание)
3) 3Ca(OH)2 + 2(NH4)2HPO4 = Ca3(PO4)3↓ + 4NH3↑ + 6H2O
или Ca(OH)2 + (NH4)2HPO4 = CaHPO4↓ + 2NH3↑ + 2H2O
4) 3CuO + 2NH3 = 3Cu + N2 + 3H2O (нагревание)
Реальный ЕГЭ 2020. Задание 32. Вариант 12
- Дихромат аммония прокалили до постоянной массы. Твёрдый остаток растворили в растворе пероксида водорода с гидроксидом калия. К образовавшемуся раствору жёлтого цвета прилили избыток концентрированной бромоводородной кислоты. Полученную соль хрома выделили и добавили к раствору карбоната калия. Напишите уравнения четырёх описанных реакций.
Развернуть/свернуть решение
1) (NH4)2Cr2O7 = N2↑ + Cr2O3 + 4H2O (прокаливание)
2) Cr2O3 + 4KOH + 3H2O2 = 2K2CrO4 + 5H2O
3) 2K2CrO4 + 16HBr = 4KBr + 2CrBr3 + 3Br2 + 8H2O
4) 2CrBr3 + 3K2CO3 + 3H2O = 6KBr + 2Cr(OH)3↓ + 3CO2↑
Реальный ЕГЭ 2020. Задание 32. Вариант 13
- Карбид алюминия сожгли. Полученное твёрдое вещество поместили в раствор гидроксида натрия. Через образовавшийся прозрачный раствор пропустили газ, полученный при действии на магний концентрированной серной кислоты. При пропускании газа происходило выпадение белого осадка и образование соли бескислородной кислоты.
Развернуть/свернуть решение
1) Al4C3 + 6O2 = 3CO2 + 2Al2O3
2) Al2O3 + 2NaOH + 3H2O = 2Na[Al(OH)4]
3) 4Mg + 5H2SO4 (конц.) = 4MgSO4 + H2S↑ + 4H2O
4) H2S + 2Na[Al(OH)4] = 2Al(OH)3 ↓+ Na2S + 2H2O (допустимо образование NaHS)
Реальный ЕГЭ 2020. Задание 32. Вариант 14
- Натрий растворили в воде. Образовавшееся газообразное вещество при нагревании пропустили через железную окалину. Получившееся простое вещество при нагревании растворили в необходимом количестве концентрированной серной кислоты, при этом образовался бесцветный газ с резким запахом. К полученному раствору добавили раствор карбоната калия.
Развернуть/свернуть решение
1) 2Na + 2H2O = 2NaOH + H2↑
2) Fe3O4 + 4H2 = 3Fe + 4H2O
3) 2Fe + 6H2SO4 = Fe2(SO4)3 + 3SO2↑ + 6H2O
4) Fe2(SO4)3 + 3K2CO3 + 3H2O = 2Fe(OH)3↓ + 3CO2↑ + 3K2SO4
Реальный ЕГЭ 2020. Задание 32. Вариант 15
- Оксид меди (I) растворили в концентрированном растворе азотной кислоты. Полученный в результате бурый газ поглотили холодным раствором гидроксида натрия. К образовавшемуся раствору добавили подкисленный серной кислотой раствор дихромата натрия. Образовавшееся соединение хрома выделили и поместили в раствор карбоната калия.
Развернуть/свернуть решение
1) Cu2O + 6HNO3 = 2Cu(NO3)2 + 2NO2↑ + 3H2O
2) 2NO2 + 2NaOH = NaNO2 + NaNO3 + H2O
3) 3NaNO2 + Na2Cr2O7 + 4H2SO4 = 3NaNO3 + Cr2(SO4)3 + Na2SO4 + 4H2O
4) Cr2(SO4)3 + 3K2CO3 + 3H2O = 2Cr(OH)3↓ + 3CO2↑ + 3K2SO4
Реальный ЕГЭ 2020. Задание 32. Вариант 16
- К раствору дигидрофосфата калия добавили избыток раствора гидроксида кальция. Образовавшийся осадок отделили, высушили и нагрели с кремнезёмом и углём. Полученное простое вещество вступило в реакцию с хлоратом калия. Полученный при этом оксид поместили в избыток раствора гидроксида натрия.
Развернуть/свернуть решение
1) 2KH2PO4 + 3Ca(OH)2 = Ca3(PO4)2↓ + 2KOH + 4H2O
2) Ca3(PO4)2 + 3SiO2 + 5C = 3CaSiO3 + 5CO + 2P
3) 6P + 5KClO3 = 3P2O5 + 5KCl
4) P2O5 + 6NaOH = 2Na3PO4 + 3H2O
Реальный ЕГЭ 2020. Задание 32. Вариант 17
- Нитрат хрома (III) прокалили. Образовавшееся при этом твёрдое вещество нагрели с хлоратом натрия и гидроксидом натрия. Одно из полученных веществ прореагировало с концентрированным раствором хлороводородной кислоты. Образовавшуюся при этом соль хрома выделили, растворили в воде и полученный раствор прилили к раствору карбоната натрия.
Развернуть/свернуть решение
1) 4Cr(NO3)3 = 2Cr2O3 + 12NO2↑ + 3O2↑
2) Cr2O3 + NaClO3 + 4NaOH = 2Na2CrO4 + NaCl + 2H2O
3) 2Na2CrO4 + 16HCl = 2CrCl3 + 3Cl2↑ + 4NaCl + 8H2O
4) 2CrCl3 + 3Na2CO3 + 3H2O = 2Cr(OH)3↓ + 3CO2↑ + 6NaCl
Реальный ЕГЭ 2020. Задание 32. Вариант 18
- Перхлорат натрия сплавили с оксидом хрома (III) и гидроксидом натрия. Полученное соединение хрома поместили в разбавленный раствор серной кислоты. В образовавшийся раствор добавили серную кислоту и поместили иодид натрия. Образовавшееся простое вещество при нагревании прореагировало с гидроксидом калия.
Развернуть/свернуть решение
1) 3NaClO4 + 4Cr2O3 + 16NaOH = 8Na2CrO4 + 3NaCl + 8H2O
2) 2Na2CrO4 + H2SO4 = Na2Cr2O7 + Na2SO4 + H2O
3) Na2Cr2O7 + 6NaI + 7H2SO4 = 3I2↓ + Cr2(SO4)3 + 4Na2SO4 + 7H2O
4) 3I2 + 6KOH = KIO3 + 5KI + 3H2O
Реальный ЕГЭ 2020. Задание 32. Вариант 19
- Пероксид натрия поместили в раствор, содержащий перманганат калия и серную кислоту. Полученное простое вещество при нагревании прореагировало с железом. Образовавшееся при этом твёрдое вещество черного цвета поместили в раствор иодоводородной кислоты. Образовавшуюся при этом соль железа выделили, растворили в воде и полученный раствор прилили к раствору карбоната натрия.
Развернуть/свернуть решение
1) 5Na2O2 + 2KMnO4 + 8H2SO4 = 5O2↑ + 2MnSO4 + 5Na2SO4 + K2SO4 + 8H2O
2) 2O2 + 3Fe = Fe3O4
3) Fe3O4 + 8HI = 3FeI2 + I2↓ + 4H2O
4) FeI2 + Na2CO3 = FeCO3↓ + 2NaI
Реальный ЕГЭ 2020. Задание 32. Вариант 20
- Оксид железа (III) поместили в раствор бромоводородной кислоты. Через получившийся раствор пропустили аммиак. Образовавшийся при этом осадок отделили и прокалили. Полученное бурое вещество сплавили с твёрдым гидроксидом калия.
Развернуть/свернуть решение
1) Fe2O3 + 6HBr = 2FeBr3 + 3H2O
2) FeBr3 + 3NH3 + 3H2O = Fe(OH)3↓ + 3NH4Br
3) 2Fe(OH)3 = Fe2O3 + 3H2O
4) Fe2O3 + 2KOH = 2KFeO2 + H2O
Реальный ЕГЭ 2020. Задание 32. Вариант 21
- Через раствор силиката калия пропустили углекислый газ. Полученный при этом осадок отделили, а оставшийся раствор смешали с раствором сульфата железа (III). Выпавший при этом осадок отделили и прокалили. Полученное бурое вещество сплавили с твёрдым карбонатом натрия.
Развернуть/свернуть решение
1) K2SiO3 + CO2 + H2O = H2SiO3↓ + K2CO3 (допустимо образование KHCO3)
2) 3K2CO3 + Fe2(SO4)3 + 3H2O = 2Fe(OH)3↓ + 3CO2↑ + 3K2SO4
3) 2Fe(OH)3 = Fe2O3 + 3H2O
4) Fe2O3 + Na2CO3 = 2NaFeO2 + CO2↑
Реальный ЕГЭ 2020. Задание 32. Вариант 22
- Алюминат натрия растворили в серной кислоте. К полученному при этом раствору добавили раствор сульфида натрия. Выделившийся газ разделили на две части, одну часть поглотили раствором дихромата натрия, подкисленным серной кислотой. Другую часть газа поглотили бромной водой.
Развернуть/свернуть решение
1) 2NaAlO2 + 4H2SO4 = Na2SO4 + Al2(SO4)3 + 4H2O
2) Al2(SO4)3 + 3Na2S + 6H2O = 2Al(OH)3↓ + 3H2S↑ + 3Na2SO4
3) 3H2S + Na2Cr2O7 + 4H2SO4 = 3S↓ + Cr2(SO4)3 + Na2SO4 + 7H2O
4) H2S + Br2 = S↓ + 2HBr
Реальный ЕГЭ 2020. Задание 32. Вариант 23
- Цинк сплавили с твёрдым гидроксидом калия. Полученное в результате твёрдое вещество растворили в необходимом количестве раствора серной кислоты. В образовавшийся раствор добавили сульфид калия, в результате чего образовался белый осадок. Осадок отделили и при нагревании растворили в концентрированной серной кислоте, при этом образовался бесцветный газ с резким запахом.
Развернуть/свернуть решение
1) Zn + 2KOH = K2ZnO2 + H2↑
2) K2ZnO2 + 2H2SO4 = K2SO4 + ZnSO4 + 2H2O
3) ZnSO4 + K2S = ZnS↓ + K2SO4
4) ZnS + 4H2SO4 (конц.) = ZnSO4 + 4SO2↑ + 4H2O
Реальный ЕГЭ 2020. Задание 32. Вариант 24
- Нитрат железа (II) прокалили. Полученное твердое вещество сплавили с твердым гидроксидом калия. Образовавшийся твердый продукт растворили в необходимом количестве бромоводородной кислоты. Через полученный раствор пропустили аммиак.
Развернуть/свернуть решение
1) 4Fe(NO3)2 = 2Fe2O3 + 8NO2↑ + O2↑
2) Fe2O3 + 2KOH = 2KFeO2 + H2O
3) KFeO2 + 4HBr = KBr + FeBr3 + 2H2O
4) FeBr3 + 3NH3 + 3H2O = Fe(OH)3↓ + 3NH4Br
Реальный ЕГЭ 2020. Задание 32. Вариант 25
- Нитрат цинка прокалили. Полученное простое вещество прореагировало с оксидом азота (II). Полученный продукт прореагировал с холодным раствором гидроксида натрия. К образовавшемуся раствору прилили раствор, содержащий дихромат натрия и серную кислоту.
Развернуть/свернуть решение
1) 2Zn(NO3)2 = 2ZnO + 4NO2↑ + O2↑
2) 2NO + O2 = 2NO2
3) 2NO2 + 2NaOH = NaNO2 + NaNO3 + H2O
4) 3NaNO2 + Na2Cr2O7 + 4H2SO4 = 3NaNO3 + Cr2(SO4)3 + Na2SO4 + 4H2O
Резерв
Реальный ЕГЭ 2020 (резервные дни). Задание 32. Вариант 1
- Гидросульфит бария растворили в водном растворе пероксида водорода. Полученную соль отделили и нагрели с водородом. Полученное вещество добавили в раствор сульфата алюминия. К образовавшемуся нерастворимому основанию, которое отделили от раствора, добавили раствор гидроксида натрия. Напишите уравнения четырёх описанных реакций.
Развернуть/свернуть решение
1) Ba(HSO3)2 + 2H2O2 = BaSO4↓ + H2SO4 + 2H2O
2) BaSO4 + 4H2 = BaS + 4H2O (нагревание) (очень спорная реакция)
3) 3BaS + Al2(SO4)3 + 6H2O = 3BaSO4↓ + 3H2S↑ + 2Al(OH)3↓
4) Al(OH)3 + NaOH = Na[Al(OH)4]
или Al(OH)3 + 3NaOH = Na3[Al(OH)6]
Реальный ЕГЭ 2020 (резервные дни). Задание 32. Вариант 2
- Прокалили смесь карбоната калия и оксида цинка. Полученный в результате реакции газ прореагировал с избытком твёрдой щёлочи при нагревании. В результате реакции образовалась соль, которую растворили в воде и к образовавшемуся раствору добавили хлорид алюминия. Полученный осадок отделили и растворили в растворе гидроксида калия. Напишите уравнения четырёх описанных реакций.
Развернуть/свернуть решение
1) K2CO3 + ZnO = K2ZnO2 + CO2↑ (прокаливание)
2) CO2 + 2NaOH = Na2CO3 + H2O
3) 2Na2CO3 + 2AlCl3 + 3H2O = 2Al(OH)3↓ + 3CO2↑ + 6NaCl
4) Al(OH)3 + KOH = K[Al(OH)4]
или Al(OH)3 + 3KOH = K3[Al(OH)6]
Реальный ЕГЭ 2020 (резервные дни). Задание 32. Вариант 3
- Металюминат калия растворили в серной кислоте. В полученный раствор добавили сульфит натрия. В результате реакции выделился газ, который разделили на две части. Одну часть полученного газа пропустили через бромную воду, а вторую – через подкисленный серной кислотой раствор дихромата натрия. Напишите уравнения четырёх описанных реакций.
Развернуть/свернуть решение
1) 2KAlO2 + 4H2SO4 = K2SO4 + Al2(SO4)3 + 4H2O
2) Al2(SO4)3 + 3Na2SO3 + 3H2O = 2Al(OH)3↓ + 3Na2SO4 + 3SO2↑
3) 3SO2 + Na2Cr2O7 + H2SO4 = Na2SO4 + Cr2(SO4)3 + H2O
4) SO2 + Br2 + 2H2O = 2HBr + H2SO4
Реальный ЕГЭ 2020 (резервные дни). Задание 32. Вариант 4
- Оксид меди (II) нагрели с медью. Образовавшееся вещество растворили в концентрированной азотной кислоте. Выделившийся бурый газ поглотили раствором гидроксида калия. К образовавшемуся раствору добавили подкисленный серной кислотой раствор дихромата калия. Напишите уравнения четырёх описанных реакций.
Развернуть/свернуть решение
1) CuO + Cu = Cu2O (нагревание)
2) Cu2O + HNO3 (конц.) = 2Cu(NO3)2 + 2NO2↑ + 3H2O
3) 2NO2 + 2KOH = KNO2 + KNO3 + H2O
4) 3KNO2 + K2Cr2O7 + 4H2SO4 = 3KNO3 + K2SO4 + Cr2(SO4)2 + 4H2O
Реальный ЕГЭ 2020 (резервные дни). Задание 32. Вариант 5
- Через избыток раствора силиката натрия пропустили углекислый газ. Образовавшуюся соль отделили и растворили в растворе хлорида железа (III). Образовавшийся осадок отфильтровали и прокалили до постоянной массы. Образовавшийся твёрдый остаток растворили в растворе иодоводородной кислоты. Напишите уравнения четырёх описанных реакций.
Развернуть/свернуть решение
1) Na2SiO3 + CO2 + H2O = H2SiO3↓ + Na2CO3 (допустимо образование NaHCO3)
2) 3Na2CO3 + 2FeCl3 + 3H2O = 2Fe(OH)3↓ + 6NaCl + 3CO2↑
3) 2Fe(OH)3 = Fe2O3 + 3H2O (прокаливание)
4) Fe2O3 + 6HI = I2↓ + 2FeI2 + 3H2O
Реальный ЕГЭ 2020 (резервные дни). Задание 32. Вариант 6
- Прокалили смесь карбоната калия и оксида цинка. Выделившийся газ пропустили через раствор силиката натрия. Образовавшийся осадок отделили, а оставшийся раствор смешали с раствором хлорида железа(III), при этом наблюдали образование осадка и выделение газа. Полученный осадок отделили и поместили в раствор иодоводородной кислоты.Напишите уравнения четырёх описанных реакций.
Развернуть/свернуть решение
1) Na2CO3 + ZnO = Na2ZnO2 + CO2↑ (прокаливание)
2) Na2SiO3 + CO2 + H2O = H2SiO3↓ + Na2CO3 (допустимо образование NaHCO3)
3) 2Na2CO3 + 2FeCl3 + 3H2O = 2Fe(OH)3↓ + 3CO2↑ + 6NaCl
4) 2Fe(OH)3 + 6HI = 2FeI2 + I2↓ + 6H2O
Реальный ЕГЭ 2020 (резервные дни). Задание 32. Вариант 7
- К раствору сульфата цинка добавили избыток раствора гидроксида натрия. Через полученный раствор пропустили сероводород. Образовавшийся при этом осадок при нагревании растворили в концентрированной серной кислоте, при этом образовался бесцветный газ с резким запахом. Полученный газ поглотили раствором перманганата калия, подкисленным серной кислотой.
Развернуть/свернуть решение
1) ZnSO4 + 4NaOH = Na2[Zn(OH)4] + Na2SO4
2) Na2[Zn(OH)4] + 2H2S = ZnS↓ + Na2S + 4H2O (допустимо образование NaHS)
3) ZnS + 4H2SO4 = ZnSO4 + 4SO2↑ + 4H2O
4) 5SO2 + 2KMnO4 + 2H2O = 2MnSO4 + K2SO4 + 2H2SO4
Реальный ЕГЭ 2020 (резервные дни). Задание 32. Вариант 8
- К раствору нитрата алюминия добавили раствор сульфида натрия. Полученный газ поглотили раствором перманганата калия, подкисленным серной кислотой, при этом наблюдали образование осадка. Осадок отделили и обработали горячим концентрированным раствором гидроксида калия. Полученную при этом кислородосодержащую соль добавили в раствор, содержащий дихромат калия и серную кислоту.
Развернуть/свернуть решение
1) 2Al(NO3)3 + 3Na2S + 6H2O = 2Al(OH)3↓ + 3H2S↑ + 6NaNO3
2) 5H2S + 2KMnO4 + 3H2SO4 = 5S↓ + 2MnSO4 + K2SO4 + 8H2O
3) 3S + 6KOH = 2K2S + K2SO3 + 3H2O
4) 3K2SO3 + K2Cr2O7 + 4H2SO4 = 4K2SO4 + Cr2(SO4)3 + 4H2O
Реальный ЕГЭ 2020 (резервные дни). Задание 32. Вариант 9
- Оксид хрома (VI) поместили в раствор гидроксида калия. В полученный при этом раствор добавили раствор серной кислоты. Образовавшийся раствор дополнительно подкислили серной кислотой и пропустили через этот раствор сероводород. Образовавшийся при этом осадок отделили и поместили в горячий концентрированный раствор гидроксида калия.
Развернуть/свернуть решение
1) CrO3 + 2KOH = K2CrO4 + H2O
2) 2K2CrO4 + H2SO4 = K2Cr2O7 + K2SO4 + H2O
3) 3H2S + K2Cr2O7 + 4H2SO4 = 3S↓ + Cr2(SO4)3 + K2SO4 + 7H2O
4) 3S + 6KOH = 2K2S + K2SO3 + 3H2O
Реальный ЕГЭ 2020 (резервные дни). Задание 32. Вариант 10
- Фосфид цинка растворили в соляной кислоте. Полученный газ поглотили концентрированным раствором азотной кислоты при нагревании, при этом наблюдали выделение бурого газа. Бурый газ пропустили через раствор гидроксида натрия. К полученному раствору добавили раствор, содержащий дихромат натрия и серную кислоту.
Развернуть/свернуть решение
1) Zn3P2 + 6HCl = 3ZnCl2 + 2PH3↑
2) PH3 + 8HNO3 = H3PO4 + 8NO2↑ + 4H2O
3) 2NO2 + 2NaOH = NaNO2 + NaNO3 + H2O
4) 3NaNO2 + Na2Cr2O7 + 4H2SO4 = 3NaNO3 + Cr2(SO4)3 + Na2SO4 + 4H2O
Реальный ЕГЭ 2020 (резервные дни). Задание 32. Вариант 11
- Алюминий добавили к раствору гидроксида натрия. Через образовавшийся прозрачный раствор пропустили газ, полученный при растворении серы в концентрированной серной кислоте. Образовавшийся осадок отделили, а к полученному раствору добавили раствор перманганата калия.
Развернуть/свернуть решение
1) 2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2 ↑
2) S + 2H2SO4 = 3SO2↑ + 2H2O
3) SO2 + 2Na[Al(OH)4] = 2Al(OH)3↓ + Na2SO3 + H2O (допустимо образование NaHSO3)
4) 3Na2SO3 + 2KMnO4 + H2O = 3Na2SO4 + 2MnO2↓ + 2KOH
Также предлагаем вам плейлист видео-уроков и видео-объяснений заданий на эту тему:
А также вы можете получить доступ ко всем видео-урокам, заданиям реального ЕГЭ с подробными видео-объяснениями, задачам и всем материалам сайта кликнув:
- Посмотреть видео-объяснения решений всех типов задач вы можете здесь, нажав на эту строку
- Просмотреть задания ЕГЭ всех лет вы можете здесь, нажав на эту строку
- Посмотреть все видео-уроки вы можете здесь, нажав на эту строку
- Прочитать всю теорию для подготовки к ЕГЭ и ЦТ вы можете здесь, нажав на эту строку
- Все видео-объяснения вы можете найти на YouTube канале, нажав на эту строку
Галогены.
Хлор. Соединения хлора.
- Хлор — простое вещество
Получение.
- В промышленности хлор получают электролизом расплава или раствора хлорида натрия:
2NaCl 2Na + Cl2↑
2NaCl + 2H2O H2↑ + 2NaOH + Cl2↑
- В лаборатории хлор получают взаимодействием соляной кислоты с сильными окислителями, например:
MnO2 + 4HCl = MnCl2 + Cl2↑ + 2H2O
2KMnO4 + 16HCl = 2MnCl2 + 2KCl + 5Cl2↑ + 8H2O
KClO3 + 6HCl = KCl + 3Cl2↑ + 3H2O
K2Cr2O7 + 14HCl = 2CrCl3 + 2KCl + 3Cl2↑ + 7H2O
Химические свойства. Свободный хлор реагирует со всеми простыми веществами, за исключением кислорода, азота и благородных газов. Хлор проявляет сильные окислительные свойства в реакциях как с простыми веществами – неметаллами и металлами, так и со сложными веществами:
- С неметаллами
Cl2 + H2 = 2HCl 3Cl2+ 2P = 2PCl3 5Cl2 + 2P = 2PCl5
2Cl2 + Si = SiCl4 2Cl2 + C (кокс) + 2H2O (пар)= CO2 + 4HCl
- С металлами
Cl2 + 2Na = 2NaCl Cl2 + Mg = MgCl2 3Cl2 + 2Fe = 2FeCl3
- Со сложными веществами
Cl2 + H2O↔ HCl + HClO (хлорная вода)
2Cl2 + 2H2O = 4HCl + O2 (на свету или кип.)
Сl2 + 2NaOH(хол.) = NaCl + NaClO + H2O
3Cl2 + 6NaOH(гор.) = 5NaCl + NaClO3 + 3H2O
2Сl2 + 2Са(OH)2 (хол.) = СaCl2 + Сa(ClO)2 + 2H2O хлорная известь
Cl2 + 2NaI = 2NaCl + I2 Cl2 + H2S = S + 2HCl
Cl2 + 3H2O2 = 2HCl + 2H2O + O2
Cl2 + H2O + Na2SO3 = 2HCl + Na2SO4
- Соединения хлора.
- Хлороводород. Хлороводород получают действием концентрированной соляной кислоты на твердый хлорид натрия:
H2SO4(конц.) + NaCl(тверд.) = NaHSO4 + HCl↑
Хлороводород получают также прямым взаимодействием простых веществ: Cl2 + H2 2HCl
- Кислоты.
Соляная кислота. В химических реакциях соляная кислота проявляет все свойства сильных кислот: взаимодействует с металлами, стоящими в ряду напряжений левее водорода, с оксидами (основными, амфотерными), основаниями, амфотерными гидроксидами и солями:
2HCl + Fe = FeCl2 + H2
2HCl + CaO = CaCl2 + H2O
6HCl + Al2O3 = 2AlCl3 + 3H2O
HCl + NaOH = NaCl + H2O
2HCl + Cu(OH)2 = CuCl2 + 2H2O
2HCl + Zn(OH)2 = ZnCl2 + 2H2O
HCl + NaHCO3 = NaCl + CO2↑ + H2O
HCl + AgNO3 = AgCl↓ + HNO3 (качественная реакция на галогенид-ионы)
6HCl(конц.) + 2HNO3(конц.) = 3Cl2 + 2NO + 4H2O
Кислородсодержащие кислоты:
HClO HClO2 HClO3 HClO4
Хлорноватистая хлористая хлорноватая хлорная
усиление кислотных свойств
2HClO 2HCl + O2 HClO + 2HI = HCl + I2 + H2O
HClO + H2O2 = HCl + H2O + O2
- Соли.
Соли соляной кислоты – хлориды.
AgCl + 2(NH3∙ H2O) = [Ag(NH3)2]Cl + 2H2O
2AgCl 2Ag + Cl2
Соли кислородсодержащих кислот.
|
Кислота |
название солей |
|
HClO |
гипохлориты |
|
HClO2 |
хлориты |
|
HClO3 |
Хлораты |
|
HClO4 |
перхлораты |
NaClO + 2HCl = NaCl + Cl2 + H2O
Ca(ClO)2 + H2SO4 = CaSO4 + 2HCl + O2
Ca(ClO)2 + CO2 + H2O = CaCO3 + 2HCl + 2O2
Ca(ClO)2 + Na2CO3 = CaCO3 + 2NaClO
Ca(ClO)2 CaCl2 + O2
4KClO3 3KClO4 + KCl
Бертолетова соль
2KClO3 2KCl + 3O2↑
KClO4 2O2 + KCl
III. Бром. Соединения брома. По химической активности бром занимает промежуточное положение между хлором и иодом.
Br2 + H2 = 2HBr 3Br2 + 2Fe = 2FeBr3
Br2 + H2O = НBr + НBrO – бромная вода
3Br2 + 6NaOH(конц.) = 5NaBr + NaBrO3 + 3H2O при нагревании
Br2 + 2NaOH(конц.) = NaBr + NаBrO + H2O без нагревания
3Br2 + 3Na2CO3 = 5NaBr + NaBrO3 + 3CO2
3Br2 + S + 4H2O = 6HBr + H2SO4
Br2 + SO2 + 2H2O = 2HBr + H2SO4
Br2 + 2NaI = 2NaBr + I2 Br2 + H2S = S + 2HBr
4Br2 + Na2S2O3 + 10NaOH = 2Na2SO4 + 8NaBr + 5H2O
14HBr + K2Cr2O7 = 2KBr + 2CrBr3 + 3Br2 + 7H2O
4HBr + MnO2 = MnBr2 + Br2 + 2H2O
2HBr + H2O2 = Br2 + 2H2O
2KBr + 2H2SO4 (конц.) = 4K2SO4 + 4Br2 + SO2 + 2H2O
2KBrO3 3O2 + 2KBr
2KBrO4O2 + 2KBrO3 (до 275°С)
KBrO4 2O2 + KBr (выше 390°С)
IV. Йод. Соединения йода.
Йод существенно отличается по химической активности от остальных галогенов. Он не реагирует с большинством неметаллов, а с металлами медленно реагирует только при нагревании.
3I2 + 3P = 2PI3 I2 + H2 = 2HI I2 + Fe = FeI2
Йод практически в воде не растворим и не способен ее окислять даже при нагревании; по этой причине не существует «йодной воды».
3I2 + 6NaOH(гор.) = 5NaI + NaIO3 + 3H2O
I2 + 2NaOH(хол) =NaI + NaIO + H2O
3I2 + 10HNO3(разб) = 6HIO3 + 10NO + 2H2O
I2 + 10HNO3(конц.)= 2HIO3 + 10NO2 + 4H2O
I2 + 5NaClO + 2NaOH = 5NaCl + 2NaIO3 + H2O
I2 + 5Cl2 + 6H2O = 10HCl + 2HIO3
I2 + Na2SO3 + 2NaOH = 2NaI + Na2SO4 + H2O
2HI + 2FeCl3 = I2 + 2FeCl2 + 2HCl
2HI + Fe2(SO4)3 = 2FeSO4 + I2 + H2SO4
2HI + NO2 = I2 + NO + H2O
2HI + S = I2 + H2S
8KI + 5H2SO4 (конц.) = 4K2SO4 + 4I2 + H2S + 4H2Oили
8KI + 9H2SO4(конц.) = 4I2↓ + H2S↑ + 8KHSO4 + 4H2O
KI + 3H2O + 3Cl2 = HIO3 + KCl + 5HCl
10KI + 8H2SO4 + 2KMnO4 = 5I2 + 2MnSO4 + 6K2SO4 + 8H2O
6KI + 7H2SO4 + K2Cr2O7 = Cr2(SO4)3 + 3I2 + 4K2SO4 + 7H2O
2KI + H2SO4 + H2O2 = I2 + K2SO4 + 2H2O
2KI + Fe2(SO4)3 = I2 + 2FeSO4 + K2SO4
2KI + 2CuSO4 + K2SO3 + H2O = 2CuI + 2K2SO4 + H2SO4
2HIO3 I2O5 + H2O
2HIO3 + 10HCl = I2 + 5Cl2 + 6H2O
2HIO3 + 5Na2SO3 = 5Na2SO4 + I2 + H2O
2HIO3 + 5H2SO4 + 10FeSO4 = Fe2(SO4)3 + I2 + 6H2O
I2O5 + 5CO I2 + 5CO2
2KIO3 3O2 + 2KI
2KIO3 + 12HCl(конц.) = I2 + 5Cl2 + 2KCl + 6H2O
KIO3+ 3H2SO4 + 5KI = 3I2 + 3K2SO4 + 3H2O
KIO3 + 3H2O2 = KI + 3O2 + 3H2O
2KIO4 O2 + 2KIO3
5KIO4+ 3H2O + 2MnSO4 = 2HMnO4 + 5KIO3 + 2H2SO4
Галогены.
1. Вещество, полученное на аноде при электролизе расплава иодида натрия с инертными электродами, выделили и ввели во взаимодействие с сероводородом. Газообразный продукт последней реакции растворили в воде и к полученному раствору добавили хлорное железо. Образовавшийся осадок отфильтровали и обработали горячим раствором гидроксида натрия. Напишите уравнения описанных реакций.
2. Вещество, полученное на аноде при электролизе раствора иодида натрия с инертными электродами, ввели в реакцию с калием. Продукт реакции нагрели с концентрированной серной кислотой и выделившийся газ пропустили через горячий раствор хромата калия.Напишите уравнения описанных реакций.
3. Хлорная вода имеет запах хлора. При подщелачивании запах исчезает, а при добавлении соляной кислоты – становится более сильным, чем был ранее. Напишите уравнения описанных реакций.
4. Бесцветные газы выделяются при выдерживании концентрированной кислоты, как с хлоридом натрия, так и с иодидом натрия. При пропускании этих газов через водный раствор аммиака образуются соли.Напишите уравнения описанных реакций.
5. При термическом разложении соли А в присутствии диоксида марганца образовались бинарная соль Б и газ, поддерживающий горение и входящий в состав воздуха, при нагревании этой соли без катализатора образуются соль Б и соль кислородсодержащей кислоты. При взаимодействии соли А с соляной кислотой выделяется жёлто-зелёный газ (простое вещество) и образуется соль Б. соль Б окрашивает пламя в фиолетовый цвет, при её взаимодействии с раствором нитрата серебра выпадает осадок белого цвета.Напишите уравнения описанных реакций.
6) При добавлении раствора кислоты А к диоксиду марганца происходит выделение ядовитого газа жёлто-зелёного газа. Пропустив выделившийся газ через горячий раствор едкого кали, получают вещество, которое используется при изготовлении спичек и некоторых других зажигательных составов. При термическом разложении последнего в присутствии диоксида марганца образуется соль, из которой при взаимодействии с концентрированной серной кислотой можно получить исходную кислоту А, и бесцветный газ , входящий в состав атмосферного воздуха. Напишите уравнения описанных реакций.
7) Йод нагрели с избытком фосфора, и продукт реакции обработали небольшим количеством воды. Газообразный продукт реакции полностью нейтрализовали раствором едкого натра и добавили в полученный раствор нитрат серебра. Напишите уравнения описанных реакций.

9) Через раствор бромида натрия пропустили газ, выделяющийся при взаимодействии соляной кислоты с перманганатом калия. После окончания реакции раствор выпарили, остаток растворили в воде и подвергли электролизу с графитовыми электродами. Газообразные продукты реакции смешали друг с другом и осветили. В результате произошел взрыв.Напишите уравнения описанных реакций.
10) К пиролюзиту осторожно прибавили раствор соляной кислоты, и выделившийся газ пропустили в химический стакан, наполненный холодным раствором едкого кали. После окончания реакции стакан накрыли картонкой и оставили, при этом стакан освещали солнечные лучи; через некоторое время в стакан внесли тлеющую лучинку, которая ярко вспыхнула. Напишите уравнения описанных реакций.
11) Вещество, выделяющееся на катоде и аноде при электролизе раствора йодида натрия с графитовыми электродами, реагируют друг с другом. Продукт реакции взаимодействуют с концентрированной серной кислотой с выделением газа, который пропустили через раствор гидроксида калия.Напишите уравнения описанных реакций.
12) К оксиду свинца (IV) при нагревании добавили концентрированную соляную кислоту. Выделяющийся газ пропустили через нагретый раствор едкого кали. Раствор охладили, соль кислородсодержащей кислоты отфильтровали и высушили. При нагревании полученной соли с соляной кислотой выделяется ядовитый газ, а при нагревании её в присутствии диоксида марганца – газ, входящий в состав атмосферы. Напишите уравнения описанных реакций.
13)Йод обработали концентрированной азотной кислотой при нагревании. Продукт реакции осторожно нагрели. Образовавшийся при оксид вступил в реакцию с угарным газом. Выделившееся простое вещество растворили в теплом растворе гидроксида калия. Напишите уравнения описанных реакций.
14) Раствор иодида калия обработали избытком хлорной воды, при этом сначала наблюдали образование осадка, а затем – его полное растворение. Образовавшуюся при этом йодсодержащую кислоту выделили из раствора, высушили и осторожно нагрели. полученный оксид прореагировал с угарным газом. Напишите уравнения описанных реакций.
15) Йод обработали хлорноватой кислотой. Продукт реакции осторожно нагрели. продукт реакции осторожно нагрели. Образующийся оксид реагирует с угарным газом с образованием двух веществ – простого и сложного. Простое вещество растворяется в теплом щелочном растворе сульфита натрия. Напишите уравнения описанных реакций.
16) Перманганат калия обработали избытком раствора соляной кислоты, образовался раствор и выделился газ. Раствор разделили на две части: к первой добавили гидроксид калия, а ко второй – нитрат серебра. Выделившийся газ прореагировал газ прореагировал с гидроксидом калия при охлаждении. Напишите уравнения описанных реакций.
17) Расплав хлорида натрия подвергли электролизу. Газ, выделившийся на аноде, прореагировал с водородом с образованием нового газообразного вещества с характерным запахом. Его растворили в воде и обработали расчетным количеством перманганата калия, при этом образовался газ желто-зеленого цвета. Это вещество вступает при охлаждении с гидроксидом натрия.Напишите уравнения описанных реакций.
18) Перманганат калия обработали концентрированной соляной кислотой. Выделившийся при этом газ собрали, а к реакционной массе по каплям прибавили раствор гидроксида калия до прекращения выделения осадка. Собранный газ пропустили через горячий раствор гидроксида калия, при этом образовалась смесь двух солей. Раствор выпарили, твердый остаток прокалили в присутствии катализатора, после чего в твердом остатке осталась одна соль.Напишите уравнения описанных реакций.
17) Расплав хлорида натрия подвергли электролизу. Газ, выделившийся на аноде, прореагировал с водородом с образованием нового газообразного вещества с характерным запахом. Его растворили в воде и обработали расчетным количеством перманганата калия, при этом образовался газ желто-зеленого цвета. Это вещество вступает при охлаждении с гидроксидом натрия.Напишите уравнения описанных реакций.
18) Перманганат калия обработали концентрированной соляной кислотой. Выделившийся при этом газ собрали, а к реакционной массе по каплям прибавили раствор гидроксида калия до прекращения выделения осадка. Собранный газ пропустили через горячий раствор гидроксида калия, при этом образовалась смесь двух солей. Раствор выпарили, твердый остаток прокалили в присутствии катализатора, после чего в твердом остатке осталась одна соль.Напишите уравнения описанных реакций.
Галогены.
1) 2NaI 2Na + I2
на катоде на аноде
I2 + H2S = 2HI↑ + S↓
2HI + 2FeCl3 = I2 + 2FeCl2+ 2HCl
I2 + 6NaOH (гор.) = NaIO3 + 5NaI + 3H2O
2) 2NaI + 2H2O 2H2 + 2NaOH + I2
на катоде на аноде
I2 + 2K = 2KI
8KI + 8H2SO4(конц.) = 4I2↓ + H2S↑ + 4K2SO4 + 4H2Oили
8KI + 9H2SO4(конц.) = 4I2↓ + H2S↑ + 8KHSO4 + 4H2O
3H2S + 2K2CrO4 + 2H2O = 2Cr(OH)3 + 3S + 4KOH
3) Cl2 + H2O ↔HCl + HClO
HCl + NaOH = NaCl+ H2O
HClO + NaOH = NaClO+ H2O
NaClO + 2HCl = NaCl + Cl2 + H2O
4) H2SO4(конц.) + NaCl(тверд.) = NaHSO4 + HCl↑
9H2SO4(конц.) + 8NaI(тверд.) = 8NaHSO4 + 4I2↓ + H2S + 4H2O
NH4OH + HCl = NH4Cl + H2O
NH4OH + H2S = NH4HS + H2O
5) 2KClO3 2KCl + 3O2↑
4KClO3KCl + 3KClO4
KClO3 + 6HCl = KCl + 3Cl2↑+ 3H2O
KCl + AgNO3 = AgCl↓ + KNO3
6) 4HCl + MnO2 = MnCl2 + Cl2↑ + 2H2O
3Cl2 + 6KOH(гор.) = 5KCl + KClO3 + 3H2O
2KClO3 2KCl + 3O2↑
H2SO4(конц.) + NaCl(тверд.) = NaHSO4 + HCl↑
7) 3I2 + 2P = 2PI3
PI3 + 3H2O = H3PO3 + 3HI
HI + NaOH = NaI + H2O
NaI + AgNO3 = AgI↓ + NaNO3

16HCl + 2KMnO4 = 5Cl2 + 2KCl + 2MnCl2 + 8H2O
Cl2 + 2NaOH(хол.) = NaCl + NaClO + H2O
NaClO + 2HI = NaCl + I2 + H2O
9) 16HCl + 2KMnO4 = 5Cl2 + 2KCl + 2MnCl2 + 8H2O
2NaBr + Cl2 = 2NaCl + Br2
2NaCl + 2H2O 2H2 + 2NaOH + Cl2
на катоде на аноде
H2 + Cl2 = 2HCl
10) 4HCl+ MnO2 = MnCl2 + Cl2↑ + 2H2O
Cl2 + 2KOH(хол.) = KCl + KClO + H2O
2KClO3 2KCl + 3O2↑
C + O2 = CO2
11) 2NaI + 2H2O 2H2 + 2NaOH + I2
на катоде на аноде
I2 + H2 = 2HI
8HI + H2SO4(конц.) = 4I2↓ + H2S↑ + 4H2Oили
2HI + H2SO4(конц.) = I2↓ + SO2↑ + 2H2O
а) H2S + 2KOH = K2S + 2H2O
H2S + K2S = 2KHSили
б) SO2 + 2KOH = K2SO3 + 2H2O
K2SO3 + SO2 + H2O = 2KHSO3
12) 4HCl+ PbO2 = PbCl2 + Cl2↑ + 2H2O
3Cl2 + 6KOH(гор.) = 5KCl + KClO3 + 3H2O
KClO3 + 6HCl = KCl + 3Cl2 + 3H2O
2KClO3 2KCl + 3O2↑
13) I2 + 10HNO32HIO3 + 10NO2 + 4H2O
2HIO3 I2O5 + H2O
I2O5 + 5CO I2 + 5CO2
3I2 + 6KOH(гор.) = 5KI + KIO3 + 3H2O
14) 2KI + Cl2 = 2KCl + I2
I2 + 5Cl2 + 6H2O = 10HCl + 2HIO3
2HIO3 I2O5 + H2O
I2O5 + 5CO = I2 + 5CO2
15) I2+ 2HClO3 = 2HIO3 + Cl2
2HIO3 I2O5 + H2O
I2O5 + 5CO I2 + 5CO2
I2 + Na2SO3 + 2NaOH = 2NaI + Na2SO4 + H2O
16) 16HCl + 2KMnO4 = 5Cl2 + 2KCl + 2MnCl2 + 8H2O
MnCl2 + 2KOH = Mn(OH)2↓ + 2KCl
KCl + AgNO3 = AgCl↓ + KNO3
Cl2 + 2KOH(хол.) = KCl + KClO + H2O
17) 2NaCl 2Na + CL2
на катоде на аноде
Cl2 + H2 = 2HCl
16HCl + 2KMnO4 = 5Cl2 + 2KCl + 2MnCl2 + 8H2O
Cl2 + 2NaOH(хол.) = NaCl + NaClO + H2O
18) 16HCl + 2KMnO4 = 5Cl2 + 2KCl + 2MnCl2 + 8H2O
MnCl2 + 2KOH = Mn(OH)2↓ + 2KCl
3Cl2 + 6KOH(гор.) = 5KCl + KClO3 + 3H2O
2KClO3 2KCl + 3O2↑
20920. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 20920.
7934. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.

1) C2H5OH = (400 °C, Al2O3) CH2=CH2 + H2O
2) 3CH2=CH2 + 2KMnO4 + 4H2O = 3CH2(OH)-CH2(OH) + 2MnO2 + 2KOH
3) CH2(OH)-CH2(OH) + 2HBr = C2H4Br2 + 2H2O
4) C2H4Br2 + 2KOH(спирт.) = CH≡CH + 2H2O + 2KBr
5) CH≡CH + H2O = (Hg2+) CH3-CHO
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7934.
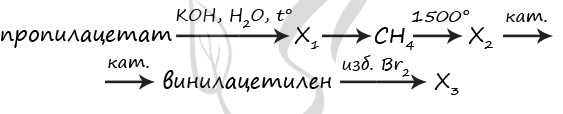
7899. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.

1) H3C-C(O)O-CH2-CH2-CH3 + KOH = (t°) CH3COOK + CH3-CH2-CH2-OH
2) CH3COOK + KOH = (t°) CH4↑ + K2CO3
3) 2CH4 = (1500 °C) CH≡CH + 3H2
4) CH≡CH + CH≡CH = (кат.) CH2=CH-C≡CH
5) CH2=CH-C≡CH + 3Br2 = CH2(Br)-CH(Br)-C(Br2)-CH(Br2)
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7899.
7864. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7864.
7829. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.

1) C2H5Cl + CH3Cl + Mg = MgCl2 + CH3-CH2-CH3 (допустимо использовать Na)
2) CH3-CH2-CH3 = (t°, Pt) H3C-CH=CH2 + H2
3) 3H3C-CH=CH2 + 2KMnO4 + 4H2O = 3H3C-CH(OH)-CH2(OH) + 2MnO2 + 2KOH
4) H3C-CH(OH)-CH2(OH) + 2HBr = H3C-CH(Br)-CH2(Br) + 2H2O
5) H3C-CH(Br)-CH2(Br) + 2KOH(спирт.) = (t°) H3C-C≡CH + 2KBr + 2H2O
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7829.
7794. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.

1) CaC2 + 2H2O = Ca(OH)2 + CH≡CH↑
2) CH≡CH + H2O = (Hg2+, H2SO4, t°) CH3CHO
3) 5CH3CHO + 2KMnO4 + 3H2SO4 = 5CH3COOH + K2SO4 + 2MnSO4 + 3H2O
4) CH3COOH + Cl2 = (P) Cl-CH2-COOH + HCl
5) Cl-CH2-COOH + 2NH3 = NH2-CH2-COOH + NH4Cl
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7794.
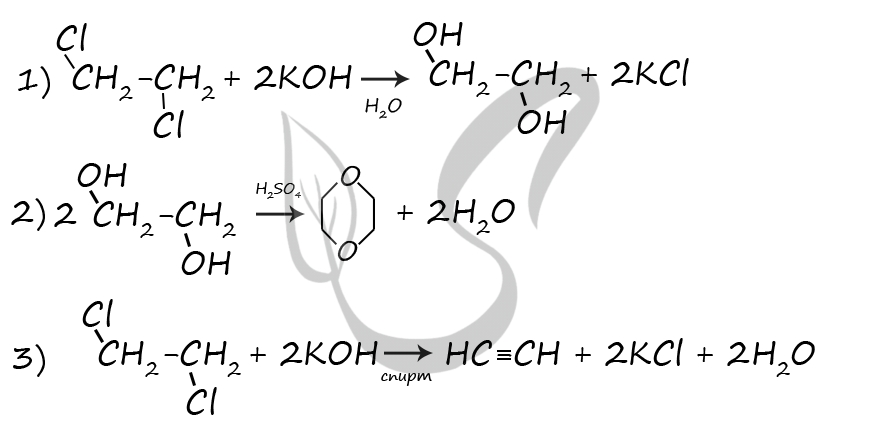
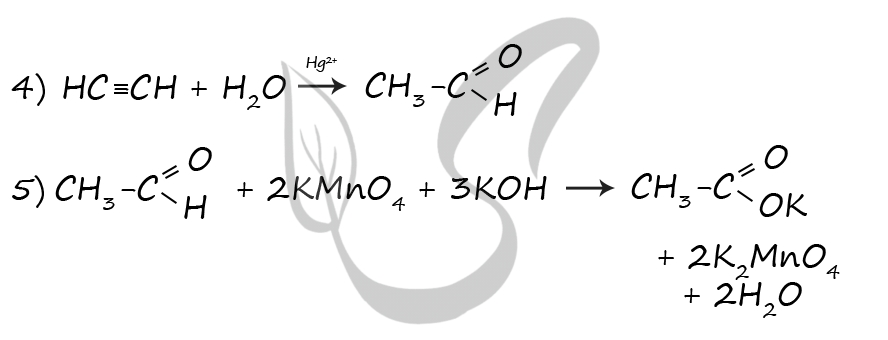
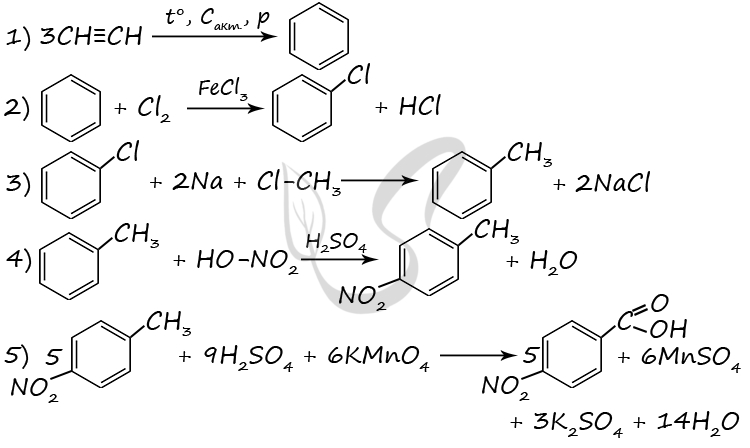
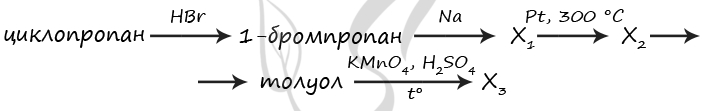
7759. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.

1) C3H6 + HBr = (t°) CH3CH2CH2Br
2) 2CH3CH2CH2Br + 2Na = C6H14 + 2NaBr
3) C6H14 = (Pt, 300 °C) C6H6 + 4H2
4) C6H6 + CH3Cl = (AlCl3) C6H5CH3 + HCl
5) 5C6H5CH3 + 6KMnO4 + 9H2SO4 = (t°) 5C6H5COOH + 6MnSO4 + 3K2SO4 + 14H2O
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7759.
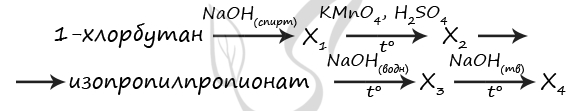
7724. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.

1) C4H9Cl + NaOH(спирт.) = (t°) C2H5-CH=CH2 + NaCl + H2O
2) C2H5-CH=CH2 + 2KMnO4 + 3H2SO4 = (t°) C2H5COOH + CO2↑ + 4H2O + 2MnSO4 + K2SO4
3) C2H5COOH + CH3-CH(OH)-CH3 = CH3-CH2-C(O)O-CH(CH3)2 + H2O
4) CH3-CH2-C(O)O-CH(CH3)2 + NaOH(водн.) = CH3-CH(OH)-CH3 + C2H5COONa
5) C2H5COONa(тв.) + NaOH(тв.) = (t°) C2H6↑ + Na2CO3
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7724.
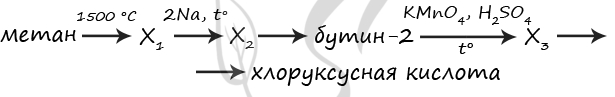
7689. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.

1) 2CH4 = (1500 °C) CH≡CH + 3H2
2) CH≡CH + 2Na = (t°) Na-C≡C-Na + H2
3) Na-C≡C-Na + 2CH3I = CH3-C≡C-CH3 + 2NaI
4) 5CH3-C≡C-CH3 + 6KMnO4 + 9H2SO4 = (t°) 10CH3COOH + 6MnSO4 + 3K2SO4 + 4H2O
5) CH3COOH + Cl2 = (P) Cl-CH2-COOH + HCl
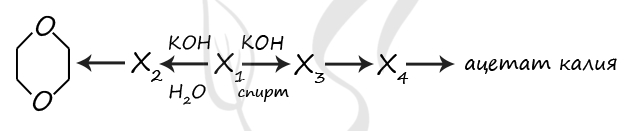
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7689.
7654. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.

1) CaC2 + 2H2O = Ca(OH)2 + CH≡CH↑
2) 3CH≡CH + 8KMnO4 = 3KOOC-COOK + 2H2O + 8MnO2 + 2KOH
3) 3KOOC-COOK + 2H2SO4 = CO↑ + CO2↑ + H2O + 2KHSO4
4) CO + KOH = (t°, p) HCOOK
5) HCOOK + H3PO4 = HCOOH + KH2PO4 (образование K3PO4 следует считать ошибочным)
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7654.
Для вас приятно генерировать тесты, создавайте их почаще
Задание 1:
Газ, выделившийся при взаимодействии хлороводородной кислоты с перманганатом калия, реагирует с железом. Продукт реакции растворили в воде и добавили к нему сульфид натрия. Более легкое из образовавшихся нерастворимых веществ отделили и ввели в реакцию с горячей концентрированной азотной кислотой. Составьте уравнения четырех описанных реакций.
Решение:
Первая реакция — хлороводородная (соляная) кислота реагирует с перманганатом калия:
16HCl + 2KMnO4 = 2KCl + 2MnCl2 + 5Cl2 + 8H2O — в результате выделяется тот газ (хлор), который нужен для следующей реакции.
Вторая реакция — идет между хлором и железом (хлор окисляет железо до степени окисления +3):
2Fe + 3Cl2 = 2FeCl3.
Следующий этап — хлорид железа растворили (FeCl3 хорошо растворяется в воде (92 г/ 100 мл), и добавили к нему сульфид натрия
Это не ионно-обменная реакция, а ОВР, так как хлорид Fe (III) является сильным окислителем:
2FeCl3 + 3Na2S = S↓ + 2FeS + 6NaCl — эффектом реакции является выделение желтого осадка в виде чистой серы, которую возьмут для взаимодействия с горячей азотной кислотой.
Последняя реакция в этом блоке — сера плюс концентрированная HNO3:
S + HNO3 (конц.,гор.) = H2SO4 + 6NO2↑ + 2H2O
Задание 2:
Раствор хлорида железа (III) подвергли электролизу с графитовыми электродами. Осадок бурого цвета, образовавшийся в качестве побочного продукта электролиза, отфильтровали и прокалили. Вещество, образовавшееся на катоде, растворили в концентрированной азотной кислоте при нагревании. Продукт, выделившийся на аноде, пропустили через холодный раствор гидроксида калия. Составьте уравнения четырех описанных реакций.
Решение:
Первая реакция в списке — это электролиз водного раствора хлорида железа; на катоде выделяется Fe и H2; на аноде — Cl2.
4FeCl3 +6H2O = 2Fe + 3H2 + 6Cl2 + 2Fe(OH)3 ↓
Вторая реакция — взяли бурый осадок из предыдущей реакции электролиза и прокалили; это процесс разложения нерастворимого основания гидроксида железа (III):
2Fe(OH)3 = Fe2O3 + 3H2O
Следующая реакция проходит между веществом, которое образовалось на катоде и растворили его в концентрированной азотной кислоте; естественно, речь идет о железе:
Fe + 6HNO3 (конц.) = Fe(NO3)3 + 3NO2↑ + 3H2O
Последняя реакция — продукт, который выделился на аноде пропустили через холодную щелочь (это важное дополнение, так как с горячей образуются другие продукты реакции); это взаимодействие хлора с KOH:
Cl2 + 2KOH = KClO + KCl + H2O — данный тип ОВР называется диспропорционированием (один и тот же элемент и окисляется, и восстанавливается).
Задание 3:
Йод обработали концентрированной азотной кислотой при нагревании. Раствор осторожно выпарили и остаток нагрели, получив оксид, который взаимодействует с угарным газом с образованием двух веществ — простого и сложного. Образовавшееся при этом простое вещество растворили в теплом растворе гидроксида калия. Составьте уравнения четырех описанных реакций.
Решение:
Первая реакция — йод и азотная кислота, достаточно простая реакция с образованием йодноватой кислоты, газа с оттенком «лисьего хвоста» и воды:
I2 + 10HNO3 = 2HIO3 + 10NO2↑ + 4H2O (t)
Следующий этап — выпарили раствор, и остаток нагрели; это касается разложения йодноватой кислоты:
2HIO3 = I2O5 + H2O (t)
Третья реакция — полученный в предыдущей реакции оксид пропустили через угарный газ:
I2O5 + 5CO = I2 + 5CO2 — как и сказано в условии, получаем одно простое и одно сложное вещества.
Последняя реакция из списка — простое вещество (I2) растворили в теплом растворе щелочи (KOH):
I2 + 6KOH = 5KI + KIO3 +3H2O.
Задание 4:
Оксид железа (III) сплавили с поташом. Полученный продукт добавили в воду. Образовавшийся осадок отделили и растворили в йодоводородной кислоте. Выделившееся простое вещество реагирует с тиосульфатом натрия. Напишите уравнения четырех описанных реакций.
Решение:
Первая реакция может вызвать сложности из — за незнания тривиального названия «поташ«, который представляет собой карбонат калия:
Fe2O3 + K2CO3 = 2KFeO2 + CO2↑ — это непростая реакция сплавления, которую надо запомнить.
Следующая реакция — добавление к полученному продукту воды:
KFeO2 + 2H2O = KOH + Fe(OH)3↓
Третья реакция — осадок в виде гидроксида железа (III) растворили в йодоводородной кислоте, в результате выделяется чистый йод:
2Fe(OH)3 + 6HI = 2FeI2 + I2 + 6H2O
Последний этап — взаимодействие йода с тиосульфатом натрия с образованием йодида натрия и тетратионата натрия:
I2 + 2Na2S2O3 = 2NaI + Na2S4O6.
Задание 5:
Кремний сожгли в атмосфере хлора. Продукт реакции обработали водой. Выделившийся осадок отделили, прокалили и обработали плавиковой кислотой. Напишите уравнения четырех описанных реакций.
Решение:
Первый этап — сожгли кремний в атмосфере хлора, эта реакция представляет взаимодействие двух простых веществ:
Si + 2Cl2 = SiCl4
Следующая реакция — тетрахлорсилан (SiCl4) обработали водой:
SiCl4 + 3H2O = H2SiO3 + 4HCl — эффектом этой реакции является выпадение бесцветного студенистого осадка кремниевой кислоты.
Третья реакция — разложение кремниевой кислоты:
H2SiO3 = SiO2 + H2O
Четвертая реакция — взаимодействие кремнезема с плавиковой кислотой:
SiO2 + 4HF = SiF4 + 2H2O — эта реакция объясняет, почему плавиковую кислоту не хранят в стеклянной посуде (HF реагирует с диоксидом кремния, соответственно, разъедает стекло).
Задание 6:
В раствор гидроксида натрия внесли оксид хрома (VI). Раствор выпарили, твердый остаток обработали серной кислотой и из полученного раствора при охлаждении выделили соль оранжевого цвета. При растворении соли в бромоводородной кислоте образуется простое вещество, которое может взаимодействовать с сероводородом. Напишите уравнения четырех описанных реакций.
Решение:
Первая реакция — оксид хрома (VI), который является кислотным оксидом, прореагирует с щелочью:
CrO3 + 2NaOH = Na2CrO4 + H2O — эффектом этой реакции является образование вещества желтого цвета — хромата натрия.
Далее нужно написать взаимодействие хромата натрия с серной кислотой — это необычная ионно-обменная реакция, которую нужно запомнить:
2Na2CrO4 + H2SO4 = Na2Cr2O7 + Na2SO4 + H2O — цвет раствора изменился с желтого на оранжевый (это цвет дихромата натрия).
Третья реакция — взаимодействие Na2Cr2O7 с бромоводородной кислотой:
Na2Cr2O7 + 14HBr = 2NaBr + 2CrBr3 + 3Br2 + 7H2O
Четвертая реакция — выделили простое вещество, который прореагировал с сероводородом (бром замещает серу):
Br2 + H2S = 2HBr + S.
Задание 7:
Раствор, полученный при пропускании сернистого газа через бромную воду, нейтрализовали гидроксидом бария. Выпавший осадок отделили, смешали с коксом и прокалили. При обработке продукта прокаливания хлороводородной кислотой выделяется газ с запахом тухлых яиц. Составьте уравнения четырех описанных реакций.
Решение:
Первая реакция — сернистый газ реагирует с бромной водой, поэтому надо добавить воду:
SO2 + Br2 + 2H2O = H2SO4 + 2HBr
Вторая и третья реакции представляют собой нейтрализацию полученного раствора (серная кислота и бромоводородная кислота):
H2SO4 + Ba(OH)2 = BaSO4↓ + 2H2O
2HBr + Ba(OH)2 = BaBr2 + 2H2O
Четвертая реакция — осадок реагирует с коксом при прокаливании; это взаимодействие с углеродом:
BaSO4 + 4C = BaS + 4CO↑
Последняя реакция — продукт прокаливания обработали HCl и выделился газ с запахом тухлых яиц (это сероводород):
BaS + 2HCl = BaCl2 + H2S↑.
На сегодня все!