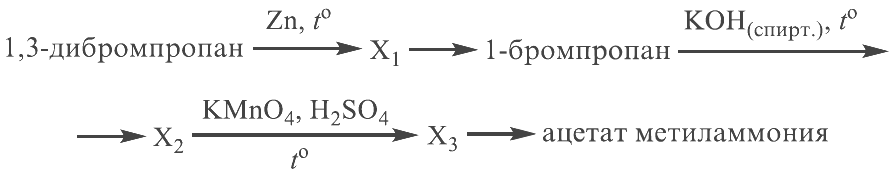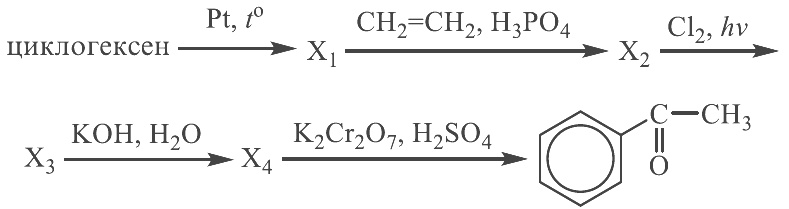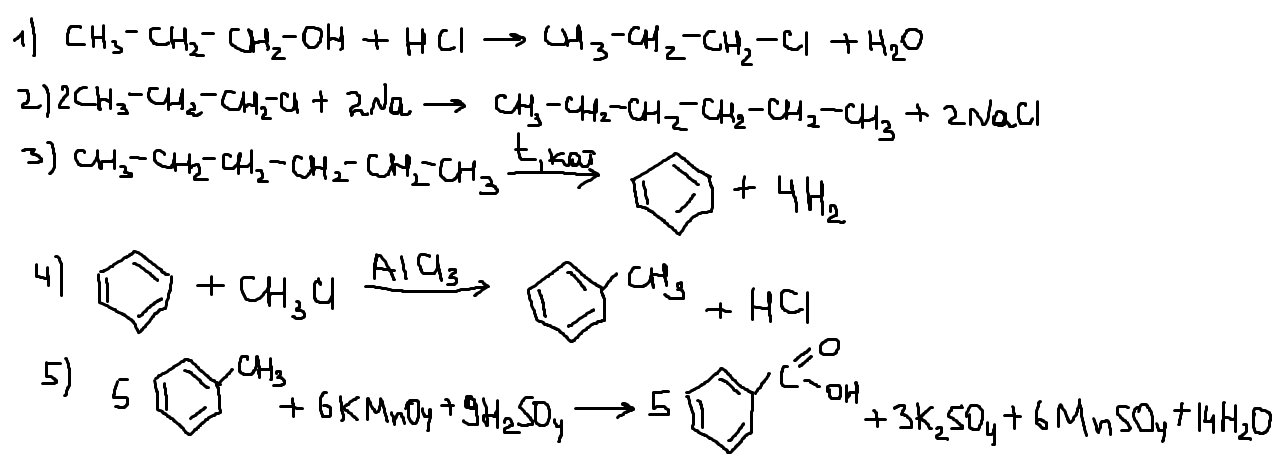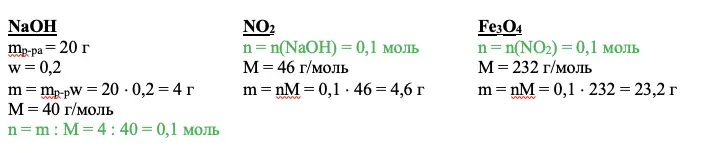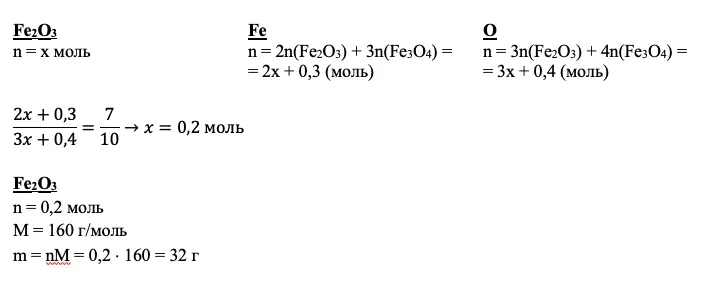Чтобы поделиться, нажимайте
Реальный ЕГЭ по химии 2019. Задание 33
Представляем вашему вниманию задание 33 из реального ЕГЭ 2019 и резервных дней основного периода (31 мая 2019 года, 20 июня 2019 года и 1 июля 2019 года) с подробными текстовыми решениями и ответами.
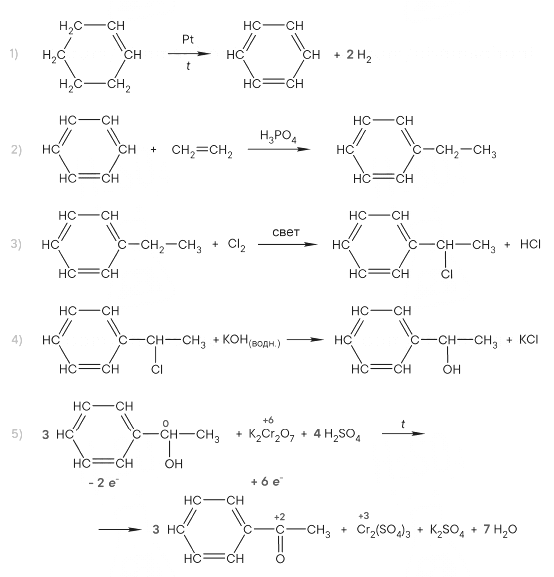
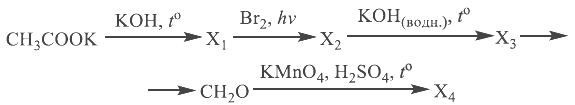
Реальный ЕГЭ 2019. Задание 33. Вариант 1.
Развернуть/свернуть решение
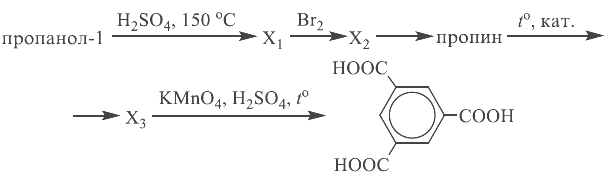
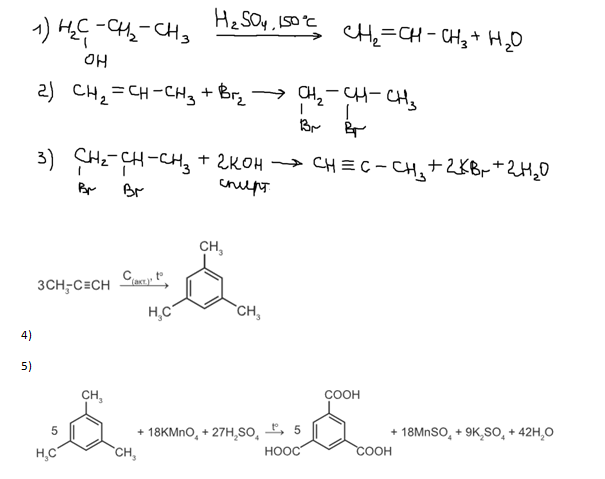
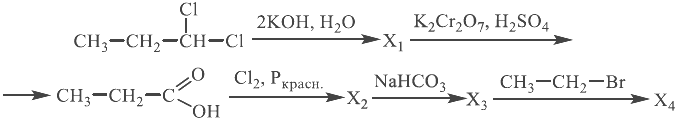
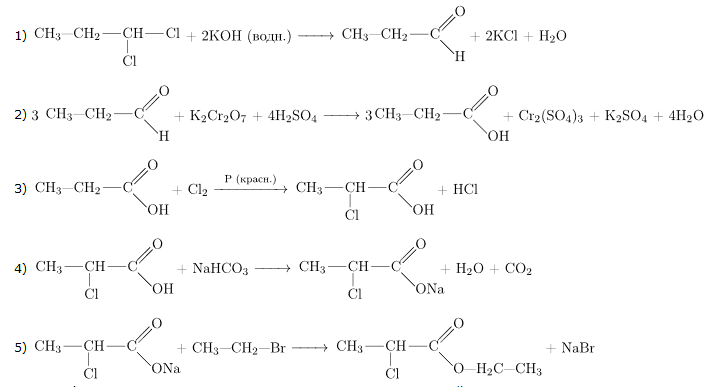
Реальный ЕГЭ 2019. Задание 33. Вариант 2.
Развернуть/свернуть решение
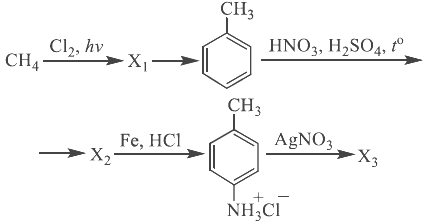
Реальный ЕГЭ 2019. Задание 33. Вариант 3.
Развернуть/свернуть решение
Реальный ЕГЭ 2019. Задание 33. Вариант 4.
Развернуть/свернуть решение
Реальный ЕГЭ 2019. Задание 33. Вариант 5.
Развернуть/свернуть решение
Реальный ЕГЭ 2019. Задание 33. Вариант 6.
Развернуть/свернуть решение
Реальный ЕГЭ 2019. Задание 33. Вариант 7.
Развернуть/свернуть решение
Реальный ЕГЭ 2019. Задание 33. Вариант 8.
Развернуть/свернуть решение
Реальный ЕГЭ 2019. Задание 33. Вариант 9.
Развернуть/свернуть решение
Реальный ЕГЭ 2019. Задание 33. Вариант 10.
Развернуть/свернуть решение
Реальный ЕГЭ 2019. Задание 33. Вариант 11.
Развернуть/свернуть решение
Реальный ЕГЭ 2019. Задание 33. Вариант 12.
Развернуть/свернуть решение
Реальный ЕГЭ 2019. Задание 33. Вариант 13.
Развернуть/свернуть решение
Реальный ЕГЭ 2019. Задание 33. Вариант 14.
Развернуть/свернуть решение
Реальный ЕГЭ 2019. Задание 33. Вариант 15.
Развернуть/свернуть решение
Реальный ЕГЭ 2019 (резервные дни). Задание 33. Вариант 1.
Развернуть/свернуть решение
Реальный ЕГЭ 2019 (резервные дни). Задание 33. Вариант 2.
Развернуть/свернуть решение
Реальный ЕГЭ 2019 (резервные дни). Задание 33. Вариант 3.
Развернуть/свернуть решение
Реальный ЕГЭ 2019 (резервные дни). Задание 33. Вариант 4.
Развернуть/свернуть решение
Реальный ЕГЭ 2019 (резервные дни). Задание 33. Вариант 5.
Развернуть/свернуть решение
Реальный ЕГЭ 2019 (резервные дни). Задание 33. Вариант 6.
Развернуть/свернуть решение
Реальный ЕГЭ 2019 (резервные дни). Задание 33. Вариант 7.
Развернуть/свернуть решение
Реальный ЕГЭ 2019 (резервные дни). Задание 33. Вариант 8.
Развернуть/свернуть решение
Ещё вы можете скачать Подборку всех цепочек превращений, которые встречались в задании 32 на реальном ЕГЭ по химии за все годы.
А также вы можете получить доступ ко всем видео-урокам, заданиям реального ЕГЭ с подробными видео-объяснениями, задачам и всем материалам сайта кликнув:
- Посмотреть видео-объяснения решений всех типов задач вы можете здесь, нажав на эту строку
- Просмотреть задания ЕГЭ всех лет вы можете здесь, нажав на эту строку
- Посмотреть все видео-уроки вы можете здесь, нажав на эту строку
- Прочитать всю теорию для подготовки к ЕГЭ и ЦТ вы можете здесь, нажав на эту строку
- Все видео-объяснения вы можете найти на YouTube канале, нажав на эту строку
22 июня 2022
В закладки
Обсудить
Жалоба
Подборка задач 33 и 34 с прошедшего ЕГЭ 2022 по химии.
→ 33 с ответами и уравнениями описанных реакций: 33.pdf
→ 34 c ответами: 34.pdf
Источник: vk.com/examtop
Задания 33 из реального ЕГЭ по химии-2020, все органические цепочки из реального экзамена ЕГЭ по химии, задания 33 из реального ЕГЭ 2020 (основная волна и резервные дни — 16 июля 2020 года, 24 июля 2020) с текстовыми решениями и ответами.
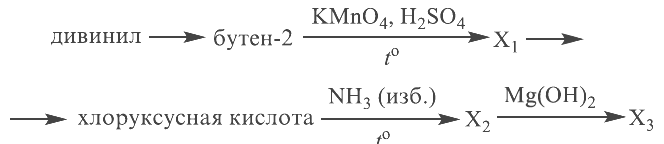
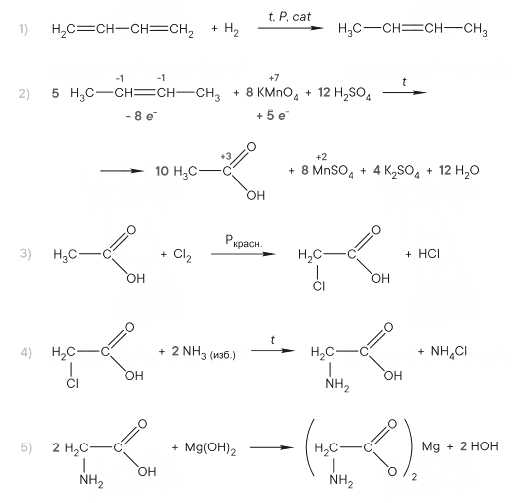
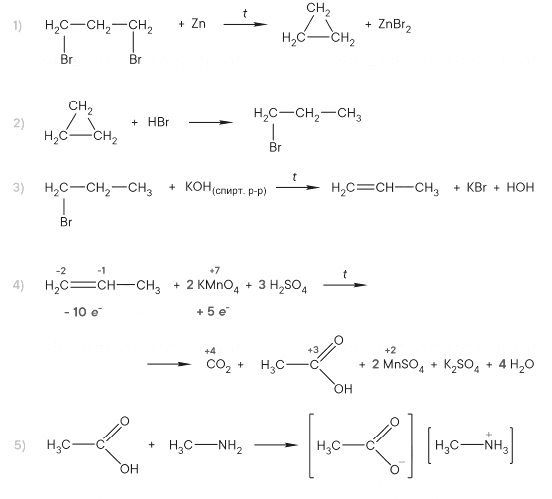
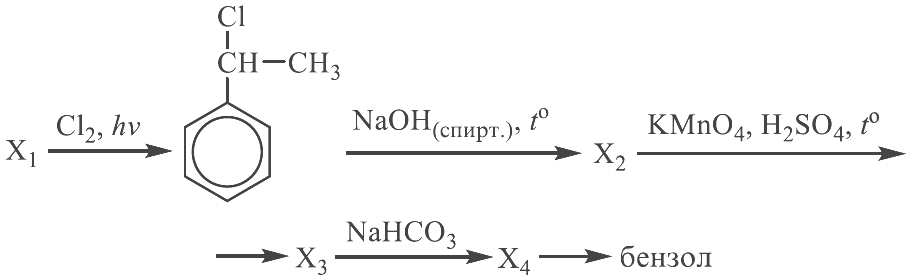
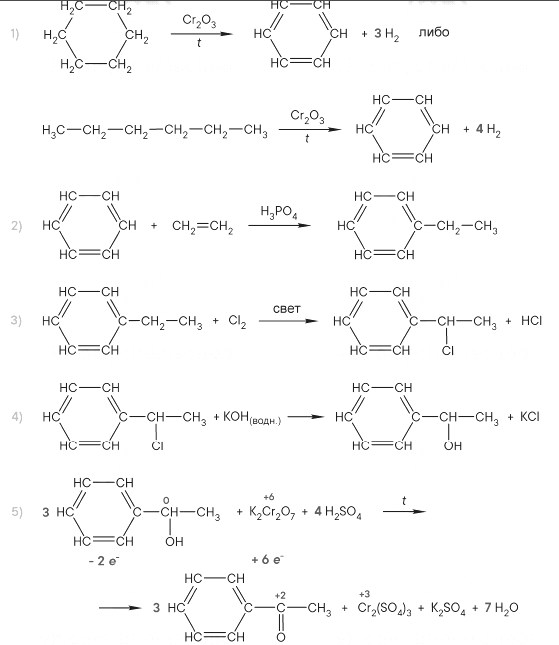
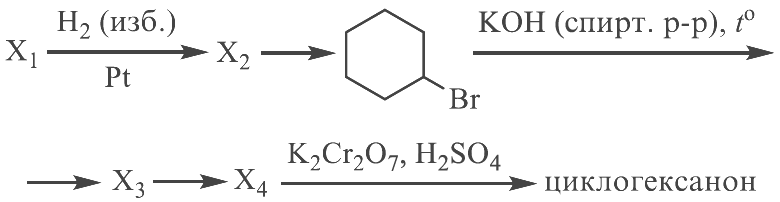
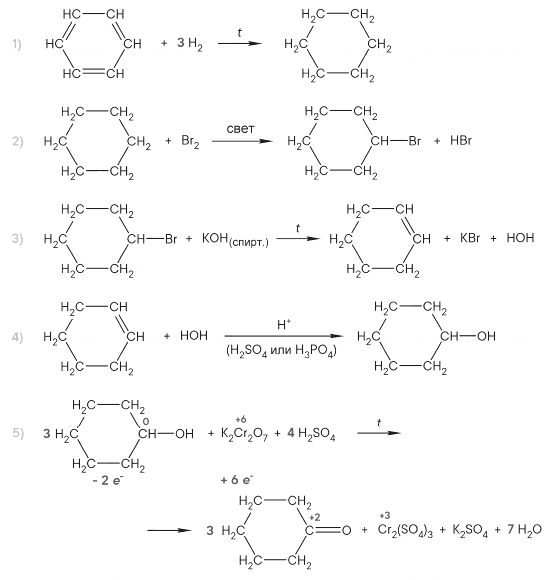
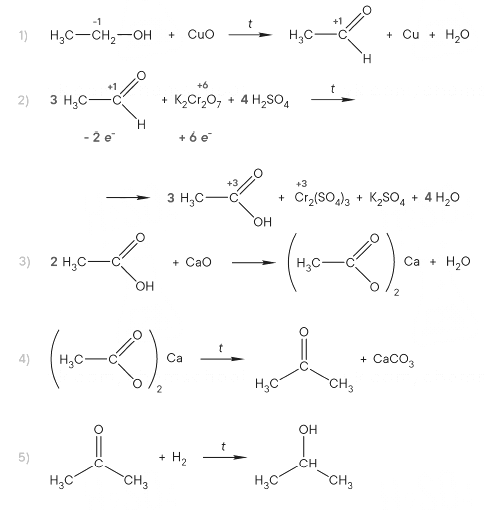
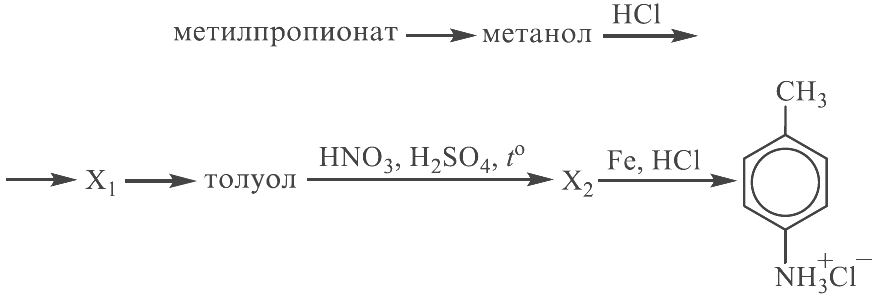
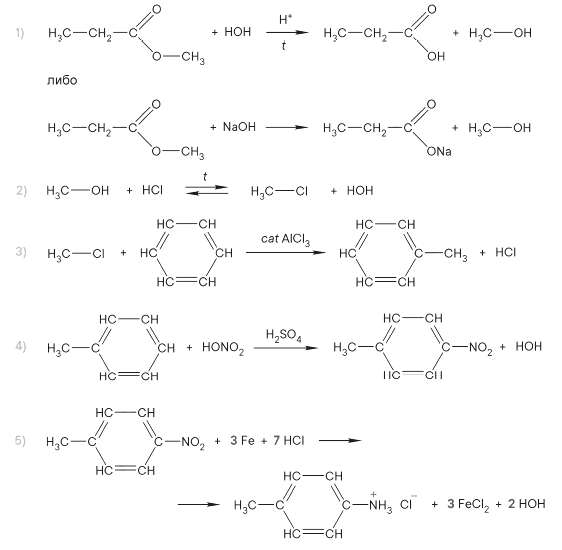
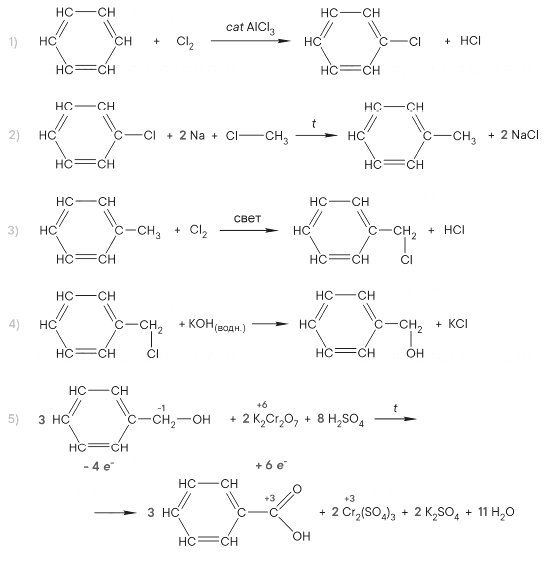
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Admin
Этот сайт использует Akismet для борьбы со спамом. Узнайте, как обрабатываются ваши данные комментариев.
Подготовка к ЕГЭ, ОГЭ, ВПР и КДР
Подготовка к ЕГЭ, ОГЭ, ВПР и КДР по всем предметам с возможностью прохождения онлайн.
Более 100 вариантов и тысячи заданий с решениями.
Видео уроки.
ВАЖНО! Никаких реальных вариантов ЕГЭ ни до экзамена, ни во время его проведения на сайте нет, не было и не будет.
КОНТАКЫ
В случае нарушения авторских прав, правообладателям обращаться по адресу: tolkoege@gmail.com
ЗАПРЕЩЕНО копирование материалов без указания активные ссылки на источник, все демо-версии с сайта ФИПИ http://fipi.ru/
Решение 31 задания ЕГЭ 2020 по химии из демонстрационного варианта.
Из предложенного перечня веществ выберите кислую соль и вещество, которое вступает с этой кислой солью в реакцию ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
Решение
2NaHCO3 + 2KOH = Na2CO3 + K2CO3 + 2H2O
2Na+ + 2HCO3– + 2K+ + 2OH– = 2Na+ + 2K+ + 2CO32– + 2H2O
HCO3– + OH– = CO32– + H2O
Опубликовано: 23.03.2020
Обновлено: 23.03.2020
За это задание ты можешь получить 2 балла. На решение дается около 15 минут. Уровень сложности: высокий.
Средний процент выполнения: 54.9%
Ответом к заданию 30 по химии может быть развернутый ответ (полная запись решения с обоснованием выполненных действий).
Задачи для практики
Задача 1
Для выполнения задания используйте следующий перечень веществ: цинк, пиросерная кислота, сульфат бария, сульфид калия, нитрат цинка. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите среднюю соль и вещество, которое вступает с ней в реакцию ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
Решение
$K_2S + Zn(NO_3)_2 = 2KNO_3 + ZnS$
$2K^{+} + S^{2–} + Zn^{2+} + 2NO_3^{–} = 2K^{+} + 2NO_3^{–} + ZnS$
$Zn^{2+} + S^{2–} = ZnS$
Ответ:
Показать решение
Полный курс
Задача 2
Для выполнения задания используйте следующий перечень веществ: хромит калия, хлор, гидроксид калия, хлорид калия, нитрат серебра. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите среднюю соль и вещество, которое вступает с ней в реакцию ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
Решение
$AgNO_3 + KCl = KNO_3 + AgCl$
$Ag^{+} + NO_3^{–} + K^{+} + Cl^{–} = K^{+} + NO_3^{–} + AgCl$
$Ag^{+} + Cl^{–} = AgCl$
Ответ:
Показать решение
Полный курс
Задача 3
Для выполнения задания используйте следующий перечень веществ: сульфид натрия, концентрированная азотная кислота, сульфат натрия, хлорид цинка, нитрат калия. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите среднюю соль и вещество, которое вступает с ней в реакцию ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
Решение
$Na_2S + ZnCl_2 = 2NaCl + ZnS$
$2Na^{+} + S^{2–} + Zn^{2+} + 2Cl^{–} = 2Na^{+} + 2Cl^{–} + ZnS$
$Zn^{2+} + S^{2–} = ZnS$
Ответ:
Показать решение
Полный курс
Задача 4
Для выполнения задания используйте следующий перечень веществ: нитрат натрия, йодид натрия, хлорид бария, серная кислота, йод. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите среднюю соль и вещество, которое вступает с ней в реакцию ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
Решение
$H_2SO_4 + BaCl_2 = 2HCl + BaSO_4$
$2H^{+} + SO_4^{2–} + Ba^{2+} + 2Cl^{–} = 2H^{+} + 2Cl^{–} + BaSO_4$
$Ba^{2+} + SO_4^{2–} = BaSO_4$
Ответ:
Показать решение
Полный курс
Задача 5
Для выполнения задания используйте следующий перечень веществ: карбонат калия, оксид марганца(IV), гидроксид калия, хлорид кальция, нитрат калия. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите среднюю соль и вещество, которое вступает с ней в реакцию ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
Решение
$K_2CO_3 + CaCl_2 = 2KCl + CaCO_3$
$2K^{+} + CO_3^{2–} + Ca^{2+} + 2Cl^{–} = 2K^{+} + 2Cl^{–} + CaCO_3$
$Ca^{2+} + CO_3^{2–} = CaCO_3$
Ответ:
Показать решение
Полный курс
Задача 6
Для выполнения задания используйте следующий перечень веществ: гипохлорит калия, оксид азота(II), едкое кали, хлорид цинка, нитрат калия. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите среднюю соль и вещество, которое вступает с ней в реакцию ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
Решение
$2KOH + ZnCl_2 = 2KCl + Zn(OH)_2$
$2K^{+} + 2OH^{–} + Zn^{2+} + 2Cl^{–} = 2K^{+} + 2Cl^{–} + Zn(OH)_2$
$Zn^{2+} + 2OH^{–} = Zn(OH)_2$
Ответ:
Показать решение
Полный курс
Задача 7
Для выполнения задания используйте следующий перечень веществ: сульфит натрия, йодат натрия, серная кислота, сульфат натрия, сульфид серебра. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите среднюю соль и вещество, которое вступает с ней в реакцию ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
Решение
$H_2SO_4 + Na_2SO_3 = Na_2SO_4 + H_2O + SO_2$
$2H^{+} + SO_4^{2–} + 2Na^{+} + SO_3^{2–} = 2Na^{+} + SO_4^{2–} + H_2O + SO_2$
$2H^{+} + SO_3^{2–} = H_2O + SO_2$
Ответ:
Показать решение
Полный курс
Задача 8
Для выполнения задания используйте следующий перечень веществ: перманганат калия, сульфат марганца(II), сернистый газ, гидроксид калия, сульфид серебра. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите среднюю соль и вещество, которое вступает с ней в реакцию ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
Решение
$2KOH + MnSO_4 = Mn(OH)_2↓ + K_2SO_4$
$2K^{+} + 2OH^{–} + Mn^{2+} + SO_4^{2–} = Mn(OH)_2 + 2K^{+} + SO_4^{2–}$
$Mn^{2+} + 2OH^{–} = Mn(OH)_2$
Ответ:
Показать решение
Полный курс
Задача 9
Для выполнения задания используйте следующий перечень веществ: аммиак, феррат натрия, серная кислота, гидроксокарбонат меди(II), сульфат натрия. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите оснóвную соль и вещество, которое вступает с ней в реакцию ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
Решение
$2H_2SO_4 + (CuOH)_2CO_3 = 3H_2O + CO_2↑ + 2CuSO_4$
$4H^{+} + 2SO_4^{2–} + (CuOH)_2CO_3= 3H_2O + CO_2 + 2Cu^{2+} + 2SO_4^{2–}$
$4H^{+} + (CuOH)_2CO_3= 3H_2O + CO_2 + 2Cu^{2+}$
Ответ:
Показать решение
Полный курс
Задача 10
Для выполнения задания используйте следующий перечень веществ: фосфор, нитрат натрия, хлорноватая кислота, гидрокарбонат натрия, сульфат бария. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите кислую соль и вещество, которое вступает с ней в реакцию ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
Решение
$HClO_3 + NaHCO_3 = NaClO_3 + H_2O + CO_2$
$H^{+} + ClO_3^{–} + Na^{+} + HCO_3^{–} = Na^{+} + ClO_3^{–} + H_2O + CO_2$
$H^{+} + HCO_3^{–} = H_2O + CO_2$
Ответ:
Показать решение
Полный курс
Задача 11
Для выполнения задания используйте следующий перечень веществ: гипохлорит натрия, аммиак, гидроксид натрия, хлорид алюминия, хлорид натрия. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите среднюю соль и вещество, которое вступает с ней в реакцию ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
Решение
$AlCl_3 + 3NaOH_{(недост.)} = Al(OH)_3 + 3NaCl$
$Al^{3+} + 3Cl^{–} + 3Na^{+} + 3OH^{–} = Al(OH)_3 + 3Na^{+} + 3Cl^{–}$
$Al^{3+} + 3OH^{–} = Al(OH)_3$
или
$AlCl_3 + 4NaOH_{(изб.)} = Na[Al(OH)_4] + 3NaCl$
$Al^{3+} + 3Cl^{–} + 4Na^{+} + 4OH^{–} = Na^{+} + [Al(OH)_4]^{–} + 3Na^{+} + 3Cl^{–}$
$Al^{3+} + 4OH^{–} = [Al(OH)_4]^{–}$
или
$AlCl_3 + 3NH_4OH = Al(OH)_3 + 3NaCl$
$Al^{3+} + 3Cl^{–} + 3NH_4OH = Al(OH)_3 + 3NH_4^{+} + 3Cl^{–}$
$Al^{3+} + 3NH_4OH = Al(OH)_3 + 3NH_4^{+}$
Ответ:
Показать решение
Полный курс
Задача 12
Для выполнения задания используйте следующий перечень веществ: сульфат хрома(III), гидроксид натрия, перекись водорода, сульфат свинца(II), карбонат кальция. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите среднюю соль и вещество, которое вступает с ней в реакцию ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
Решение
$Cr_2(SO_4)_3 + 6NaOH = 3Na_2SO_4 + 2Cr(OH)_3$
$2Cr^{3+} + 3SO_4^{2–} + 6Na^{+} + 6OH^{–} = 6Na^{+} + 3SO_4^{2–} + 2Cr(OH)_3$
$Cr^{3+} + 3OH^{–} = Cr(OH)_3$
Ответ:
Показать решение
Полный курс
Задача 13
Для выполнения задания используйте следующий перечень веществ: сульфат железа(II), серная кислота, азотная кислота, кремниевая кислота, гидроксид натрия. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите среднюю соль и вещество, которое вступает с ней в реакцию ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
Решение
$FeSO_4 + 2NaOH = Fe(OH)_2 + Na_2SO_4$
$Fe^{2+} + SO_4^{2–} + 2Na^{+} + 2OH^{–} = Fe(OH)_2 + 2Na^{+} + SO_4^{2–}$
$Fe^{2+} + 2OH^{–} = Fe(OH)_2$
Ответ:
Показать решение
Полный курс
Задача 14
Для выполнения задания используйте следующий перечень веществ: сульфит натрия, оксид кремния(IV), ортофосфат кальция, перманганат калия, нитрат бария. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите среднюю соль и вещество, которое вступает с ней в реакцию ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
Решение
$Na_2SO_3 + Ba(NO_3)_2 = 2NaNO_3 + BaSO_3$
$2Na^{+} + SO_3^{2–} + Ba^{2+} + 2NO_3^{–} = 2Na^{+} + 2NO_3^{–} + BaSO_3$
$Ba^{2+} + SO_3^{2–} = BaSO_3$
Ответ:
Показать решение
Полный курс
Задача 15
Для выполнения задания используйте следующий перечень веществ: йодид натрия, концентрированная серная кислота, карбонат калия, нитрат калия, сернистый газ. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите среднюю соль и вещество, которое вступает с ней в реакцию ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
Решение
$K_2CO_3 + H_2SO_4 = K_2SO_4 + H_2O + CO_2↑$
$2K^{+} + CO_3^{2–} + 2H^{+} + SO_4^{2–} = 2K^{+} + SO_4^{2–} + H_2O + CO_2$
$2H^{+} + CO_3^{2–} = H_2O + CO_2$
Ответ:
Показать решение
Полный курс
Задача 16
Для выполнения задания используйте следующий перечень веществ: нитрит калия, оксид хрома(VI), серная кислота, нитрат кальция, хлорид алюминия. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите среднюю соль и вещество, которое вступает с ней в реакцию ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
Решение
$Ca(NO_3)_2 + H_2SO_4 = CaSO_4 + 2HNO_3$
$Ca^{2+} + 2NO_3^{–} + 2H^{+} + SO_4^{2–} = CaSO_4 + 2H^{+} + 2NO_3^{–}$
$Ca^{2+} + SO_4^{2–} = CaSO_4$
Ответ:
Показать решение
Полный курс
Задача 17
Для выполнения задания используйте следующий перечень веществ: оксид хрома(III), нитрат калия, карбонат калия, гидросульфат натрия, хлорид натрия. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите среднюю соль и вещество, которое вступает с этой солью в реакцию ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
Решение
$K_2CO_3 + 2NaHSO_4 = K_2SO_4 + Na_2SO_4 + H_2O + CO_2$
$2K^{+} + CO_3^{2–} + 2Na^{+} + 2H^{+} + 2SO_4^{2–} = 2K^{+} + SO_4^{2–} + 2Na^{+} + SO_4^{2–} + H_2O + CO_2$
$2H^{+} + CO_3^{2–} = H_2O + CO_2$
Ответ:
Показать решение
Полный курс
Задача 18
Для выполнения задания используйте следующий перечень веществ: нитрат натрия, щавелевая кислота, серная кислота, нитрат бария, перманганат калия. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите кислоту и вещество, которое вступает с этой кислотой в реакцию ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
Решение
$H_2SO_4 + Ba(NO_3)_2 = 2HNO_3 + BaSO_4$
$2H^{+} + SO_4^{2–} + Ba^{2+} + 2NO_3^{–} = 2H^{+} + 2NO_3^{–} + BaSO_4$
$Ba^{2+} + SO_4^{2–} = BaSO_4$
Ответ:
Показать решение
Полный курс
Задача 19
Для выполнения задания используйте следующий перечень веществ: нитрит натрия, сульфат кальция, серная кислота, хлорид железа(II), нитрат бария. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите среднюю соль и вещество, которое вступает с этой солью в реакцию ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
Решение
$H_2SO_4 + Ba(NO_3)_2 = 2HNO_3 + BaSO_4$
$2H^{+} + SO_4^{2–} + Ba^{2+} + 2NO_3^{–} = 2H^{+} + 2NO_3^{–} + BaSO_4$
$Ba^{2+} + SO_4^{2–} = BaSO_4$
Ответ:
Показать решение
Полный курс
Задача 20
Для выполнения задания используйте следующий перечень веществ: нитрат натрия, гидроксид натрия, сульфид меди(II), сульфат цинка, оксид хрома(III). Допустимо использование водных растворов веществ.
Из предложенного перечня выберите среднюю соль и вещество, которое вступает с этой солью в реакцию ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
Решение
$2NaOH + ZnSO_4 = Zn(OH)_2↓ + Na_2SO_4$
$2Na^{+} + 2OH^{–} + Zn^{2+} + SO_4^{2–} = Zn(OH)_2 + 2Na^{+} + SO_4^{2–}$
$2OH^{–} + Zn^{2+} = Zn(OH)_2$
Ответ:
Показать решение
Полный курс
ВАЖНО! Никаких реальных вариантов ни до экзамена, ни во время его проведения на сайте нет, не было и не будет.
ЗАПРЕЩЕНО копирование материалов без указания активные ссылки на источник
В случае нарушения авторских прав, правообладателям обращаться по адресу:
Контакты: tolkoexamen@gmail.com
Задания 30 и 31 ЕГЭ по химии (vk.com/examtop)
1
1. Сульфид меди(II), гидросульфат калия, гидроксид бария, фосфин, гидроксид алюминия, азотная кислота.
ОВР: образуется бесцветный раствор.
РИО: нет видимых признаков.
2. Гидрокарбонат калия, нитрат алюминия, оксид фосфора(V), азотная кислота, сульфид меди(II), гидроксид бария.
ОВР: образуется окрашенный раствор.
РИО: в реакцию вступает кислая соль, образуется осадок, выделяется газ.
3. Оксид серы(IV), перманганат калия, гидроксид магния, бромоводородная кислота, аммиак, гидроксид железа(III).
ОВР: образуется в растворе две соли и кислота.
РИО: происходит растворение белого осадка.
4. Перманганат натрия, нитрит натрия, гидроксид натрия, гидрокарбонат бария, серная кислота, гидрокарбонат магния.
ОВР: образуется зеленый раствор, не образуется осадок.
РИО: выделяется газ, не образуется осадок.
5. Аммиак, перманганат калия, гидросульфат лития, нитрат стронция, иод, сульфит натрия.
ОВР: образуется нерастворимое вещество, не выделяется газ.
РИО: в реакцию вступает кислая соль, образуется осадок.
6. Гидрофосфат калия, сульфит кальция, перманганат калия, хлороводород, гидроксид железа(III), нитрат марганца(II).
ОВР: образуется осадок.
РИО: в реакцию вступает кислая соль, реакция не сопровождается видимыми признаками.
7. Сероводород, карбонат аммония, сульфат железа(II), дихромат калия, серная кислота, хлорид натрия.
ОВР: образуется в растворе три соли.
РИО: в реакцию вступают два сильных электролита, образуется осадок.
8. Бромид кальция, гидрофосфат аммония, перманганат калия, серная кислота, нитрат калия, медь.
ОВР: выделяется бурый газ, не образуется осадок.
РИО: в реакцию вступают две соли, образуется осадок.
9. Бромоводород, гидросульфат калия, перманганат калия, графит, нитрат серебра, ацетат бария.
ОВР: образуется простое вещество.
РИО: образуется белый осадок.
10. Оксид хрома(III), дихромат аммония, гидрокарбонат натрия, графит, хлорид железа(III), серная кислота.
ОВР: образуется два кислотных оксида.
РИО: образуется осадок, выделяется газ.
11. Оксид серы(IV), гидроксокарбонат меди(II), перманганат калия, дигидрофосфат натрия, аммиак, гидроксид калия.
ОВР: образуется осадок, выделяется газ.
РИО: в реакцию вступает кислая соль. vk.com/examtop
Задания 30 и 31 ЕГЭ по химии (vk.com/examtop)
2
12. Оксид хрома(VI), хлорид железа(II), азотная кислота, аммиак, иод, фторид аммония.
ОВР: образуется кислота, одна молекула восстановителя отдает десять электронов.
РИО: в реакцию вступают два сильных электролита, реакция не сопровождается видимыми признаками.
13. Оксид серы(IV), фосфин, аммиак, дигидрофосфат натрия, пероксид натрия, гидроксид натрия.
ОВР: образуется щелочь, выделяется газ
РИО: в реакцию вступает кислая соль, образуется средняя соль.
14. Серная кислота, гидросульфат аммония, фосфин, сульфид меди(II), гидроксид бария, гидроксид хрома(III).
ОВР: образуется бесцветный раствор кислоты
РИО: образуется окрашенный раствор, не выделяется газ
15. Бром, нитрат бария, гидроксид хрома(III), гидрокарбонат калия, оксид серы(IV), нитрат алюминия.
ОВР: образуется в растворе две кислоты.
РИО: образуется осадок, выделяется газ. vk.com/examtop
Ни для кого не секрет, что задача 33 (она же бывшая задача 34) в ЕГЭ по химии — самое сложное задание, а судя по статистике (только 8,3% выпускников справляются с ним), она еще и практически невыполнимая. Поэтому значительное число выпускников даже не читают условие этой задачи. А зря. Если вы пришли на экзамен по химии, то уж точно сможете записать несколько уравнений, ведь так?
Задача 33 по химии: суть и критерии оценивания
Задание № 33 в ЕГЭ по химии — это расчетная задача высокого уровня сложности. Чтобы успешно решить ее, вам необходимо знать химические свойства веществ, уметь устанавливать логические связи между реакциями, применять расчетные формулы для нахождения количества вещества, массы и объема, массовой доли вещества в смеси.
Для получения максимально возможных 4 баллов за задачу 33 вам предстоит:
- записать все уравнения реакций, описанных в тексте (1 балл);
- рассчитать количества вещества всех известных и искомых веществ (1 балл);
- провести анализ и рассчитать искомые величины (1 балл);
- дать правильный ответ и безошибочно оформить решение (1 балл; снимается за отсутствие размерных величин — больше трех, также за математические ошибки)
Но слова в сторону, нам нужна успешная пошаговая стратегия: что делать, чтобы не получить за этот номер 0?
ЕГЭ по химии — в принципе достаточно сложный экзамен. Чтобы получить за него высокий балл, нужно хорошо постараться. Так, необходимо хорошо знать теорию и формулы, уметь выводить уравнения без ошибок, понимать, как правильно читать задания (в них могут быть ловушки!) и оформлять ответы по критериям. И все это — за ограниченный период времени.
Чтобы не стрессовать на экзамене и показать лучший результат, записывайтесь ко мне на курсы подготовки к ЕГЭ по химии. Мы изучим только то, что гарантированно пригодится вам на экзамене: ничего лишнего, только актуальные знания. А пробные экзамены, которые мы обязательно проводим, помогут понять, что ЕГЭ — совсем не такое страшное. Приходите к нам — за знаниями и спокойствием!
Пошаговый разбор реального задания 33
Уровень «Новичок»
Вы выбрали химию для поступления и готовилист к ЕГЭ минимум год. Вам абсолютно под силу записать уравнения реакций, описанных в тексте. Чаще всего здесь встречаются реакции обмена, замещения и разложения, ОВР, электролиз и совместный гидролиз. Правильно записанные реакции с расставленными коэффициентами дают 1 первичный балл за 33 задачу в ЕГЭ по химии.
ШАГ 1. Запишите все уравнения реакций, о которых идет речь в тексте
Если возможны вариации одной и той же реакции, рассмотрите их на черновике (например, получение средних/кислых солей, образование амфотерного гидроксида/ комплексной соли и т.п.). Какую реакцию оставить, вы поймете после получения первых результатов расчета.
Совет: повторите перед экзаменом тривиальные названия. Например, если вы не знаете, что такое «железная окалина», то ни записать реакцию, ни решить данную задачу не удастся 🙃
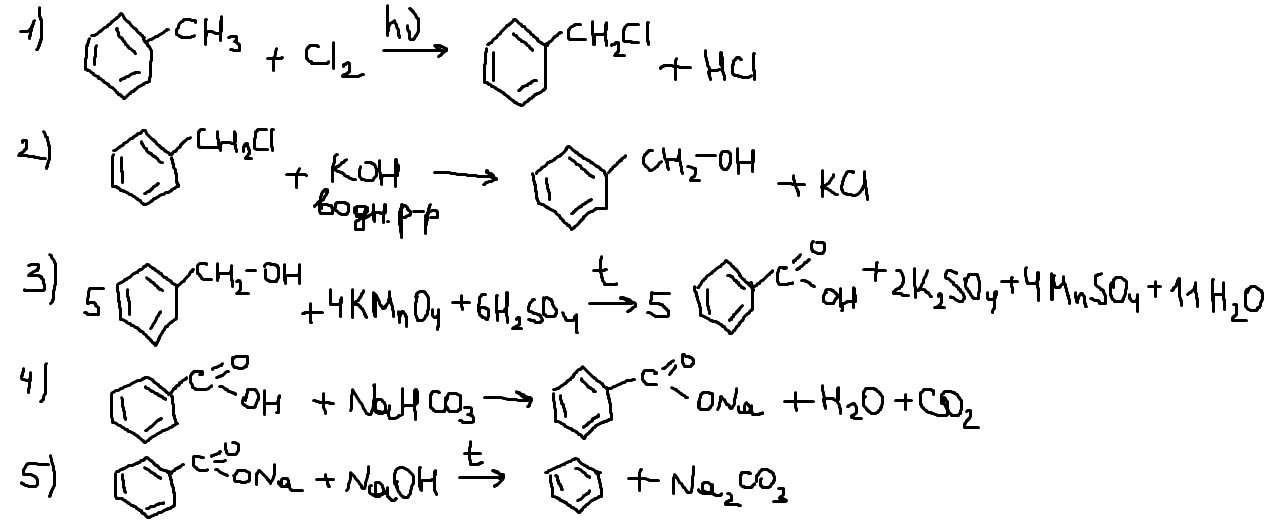
Смесь железной окалины и оксида железа III растворяют в азотной концентрированной кислоте. Запишем их по очереди. Железная окалина содержит железо в степени окисления +2, отсюда и протекание окислительно-восстановительной реакции: железо повышает степень окисления до +3, а азот изменяет свою степень окисления с +5 до +4. Вторая реакция представляет собой классическую реакцию обмена:
Fe3O4 + 10HNO3 = 3Fe(NO3)3 + NO2 + 5H2O
Fe2O3 + 6HNO3 = 2Fe(NO3)3 + 3H2O
Образовавший газ (это NO2, полученный в первой реакции) взаимодействует с гидроксидом натрия:
2NO2 + 2NaOH = NaNO2 + NaNO3 + H2O
ИТОГО: +1 балл
С одним пунктом вы справились. Далее запишите «дано». Баллов за эту запись вам не добавят, но при этом вы сможете увидеть все известные величины и помнить, что необходимо найти.
Дано:
N(Fe) : N(O) = 7 : 10
mp-p(HNO3) = 500 г
mp-p(NaOH) = 20 г
w(NaOH) = 20%
Найти:
w(Fe(NO3)3) — ?
Уровень «Мастер»
Вы готовы сделать больше, чем записать уравнения реакции. Вы помните основные расчетные формулы и можете найти количество вещества по заданной массе и объему.
ШАГ 2. Используйте известные числовые значения, чтобы рассчитать количества вещества всех необходимых участников реакций
Переходим к действию. Нужно найти вещество, о котором мы все знаем. В приведенном примере это гидроксид натрия. Необходимо рассчитать количество вещества. Используем для этого основные расчетные формулы:
NaOH
mp-pa = 20 г
w = 0,2
m = mp-pw = 20 × 0,2 = 4 г
М = 40 г/моль
n = m : M = 4 : 40 = 0,1 моль
Задаем себе вопрос: что нам дает это значение? Каждый ответ должен вести к следующему действию. Так, мы можем рассчитать количество оксида азота IV – NO2, а благодаря ему получим количество вещества Fe3O4.
Совет: в задаче 33 по химии рассчитывайте сразу и количество вещества, и массу любого соединения, с которым работаете. Эти массы пригодятся при нахождении итогового раствора. А если не пригодятся, не переписывайте их в чистовик.
ИТОГО: +1 балл
Уровень «Гуру»
Вас не пугает уравнение с иксом в химии. Более того, вы можете его и составить, и решить.
ШАГ 3. Продумайте, как от найденных количеств вещества дойти по цепочке до искомого соединения
Что нужно найти дополнительно, чтобы получить ответ в задаче 33 по химии? Здесь может пригодиться работа с переменными, пропорции, соотношения и даже составление системы уравнений с двумя неизвестными.
Работаем!
Мы получили количества вещества нескольких соединений. Но так и не добрались до второй реакции и Fe2O3. Кроме того, мы не использовали соотношение атомов. Если вам ничего не дано для вещества по условию, а также вам не удалось подойти к нему через промежуточные расчеты, дело за уравнением. За х всегда принимайте количество неизвестного вещества.
Для нашего примера получим:
Совет: не пытайтесь принять за х все, что не получается рассчитать. Чаще всего задача 33 по химии решается без каких-либо переменных.
ИТОГО: +1 балл
Уровень «Профессионал»
Самое сложное уже позади. Теперь вам остается грамотно довести до конца. Обычно в завершении задачи требуется рассчитать массу полученного раствора и массовую долю вещества в нем. Чтобы не допустить ошибку на последнем этапе, помним, что в раствор входят все вещества, описанные в условии задачи, за исключением веществ, участвующих в реакциях сплавления, разложения и горения. Также обязательно нужно вычесть из этой массы потери. Потерями считаем осадки, газы, выпаренную воду, непрореагировавшие металлы и их оксиды.
ШАГ 4. Внимательно прочитайте вопрос задачи и рассчитайте искомую величину
Чаще всего необходимо вычислять массовую долю вещества в растворе. Предварительно вычислите массу полученного раствора с учетом всех потерь — осадков, газов и т.п.
В приведенном примере в раствор входит смесь железной окалины и оксида железа (III) и раствор азотной кислоты. Потеря — газообразное вещество NO2 (он же бурый газ).
mp-pa = m(Fe3O4) + m(Fe2O3) + mp-p(HNO3) – m(NO2) = 23,2 + 32 + 500 – 4,6 = 550,7 г
Зная количества вещества оксидов, вычислим количество вещества и массу искомой соли, а также ее массовую долю:
ИТОГО: +1 балл
Вот вы и решили 33 задачу в ЕГЭ по химии. Сложная ли она? Безусловно. Но можно ли с ней побороться? Да! Помните, что это задание, как и любое другое из второй части, оценивают согласно критериям. Не оставляйте его совсем без решения. Вы сможете остановиться на любом этапе и при этом принести в свою копилку больше, чем 0 баллов. А в пересчете на 100-балльную шкалу это будет уже весомо!
А если хотите научиться пошагово решать и другие задания из ЕГЭ по химии, записывайтесь ко мне на курсы подготовки к экзамену. Мы разберемся во всей теории, будем тренироваться в практических заданиях и научимся оформлять ответы в полном соответствии с критериями. Не теряйте возможность получить 80+ за ЕГЭ по химии — записывайтесь.