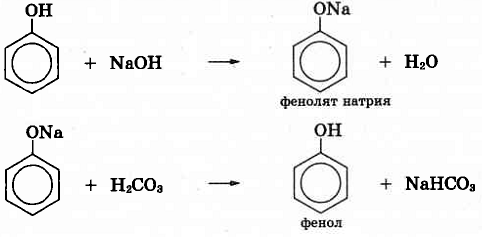
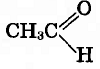
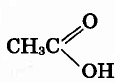
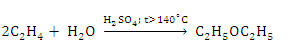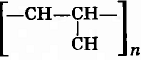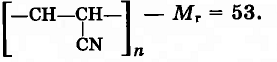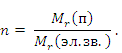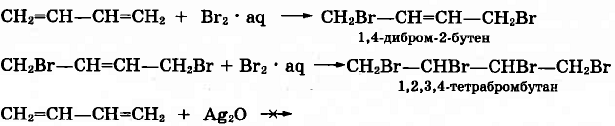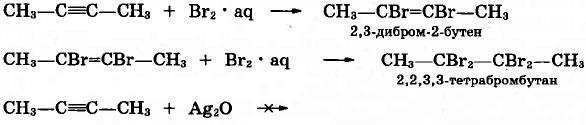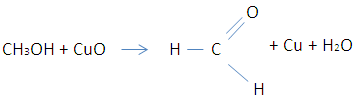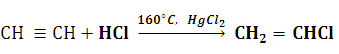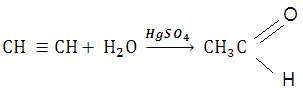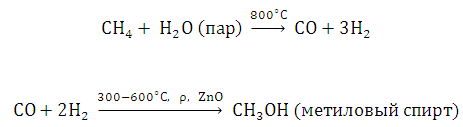Пройти тестирование по 10 заданиям
Пройти тестирование по всем заданиям
Вернуться к каталогу заданий
Версия для печати и копирования в MS Word
1
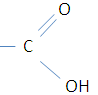
Установите соответствие между названием вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
НАЗВАНИЕ ВЕЩЕСТВА
А) метилбензол
Б) анилин
В) 3-метилбутаналь
КЛАСС/ГРУППА
1) альдегиды
2) амины
3) аминокислоты
4) углеводороды
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Источник: Демонстрационная версия ЕГЭ—2017 по химии, Демонстрационная версия ЕГЭ—2018 по химии, Демонстрационная версия ЕГЭ−2019 по химии
2
Установите соответствие между названием соединения и общей формулой гомологического ряда, к которому оно принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
НАЗВАНИЕ СОЕДИНЕНИЯ
А) бутен-1
Б) циклопропан
В) бутадиен-1,3
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Источник: РЕШУ ЕГЭ
3
Установите соответствие между названием соединения и общей формулой гомологического ряда, к которому оно принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
НАЗВАНИЕ СОЕДИНЕНИЯ
А) бутин
Б) циклогексен
В) бутадиен-1,2
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Источник: РЕШУ ЕГЭ
4
Установите соответствие между названием соединения и общей формулой гомологического ряда, к которому оно принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
НАЗВАНИЕ СОЕДИНЕНИЯ
А) бутан
Б) бутин-1
В) циклогексан
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Источник: РЕШУ ЕГЭ
5
Установите соответствие между названием соединения и общей формулой гомологического ряда, к которому оно принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
НАЗВАНИЕ СОЕДИНЕНИЯ
А) бутадиен-1,3
Б) 2-метилпропанол-1
В) этилформиат
КЛАСС (ГРУППА) ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
1) простые эфиры
2) сложные эфиры
3) спирты
4) углеводороды
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Источник: РЕШУ ЕГЭ
Пройти тестирование по этим заданиям
Чтобы поделиться, нажимайте
Задания ЕГЭ по номерам (по темам)
Предлагаем вам Задания ЕГЭ по номерам формата ЕГЭ 2022 по химии с ответами и видео-объяснениями. Листайте ниже и выбирайте тот номер задания, который вы хотите выполнить.
- Первая часть (указывается только ответ, без решения)
1. Электронная конфигурация атома
- Часть 1 (30 заданий с ответами)
- Часть 2 (30 заданий с ответами, а для некоторых заданий — видеообъяснения)
2. Закономерности изменения химических свойств элементов. Характеристика элементов
- Часть 1 (30 заданий с ответами)
- Часть 2 (30 заданий с ответами, а для некоторых заданий — видеообъяснения)
3. Электроотрицательность, степень окисления и валентность химических элементов
- Часть 1 (30 заданий с ответами)
- Часть 2 (30 заданий с ответами, а для некоторых заданий — видеообъяснения)
4. Характеристики химических связей. Зависимость свойств веществ от их состава и строения
- Часть 1 (30 заданий с ответами)
- Часть 2 (30 заданий с ответами, а для некоторых заданий — видеообъяснения)
5. Классификация и номенклатура неорганических веществ
- Часть 1 (30 заданий с ответами) — старый формат
- Часть 2 (30 заданий с ответами, а для некоторых заданий — видеообъяснения) — старый формат
- Часть 3 (10 заданий с ответами) — новый формат 2022 года
6. Свойства оснований, амфотерных гидроксидов, кислот и солей. Ионный обмен и диссоциация
- Часть 1 (30 заданий с ответами)
- Часть 2 (30 заданий с ответами, а для некоторых заданий — видеообъяснения)
7. Свойства неорганических веществ
- Часть 1 (30 заданий с ответами)
- Часть 2 (30 заданий с ответами, а для некоторых заданий — видеообъяснения)
8. Свойства неорганических веществ
- Часть 1 (30 заданий с ответами)
- Часть 2 (30 заданий с ответами, а для некоторых заданий — видеообъяснения)
9. Взаимосвязь неорганических веществ
- Часть 1 (30 заданий с ответами)
- Часть 2 (30 заданий с ответами, а для некоторых заданий — видеообъяснения)
10. Классификация и номенклатура органических веществ
- Часть 1 (30 заданий с ответами)
- Часть 2 (30 заданий с ответами, а для некоторых заданий — видеообъяснения)
11. Теория строения органических соединений. Типы связей в молекулах органических веществ. Изомеры. Гомологи
- Часть 1 (30 заданий с ответами)
- Часть 2 (30 заданий с ответами, а для некоторых заданий — видеообъяснения)
12. Свойства углеводородов и кислородосодержащих соединений. Получение углеводородов и кислородосодержащих соединений
- Часть 1 (30 заданий с ответами) — старый формат
- Часть 2 (30 заданий с ответами, а для некоторых заданий — видеообъяснения) — старый формат
- Часть 3 (30 заданий с ответами) — старый формат
- Часть 4 (30 заданий с ответами, а для некоторых заданий — видеообъяснения) — старый формат
- Часть 5 (5 заданий с ответами) — новый формат 2022 года
13. Свойства азотсодержащих органических соединений. Белки, жиры, углеводы
- Часть 1 (30 заданий с ответами)
- Часть 2 (30 заданий с ответами, а для некоторых заданий — видеообъяснения)
14. Характерные химические свойства углеводородов. Механизмы реакций
- Часть 1 (30 заданий с ответами)
- Часть 2 (30 заданий с ответами, а для некоторых заданий — видеообъяснения)
15. Свойства спиртов, альдегидов, кислот, сложных эфиров, фенола
- Часть 1 (30 заданий с ответами)
- Часть 2 (30 заданий с ответами, а для некоторых заданий — видеообъяснения)
16. Взаимосвязь углеводородов и кислородосодержащих органических соединений
- Часть 1 (30 заданий с ответами)
- Часть 2 (30 заданий с ответами, а для некоторых заданий — видеообъяснения)
17. Классификация химических реакций в неорганической и органической химии
- Часть 1 (30 заданий с ответами)
- Часть 2 (30 заданий с ответами, а для некоторых заданий — видеообъяснения)
18. Скорость реакции, ее зависимость от различных факторов
- Часть 1 (30 заданий с ответами)
- Часть 2 (30 заданий с ответами, а для некоторых заданий — видеообъяснения)
19. Реакции окислительно-восстановительные
- Часть 1 (30 заданий с ответами)
- Часть 2 (30 заданий с ответами, а для некоторых заданий — видеообъяснения)
20. Электролиз расплавов и растворов
- Часть 1 (30 заданий с ответами)
- Часть 2 (30 заданий с ответами, а для некоторых заданий — видеообъяснения)
21. Гидролиз солей. Среда водных растворов: кислая, нейтральная, щелочная. pH
- Часть 1 (30 заданий с ответами) — старый формат
- Часть 2 (30 заданий с ответами, а для некоторых заданий — видеообъяснения) — старый формат
- Часть 3 (5 заданий с ответами) — новый формат 2022 года
22. Обратимые и необратимые химические реакции. Химическое равновесие
- Часть 1 (30 заданий с ответами)
- Часть 2 (30 заданий с ответами, а для некоторых заданий — видеообъяснения)
23. Химическое равновесие. Расчёты концентраций — новое задание 2022 года
- Часть 1 (5 заданий с ответами)
24. Качественные реакции органических и неорганических соединений
- Часть 1 (30 заданий с ответами)
- Часть 2 (30 заданий с ответами, а для некоторых заданий — видеообъяснения)
25. Химическая лаборатория. Химическая промышленность. Полимеры
- Часть 1 (30 заданий с ответами)
- Часть 2 (30 заданий с ответами, а для некоторых заданий — видеообъяснения)
26. Расчёты с использованием понятия «массовая доля вещества в растворе»
- Часть 1 (30 заданий с ответами)
- Часть 2 (30 заданий с ответами, а для некоторых заданий — видеообъяснения)
27. Расчеты теплового эффекта (по термохимическим уравнениям)
- Часть 1 (30 заданий с ответами, а для некоторых заданий — видеообъяснения)
28. Расчет массы или объёма вещества по параметрам одного из участвующих в реакции веществ. Выход продукта. Примеси. Массовая доля вещества в смеси
- Часть 1 (30 заданий с ответами)
- Часть 2 (30 заданий с ответами, а для некоторых заданий — видеообъяснения)
- Часть 3 (29 заданий с ответами, а для некоторых заданий — видеообъяснения)
- Часть 4 (5 заданий с ответами, а для некоторых заданий — видеообъяснения) — задачи, которых не было до 2022 года
- Вторая часть (оформляется подробным решением на бланках ответов)
29. Окислительно-восстановительные реакции
- Часть 1 (30 заданий с ответами)
- Часть 2 (17 заданий с ответами, реальный ЕГЭ 2018)
- Часть 3 (22 задания с ответами, а также для некоторых заданий — видеообъяснения)
- Часть 4 (23 задания с ответами, реальный ЕГЭ 2019)
- Часть 5 (33 задания с ответами, реальный ЕГЭ 2020)
30. Реакции ионного обмена
- Часть 1 (30 заданий с ответами)
- Часть 2 (17 заданий с ответами, реальный ЕГЭ 2018)
- Часть 3 (22 задания с ответами, а также для некоторых заданий — видеообъяснения)
- Часть 4 (23 заданий с ответами, реальный ЕГЭ 2019)
- Часть 5 (32 задания с ответами, реальный ЕГЭ 2020)
31. Взаимосвязь различных классов неорганических веществ: описание реакций
- Часть 1 (30 заданий с ответами)
- Часть 2 (17 заданий с ответами, реальный ЕГЭ 2018)
- Часть 3 (22 задания с ответами, а также для некоторых заданий — видеообъяснения)
- Часть 4 (23 задания с ответами, реальный ЕГЭ 2019)
- Часть 5 (36 заданий с ответами, реальный ЕГЭ 2020)
32. Взаимосвязь органических соединений
- Часть 1 (30 заданий с ответами)
- Часть 2 (17 заданий с ответами, реальный ЕГЭ 2018)
- Часть 3 (22 задания с ответами, а также для некоторых заданий — видеообъяснения)
- Часть 4 (23 задания с ответами, реальный ЕГЭ 2019)
- Часть 5 (35 заданий с ответами, реальный ЕГЭ 2020)
33. Расчёты с использованием понятий растворимость, массовая доля вещества в растворе, избыток, примеси. Расчёты массовой доли химического соединения (атомов элемента) в смеси
- Часть 1 (17 задач с решениями и видео-объяснениями, реальный ЕГЭ 2018)
- Часть 2 (30 задач с решениями и видео-объяснениями, реальный ЕГЭ 2019)
- Часть 3 (27 задач с решениями и видео-объяснениями, пробные и тренеровочные варианты)
- Часть 4 (43 задачи с решениями и видео-объяснениями, реальный ЕГЭ 2020)
- Часть 5. Задачи на «атомистику» (66 задач с видео-объяснениями, появились на ЕГЭ 2020)
- Часть 6 (16 задач с видео-объяснениями и ответами, реальный ЕГЭ 2021)
- Часть 7 (38 задач с видео-объяснениями и ответами, возможные задачи ЕГЭ 2022)
34. Нахождение молекулярной и структурной формулы органического вещества
- Часть 1 (17 задач с решениями и видео-объяснениями, реальный ЕГЭ 2018)
- Часть 2 (21 задача с решениями и видео-объяснениями, реальные ЕГЭ 2019)
- Часть 3 (27 задач с решениями и видео-объяснениями, пробные и тренеровочные варианты)
- Часть 4 (43 задачи с решениями и видео-объяснениями, реальный ЕГЭ 2020)
- Часть 5 (31 задача с решениями и видео-объяснениями, возможные задачи ЕГЭ 2022)
Задания ЕГЭ 2021, которых НЕ будет в таком формате в ЕГЭ 2022:
Химические свойства неорганических веществ
- Часть 1 (30 заданий с ответами)
- Часть 2 (30 заданий с ответами, а для некоторых заданий — видеообъяснения)
А также вы можете получить доступ ко всем видео-урокам, заданиям реального ЕГЭ с подробными видео-объяснениями, задачам и всем материалам сайта кликнув:
- Реальный вариант ЕГЭ по химии 2021. Центр
- Реальный вариант ЕГЭ по химии 2021. Сибирь
- Реальный вариант ЕГЭ по химии 2021. Урал
- Посмотреть видео-объяснения решений всех типов задач вы можете здесь, нажав на эту строку
- Просмотреть задания ЕГЭ всех лет вы можете здесь, нажав на эту строку
- Посмотреть все видео-уроки вы можете здесь, нажав на эту строку
- Прочитать всю теорию для подготовки к ЕГЭ и ЦТ вы можете здесь, нажав на эту строку
- Все видео-объяснения вы можете найти на YouTube канале, нажав на эту строку
-
Органические цепочки из ЕГЭ с решениями.
Задание №1
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
1) Уравнение спиртового брожения глюкозы под действием дрожжей:
2) Этиловый спирт сернокислым раствором перманганата калия может быть окислен до уксусной кислоты:
3) Уравнение нейтрализации уксусной кислоты гидроксидом натрия:
4) Взаимодействие солей карбоновых кислот со щелочами при сплавлении приводит к образованию углеводорода с меньшим числом атомов углерода
5) Алканы вступают в реакцию нитрования с разбавленной азотной кислотой при сильном нагревании:
Задание №2
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
1) При нагревании одноатомных спиртов с концентрированной серной кислотой выше 140 оС протекает внутримолекулярная дегидратация с образованием алкена:
2) Алкены вступают в реакцию соединения с бромом. При этом атомы брома присоединяются по месту двойной связи, сами двойная связь превращается в одинарную:
3) Вицинальные дигалогенпроизоводные углеводородов при нагревании с некоторыми металлами, например, цинком или магнием, образуют алкены:
4) Гидратация несимметричных алкенов протекает в соответствии с правилом Марковникова:
5) Вторичные спирты в ЕГЭ окисляем до соответствующих кетонов (углеродный скелет не рвем):
Задание №3
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
1) При бромировании бутана на свету образуется преимущественно 2-бромбутан:
2) При действии на галогенпроизводные алканов спиртового раствора щелочи при нагревании образуется алкен. Реакция протекает для 2-бромбутана в соответствии с правилом Зайцева:
3) Бутен-2, реагируя с бромом, образует 2,3-дибромбутан:
4) 2,3-дибромбутан при реакции с избытком спиртового раствора щелочи образует бутин-2:
5) Гидратация алкинов с числом углеродных атомов в молекуле больше 2-х приводит к образованию кетонов:
Задание №4
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
v1) Реакция алкенов с нейтральным холодным раствором перманганата калия приводит к образованию соответствующих вицинальных диолов:
2) Взаимодействие этиленгликоля с избытком бромоводорода приводит к образованию 1,2-дибромэтана:
3) Дегидрогалогенирование вицинальных дигалогеналканов действием спиртового раствора щелочи приводит к образованию соответствующих алкинов:
4) В результате гидратации ацетилена в присутствии солей ртути образуется ацетальдегид:
5) Совместное нагревание ацетальдегида с гидроксидом меди (II) приводит к его окислению до уксусной кислоты. Гидроксид меди (II) при этом восстанавливается до оксида меди (I) (кирпично-красный осадок):
Задание №5
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
Задание №6
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
Задание №7
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
Задание №8
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
Задание №9
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
Задание №10
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
Ответ:
[adsp-pro-3]
Задание №11
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
Ответ:
Задание №12
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
Ответ:
Задание №13
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
Ответ:
Задание №14
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
Ответ:
Задание №15
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
Ответ:
Задание №16
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
Ответ:
Задание №17
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
Ответ:
Задание №18
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
Ответ:
Задание №19
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
Ответ:
Задание №20
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
Ответ:
[adsp-pro-3]
Задание №21
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
Ответ:
Задание №22
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
Ответ:
Задание №23
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
Ответ:
Задание №24
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
Ответ:
Задание №25
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
Ответ:
Задание №26
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
Ответ:
Задание №27
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
Ответ:
Задание №28
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
Ответ:
Задание №29
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
Ответ:
Задание №30
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
Ответ:
[adsp-pro-3]
Задание №31
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: При написании уравнений реакций используйте структурные формулы органических веществ. Решение
Ответ:
Задание №32
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
Ответ:
Задание №33
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
Ответ:
Задание №34
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
Ответ:
Задание №35
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
Ответ:
Задание №36
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
Ответ:
Задание №37
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
Ответ:
Задание №38
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
Ответ:
Задание №39
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
Ответ:
Задание №40
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
Ответ:
[adsp-pro-3]
Задание №41
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
Ответ:
Задание №42
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
Ответ:
Задание №43
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
Ответ:
Задание №44
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
Ответ:
Задание №45
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
Ответ:
Задание №46
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
Ответ:
Задание №47
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
Ответ:
Задание №48
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
Ответ:
Задание №49
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
Ответ:
Задание №50
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
Ответ:
[adsp-pro-10]
Типовые (тематические) тесты в формате ЕГЭ по химии по каждому заданию. Тренировочные тесты, которые соответствуют заданиям ЕГЭ-2023 по химии по темам КИМ ЕГЭ по химии.
Хотите видеть больше интересных материалов? Вы можете поддержать работу сайта:
Обратите внимание! Форма выше — это форма для сбора донатов на работу сайта.
Полные тренировочные варианты ЕГЭ по химии с автопроверкой первой части
Спецификация ЕГЭ по химии-2023
| Номер задания | Тематические тесты по теме |
| 1 | Строение электронных оболочек атомов элементов первых четырёх периодов: s-, p- и d-элементы. Электронная конфигурация атома. Основное и возбуждённое состояния атомов |
| 2 | Закономерности изменения химических свойств элементов и их соединений по периодам и группам. Общая характеристика металлов IА–IIIА групп в связи с их положением в Периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов. Характеристика переходных элементов – меди, цинка, хрома, железа – по их положению в Периодической системе химических элементов Д.И. Менделеева и особенностям строения их атомов. Общая характеристика неметаллов IVА–VIIА групп в связи с их положением в Периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов |
| 3 | Электроотрицательность. Степень окисления и валентность химических элементов |
| 4 | Ковалентная химическая связь, её разновидности и механизмы образования. Характеристики ковалентной связи (полярность и энергия связи). Ионная связь. Металлическая связь. Водородная связь. Вещества молекулярного и немолекулярного строения. Тип кристаллической решётки. Зависимость свойств веществ от их состава и строения |
| 5 | Классификация неорганических веществ. Номенклатура неорганических веществ (тривиальная и международная) |
| 6 | Характерные химические свойства простых веществ – металлов: щелочных, щёлочноземельных, магния, алюминия; переходных металлов: меди, цинка, хрома, железа. Характерные химические свойства простых веществ – неметаллов: водорода, галогенов, кислорода, серы, азота, фосфора, углерода, кремния. Характерные химические свойства оксидов: оснóвных, амфотерных, кислотных Характерные химические свойства оснований и амфотерных гидроксидов. Характерные химические свойства кислот. Характерные химические свойства солей: средних, кислых, оснóвных; комплексных (на примере гидроксосоединений алюминия и цинка). Электролитическая диссоциация электролитов в водных растворах. Сильные и слабые электролиты. Реакции ионного обмена |
| 7 | Классификация неорганических веществ. Номенклатура неорганических веществ (тривиальная и международная). Характерные химические свойства неорганических веществ: – простых веществ – металлов: щелочных, щёлочноземельных, магния, алюминия, переходных металлов (меди, цинка, хрома, железа); – простых веществ – неметаллов: водорода, галогенов, кислорода, серы, азота, фосфора, углерода, кремния; – оксидов: оснóвных, амфотерных, кислотных; – оснований и амфотерных гидроксидов; – кислот; – солей: средних, кислых, оснóвных; комплексных (на примере гидроксосоединений алюминия и цинка) |
| 8 | Классификация неорганических веществ. Номенклатура неорганических веществ (тривиальная и международная); Характерные химические свойства неорганических веществ: – простых веществ – металлов: щелочных, щёлочноземельных, магния, алюминия, переходных металлов (меди, цинка, хрома, железа); – простых веществ – неметаллов: водорода, галогенов, кислорода, серы, азота, фосфора, углерода, кремния; – оксидов: оснóвных, амфотерных, кислотных; – оснований и амфотерных гидроксидов; – кислот; – солей: средних, кислых, оснóвных; комплексных (на примере гидроксосоединений алюминия и цинка) |
| 9 | Взаимосвязь неорганических веществ |
| 10 | Классификация органических веществ. Номенклатура органических веществ (тривиальная и международная) |
| 11 | Теория строения органических соединений: гомология и изомерия (структурная и пространственная). Взаимное влияние атомов в молекулах. Типы связей в молекулах органических веществ. Гибридизация атомных орбиталей углерода. Радикал. Функциональная группа |
| 12 | Характерные химические свойства углеводородов: алканов, циклоалканов, алкенов, диенов, алкинов, ароматических углеводородов (бензола и гомологов бензола, стирола). Основные способы получения углеводородов (в лаборатории). Характерные химические свойства предельных одноатомных и многоатомных спиртов, фенола. Характерные химические свойства альдегидов, предельных карбоновых кислот, сложных эфиров. Основные способы получения кислородсодержащих органических соединений (в лаборатории) |
| 13 | Характерные химические свойства азотсодержащих органических соединений: аминов и аминокислот. Важнейшие способы получения аминов и аминокислот. Биологически важные вещества: жиры, углеводы (моносахариды, дисахариды, полисахариды), белки |
| 14 | Характерные химические свойства углеводородов: алканов, циклоалканов, алкенов, диенов, алкинов, ароматических углеводородов (бензола и гомологов бензола, стирола). Важнейшие способы получения углеводородов. Ионный (правило В.В. Марковникова) и радикальные механизмы реакций в органической химии |
| 15 | Характерные химические свойства предельных одноатомных и многоатомных спиртов, фенола, альдегидов, карбоновых кислот, сложных эфиров. Важнейшие способы получения кислородсодержащих органических соединений |
| 16 | Взаимосвязь углеводородов, кислородсодержащих и азотсодержащих органических соединений |
| 17 | Классификация химических реакций в неорганической и органической химии |
| 18 | Скорость реакции, её зависимость от различных факторов |
| 19 | Реакции окислительно-восстановительные |
| 20 | Электролиз расплавов и растворов (солей, щелочей, кислот) |
| 21 | Гидролиз солей. Среда водных растворов: кислая, нейтральная, щелочная |
| 22 | Обратимые и необратимые химические реакции. Химическое равновесие. Смещение равновесия под действием различных факторов |
| 23 | Обратимые и необратимые химические реакции. Химическое равновесие. Расчёты количества вещества, массы вещества или объёма газов по известному количеству вещества, массе или объёму одного из участвующих в реакции веществ |
| 24 | Качественные реакции на неорганические вещества и ионы. Качественные реакции органических соединений |
| 25 | Правила работы в лаборатории. Лабораторная посуда и оборудование. Правила безопасности при работе с едкими, горючими и токсичными веществами, средствами бытовой химии. Научные методы исследования химических веществ и превращений. Методы разделения смесей и очистки веществ. Понятие о металлургии: общие способы получения металлов. Общие научные принципы химического производства (на примере промышленного получения аммиака, серной кислоты, метанола). Химическое загрязнение окружающей среды и его последствия. Природные источники углеводородов, их переработка. Высокомолекулярные соединения. Реакции полимеризации и поликонденсации. Полимеры. Пластмассы, волокна, каучуки |
| 26 | Расчёты с использованием понятий «растворимость», «массовая доля вещества в растворе» |
| 27 | Расчёты теплового эффекта (по термохимическим уравнениям) |
| 28 | Расчёты массы вещества или объёма газов по известному количеству вещества, массе или объёму одного из участвующих в реакции веществ. Расчёты массовой или объёмной доли выхода продукта реакции от теоретически возможного. Расчёты массовой доли (массы) химического соединения в смеси |
| 29 | Окислитель и восстановитель. Реакции окислительно-восстановительные
Задания 29 (ранее 30) из реального ЕГЭ по химии 2021 Задания 29 (ранее 30) из реального ЕГЭ по химии 2020 |
| 30 | Электролитическая диссоциация электролитов в водных растворах. Сильные и слабые электролиты. Реакции ионного обмена
Задания 30 (ранее 31) из реального ЕГЭ по химии 2021 Задания 30 (ранее 31) из реального ЕГЭ по химии 2020 |
| 31 | Тренажер задания 31 по химии железа
Тренажер задания 31 ЕГЭ по химии щелочных металлов Тренажер задания 31 ЕГЭ по химии щелочноземельных металлов Тренажер задания 31 по химии азота Тренажер задания 31 по химии алюминия Тренажер задания 31 по химии галогенов Тренажер задания 31 по химии марганца Тренажер задания 31 по химии меди Тренажер задания 31 по химии серы Тренажер задания 31 по химии углерода и кремния Тренажер задания 31 по химии цинка Тренажер задания 31 по химии хрома Задания 31 (ранее 32) из реального ЕГЭ по химии 2021 Задания 31 (ранее 32) из реального ЕГЭ по химии 2020 |
| 32 | Реакции, подтверждающие взаимосвязь органических соединений
Органические цепочки (задания 32, ранее 33) из реального ЕГЭ по химии 2021 Органические цепочки (задания 32, ранее 33) из реального ЕГЭ по химии 2020 |
| 33 | Расчёты с использованием понятий «растворимость», «массовая доля вещества в растворе». Расчёты массы (объёма, количества вещества) продуктов реакции, если одно из веществ дано в избытке (имеет примеси).Расчёты массы (объёма, количества вещества) продукта реакции, если одно из веществ дано в виде раствора с определённой массовой долей растворённого вещества.Расчёты массовой доли (массы) химического соединения в смесиРасчетные задачи по неорганике (задания 33, ранее 34) из реального ЕГЭ по химии 2021Расчетные задачи по неорганике (задания 33, ранее 34) из реального ЕГЭ по химии 2020 |
| 34 | Установление молекулярной и структурной формул вещества
Расчетные задачи, органическая химия (задания 34, ранее 35) из реального ЕГЭ по химии 2021 Расчетные задачи, органическая химия (задания 34, ранее 35) из реального ЕГЭ по химии 2020 |
16 февраля 2018
В закладки
Обсудить
Жалоба
Задания по органической химии
В сборнике представлено более 1000 заданий, которые охватывают ключевые темы органической химии, изучаемые в школе как на базовом, так и на профильном уровне.
organik.doc
ЗАДАЧИ по ОРГАНИЧЕСКОЙ ХИМИИ
-
При каталитической гидратации этилена в зависимости от условий реакции образуется этиловый спирт (выход 85%) или диэтиловый эфир (выход 2%). Напишите уравнение реакции и вычислите, какая масса указанных веществ образуется из 1 м3 этилена.
Решение:
1) Составляем уравнение реакции получения этилового спирта из этилена:
Vm, 1 = 22,4 м3/моль
V1 = 22,4 м3
М2 = 46 кг/моль
m2 = 46 кг
2) Находим массу этилового спирта, образовавшуюся из 1 м3 этилена:
— из 22,4 м3 этилена образуется 46 кг этилового спирта
— из 1 м3 этилена образуется х кг этилового спирта
х = 46/22,4 = 2,05 кг этилового спирта (теоретический выход).
3) Определяем практический выход этилового спирта:
2,05 кг этилового спирта соответствует 100%-ному выходу
х кг этилового спирта соответствует 85%-ному выходу
х = (2,05 · 85)/100 = 1,74 кг этилового спирта (практический выход).
4) Составляем уравнение реакции получения диэтилового эфира из этилена:
Vm, 1 = 22,4 м3/моль
V = 22,4 м3 · 2 = 44,8 м3
М2 = 74 кг/моль
m2 = 74 кг
5) Находим массу диэтилового эфира, образовавшуюся из 1 м3 этилена:
— из 44,8 м3 этилена образуется 74 кг диэтилового эфира
— их 1 м3 этилена образуется х кг диэтилового эфира
х = 74/44,8 = 1,65 кг диэтилового эфира (теоретический выход).
6) Определяем практический выход диэтилового эфира:
1,65 кг диэтилового эфира соответствуют 100%-ному выходу
х кг диэтилового эфира соответствует 2%-ному выходу
х = (1,65 · 2)/100 = 0,033 кг диэтилового эфира (практический выход).
Ответ: Из 1 м3 этилена можно получить, в зависимости от условий реакции, 1,74 кг этилового спирта и 0,033 кг диэтилового эфира.
-
Вычислить среднюю относительную молекулярную массу полипропилена, целлюлозы (хлопковой) и натурального каучука, если известно, что степень полимеризации их составляет 3000, 15000 и 2500 соответственно.
Решение:
1) Определяем относительную молекулярную массу элементарного звена:
а) полипропилена
Mr = 42;
б) целлюлозы (С6Н10О5)n, Mr = 162;
в) натурального каучука (С5Н8)n, Mr = 68.
2) Связь между средней относительной молекулярной массой полимера и степенью полимеризации выражается уравнением:
Mr (п.) = Mr (эл. зв.)n,
где
Mr (п.) — средняя относительная молекулярная масса полимера;
Mr (эл.зв.) — относительная молекулярная масса элементарного звена;
n — степень полимеризации полимера.
Исходя из этого уравнения вычисляем среднюю относительную молекулярную массу полимеров:
а) полипропилена:
Mr (п.) = 300 · 42 = 126000;
б) целлюлозы (хлопковой):
Mr (п.) = 15000 · 162 = 2430000;
в) натурального каучука:
Mr (п.) = 2500 · 68 = 170000.
Ответ: Средняя относительная молекулярная масса полипропилена, целлюлозы (хлопковой) и натурального каучука составляет 126000, 2430000 и 170000 соответственно.
-
Вычислить степень полимеризации полиэтилена низкого давления, крахмала и полиакрилонитрила (волокно нитрон), если их средняя относительная молекулярная масса равна 120400, 972000 и 59890 соответственно.
Решение:
1) Определяем относительную молекулярную массу элементарного звена полимеров:
а) полиэтилена (-СН-СН-)n — Mr = 28;
б) крахмала (С6Н10О5)n — Mr = 162;
в) полиакрилонитрила
2) Степень полимеризации связана со средней относительной молекулярной массой полимера уравнением:
Исходя из этого уравнения, вычисляем степень полимеризации полимеров:
а) полиэтилена:
n = 120400 : 28 = 4300;
б) крахмала:
n = 972000 : 162 = 6000;
в) полиакрилонитрила:
n = 59890 : 53 = 1130.
Ответ: Степень полимеризации полиэтилена низкого давления, крахмала и полиакрилонитрила составляет 4300, 6000 и 1130 соответственно.
-
Какие структурные формулы соответствуют соединениям состава С4Н6, если они легко присоединяют две молекулы брома, а одно из них не реагирует с аммиачным раствором серебра?
Решение:
Вещество состава С4Н6 соответствует общей формуле CnH2n−2, которая может принадлежать диеновым и ацетиленовым углеводородам. Диеновый углеводород СН2 = СН — СН = СН2 (1,3 — бутадиен), молекула которого содержит две двойные связи, может легко присоединять две молекулы брома и не взаимодействует с аммиачным раствором оксида серебра:
Молекулярная формула С4Н6 может также принадлежать двум изомерам ацетиленовых углеводородов:
(2-бутин)
и
(1-бутин).
Ацетиленовые углеводороды типа
не имеющие водорода при тройной связи, с аммиачным раствором оксида серебра не взаимодействуют. Значит, из двух изомеров 2-бутин не будет взаимодействовать с аммиачным раствором оксида серебра, но он легко присоединяет две молекулы брома:
1-бутин взаимодействует и с оксидом серебра, и с двумя молекулами брома.
Ответ: Молекулярная формула состава С4Н6 соответствует двум структурным формулам. Одна из них принадлежит диеновому углеводороду СН2 = СН — СН = СН2 (1,3 — бутадиену), а другая — ацетиленовому углеводороду
(2-бутину).
-
Каким будет содержание (массовая доля, %) формальдегида в растворе, если в 50 г воды растворить формальдегид, образовавшийся при окислении 0,5 моль метилового спирта?
Решение:
1) Составляем уравнение реакции получения формальдегида из метилового спирта:
v = 1 моль v = 1 моль
М1 = 32 г/моль М2 = 30 г/моль
m1 = 32 г m2 = 30 г
2) Определяем массу 0,5 моль метилового спирта:
m = 0,5 · 32 = 16 г.
3) Находим массу формальдегида, полученную при окислении 16 г метилового спирта:
— из 32 г метилового спирта образуется 30 г формальдегида
— из 16 г метилового спирта образуется х г формальдегида
х = (16 · 30) / 32 = 15 г формальдегида.
4) Находим массу раствора:
Растворённое вещество + растворитель = раствор,
15 г формальдегида + 50 г воды = 65 г раствора.
5) Определяем массовую долю (%) формальдегида в 65 г раствора:
— 65 г раствора содержит 15 г формальдегида
— 100 г раствора содержит х г формальдегида
х = (100 · 15) / 65 = 23 г, или 23%.
Ответ: Массовая доля формальдегида в растворе, полученном при окислении 0,5 моль метилового спирта, составляет 23%.
-
Термохимическое уравнение горения этана
С2Н6 + 31/2 О2 = 2СО2 + 3Н2О + 1559,38 кДж.
1. Сколько теплоты выделится, если сгорает этана:
а) 78,4 л; б) 45 г; в) 0,25 моль?
2. Какой объём и массу этана требуется сжечь, чтобы выделилось 389,97 кДж теплоты?
Решение:
1) Составляем термохимическое уравнение реакции горения этана:
С2Н6 + 31/2 О2 → 2СО2 + 3Н2О + 1559,38 кДж/моль
v = 1 моль
М = 30 г/моль
m = 30 г
Vm = 22,4 л/моль
V = 22,4 л
2) Находим, сколько теплоты выделится, если сгорит этана:
а) 78,4 л
1559,38 кДж теплоты выделяется при сжигании 22,4 л этана
х кДж теплоты выделяется при сжигании 78, 4 л этана
х = (78,4 · 1559,38) / 22,4 = 5457,83 кДж теплоты.
б) 45 г
1559,38 кДж теплоты выделяется при сжигании 30 г этана
х кДж теплоты выделяется при сжигании 45 г этана
х = (45 · 1559,38) / 30 = 2339,07 кДж теплоты.
в) 0,25 моль
1559,38 кДж теплоты выделяется при сжигании 1 моль этана
х кДж теплоты выделяется при сжигании 0,25 моль этана
х = (0,25 · 1559,38) / 1 = 389,85 кДж теплоты.
3) Определяем объём этана, который необходимо сжечь, чтобы выделилось 389,97 кДж теплоты:
1559,38 кДж теплоты выделяется при сжигании 22,4 л этана
389,97 кДж теплоты выделяется при сжигании х л этана
х = (22,4 · 389,97) / 1559,38 = 5,6 л этана.
4) Определяем, какую массу этана необходимо сжечь, чтобы выделилось 389,97 кДж теплоты:
1559,38 кДж теплоты выделяется при сжигании 30 г этана
389,97 кДж теплоты выделяется при сжигании х г этана
х = (30 · 389,97) / 1559,38 = 7,5 г этана.
Ответ: 1. При сжигании 78,4 л, 45 г и 0,25 моль этана выделилось соответственно 5457,83, 2339,07 и 389,85 кДж теплоты. 2. Для получения 389,97 кДж теплоты необходимо сжечь 5,6 л и 7,5 г этана.
-
Термохимическое уравнение реакции горения метана
СН4 + 2О2 = СО2 + 2Н2О + 890,31 кДж.
Какой объем метана вступил в реакцию с кислородом, если при этом выделилось 222,57 кДж?
Решение:
1) Составляем термохимическое уравнение реакции горения метана:
СН4 + 2О2 → СО2 + 2Н2О + 890,31 кДж/моль
Vm = 22,4 л/моль
V = 22,4 л
2) Определяем объем метана, который вступит в реакцию с кислородом, чтобы выделилось 222,57 кДж теплоты:
890,31 кДж теплоты выделяется при сжигании 22,4 л метана
222,57 кДж теплоты выделяется при сжигании х л метана
х = (222,57 · 22,4) / 890,31 = 5,6 л метана.
Ответ: Для выделения 222,57 кДж теплоты с кислородом должно вступить в реакцию 5,6 л метана.
-
Из 156 г ацетилена путем его полимеризации получили 0,5 моль бензола. Какую массовую долю (%) составляет полученная масса бензола от теоретического выхода?
Решение:
1) Составляем уравнение реакции получения бензола из ацетилена:
М1 = 26 г/моль М2 = 78 г/моль
m1 = 26 · 3 = 78 m2 = 78 г
2) Определяем массу 0,5 моль бензола:
m = 78 · 0,5 = 39 г.
3) Находим массу бензола, которую можно получить из 156 г ацетилена:
— из 78 г ацетилена можно получить 78 г бензола
— из 156 г ацетилена можно получить х г бензола
х = (156 · 78) / 78 = 156 г бензола (теоретический выход).
4) Определяем практический выход бензола:
156 г бензола соответствует 100%-ному выходу
39 г бензола соответствует х%-ному выходу
х = (39 · 100) / 156 = 25% (практический выход).
Ответ: Практический выход бензола составляет 25% от теоретического.
-
Какой объем и масса ацетилена потребуется для получения: а) 2 кг винилхлорида; б) 2 кг бензола; в) 2 кг уксусного альдегида?
Решение:
а) Получение из ацетилена 2 кг винилхлорида.
1) Составляем уравнение реакции:
М1 = 26 кг/моль М2 = 62,5 кг/моль
m1 = 26 кг m2 = 62,5 кг
Vm, 1 = 22,4 м3/моль
V1 = 22,4 м3
2) Находим массу ацетилена, необходимую для получения 2 кг винилхлорида:
— для получения 62,5 кг винилхлорида необходимо 26 кг ацетилена
— для получения 2 кг винилхлорида необходимо х кг ацетилена
х = (26 · 2) / 62,5 = 0,832 кг ацетилена.
3) Определяем объем ацетилена, необходимый для получения 2 кг винилхлорида:
— 62,5 кг винилхлорида получают из 22,4 м3 ацетилена
— 2 кг винилхлорида получают из х м3 ацетилена
х = (22,4 · 2) / 62,5 = 0,72 м3 ацетилена.
Ответ: Для получения 2 кг винилхлорида необходимо 0,832 кг или 0,72 м3 ацетилена.
б) Получение из ацетилена 2 кг бензола.
1) Составляем уравнение реакции:
М1 = 26 кг/моль М2 = 78 кг/моль
m1 = 26 · 3 = 78 кг m2 = 78 кг
Vm, 1 = 22,4 м3/моль
V1 = 22,4 · 3 = 67,2 м3
2) Находим массу ацетилена, необходимую для получения 2 кг бензола:
— для получения 78 кг бензола необходимо взять 78 кг ацетилена
— для получения 2 кг бензола необходимо взять х кг ацетилена
х = (2 · 78) / 78 = 2 кг ацетилена.
3) Определяем объем ацетилена, необходимый для получения 2 кг бензола:
— для получения 78 кг бензола необходимо взять 67,2 м3 ацетилена
— для получения 2 кг бензола необходимо взять х м3 ацетилена
х = (2 · 67,2) / 78 = 1,72 м3 ацетилена.
Ответ: Для получения 2 кг бензола нужно взять 2 кг или 1,72 м3 ацетилена.
в) Получение из ацетилена 2 кг уксусного альдегида.
1) Составляем уравнение реакции:
М1 = 26 кг/моль М2 = 44 кг/моль
m1 = 26 кг m2 = 44 кг
Vm, 1 = 22,4 м3/моль
V1 = 22,4 м3
2) Находим массу ацетилена, необходимую для получения 2 кг уксусного альдегида:
— 44 кг уксусного альдегида получают из 26 кг ацетилена
— 2 кг уксусного альдегида получают из х кг ацетилена
х = (2 · 26) / 44 = 1,18 кг ацетилена.
3) Определяем объем ацетилена, необходимый для получения 2 кг уксусного альдегида:
— 44 кг уксусного альдегида получают из 22,4 м3 ацетилена
— 2 кг уксусного альдегида получают из х м3 ацетилена
х = (2 · 22,4) / 44 = 1,02 м3 ацетилена.
Ответ: Для получения 2 кг уксусного альдегида необходимо взять 1,18 кг или 1,02 м3 ацетилена.
-
Какой объем этилового спирта (плотность 0,8 г/см3) с массовой долей 96% потребуется для получения 180 кг 1,3 — бутадиена?
Решение:
1) Составляем уравнение реакции получения 1,3 — бутадиена из этилового спирта:
М1 = 46 кг/моль М2 = 54 кг/моль
m1 = 46 · 2 = 92 кг m2 = 54 кг
2) Находим массу этилового спирта с массовой долей 100%, необходимую для получения 180 кг 1,3 — бутадиена:
— 54 кг 1,3 — бутадиена получают из 92 кг спирта
— 180 кг 1,3 — бутадиена получают из х кг спирта
х = (180 · 92) / 54 = 306,67 кг 100%-ного этилового спирта.
3) Определяем массу этилового спирта с массовой долей 96%, необходимую для получения 180 кг 1,3 — бутадиена:
— в 100 кг 96%-ного спирта содержится 96 кг спирта
— в х кг 96%-ного спирта содержится 306,67 кг спирта
х = (306,67 · 100) / 96 = 319,45 кг этилового спирта.
4) Находим объем 319,45 кг этилового спирта (ρ = 0,8 г/см3):
V = 319,45 / 0,8 = 399,31 л этилового спирта.
Ответ: Для получения 180 кг 1,3 — бутадиена необходимо взять 399,31 л этилового спирта.
-
Как экспериментально можно доказать, что угольная кислота более сильная кислота, чем фенол? Составьте уравнения реакций.
Решение:
Если пропускать углекислый газ в прозрачный раствор фенолята натрия, то постепенно выделится фенол:
Этот опыт подтверждает, что угольная кислота обладает более сильными кислотными свойствами, чем фенол.
-
Температура кипения этана −88,6°С, этилового спирта +78,3°С, ацетальдегида +20,8°С, уксусной кислоты +118,7°С. Дайте характеристику веществ на основании этих данных.
Решение:
Из четырех предложенных веществ:
этана С2Н6
этилового спирта СН3СН2ОН
ацетальдегида
и уксусной кислоты
лишь два вещества — этиловый спирт и уксусная кислота имеют в своем составе гидроксильную группу, которая определяет образование водородных связей.
-
Почему в карбоксильной группе ни одна из связей углерод — кислород не имеет карбонильного характера? Ответ обоснуйте.
Решение:
Карбонильная группа С=О в альдегидах сильно поляризована за счет сдвига электронной плотности п-связи от атома углерода к атому кислорода. В результате на атоме углерода возникает значительный положительный заряд, который влияет на реакционную способность карбонильной группы: чем выше заряд, тем больше скорость протекания реакций присоединения.
В карбоксильной группе ни одна из связей — ни С=О, ни С-О — не имеет карбонильного характера. Это объясняется тем, что положительный заряд на атоме углерода в связи С=О, образовавшийся за счет кислорода карбонильной группы, возмещается вследствие притягивания электронов атома кислорода гидроксильной группы. В результате этот сдвиг электронов частично нейтрализует положительный заряд на атоме углерода и реакционная способность карбонильной группы затруднена: двойная связь становится устойчивее, поэтому реакции присоединения по месту связи С=О проходят в более жестких условиях по сравнению с альдегидами.
В карбоксиле гидроксильная группа связана не с углеводородным радикалом, как в спиртах, а с карбонильной группой и под ее влиянием связь между атомами кислорода и водорода ослабляется, подвижность атома водорода увеличивается, поэтому он способен отщепляться в виде протона. За счет разрыва связи С-О в реакцию может вступить вся гидроксильная группа — ОН. Например, замещение гидроксила в кислоте остатком спирта приводит к образованию сложных эфиров.
-
Почему группа карбоксила легче отщепляет водород, чем гидроксильная группа спиртов? Ответ обоснуйте.
Решение:
Кислотные свойства веществ проявляются в способности водорода отщепляться в виде протона Н+ и замещаться на металл. Такие свойства имеются у карбоновых кислот, содержащих карбоксильную функциональную группу
и у спиртов, содержащих гидроксильную функциональную группу — ОН. Мерой кислотности является степень диссоциации.
В гидроксильной группе спиртов связь О-Н полярна. Атом кислорода из-за смещённой к нему электронной плотности связи О-Н имеет частичный отрицательный заряд. Атом водорода вследствие смещения электронной плотности к кислороду имеет частичный положительный заряд. Он приобретает небольшую подвижность и замещается атомами щелочных металлов (натрием, калием и др.). На активность атома водорода влияют предельные углеводородные радикалы. Они отталкивают от себя электронную плотность, увеличивая отрицательный заряд на атоме кислорода. Это приводит к упрочнению связи О-Н и, соответственно, к снижению легкости отщепления водорода. Одноатомные спирты, хотя и имеют в своем составе гидроксильную группу, не проявляют ни кислотных, ни основных свойств, т.е. они практически нейтральные вещества. Спирты не изменяют окраску индикаторов, не диссоциируют на ионы в растворах и не проводят электрический ток.
В карбоновых кислотах, в отличие от спиртов, гидроксильная группа ОН входит в состав карбоксила
содержащего еще карбонильную группу
которая сильно поляризована. Под влиянием атома углерода этой группы, имеющего частичный положительный заряд, усиливается поляризация связи О-Н. Это приводит к сильному смещению электронной плотности от атома водорода к атому кислорода, и водород легко отщепляется в виде протона. Карбоновые кислоты проявляют кислотные свойства, и они выражены сильнее, чем у спиртов.
Таким образом, гидроксильная группа в карбоксиле кислот находится под влиянием карбонильной группы атомов
где кислород имеет частичный отрицательный заряд, а гидроксильная группа спиртов испытывает влияние углеводородных радикалов (нейтральных), поэтому карбоксильная группа кислот легче отщепляет водород по сравнению с гидроксильной группой спиртов. В результате спирты являются нейтральными веществами, а кислоты имеют ярко выраженный кислотный характер.
-
Назовите природное сырьё для получения метилового спирта. Ответ иллюстрируйте уравнениями реакций.
Решение:
Сырьем для получения метилового спирта являются древесина и метан.
Основными способами получения метилового спирта являются следующие:
1. Сухая перегонка древесины. Метиловый спирт содержится в водном слое (1 — 2%).
2. Синтез из СО и Н2 (синтез-газ), образующегося в результате конверсии метана водяным паром:
3. Неполное окисление метана:
-
Приведите схему получения поливинилхлорида из неорганических веществ.
Решение:
Углерод → карбид кальция → ацетилен → винилхлорид → поливинилхлорид.
3С + СаО → СаС2 (карбид кальция) + СО
-
Приведите схему получения поливинилхлорида из неорганических веществ.
Решение:
Углерод → карбид кальция → ацетилен → винилхлорид → поливинилхлорид.
3С + СаО → СаС2 (карбид кальция) + СО
-
Приведите схемы получения полистирола из метана и 1,6-дихлоргексана.
Решение:
а) Метан → ацетилен → бензол → этилбензол → стирол → полистирол.
б) 1,6 — дихлоргексан → циклогексан → бензол → этилбензол → стирол → полистирол.
Далее смотрите уравнения реакций выше (п. а).
-
Опишите строение и свойства адипиновой кислоты. Для получения какого волокна она используется?
Решение:
Адипиновая кислота как исходный материал используется для получения полиамидного волокна — анида (найлон).
Адипиновая кислота НООС-(СН2)4-СООН — двухосновная (дикарбоновая) кислота, белое кристаллическое вещество, температура плавления 153°С, растворяется в горячей воде, возгоняется.
Адипиновая кислота с гексаметилендиамином NH2(CH2)6NH2 в метаноле при 275 — 280°С в атмосфере азота образует соль АГ (гексаметилендиаминадипат), которая является сырьем для получения волокна анид (найлон).
-
Для какого вида технического волокна вискозные и полиакрилонитрильные волокна являются сырьем? Назовите свойства и области применения этого волокна.
Решение:
Вискозные и полиакрилонитрильные волокна используются как сырье для получения углеродного волокна. Эти волокна сначала подготавливают к обработке (удаляют замасливатели, вводят вещества, способствующие образованию графитоподобных структур). Затем следуют две стадии термообработки при температурах 1500 — 3000°С в инертной среде азота или аргона. В результате получают углеродный остаток волокнистой формы, который потом (на второй стадии) переходит в графитоподобные плотные структуры волокна. В процессе обработки волокно подвергается вытяжке, необходимой для повышения прочности.
Углеродные волокна по сочетанию показателей прочности, плотности и термостойкости превосходят все известные волокна. Они также являются хорошими проводниками электричества. Их отличает очень высокая химическая стойкость. Сейчас из углеродного волокна делают различные нагревательные элементы, фильтры, защитную одежду и углепластики. Без современных углепластиков невозможны были бы достижения в теннисе, велосипедном и водных видах спорта. Ракетки, весла, колеса и рамы, мачты и лыжные палки, удочки и многие другие изделия из углепластиков быстро вытесняют изделия из традиционных материалов.
Применение углеродного волокна в качестве упрочняющего компонента конструкционных пластиков и создание из них углерод-углеродных композиционных материалов являются самыми перспективными направлениями. Это основа современной авиации и ракетостроения.
-
Опишите свойства полипропиленового волокна и назовите области его применения.
Решение:
Для получения полипропиленового волокна используется стереорегулярный полипропилен, который доступен и сравнительно дешев. Он может быть переработан в волокно высокопроизводительным способом прядения из расплава.
Сочетание высокой химической стойкости, прочности и теплостойкости с эластичностью делает полипропиленовое волокно сравнимым с капроновым. Оно отлично работает на многократный изгиб, но хуже, чем капроновое, на истирание. Из-за своей химической инертности полипропиленовое волокно практически не окрашивается обычными красителями. Для повышения светостойкости и снижения термоокислительной деструкции в полимер вводят стабилизаторы.
Кроме мононитей и штапельного волокна, из полипропилена делают пленочные волокна. Их получают из ориентированной пленки путем ее расщепления и кручения. Это особый вид объемных волокон, применяемых в упаковочных материалах (ткани, жгуты).
Наибольшее применение полипропиленовые волокна находят в производстве нетонущих канатов, сетей, технических тканей типа брезента. Незаменимо полипропиленовое штапельное волокно при производстве ковров. В сочетании с другими волокнами из него делают пледы, одеяла, ткани для верхней одежды.
-
Какие полимеры и почему используются для изготовления желобов пластификационной ванны центрифугальной прядильной машины?
Решение:
В пластификационной ванне должен находиться раствор серной кислоты и различных солей при температуре 90°С. Подавляющее большинство традиционных материалов не в состоянии обеспечить длительную работоспособность ванны. Даже значительная часть известных полимерных материалов непригодна для работы в столь жестких условиях эксплуатации.
При выборе полимеров для желобов пластификационной ванны следует учитывать их химическую стойкость при повышенных температурах, доступность самого материала, его стоимость. Этим требованиям отвечают такие полимерные материалы, как непластифицированный поливинилхлорид, пентапласт и фторопласт. Поливинилхлорид химически стоек, термопластичен, доступен, дешев, достаточно надежно склеивается и сваривается. Но даже он в таких условиях при длительной эксплуатации теряет прочность. Пентапласт — термопластичный полимер, по физико-механическим свойствам похожий на полипропилен, но превосходящий по химической стойкости поливинилхлорид.
Наиболее долговечным и стойким к условиям эксплуатации пластификационной ванны является фторопласт. Исключительная химическая стойкость и долговечность в сочетании с механической прочностью даже при высоких температурах делают фторопластовую футеровку наиболее надежной. Есть трудности со сваркой и склеиванием фторопласта, но, применяя порошковое напыление, можно получить футеровку высокого качества. Применение фторопласта сдерживается только малым количеством выпускаемого полимера и его высокой ценой.
-
При переработке поливинилхлорида из-за близких значений температуры плавления и температуры разложения материала происходит частичная его деструкция с выделением хлороводорода. Выделяющийся хлороводород поглощает 20 г воды. Считая, что в полученном растворе соляной кислоты предельная массовая доля хлороводорода 37%, рассчитать, какой объем хлороводорода нужно пропустить через эту воду.
Решение:
1) Вычисляем массу воды, содержащуюся в растворе с массовой долей HCl 37%:
100 г раствора — 37 г хлороводорода = 63 г воды.
2) Находим массу хлороводорода, содержащуюся в 20 г воды:
— 63 г воды поглощает 37 г хлороводорода
— 20 г воды поглощает х г хлороводорода
х = (20 · 37) / 63 = 11,75 г хлороводорода.
3) Находим объем 11,75 г хлороводорода (HCl: М = 36,5 г/моль; m = 36,5 г; v = 1 моль; Vm = 22,4 л/моль; V = 22,4 л):
— 36,5 г хлороводорода занимает объем 22,4 л
— 11,75 г хлороводорода занимает объем х л
х = (11,75 · 22,4) / 36,5 = 7,21 л хлороводорода.
Ответ: Через 20 г воды необходимо пропустить 7,21 л хлороводорода.
-
Напишите уравнения реакций и назовите продукты, образующиеся при взаимодействии бромоводорода с пропиленом, метилацетиленом, 1,3-бутадиеном, стиролом, этиловым спиртом, метиламином и анилином.
Решение:
-
В чем сущность процесса мерсеризации целлюлозы? Какие химические реакции протекают при этом?
Решение:
Одним из первых процессов получения вискозы из целлюлозы является мерсеризация. Она проводится с целью получения щелочной целлюлозы. Для этого исходную целлюлозу обрабатывают водным раствором едкого натра NaOH в аппаратах периодического или непрерывного действия. При мерсеризации происходит сильное набухание целлюлозы в концентрированной щелочи, растворение ее низкомолекулярных полисахаридов (гемицеллюлозы), которые ухудшают качество ксантогената и готового волокна, а также образование совершенно нового вещества — щелочной целлюлозы. Химические изменения заключаются в протекании реакций с одновременным образованием алкоголятов клетчатки и молекулярного соединения целлюлозы и гидроксида натрия:
В процессе мерсеризации происходит некоторое уменьшение молекулярной массы целлюлозы вследствие окислительной деструкции за счет кислорода воздуха в присутствии щелочи.
После окончания процесса мерсеризации щелочную целлюлозу отжимают от избытка щелочного раствора и отправляют на измельчение. Измельченная щелочная (мерсеризованная) целлюлоза представляет собой пушистую белую массу.
-
Можно ли по структуре молекул определить вид связи? Дайте обоснованный ответ.
Решение:
Взаимосвязь между структурой молекул и типами химической связи позволяет прогнозировать по структуре молекул вид связи. Так, если молекула имеет тетраэдрическую конфигурацию, то можно с уверенностью утверждать, что между атомами углерода в ней имеются σ-связи. Молекула с плоской, тригональной конфигурацией имеет между атомами углерода двойную связь, с линейной конфигурацией — тройную связь, а с плоской циклической конфигурацией — ароматическую связь.
Эта взаимосвязь между структурой молекулы и видом связи основывается на различном валентном состоянии атома углерода. В предельных углеводородах в состоянии sp3 — гибридизации атомы углерода все четыре гибридных орбитали затрачивают на образование σ-связей и молекула приобретает тетраэдрическую форму. Атомы углерода в этиленовых углеводородах в состоянии sp2 — гибридизации тратят лишь три гибридных орбитали на образование σ-связей, которые располагаются в плоскости треугольника, а негибридизованная р — орбиталь идет на установление второй п-связи. Сочетание σ- и п-связи составляет двойную связь, а молекула приобретает плоскую треугольную форму. В ароматических углеводородах, где атомы углерода также находятся в состоянии sp2 — гибридизации, каждый атом углерода затрачивает по три гибридных орбитали на установление σ-связей между атомами углерода в бензольном кольце. Все σ-связи располагаются в одной плоскости, образуя правильный шестиугольник. Шесть негибридизованных р — орбиталей образуют единое п-электронное облако. Такая связь называется ароматической, а молекула имеет плоскую циклическую форму.
В состоянии sp — гибридизации — в ацетиленовых углеводородах — атомы углерода тратят лишь две гибридных орбитали на образование σ-связей, которые располагаются по одной линии. Две негибридизованных р — орбитали идут на установление двух п-связей. Сочетание одной σ- и двух п-связей приводит к образованию тройной связи, а молекула приобретает линейную форму.
-
Какие свойства характерны для изделий из пластических масс? Ответ иллюстрируйте примерами.
Ответ:
Наиболее важные и характерные свойства для изделий из пластмасс следующие:
— механическая прочность (поликарбонат, полиметилметакрилат, стеклотекстолит и др.);
— низкая плотность (полиэтилен, полипропилен, полиуретан и др.);
— легкость (пенополиэтилен, пенополиуретан, пенополистирол и др.);
— электроизоляционные свойства (поливинилхлорид, полиэтилен и др.);
— электрическая проводимость (углепластик);
— химическая устойчивость к агрессивным средам (поливинилхлорид, фторопласт, полиэтилен и др.);
— водостойкость (полиэтилен, полипропилен, фторопласт и др.);
— хорошая прозрачность (полиметилакрилат, поликарбонат, полистирол и др.);
— негорючесть (поливинилхлорид, фторопласт и др.);
— тепло- и холодостойкость (стеклотекстолит, полиимид, фторопласт и др.);
— низкий коэффициент теплопроводности (полипропилен, полистирол и др.);
— высокие адгезионные свойства (перхлорвинил, эпоксидная смола, полиуретан и др.);
— нетоксичность (фторопласт, поликарбонат и др.);
— биостойкость (фторопласт, полиметилакрилат и др.).
-
В чем особенности процесса формования кордной вискозной нити?
Решение:
Характерной особенностью получения вискозного кордного волокна является вытягивание свежесформированной вискозной нити в горячей воде с небольшим количеством серной кислоты с целью его упрочнения. Вискозный корд более прочен, чем хлопковый, поэтому он его усиленно заменяет в изделиях. Кордные нити производят на специальных машинах непрерывного действия, в которых одновременно происходит формование, промывка, замасливание, сушка и кручение волокна. Но затем нити дополнительно скручивают. Сначала скручивается одна нить, а затем две или три в обратном направлении. Этим достигается, при некоторой потере прочности, большая эластичность и стойкость корда к динамическим нагрузкам. В связи с тем что корд должен иметь большую по сравнению с текстильными нитями прочность и теплостойкость, для его производства пригодны только специальные сорта целлюлозы. А использование определенных составов ванн и модификаторов позволяет получать волокно высокого качества. Выносливость изделий из корда и резины зависит не только от их конструкции, свойств корда и резины, но и от прочности связи между кордом и резиной (адгезии). Кордное волокно используется и в виде специальных тканей.
|
Тест «Алканы 2.0» |
|
|
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 |
|
|
Цепочки «Алканы» |
|
|
1 2 3 4 5 6 7 8 9 10 |
|
|
Тест «Алкены 2.0» |
|
|
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 62 63 64 65 66 67 68 69 70 71 72 73 74 75 76 77 78 79 |
|
|
Цепочки «Алкены» |
|
|
1 2 3 4 5 6 7 8 9 10 |
|
|
Тест «Циклы и алкадиены» |
|
|
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 |
|
|
Цепочки «Циклы и алкадиены» |
|
|
1 2 3 4 5 6 7 8 9 10 |
|
|
Тест «Алкины» |
|
|
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 |
|
|
Сложные эфиры |
|
|
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 |
|
|
Цепочки «Сложные эфиры» |
|
|
1 2 3 4 5 |
|
|
Цепочки «Алкины» |
|
|
1 2 3 4 5 6 7 8 9 10 |
|
|
Тест «Арены 2.0» |
|
|
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 |
|
|
Цепочки «Арены» |
|
|
1 2 3 4 5 6 7 8 9 10 |
|
|
Тест «Спирты и фенолы» |
|
|
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 |
|
|
Цепочки «Спирты и фенолы» |
|
|
1 2 3 4 5 6 7 8 9 10 |
|
|
Цепочки «Альдегиды и кетоны» |
|
|
1 2 3 4 5 6 7 8 9 10 |
|
|
Цепочки «Карбоновые кислоты» |
|
|
1 2 3 4 5 6 7 8 9 10 11 12 13 |
|
|
Карточки с похожими реакциями |
|
|
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 |
|
|
Задание №10 ЕГЭ. Номенклатура и классификация органических веществ. |
|
|
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 62 63 64 65 66 67 68 69 70 |
|
|
Задание №11 ЕГЭ. Строение органических веществ. Изомеры и гомологи. |
|
|
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 |
|
|
Задание №12. Свойства углеводородов и кислородсодержащих веществ |
|
|
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 |
|
|
Задание №13 ЕГЭ. Азотсодержащие вещества, углеводы, жиры |
|
|
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 62 63 64 65 |
|
|
Задание №14 ЕГЭ. Свойства углеводородов |
|
|
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 |
|
|
Задание №33 ЕГЭ. Вывод формулы органического вещества |
|
|
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 |
|
|
Свойства и способы получения углеводородов |
|
|
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 62 63 64 65 66 67 68 69 70 |
|
|
Свойства и способы получения кислородсодержащих органических веществ |
|
|
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 |
|