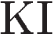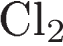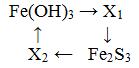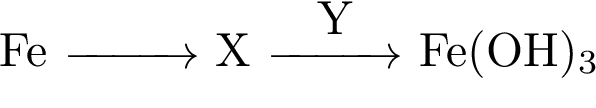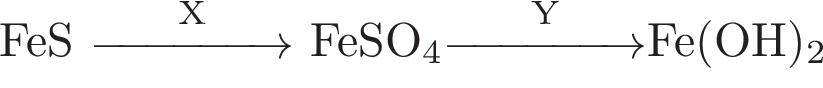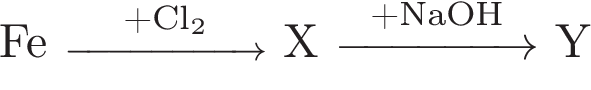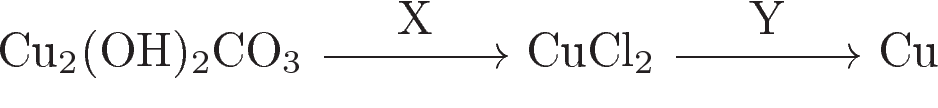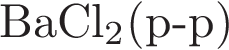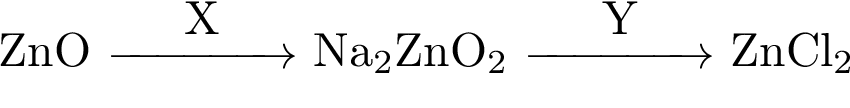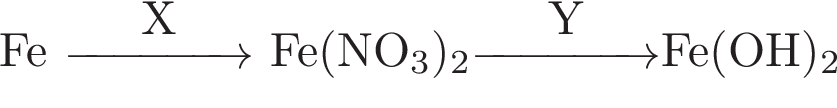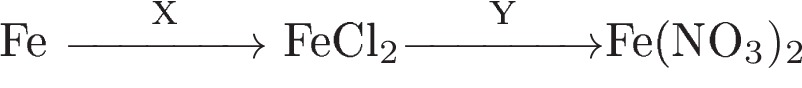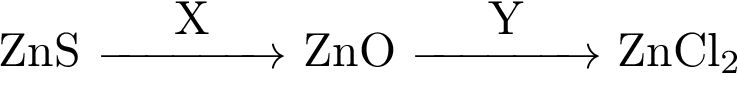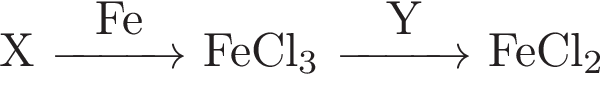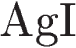Аннотация:
В работе представлен теоретический материал для подготовки выполнения задания С2, Даны уравнения реакций, характеризующие химические свойства металлов, неметаллов и их соединений. Материал сгруппирован по темам: металлы I, II, III А групп, железо, марганец, хром, медь, цинк; неметалыы IV, V, VI, VII А групп. А также даны варианты заданий С2 с ответами. Материал может быть использован на уроках химии в 9, 11 кл. и при подготовке к ЕГЭ.
Целевая аудитория: для 11 класса
Автор: Солдатова Татьяна Михайловна
Место работы: МБОУ лицей №1 г. Волжский
Добавил: солдатова
Уважаемые коллеги! Автор ждёт Ваши отзывы! Оставьте своё мнение о разработке!
Всего комментариев: 2
Порядок вывода комментариев:

Физкультминутки
Физкультминутки обеспечивают кратковременный отдых детей на уроке, а также способствуют переключению внимания с одного вида деятельности на другой.

В помощь учителю
Уважаемые коллеги! Добавьте свою презентацию на Учительский портал и получите бесплатное свидетельство о публикации методического материала в международном СМИ.
Для добавления презентации на портал необходимо зарегистрироваться.
Конкурсы
Диплом и справка о публикации каждому участнику!
© 2007 — 2023 Сообщество учителей-предметников «Учительский портал»
Свидетельство о регистрации СМИ: Эл № ФС77-64383 выдано 31.12.2015 г. Роскомнадзором.
Территория распространения: Российская Федерация, зарубежные страны.
Учредитель / главный редактор: Никитенко Е.И.
Сайт является информационным посредником и предоставляет возможность пользователям размещать свои материалы на его страницах.
Публикуя материалы на сайте, пользователи берут на себя всю ответственность за содержание этих материалов и разрешение любых спорных вопросов с третьими лицами.
При этом администрация сайта готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием сайта.
Если вы обнаружили, что на сайте незаконно используются материалы, сообщите администратору через форму обратной связи — материалы будут удалены.
Все материалы, размещенные на сайте, созданы пользователями сайта и представлены исключительно в ознакомительных целях. Использование материалов сайта возможно только с разрешения администрации портала.
Фотографии предоставлены
7560. Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) Cr(OH)3 + H2SO4 →
Б) Cr(OH)3 + NaOH → (р-р)
В) Cr(OH)3 + NaOH → (t°, сплав.)
Г) Cr(OH)3 → (t°)
ПРОДУКТЫ ВЗАИМОДЕЙСТВИЯ
1) Cr2(SO4)3 и H2O
2) Cr2O3 и H2O
3) NaCrO2 и H2
4) NaCrO2 и H2O
5) Na3[Cr(OH)6]
6) Cr2(SO4)3 и H2

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7560.
7000. Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) Fe2O3 и HI
Б) Fe и I2
В) Fe и HI
Г) FeO и HI
ПРОДУКТ(-Ы) РЕАКЦИИ
1) FeI2
2) FeI3
3) FeI2 и H2
4) FeI2 и H2O
5) FeI3 и H2O
6) FeI2, I2 и H2O

Верный ответ: 6134
В первой реакции в продуктах получается FeI2 и I2, так как FeI3 в водной среде сразу распадается до указанных продуктов (найдите FeI3 в таблице растворимости и убедитесь, что не существует/разлагается водой).
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7000.
6965. Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) Cr(OH)3 и NaOH(распл.)
Б) Cr(OH)3 и H2S
В) Cr2O3, NaOH(р-р) и O2
Г) Cr2O3 и NaOH(распл.)
ПРОДУКТЫ РЕАКЦИИ
1) NaCrO2 и H2O
2) Na3[Cr(OH)6]
3) NaCrO2 и H2
4) Cr2S3 и H2
5) Na2CrO4 + H2O
6) реакция невозможна

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 6965.
6790. Установите соответствие между реагирующими веществами и продуктами их взаимодействия: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) Cu(NO3)2 → (t°)
Б) Cu2O + HNO3(конц.) → (t°)
В) Cu(OH)2 + HNO3(конц.) →
Г) Cu + HNO3(разб.) →
ПРОДУКТЫ РЕАКЦИИ
1) Cu(NO3)2 + NO2 + H2O
2) Cu(NO3)2 + H2O
3) Cu + NO2 + O2
4) CuO + NO2 + O2
5) Cu(NO3)2 + NO + H2O

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 6790.
6755. Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
1) Cr2O3 и HCl(конц.)
2) Cr и Cl2
3) Cr и HCl(конц.)
4) Cr и HCl(г)
ПРОДУКТ(-Ы) РЕАКЦИИ
1) CrCl2
2) CrCl3
3) CrCl2 и H2O
4) CrCl3 и H2O
5) CrCl3 и H2
6) CrCl2 и H2

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 6755.
Для вас приятно генерировать тесты, создавайте их почаще
Всего: 21 1–20 | 21–21
Добавить в вариант
Верны ли следующие суждения о соединениях хрома?
А Высшая степень окисления хрома равна +4.
Б. Высший оксид хрома относится к основным оксидам.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
Верны ли следующие суждения о соединениях хрома?
А. Высшая степень окисления хрома равна +3.
Б. Высший оксид хрома проявляет амфотерные свойства.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
Задания Д2 № 534
Верны ли следующие суждения о хроме и его соединениях?
А. Степень окисления хрома в высшем оксиде равна +3.
Б. С увеличением степени окисления хрома кислотные свойства его оксидов усиливаются.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
Верны ли следующие утверждения о хроме и его соединениях?
А. Все оксиды хрома имеют кислотный характер.
Б. Высшая степень окисления хрома в соединениях равна +6.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
Задания Д6 № 367
Верны ли следующие суждения о свойствах железа?
А. При взаимодействии железа с разбавленной хлороводородной кислотой образуется
хлорид железа (II).
Б. При взаимодействии железа с хлором образуется хлорид железа (II).
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
Верны ли следующие утверждения о d-металлах?
А. Все соединения d-металлов имеют амфотерный характер.
Б. d-металлы в низших степенях окисления входят в состав катионов, а в высших степенях окисления — в состав анионов.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
Общее свойство железа и меди —
1) растворяются в кислотах-неокислителях с выделением водорода
2) вытесняют серебро из растворов его солей
3) низший оксид и гидроксид обладают амфотерными свойствами
4) растворяются в щелочах
Задания Д2 № 663
Верны ли следующие суждения о хроме и железе?
А. И хром, и железо образуют устойчивые оксиды в степени окисления +3.
Б. Оксид хрома (III) является амфотерным.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
Верны ли следующие утверждения о цинке и его соединениях?
А. Оксид и гидроксид цинка проявляют амфотерные свойства.
Б. Соединения цинка в высшей степени окисления являются сильными окислителями.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную
цифрой.
Запишите в таблицу выбранные цифры под соответствующими буквами.
Установите соответствие между исходными веществами, вступающими в реакцию, и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Запишите в таблицу выбранные цифры под соответствующими буквами.
Задания Д6 № 410
Верны ли следующие суждения о меди и ее соединениях?
А. Степень окисления меди в высшем оксиде равна +1.
Б. Медь вытесняет алюминий из раствора нитрата алюминия.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Запишите в таблицу выбранные цифры под соответствующими буквами.
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную
цифрой.
Запишите в таблицу выбранные цифры под соответствующими буквами.
Задания Д2 № 276
Верны ли следующие суждения о железе и его соединениях?
А. Железо в соединениях проявляет только степень окисления, равную +2.
Б. Металлическое железо проявляет восстановительные свойства.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
Верны ли следующие суждения о железе и меди?
А. Гидроксид железа (II) не относится к щелочам.
Б. Устойчивая степень окисления для меди равна +2.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
В двух пробирках находился свежеосаждённый гидроксид меди(II). В первую пробирку добавили раствор вещества Х, а во вторую — раствор вещества Y. В обеих пробирках осадок полностью растворился, причём в первой пробирке образовался голубой раствор, а во второй — сине-фиолетовый. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанные реакции.
1)
2)
3)
4)
5)
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
В двух пробирках находился оксид меди(II). В первую пробирку добавили раствор вещества Х, а во вторую — избыток концентрированного раствора вещества Y. В обеих пробирках осадок полностью растворился. В первой пробирке раствор приобрёл голубой цвет, а во второй — зелёный. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанные реакции.
1)
2)
3)
4)
5)
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
В двух колбах находился раствор карбоната калия. В первую колбу добавили раствор вещества Х, а во вторую — раствор вещества Y. В обеих колбах выпал осадок, но в первой колбе также выделился газ. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанные реакции.
1)
2)
3)
4)
5)
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
Задания Д2 № 706
Верны ли следующие суждения о соединениях железа и меди?
А. Гидроксид железа (III) проявляет амфотерные свойства.
Б. Устойчивая степень окисления для меди равна +2.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
Всего: 21 1–20 | 21–21
Тренажер задания 31 из ЕГЭ по химии щелочноземельных металлов, задачи на неорганическую химию (мысленный эксперимент) из экзамена ЕГЭ по химии, задания 31 по химии щелочноземельных металлов с текстовыми решениями и ответами.
1. К нерастворимой в воде соли белого цвета, которая встречается в природе в виде широко используемого в строительстве и архитектуре минерала, прилили раствор соляной кислоты, в результате соль растворилась, и выделился газ, при пропускании которого через известковую воду выпал осадок белого цвета; осадок растворился при дальнейшем пропускании газа. При кипячении полученного раствора выпадает осадок. Напишите уравнения описанных реакций.
СаСО3 + 2HCl = CaCl2 + CO2↑ + H2O
Ca(OH)2 + CO2 = CaCO3↓ + H2O
CaCO3 + CO2 + H2O = Ca(HCO3)2
2. Кальций растворили в воде. При пропускании через полученный раствор сернистого газа образуется осадок белого цвета, который растворяется при пропускании избытка газа. Добавление к полученному раствору щелочи приводит к образованию осадка белого цвета. Напишите уравнения описанных реакций.
Ca + 2H2O = Ca(OH)2 + H2↑
Ca(OH)2 + SO2 = CaSO3↓ + H2O
CaSO3 + SO2 + H2O = Ca(HSO3)2
Ca(HSO3)2 + Ca(OH)2 = 2CaSO3↓ + 2H2O
3. Раствор, полученный при пропускании сернистого газа через бромную воду, нейтрализовали гидроксидом бария. Выпавший осадок отделили, смешали с коксом и прокалили. При обработке продукта прокаливания хлороводородной кислотой выделился газ с запахом тухлых яиц. Напишите уравнения описанных реакций.
SO2 + Br2 + 2H2O = 2HBr + H2SO4
H2SO4 + Ba(OH)2 = BaSO4↓ + 2H2O
BaS + 2HCl = ВaCl2 + H2S↑
4. Кальций нагрели в атмосфере водорода. Продукт реакции обработали водой, выделяющийся газ пропустили над нагретым оксидом цинка, а в раствор добавили кальцинированную соду. Напишите уравнения описанных реакций.
СаH2 + 2H2O = Ca(OH)2 + H2↑
Ca(OH)2 + Na2CO3 = CaCO3↓ + 2NaOH
5. Через баритовую воду пропускали углекислый газ. В полученный раствор добавили гидроксид бария, продукт реакции отделили и растворили в ортофосфорной кислоте.
Напишите уравнения описанных реакций.
Ba(OH)2 + CO2 = BaCO3 + H2O
BaСО3 + CO2 + H2O = Вa(HCO3)2
Вa(HCO3)2 + Ba(OH)2 = 2BaCO3↓ + 2H2O
BaCO3 + 2Н3РО4 = СО2 + H2O + Ba(Н2РО4)
6. Через раствор, полученный при гашении извести, пропустили газ, который образуется при получении негашеной извести из известняка; в результате выделяется белый осадок. При действии уксусной кислоты на полученный осадок выделяется тот же газ, который образуется при прокаливании карбоната кальция. Напишите уравнения описанных реакций.
СаО + Н2О = Са(ОН)2
Ca(OH)2 + CO2 = CaCO3↓ + H2O
CaCO3 + 2СН3СООН = (СН3СОО)2Са + СО2 ↑ + H2O
7. Негашеную известь «погасили» водой. В полученный раствор пропустили газ, который выделяется при кальцинировании гидрокарбоната натрия, при этом наблюдали образование и последующее растворение осадка. Напишите уравнения описанных реакций.
CaO + H2O = Ca(OH)2
Ca(OH)2 + CO2 = CaCO3↓ + H2O
CaCO3 + CO2 + H2O = Ca(HCO3)
8. Вещество, образующееся при сплавлении магния с кремнием, обработали водой, в результате образовался осадок и выделился бесцветный газ. Осадок растворили в соляной кислоте, а газ пропустили через раствор перманганата калия, при этом образовались два нерастворимых в воде бинарных вещества. Напишите уравнения описанных реакций.
Mg2Si + 4H2O = 2Mg(OH)2↓ + SiH4↑
Mg(OH)2 + 2HCl = MgCl2 + 2H2O
3SiH4 + 8KMnO4 = 8MnO2 ↓ + 3SiO2 ↓ + 8KOH + 2H2O
9. Магниевую стружку нагрели в атмосфере азота и продукт реакции последовательно обработали кипящей водой, растворами серной кислоты и нитрата бария. Напишите уравнения описанных реакций
Mg3N2 + 6H2O(гор.) = 3Mg(OH)2↓ + 2NH3↑
Mg(OH)2 + H2SO4 = MgSO4 + 2H2O
MgSO4 + Ba(NO3)2 = BaSO4↓ + Mg(NO3)2
10. Негашеную известь прокалили с избытком кокса. Продукт реакции после обработки водой используется для поглощения сернистого и углекислого газов. Напишите уравнения описанных реакций.
CaO + 3C = CaC2 + CO
CaC2 + 2H2O = Ca(OH)2 + C2H2↑
Ca(OH)2 + CO2 = CaCO3↓ + H2O
или Ca(OH)2 + 2CO2 = Ca(HCO3)2
Ca(OH)2 + SO2 = CaSO3↓ + H2O
или Ca(OH)2 + 2SO2 = Ca(HSO3)2
11. Магний нагрели в сосуде, наполненном газообразным аммиаком. Образовавшееся вещество растворили в концентрированном растворе бромоводородной кислоты, раствор выпарили и остаток нагрели до появления запаха, после чего добавили раствор щелочи. Напишите уравнения описанных реакций.
Mg3N2 + 8HBr = 3MgBr2 + 2NH4Br
MgBr2 + 2NaOH = Mg(OH)2↓ + 2NaB
12. Магниевый порошок смешали с кремнием и нагрели. Продукт реакции обработали холодной водой и выделяющийся газ пропустили через горячую воду. Образовавшийся осадок отделили, смешали с едким натром и нагрели до плавления. Напишите уравнения описанных реакций.
Mg2Si + 4H2O(хол.) = 2Mg(OH)2↓ + SiH4↑
SiH4+ 2H2O(гор.) = SiO2 + 4Н2
13. Простое вещество, полученное при нагревании фосфата кальция с коксом и оксидом кремния, сплавили с металлическим кальцием. Продукт реакции обработали водой, а выделяющийся газ собрали и сожгли в избытке кислорода. Напишите уравнения описанных реакций.
Ca3P2 + 6H2O = 3Ca(OH)2↓ + 2PH3↑
2PH3 + 4O2 = P2O5 + 3H2O
14. Фосфат кальция прокалили с углём в присутствии речного песка. Образовавшееся простое вещество прореагировало с избытком хлора. Полученный продукт внесли в избыток раствора гидроксида калия. На образовавшийся раствор подействовали известковой водой. Напишите уравнения описанных реакций.
2P + 5Cl2 = 2PCl5
PCl5 + 8KOH = K3PO4 + 5KCl + 4H2O
2K3PO4 + 3Ca(OH)2 = Ca3(PO4)2↓ + 6KOH
15) Металлический кальций прокалили в атмосфере азота. Продукт реакции обработали водой, выделившийся при этом газ пропустили в раствор нитрата хрома (III). Выпавший в ходе процесса серо-зеленый осадок обработали щелочным раствором пероксида водорода. Напишите уравнения описанных реакций.
3Ca + N2 = Ca3N2
Ca3N2 + 6H2O = 3Ca(OH)2 + 2NH3↑
3NH3 + 3H2O + Cr(NO3)3 = Cr(OH)3↓ + 3NH4NO3
2Cr(OH)3 + 3H2O2 + 4KOH = 2K2CrO4 + 8H2O
16) Смесь порошков нитрита калия и хлорида аммония растворили в воде и раствор осторожно нагрели. Выделившийся газ прореагировал с магнием. Продукт реакции внесли в избыток раствора соляной кислоты, при этом выделение газа не наблюдалось. Полученную магниевую соль в растворе обработали карбонатом натрия. Напишите уравнения описанных реакций.
3Mg + N2 = Mg3N2
Mg3N2 + 8HCl = 3MgCl2 + 2NH4Cl
2MgCl2 + 2Na2CO3 + H2O = (MgOH)2CO3↓ + CO2↑ + 4NaCl
17) Магний растворили в разбавленной азотной кислоте, причем выделение газа не наблюдалось. получившийся раствор обработали избытком раствора гидроксида калия при нагревании. Выделившийся при этом газ сожгли в кислороде. Напишите уравнения описанных реакций.
4Mg + 10HNO3(оч. разб.) = 4Mg(NO3)2 + NH4NO3 + 3H2O
Mg(NO3)2 + 2KOH = Mg(OH)2↓ + 2KNO3
4NH3 + 3O2 = 2N2 + 6H2O
18) Нитрат натрия сплавили с оксидом хрома (III) в присутствии карбоната натрия. Выделившийся при этом газ прореагировал с избытком гидроксида кальция с выпадением осадка белого цвета. Осадок растворили в избытке раствора бромоводородной кислоты и в полученный раствор добавили раствор нитрата серебра до прекращения выпадения осад-ка. Напишите уравнения описанных реакций.
3NaNO3 + Cr2O3 + 2Na2CO3 = 2Na2CrO4 + 2CO2↑ + 3NaNO2
CO2 + Ca(OH)2 = CaCO3↓ + H2O
CaCO3 + 2HBr = CaBr2 + CO2↑ + H2O
CaBr2 + 2AgNO3 = 2AgBr↓ + Ca(NO3)2
19) Фосфид кальция обработали соляной кислотой. Выделившийся газ сожгли в закрытом сосуде, продукт горения полностью нейтрализовали раствором гидроксида калия. К полученному раствору прилили раствор нитрата серебра. Напишите уравнения описанных реакций.
Ca3P2 + 6HCl = 3CaCl2 + 2PH3↑
2PH3 + 4O2 = P2O5 + 3H2O
P2O5 + 6KOH = 2K3PO4 + 3H2O
K3PO4 + 3AgNO3 = Ag3PO4↓ + 3KNO
20) Оксид кремния прокалили с большим избытком магния. Полученную смесь веществ обработали водой. При этом выделился газ, который сожгли в кислороде. Твердый продукт сжигания растворили в концентрированном растворе гидроксида цезия. Напишите уравнения описанных реакций.
SiO2 + 2Mg = 2MgO + Si
2Mg + Si = Mg2Si или
SiO2 + 4Mg = 2MgO + Mg2Si
Mg2Si + 4H2O = 2Mg(OH)2↓ + SiH4↑
SiH4 + 2O2 = SiO2 + 2H2O
SiO2 + 2CsOH = Cs2SiO3 + H2O
21) Магний нагрели в атмосфере азота. При добавлении к полученному веществу воды выделился газ, который пропустили над нагретым оксидом свинца (II). Полученное твердое вещество темного цвета растворили в разбавленной азотной кислоте. Напишите уравнения описанных реакций.
3Mg + N2 = Mg3N2
Mg3N2 + 6H2O = 3Mg(OH)2 + 2NH3
2NH3 + 3PbO = 3Pb + N2 + 3H2O
3Pb + 8HNO3 = 3Pb(NO3)2 + 2NO + 4H2O
22) Щавелевую кислоту нагрели с небольшим количеством концентрированной серной кислоты. Выделившийся газ сначала пропустили над нагретым оксидом меди (II), а полученный газ пропустили через раствор гидроксида кальция до тех пор, пока первоначально выпавший осадок не растворился. Напишите уравнения описанных реакций.
CO + CuO = Cu + CO2
CO2 + Ca(OH)2 = CaCO3 + H2O
CaCO3 + CO2 + H2O = Ca(HCO3)2
23) Барий растворили в воде. К полученному раствору добавили сульфат калия, выпавший осадок отфильтровали, после чего через горячий фильтрат пропустили газообразный хлор. Реакционную массу выпарили, а затем прокалили до образования одной соли. Напишите уравнения описанных реакций.
Ba + 2H2O = Ba(OH)2 + H2
Ba(OH)2 + K2SO4 = BaSO4↓ + 2KOH
6KOH + 3Cl2 → 5KCl + KClO3 + 3H2O
2KClO3 → 2KCl + 3O2
24) Магний растворили в разбавленной азотной кислоте. К полученному раствору последовательно добавили гидроксид натрия, бромоводородную кислоту, фосфат натрия. Напишите уравнения описанных реакций.
4Mg + 10HNO3(разб.) = 4Mg(NO3)2 + N2O + 5H2O
Mg(NO3)2 + 2NaOH = Mg(OH)2↓ + 2NaNO3
Mg(OH)2 + 2HBr = MgBr2 + 2H2O
3MgBr2 + 2Na3PO4 = Mg3(PO4)2↓ + 6NaBr
25) Барий растворили в разбавленной азотной кислоте, при этом выделился бесцветный газ – несолеобразующий оксид. Полученный раствор разделили на три части. Первую выпарили досуха, полученный осадок прокалили. Ко второй части добавили раствор сульфата натрия до прекращения выделения осадка; к третьей добавили раствор карбоната натрия. Напишите уравнения описанных реакций.
4Ba + 10HNO3(разб.) = Ba(NO3)2 + N2O + 5H2O
Ba(NO3)2 → Ba(NO2)2 + O2
Ba(NO3)2 + Na2SO4 = BaSO4↓ + 2NaNO3
Ba(NO3)2 + Na2CO3 = BaCO3↓ + 2NaNO3
26) Сульфат бария сплавили с коксом. Твердый остаток растворили в соляной кислоте, выделившийся газ вступил в реакцию оксидом серы (IV), а раствор – с сульфитом натрия. Напишите уравнения описанных реакций.
BaSO4 + 4C → BaS + 4CO
BaS + 2HCl = ВaCl2 + H2S↑
H2S + SO2 = 2H2O + 3S↓
BaCl2 + Na2SO3 = BaSO3↓ + 2NaCl
Материал по химии
Элементы побочной подгруппы еще называют d-элементами или переходными металлами. Они отличаются тем, что их валентные электроны расположены не только на s-подуровне внешнего энергетического слоя, но и на d-подуровне предвнешнего слоя. Валентными электронами называют те, что способны участвовать в образовании химической связи.
Что бы построить модель атома такого элемента, нам необходимо знать одно важное отличие этих элементов от элементов А-подгрупп: если у элементов главных (А) подгрупп количество электронов на внешнем уровне определяется по номеру группы (например, у лития один электрон на внешнем слое, у бериллия – два, у бора – три и так далее), то у элементов побочных подгрупп это количество не зависит от номера группы.
Для определения количества электронов на внешнем уровне, легче всего просто запомнить несколько распространённых примеров (они выделены красным):
|
Количество электронов на внешнем уровне |
Примеры элементов |
|---|---|
|
1 |
Cu, Ag, Au, Nb, Cr, Mo, Ru, Rh, Pt, Ds |
|
2 |
Все остальные элементы B-подгрупп, кроме палладия. |
Остальные правила работают как с элементами А-подгрупп, так и с элементами Б-подгрупп. Например, заряд ядра определяется по порядковому номеру элемента, количество энергетических уровней по расположению в определенном периоде.
Рассмотрим конфигурацию нескольких элементов побочных подгрупп:
Построение структурно-электронной формулы элементов B-подгрупп
Конфигурация хрома и железа
На рисунке показано, что несмотря на положение элементов в определенных подгруппах, количество электронов у них не равно этой группе.
Для сравнения изучим еще один рисунок, на котором мы можем сравнить элементы А- и Б-подгрупп одной и той же группы:
На этом рисунке мы снова можем убедиться, что элементы, находящиеся в одной и той же группе. В одном и том же периоде, но в разных подгруппах имеют разное строение.
Что бы разобраться, почему эти элементы называются d-элементами, разберем структурно-электронные формулы некоторых из них, например, хрома, железа и марганца, строение которых описывалось выше. Как уже было сказано, у этих элементов валентными являются не только внешний. Но и предвнешний уровень.
|
Cr |
3s2 3p6 3d5 4s1 |
↓↑ |
|
|
↑ |
||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
3s |
3p |
3d |
4s |
|
Fe |
3s2 3p6 3d6 4s2 |
↓↑ |
|
|
↑↓ |
||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
3s |
3p |
3d |
4s |
|
Mn |
3s2 3p6 3d5 4s2 |
↓↑ |
|
|
↑↓ |
||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
3s |
3p |
3d |
4s |
d-орбиталь содержит неспаренные электроны, которые могут вступать в химическую связь. Поэтому высшая валентность хрома равна не двум (по количеству электронов на внешнем уровне), а шести – по общему количеству электронов внешнего энергетического уровня и d-электронов предвнешнего уровня.
Вы можете встретить немного измененный порядок заполнения орбиталей, например, у марганца: 3s2 3p6 4s2 3d5. s- и d-подуровень поменялись местами, в таких формулах учтен уровень энергии орбиталей: чем меньшей энергией обладает орбиталь, тем быстрее она будет заполняться электронами.
Правильнее будет заполнять электроны в следующем порядке:
1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p…
Тренировочные задания ЕГЭ
Задание 1.
Для выполнения заданий 1 – 3 используйте следующий ряд химических элементов:
Ответом в заданиях 1 – 3 является последовательность цифр, под которыми указаны химические элементы в данном ряду.
Определите, атомы каких из указанных элементов имеют электронную конфигурацию внешнего энергетического уровня ns2(n-1) d10
Решение задания:
Для начала разберемся со страшной формулой ns2(n-1) d10. Попробуем заменить переменную n на любое число, например, на 4, тогда мы получим 4s2(4-1)d10 или 4s23d10. Эта формула отображает порядок распределения электронов согласно их энергии. Если для нас такой порядок непривычен, то мы можем поменять его местами, тогда получим 3d104s2. Получившаяся формула приблизительна, вместо нее может быть 4d105s2 или 5d106s2 , но по этой формуле мы понимаем, что должны искать элемент с двумя электронами на внешнем энергетическом уровне (это приводит к тому, что медь выбывает из списка претендентов на правильный ответ), и элемент должен иметь d-орбиталь на внешнем уровне (кальций и стронций выпадают)
Верный ответ: 23
Задание 2.
Для выполнения заданий 1 – 3 используйте следующий ряд химических элементов:
Ответом в заданиях 1 – 3 является последовательность цифр, под которыми указаны химические элементы в данном ряду.
Определите, атомы каких из указанных в ряду элементов не имеют на внешнем энергетическом уровне неспаренных электронов.
Решение: построим электронные конфигурации данных атомов.
|
Сурьма – Sb, элемент главной подгруппы пятой группы (А), у таких элементов валентные электроны находятся только на внешнем слое: 5s25p3, что соответствует структурно-электронной формуле: Элемент имеет три неспаренных p-электрона. |
Последовательность расположения электронов на энергетических уровнях выражается следующим рядом чисел:
|
||||||||||||
|
Магний – Mg, элемент главной подгруппы второй группы (А). поэтому его внешний энергетический слой будет имеет следующую формулу: 3s2 Не имеет неспаренных электронов. |
|
||||||||||||
|
Железо – Fe, элемент побочной подгруппы (Б), у таких элементов валентными являются как электроны внешнего уровня, так и d-электроны предвнешнего уровня. 3d64s2 Есть четыре неспаренных электрона на d-подуровне. |
|
||||||||||||
|
Титан -Ti, 3d24s2 Есть два неспаренных электрона на d-подуровне. |
|
||||||||||||
|
Цинк – Zn, 3d104s2 Нет неспаренных электронов. |
|
Верный ответ: 45
1. В состав гемоглобина входит ион металла:
A) Fe (II)
B) Zn
C) Cu (II)
D) Mg
E) Fe (III)
2Железо будет выделять водород из:
A) Гидроксида натрия (конц.)
B) Раствора серной кислоты
C) Гидроксида аммония
D) Концентрированной азотной кислоты
E) Концентрированной серной кислоты
3. Масса оксидов свинца (II) и олова (IV), необходимая для получения 500 г припоя, состоящего из 34% олова и 66% свинца
A) 175 г SnO2 и 342 г PbO
B) 216 г SnO2 и 356 г PbO
C) 216 г SnO и 399 г PbO
D) 205 г SnO2 и 396 г PbO
E) 183 г SnO и 351 г PbO
4 Электронная конфигурация иона Fe2+
A) 1s2 2s2 2p6 3s2 3p6 3d0
B) 1s2 2s2 2p6 3s2 3p6 3d5 4s1
C) 1s2 2s2 2p6 3s2 3p6 3d6
D) 1s2 2s2 2p6 3s2 3p6 3d5
E) 1s2 2s2 2p6 3s2 3p6 3d5 4s2
5 Железо нельзя получить:
A) Восстановлением лимонита углем
B) Восстановлением магнетита водородом
C) Электролизом водных растворов солей железа (II)
D) Нейтрализацией гидроксидов железа
E) Восстановлением гематита водородом
6. Из приведенных оксидов – CrO, Al2O3, CO, P2O5 – с водным раствором гидроксида натрия взаимодействуют:
A) CrO и CO
B) Al2O3 и P2O5
C) Al2O3 и CO
D) CO и P2O5
E) CrO и P2O5
7 Превращение Fe → FeO → Fe2O3 → Fe соответствует переходу
A) … 3d5 4s1 … 3d6 4s2 … 3d5 3d6
B) … 3d6 4s2 … 3d6 … 3d6 4s2 3d5
C) … 3d6 4s2 … 3d6 … 3d5 3d6 4s2
D) … 3d6 … 3d6 4s1 … 3d6 3d5 4s2
E) … 3d6 4s2 … 3d5 … 3d6 4s2 3d5
8 Продукты FeSO4 и Н2О соответствуют взаимодействию реагентов:
A) Fe и H2SO4 (10%)
B) Fe и H2SO4 (96%)
С) FeO и H2SO4
D) Fe2 O 3 и H2SO4
E) FeO и H2SO3
9 При восстановлении водородом смеси оксидов железа (II) и железа (III) массой 37 г получено железо массой 28 г. Массовая доля (в %) каждого из оксидов в смеси
A) 73% FeO и 27% Fe2 O 3
B) 68% FeO и 32% Fe2 O3
C) 65% FeO и 35% Fe 2O3
D) 90% FeO и 10% Fe 2O3
E) 83% FeO и 17% Fe2O3
10. Реактивами на ионы Fe2+ и Fe3+ являются соответственно
A) K3[Fe(CN)6] и K4[Fe(CN)6]
B) K4[Fe(CN)6] и KCl
C) KCl и K3[Fe(CN)6]
D) K4[Fe(CN)6] и KCNS
E) K3[Fe(CN)6] и NaCl
11Веществом А в схеме превращений
Cr → Cr2O3 —+NaCl—> X —+NaOH—> Y —+NaCl(p-p)—> A может быть
A) Na2CrO2
B) Na2CrO4
C) Cr(OH)2
D) Na[Cr(OH)4]
E) Cr(OH)3
12 В схеме превращений
Веществами Х1 и Х2 могут быть
A) Х1 – FeO, X2 – Fe2(SO4)3
B) X1 – FeO, X2 – FeBr3
C) X1 – FeCl3, X2 – Fe(NO3)3
D) X1 – FeO, X2 – FeSO4
E) X1 – Fe2O3, X2 – FeCl2
13 Для полного осаждения серебра из 170 г 1%-ного раствора AgNO3 потребовалось 100 мл иодоводородной кислоты. Молярность раствора HI равна
A) 1М
B) 0,01М
C) 10М
D) 0,1М
E) 1,1М
14 При растворении в соляной кислоте 10,4 г смеси железа и магния выделилось 6,72 л водорода (н.у.). Масса железа в смеси
A) 6,7 г
B) 5 г
C) 4,4 г
D) 5,6 г
E) 3 г
15 В схеме превращений
Fe —Cl2—> A —NaOH—> Б —(температура 0 градусов по цельсию)—> В —HCl—> Г
вещества А, В, Г
A) FeCl3, Fe2O3, FeCl3
B) FeCl2, Fe, FeCl3
C) FeCl2, FeO, FeCl2
D) FeCl3, FeO, FeCl2
E) FeCl3, Fe2O3, FeCl2
16 В схеме превращений
Fe + HNO3 Fe(NO3)3 + NO + H2O
сумма коэффициентов в сокращенном ионном уравнении равна
A) 9
B) 8
C) 10
D) 12
E) 11
17 В стакан с 490 г 10%-ной серной кислоты опустили цинковую пластину. Через некоторое время масса пластины изменилась на 13 г. Объем (в литрах, н.у.) выделившегося газа
A) 1,24 л B) 2,24 л C) 22,4 л D) 4,48 л
E) 5,56 л
18 Красный цвет крови из-за
A) аминогруппы в гемоглобине
B) азотистых оснований в гемоглобине
C) углеводов в гемоглобине
D) гемов, которые содержат III валентное железо в оксигемоглобине
E) остатков фосфорной кислоты в гемоглобине
Ответы к тесту по теме Металлы побочных подгрупп
1A 2B 4C 5D6B7C 8B9A10A11D12C 13D14D 15A16A17B18D
Общая характеристика металлов побочных подгрупп (d -металлов)
Все элементы побочных подгрупп ПСЭ относятся к электронному семейству d-элементови являются металлами.
Находясь только в больших периодах (IV, V, VI), d-элементы образуют «вставные декады» (по 10 элементов) между s- и р- элементами, поэтому имеют общее название — переходные элементы.
Кроме этих 30 d-элементов, имеющих стабильные изотопы, искусственно синтезированы несколько радиоактивных d- элементов, занимающих свои места внезавершенном VII периоде.
В атомах d-элементов содержится от 1 до 10 электронов на d-подуровне предвнешнего электронного слоя и 2 (или 1 в случае проскока е-) электрона на s-подуровне внешнего электронного слоя. Общая формула электронной конфигурации валентных подуровней в атомах d -элементов.

В каждом большом периоде d-элементы располагаются после двух s-элементов, которые являются щелочным и щелочноземельным металлами:
|
Щелочные металлы |
Щелочно-земельные металлы |
d-металлы |
|
|
||
|
Радиусы атомов уменьшаются |
||
|
Заряды ядер атомов увеличиваются |
Поэтому d-металлы являются менее активными, чем щелочные и щелочноземельные металлы.
Вотличие от щелочных и щелочноземельных Me, большинство d-металлов имеют переменную валентность и переменную степень окисления. Это объясняется тем, что валентными в атомах d-элементовявляются не только s-электроны внешнего слоя, но и все или некоторые d -электроны предвнешнего слоя.
Для d-металлов III — VII групп высшая Ви высшая С.О. равны номеру группы, т. е. суммарному числу е— на (n -1)d и ns-подуровнях; например у d -элементов четвертого периода:
|
№ группы |
III |
IV |
V |
VI |
VII |
|
Элемент |
Sc |
Ti |
V |
Cr |
Mn |
|
Электронная конфигурация |
3d14s2 |
3d24s2 |
3d34s2 |
3d54s2 |
3d54s2 |
|
Высшая валентность |
III |
IV |
V |
VI |
VII |
|
Высшая степень окисления |
+3 |
+4 |
+5 |
+6 |
+7 |
Для d-металлов VIII группы высшая В и высшая с о., как правило, меньше суммарного числа е— на (n — 1)d и ns -подуровнях;
например:
|
№ группы |
VIII |
||
|
Элемент |
Fe |
Co |
Ni |
|
Электронная конфигурация |
3d64s2 |
3d74s2 |
3d84s2 |
|
Высшая валентность |
VI |
III |
III |
|
Высшая степень окисления |
+6 |
+3 |
+3 |
d-Металлы II группы, атомы которых имеют завершенную структуру d-подуровня (n -1)d10, проявляют в своих соединениях постоянную В = II и постоянную с.о. = +2.
Наиболее характерными валентностями и степенями окисления для d-металлов I группы являются: Сu — II и +2; Ag — I и +1; Au — III и +3.
Важной особенностью атомов d-металлов является наличие свободных орбиталей (на (n — 1)d -, ns — образованию и nр-подуровнях), что позволяет им образовывать донорно-акцепторные (координационные) связи с различными донорами неподеленных электронных пар (молекулы NH3, Н2O, ионы ОН—, CN— и др.).
Вследствие этого d-металлы образуют многочисленные и разнообразные комплексные соединения; например:
[Co(NH3)6]CI3, K4[Fe(CN)6],
Na2[Zn(OH)4), [Cr(H2O)6](NО3)3
В свободном состоянии d -металлы (как и вообще все металлы) являются восстановителями. Восстановительная активность различных d — металлов изменяется в широких пределах: среди них есть металлы средней активности, находящиеся в ряду напряжений до водорода (Fe, Cr , Zn , Mn и др.); малоактивные металлы (Сu, Нg и др.) и благородные металлы (Au , Pt и др.), располагающиеся в ряду напряжений после водорода.
Соединения d-элементов могут выполнять как восстановительные, так и окислительные функции. Соединения с невысокими степенями окисления являются восстановителями, а соединения с высокими степенями окисления — окислителями;
например:
MnSO4, FeCl2 , CrCl2 — восстановители
КMnO4, K2FeO4, K2Cr2O7 — сильные окислители
При увеличении степени окисления металла основной характер оксидов и гидроксидов ослабляется, а кислотный характер усиливается:
|
Me+12O |
Me+2O |
Me+32O3 |
Me+4O2 |
Me+52O5 |
Me+6O3 |
Me+72O7 |
|
MeOH |
Me(OH)2 |
Me(OH)3H3MeO3(HMeO2) |
Me(OH)4H4MeO4(H2MeO3) |
HMeO3или(H3MeO4) |
H2MeO4или(H2MeO7) |
HMeO4 |
|
основные свойства |
амфотерные свойства |
кислотные свойства |
Смотреть видео:
СМОТРЕТЬ ВИДЕОРОЛИК:
youtu.be/OibYozFLq2c
#химия #химияпросто #неорганика #егэпохимии #эксперименты #химик #егэхимия #химияегэ #chemistry
Свежая информация для ЕГЭ и ОГЭ по Химии (листай):
С этим видео ученики смотрят следующие ролики:

Металлы побочных подгрупп Железо
Олег Алексндрович

Химия. Металлы главных подгрупп
Уроки химии

Задание 21 Металлы. ОГЭ 2020 химия
Видеоуроки по химии

Серная кислота и металлы за 10 минут | ХИМИЯ ЕГЭ | СОТКА
Химия ЕГЭ сотка
Облегчи жизнь другим ученикам — поделись! (плюс тебе в карму):
18.06.2019
| Меню сайта |
|
| Категории раздела | |||||
|
| Наш опрос |
|
Как вы относитесь к открытию ресторанов McDonald’s в Томске? приветствую отрицательно мне все равно Результаты | Архив опросов Всего ответов: 235 |
| Статистика |
|
Онлайн всего: 1 Гостей: 1 Пользователей: 0 |
| Главная » Файлы » ЕГЭ и ГИА » Теория (химия) |
Металлы побочных подгрупп
| [ Скачать с сервера (71.7 Kb)
] |
07.11.2012, 21:15 |
| Металлы побочных подгрупп |
|
Категория: Теория (химия) | Добавил: biolog |
|
| Просмотров: 1794 | Загрузок: 429
| Рейтинг: 0.0/0 |
Добавлять комментарии могут только зарегистрированные пользователи.
[
Регистрация
|
Вход
]
| Погода |
 |
| Друзья сайта |
|
|
Выборка_ЕГЭ_Металлы побочных подгрупп
Вопрос №10
1.В схеме превращений
веществами Х и Y соответственно являются
1) 


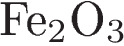
2.Задана следующая схема превращений веществ:
Определите, какие из указанных веществ являются веществами X и Y.
1) 


3.Задана следующая схема превращений веществ:
Определите, какие из указанных веществ являются веществами X и Y.
1) оксид железа(II) 2) гидроксид железа(III) 3) гидроксид железа(II)
4) хлорид железа(II) 5) хлорид железа(III)
4.Задана следующая схема превращений веществ:
Определите, какие из указанных веществ являются веществами X и Y.
1) 

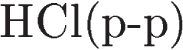

5.Задана следующая схема превращений веществ:
Определите, какие из указанных веществ являются веществами X и Y.
1) 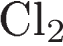

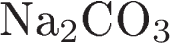

6.Задана следующая схема превращений веществ:
Определите, какие из указанных веществ являются веществами X и Y.
1) 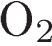



7.Задана следующая схема превращений веществ:
Определите, какие из указанных веществ являются веществами X и Y.
1) 

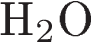

8.Задана следующая схема превращений веществ:
Определите, какие из указанных веществ являются веществами X и Y.
1) 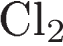



9.Задана следующая схема превращений веществ:
Определите, какие из указанных веществ являются веществами X и Y.
1) 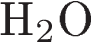
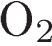


10.Задана следующая схема превращений веществ:
Определите, какие из указанных веществ являются веществами X и Y.
1)