в условии
в решении
в тексте к заданию
в атрибутах
Категория:
Атрибут:
Всего: 183 1–20 | 21–40 | 41–60 | 61–80 …
Добавить в вариант
Из предложенного перечня выберите два вещества, для которых характерна водородная связь.
1) фенол
2) алкан
3) арен
4) спирт
5) алкин
Запишите в поле ответа номера выбранных соединений.
Источник: РЕШУ ЕГЭ
Из предложенного перечня выберите два вещества, в которых между молекулами образуется водородная связь.
1)
2)
3)
4)
5)
Запишите в поле ответа номера выбранных веществ.
Из предложенного перечня выберите два вещества, в которых между молекулами образуются водородные связи.
1) метанол
2) метан
3) ацетилен
4) вода
5) метилформиат
Запишите в поле ответа номера выбранных соединений.
Источник: РЕШУ ЕГЭ
Из предложенного перечня выберите два вещества, в которых имеются водородные связи.
1)
2)
3)
4)
5)
Запишите в поле ответа номера выбранных веществ в порядке возрастания.
Из предложенного перечня выберите два вещества, в которых между молекулами образуется водородная связь.
1)
2)
3)
4)
5)
Запишите в поле ответа номера выбранных веществ.
Выберите два правильных утверждения об энергиях связей.
1) Энергия связи больше энергии связи
.
2) Энергия связи равна энергии связи
.
3) Энергия связи больше энергии связи
.
4) Энергия связи равна энергии связи
.
5) Энергия водородной связи между молекулами воды больше энергии ковалентной связи в молекуле воды.
Запишите в поле ответа номера выбранных утверждений.
Из предложенного перечня выберите два вещества, в которых присутствуют водородные связи.
1) фтороводород
2) бутанол
3) хлорметан
4) диметиловый эфир
5) этилен
Запишите в поле ответа номера выбранных соединений.
Источник: РЕШУ ЕГЭ
Из предложенного перечня выберите два вещества, в которых присутствует водородная связь.
1) вода
2) этан
3) бензол
4) водород
5) этанол
Запишите в поле ответа номера выбранных соединений.
Источник: РЕШУ ЕГЭ
Из предложенного перечня выберите два вещества, в которых присутствуют водородные связи.
1) глицерин
2) этилен
3) пропин-1
4) толуол
5) муравьиная кислота
Запишите в поле ответа номера выбранных веществ.
Источник: РЕШУ ЕГЭ
Из предложенного перечня выберите два вещества, в которых характерна водородная связь.
1) алкен
2) фенол
3) простой эфир
4) первичный спирт
5) арен
Запишите в поле ответа номера выбранных веществ.
Источник: РЕШУ ЕГЭ
Из предложенного перечня выберите два вещества, в которых между молекулами образуются водородные связи.
1) уксусная кислота
2) фторводород
3) углекислый газ
4) ацетилен
5) сероводородная кислота
Запишите в поле ответа номера выбранных веществ.
Источник: РЕШУ ЕГЭ
Из предложенного перечня выберите два вещества, в которых имеются водородные связи.
1)
2)
3)
4)
5)
Запишите в поле ответа номера выбранных свойств.
Из предложенного перечня выберите два вещества, в которых водородные связи отсутствуют.
1)
2)
3)
4)
5)
Запишите в поле ответа номера выбранных свойств.
Из предложенного перечня выберите два вещества, в которых присутствует водородная связь.
1)
2)
3)
4)
5)
Запишите в поле ответа номера выбранных веществ в порядке возрастания.
Из предложенного перечня выберите два вещества, в которых водородная связь не образуется.
1)
2)
3)
4)
5)
Запишите в поле ответа номера выбранных веществ в порядке возрастания.
Из предложенного перечня выберите два вещества, в которых нет водородных связей.
1)
2)
3)
4)
5)
Запишите номера выбранных веществ в порядке возрастания.
Из предложенного перечня выберите два вещества, в которых образуются водородные связи.
1)
2)
3)
4)
5)
Запишите в поле ответа номера выбранных веществ в порядке возрастания.
Из предложенного перечня выберите два вещества, в которых нет водородных связей.
1)
2)
3)
4)
5)
Запишите в поле ответа номера выбранных веществ в порядке возрастания.
Из предложенного перечня выберите два вещества, в которых нет водородных связей.
1)
2)
3)
4)
5)
Запишите номера выбранных ответов.
Источник: СтатГрад: Тренировочная работа 09.11.2022. Вариант ХИ2210201.
Из предложенного перечня выберите два вещества, в которых между молекулами образуются водородные связи.
1)
2)
3)
4)
5)
Запишите номера выбранных ответов.
Источник: СтатГрад: Тренировочная работа 09.11.2022. Вариант ХИ2210202.
Всего: 183 1–20 | 21–40 | 41–60 | 61–80 …
Тест по теме Водородные связи
Линия заданий 4, ЕГЭ по химии
N.B. Разделение на темы вопросов по химии носит приблизительный характер, так как сам формат большинства вопросов ЕГЭ по химии исключает возможность однозначного отнесения вопроса к одной определённой теме.
7170. Из предложенного перечня выберите два вещества, между молекулами которых образуются водородные связи.
1. водород2. ацетальдегид3. пропанол-14. метаналь5. пропанол-2

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7170.
6995. Из предложенного перечня выберите два соединения, между молекулами которых образуется водородная связь.
1. метилацетат2. пропионовый альдегид3. пропанол-14. муравьиная кислота5. диэтиловый эфир

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 6995.
6855. Из предложенного перечня выберите два вещества, для которых характерно образование межмолекулярных водородных связей.
1. H3N2. C2H63. HF4. H25. CH4

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 6855.
Для вас приятно генерировать тесты, создавайте их почаще
В результате выполнения задания 4 ЕГЭ по химии проверяются следующие требования/умения:
Коды проверяемых требований к уровню подготовки (по кодификатору):
Читать подробнее…
Коды проверяемых элементов содержания (по кодификатору):
Уровень сложности задания:
Максимальный балл за выполнение задания:
Примерное время выполнения задания выпускником, изучавшим предмет:
Межмолекулярные водородные связи в жидком состоянии характерны для:
1. водорода
2. воды
3. аммиака
4. ацетальдегида
5. изобутана
И ионные, и ковалентные химические связи имеются в веществе:
1. НСl
2. H2SO4
3. NaOH
4. NH4Br
5. С2Н5ОН
Ионные связи реализуются в каждом из двух веществ:
1. Аl2O3 и FeCl3
2. K2S и NaNO3
3. KNO2 и NO2
4. HF и НСl
5. NaBr и NH4F
Из предложенного перечня выберите два соединения, в которых присутствует ковалентная неполярная химическая связь.
1) N2
2) НСlO
3) NH4Br
4) НСl
5) Р4
Ковалентные неполярные химические связи имеются в веществах:
1. белый фосфор
2. ортофосфорная кислота
3. аммиак
4. этиловый спирт
5. сера ромбическая
Немолекулярное строение имеют:
1. гидроксид калия
2. аммиак
3. уксусная кислота
4. азотная кислота
5. графит
Из предложенного перечня выберите два соединения, в которых присутствует и ионная, и ковалентная химическая связь.
1. Ca(NO3)2
2. НСlO
3. NH4Br
4. НВг
5. H2SO4
Из предложенного перечня выберите два соединения, в которых присутствует ковалентная химическая связь.
1. H2
2. NH3
3. CaO
4. BaF2
5. NaBr
Из предложенного перечня выберите два соединения, между молекулами которых образуется водородная химическая связь.
1. H2
2. C2H5OH
3. C2H6
4. CH2=CH2
5. H2O
В сульфате калия присутствуют химические связи:
1. ионные
2. ковалентные неполярные
3. ковалентные полярные
4. водородные
5. металлические
ЕГЭ по химии задание 4
План
- Ковалентная химическая связь, ее разновидности и механизмы образования. Характеристики ковалентной связи (полярность и энергия связи). Ионная связь. Металлическая связь. Водородная связь
- Вещества молекулярного и немолекулярного строения. Тип кристаллической решетки. Зависимость свойств веществ от их состава и строения
Ковалентная химическая связь, ее разновидности и механизмы образования. Характеристики ковалентной связи (полярность и энергия связи). Ионная связь. Металлическая связь. Водородная связь
- Химические связи – определение, возникновение
- Как определить тип связи
- Ковалентная химическая связь
- Ионная связь
- Металлическая связь
- Водородная связь
Химические связи – определение, возникновение
Теорию отдельно выдвинули Гильберт Ньютон Льюис и Вальтер Коссель в 1916 году. Для описания соединения двух атомов используется термин «химическая связь». В образовании участвуют электроны, которые расположены на внешних энергетических уровнях, а потому наименее связанные с ядром – это валентные электроны. При соединении образуется три вида частиц:
- молекула – небольшого размера электронейтральная частица вещества с характерными для него химическими свойствами;
- ионы – заряженные частицы, атомы и группы связанных атомов с обилием (анионы) или дефицитом (катионы) электронов;
- свободный радикал – частица с ненасыщенной (свободной) валентностью.
Возникновение химической связи между атомами ведёт к образованию частиц: молекул, ионов и свободных радикалов. При этом уменьшается полная энергия системы – объединение атомов в частицу протекает энергетически выгодно. Образование связи на примере водородной молекулы
- Пребывание двух мелких частиц на дальнем друг от друга промежутке – энергия взаимосвязи приближается к нулю (взаимосвязи нет).
- Сближение атомов на отдаление, соизмеримое с размером электронного пространства – вступают силы притяжения и отталкивания.
- Начало действия силы притяжения между электронной оболочкой одного атома и ядром другого атома, конкурирующие силы отталкивания между ядрами и между электронами.
- Силы притяжения преобладают над силами отталкивания – сближаются атомы, а потенциальная энергия снижается до возникновения стабильной молекулы при r = r 0 .
- Дальнейшее сближение – энергия системы стремительно повышается за счёт преобладания сил отталкивания.
Энергетический минимум идентичен устойчивому состоянию системы – в этой ситуации из пары обособленных водородных частиц получается молекула H2. Во время реакции производится 436 кДж/моль.
Определение вида взаимосвязи по разнице электроотрицательност (ЭО):В многообразии источников попадаются разные таблицы. Использовать можно каждую шкалу, потому что важнее разница электроотрицательностей, которая в среднем сходна в изобретённых системах, а не значение.
Δ ЭО = 0 – неполярная ковалентная;
Δ ЭО
Δ ЭО ≥ 1,7 – ионная.
Химические связи различаются по связываемым атомам, образующимся частицам, кристаллической решётке, характере вещества. Выделяют 4 типа:
- Ковалентная (полярная и неполярная).
- Ионная.
- Механическая.
- Водородная.
Определяют тип по веществу, принимающему участие в связи. Если это 2 неметалла, то связь ковалентная. Если метал с неметаллом, то ионный тип, но если 2 металла, то металлический тип. Водородная связь – соединение молекул водорода с фтором, хлором, кислородом или азотом.
Ковалентная химическая связь
Ковалентный тип – это химическая связь, в результате которой возникают общие пары электронов. Два пути появления:
- Обменный способ – каждая частица предоставляет по одному электрону в совместное использование.
- Донорно-акцепторный механизм – одна частица предоставляет уже по 2 электрона, а второй атом отдаёт свободную орбиталь.
Пример обменного способа – объединение атомов в молекулу водорода. Сближаясь, электронные оболочки перекрываются, а электронная плотность между ядрами повышается. Идёт притяжение, и энергия системы понижается. При близком сближении ядра отталкиваются – появляется расстояние
Характеристики ковалентной связи:
- Полярность – неравномерное сосредоточение между частицами с разной электроотрицательностью электронной плотности.
- Кратность – количество общих электронных пар между двумя атомами.
- Длина – протяжённость между центральными частями ядер атомов.
- Насыщаемость – возможность атомов создавать условное число связей.
- Энергия связи – мера прочности, энергия, требуемая для разрыва связи во всех молекулах, составляющих 1 моль вещества.
Ковалентная связь включает две разновидности по полярности: полярная и неполярная. Определяют по электроотрицательности атомов – одинаковая она или нет.
Характеристика:
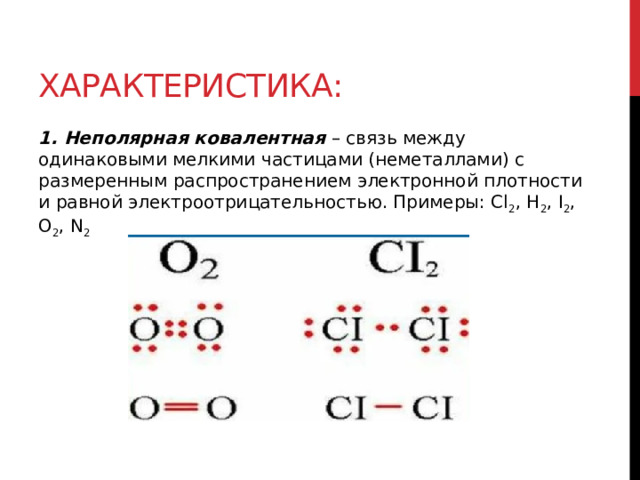
1. Неполярная ковалентная – связь между одинаковыми мелкими частицами (неметаллами) с размеренным распространением электронной плотности и равной электроотрицательностью. Примеры: Cl 2 , H 2 , I 2 , O 2 , N 2
Характеристика:
Полярная ковалентная – это соединение неравных частиц (неметаллов) с разницей в электроотрицательности и смещением общей пары электронов. Примеры: NH 3 , HCl, CO 2 , H 2 O
Полярность – характеристика, определяющая физические или химические свойства вещества. Она влияет на механизм реакций, реакционную способность ближайших связей. Полярность молекулы, температуры плавления и кипения, а также растворимость – показатели, зависящие от полярности связей.
Ионная связь
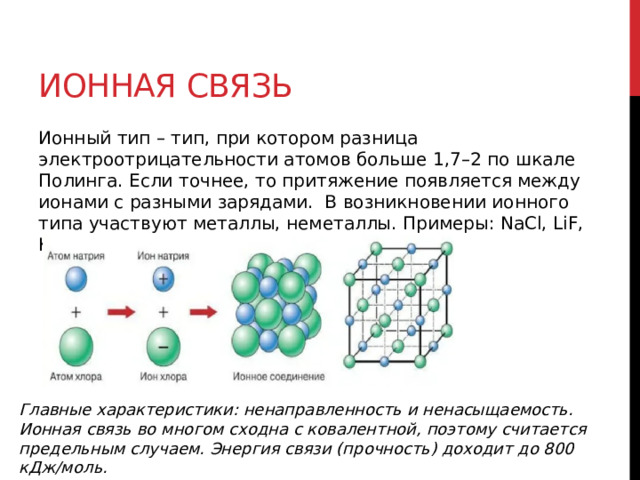
Ионный тип – тип, при котором разница электроотрицательности атомов больше 1,7–2 по шкале Полинга. Если точнее, то притяжение появляется между ионами с разными зарядами. В возникновении ионного типа участвуют металлы, неметаллы. Примеры: NaCl, LiF, K 2 O, другие
Главные характеристики: ненаправленность и ненасыщаемость. Ионная связь во многом сходна с ковалентной, поэтому считается предельным случаем. Энергия связи (прочность) доходит до 800 кДж/моль.
Металлическая связь
Характеристики металлов: блеск, ковкость, пластичность и сравнительно высокая температура плавления, тепло- и электропроводность. Общность этих качеств объясняется сходством организации атомов:
малое количество электронов на внешнем уровне;
слабое притяжение между валентными электронами и ядром;
низкая ионизация и электроотрицательность.
Металлический тип – это связь сравнительно свободных отрицательно заряженных частиц между ионами металлов с образованием кристаллической решётки. Примеры – Fe, Na, Ca, Sc и Au 3 Cu, другие
Прочность (энергия) у металлической связи в 3–4 раза ниже этого же показателя у ковалентного типа. Образование металлической связи между атомами металлов возможна из-за наличия кинетической энергии внутри каждого атома металла, при увеличении центробежной силы электроны последнего электронного слоя вылетают за пределы атома и связывают атомы металлов между собой.
Существованием свободных электронов объяснятся свойство металлов к электропроводности (электрический ток – направленное движение электронов). Поэтому металлическую кристаллическую решетку химически невозможно разрушить, её можно только механически распилить.
Водородная связь
Водородные соединения с электроотрицательными атомами фтора, хлора, азота, кислорода образуются благодаря водородным связям. В молекуле общая пара электронов движется к более электроотрицательному атому. Классический пример – жидкий фторид водорода
Энергия водородной связи составляет до 40 кДж/моль, поэтому этот тип в 10–20 раз слабее ковалентного. Водородные связи возникают между или внутри молекул. От этого зависят физико-химические свойства вещества.
Вещества молекулярного и немолекулярного строения. Тип кристаллической решетки. Зависимость свойств веществ от их состава и строения
Молекулярное и немолекулярное строение веществ
Представления о существовании атомов возникли в древности. Греческое название переводится как «неделимые». Долгое время термины «атом», «корпускула», «молекула» были почти синонимами. Ясность внесли химики всего мира в 1860 году. Ученые приняли решение называть атомами мельчайшие частицы вещества. Они могут входить в состав молекул и немолекулярных структур.
Строение — это характеристика структурных единиц вещества, их расположение в пространстве (кристаллическая решетка).
Неметаллы, их соединения — вещества преимущественно молекулярного строения. Водород, кислород, азот, хлор, моно- и диоксид углерода, аммиак состоят из молекул сравнительно небольшого размера. Состав отражают формулы Н 2 , О 2 , N 2 , Cl 2 , СО, СО 2 , NH 3 . Наиболее распространенное вещество молекулярного строения — вода (Н 2 О)
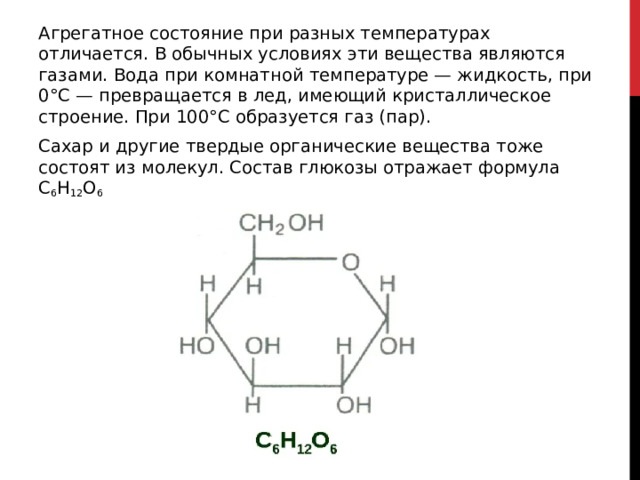
Агрегатное состояние при разных температурах отличается. В обычных условиях эти вещества являются газами. Вода при комнатной температуре — жидкость, при 0°С — превращается в лед, имеющий кристаллическое строение. При 100°С образуется газ (пар).
Сахар и другие твердые органические вещества тоже состоят из молекул. Состав глюкозы отражает формула С 6 Н 12 О 6
Немолекулярных соединений в природе гораздо больше. К этой группе относятся инертные газы, алмаз, графит (аллотропные видоизменения, модификации углерода), минерал кварц, различные соли, металлы. Это преимущественно твердые вещества (при комнатной температуре). Исключение — ртуть, жидкий металл, затвердевающий лишь при –30°С. Среди веществ немолекулярного строения встречаются наиболее твердые и тугоплавкие, обладающие высокой тепло- и электропроводностью.
Кристаллические решетки: типы и примеры
Структурные частицы природных и искусственно полученных веществ находятся в определенных точках пространства, на расстоянии друг от друга. Упорядоченное расположение называют кристаллической решеткой. В ее узлах находятся атомы, ионы или молекулы. На рисунках они обычно изображены кружочками. Черточками между ними условно обозначают химические связи.
Шаро-стержневые объемные модели тоже помогают лучше представить расположение структурных единиц в пространстве. Шарики символизируют частицы вещества, стержни между ними — химическую связь
Вещества кристаллического строения широко распространены, имеют большое практическое значение. Они встречаются в природе, находят применение в промышленности, медицине, сельском хозяйстве, быту.
Атомная
Такие кристаллические структуры распространены среди простых веществ. В узлах находятся атомы. Примеры веществ: графит и алмаз (аллотропные видоизменения, модификации углерода), кремний.
Прочную атомную кристаллическую решетку также имеют горный хрусталь и кварц (минералы состоят из диоксида кремния). Отличие от простых веществ существенное — в узлах находятся атомы кремния и кислорода, т. е. разных элементов.
Вещества атомного строения обычно твердые (за исключением графита), нерастворимые в воде, тугоплавкие, являются изоляторами или полупроводниками.
Молекулярная
В узлах кристаллической решетки — молекулы. Простые вещества с этим типом пространственного строения: S 8 — кристаллическая сера, Р 4 — белый фосфор, Br 2 — бром, I 2 — кристаллический йод. Н 2 О в виде льда, СО 2 («сухой лед») — сложные вещества с молекулярной кристаллической решеткой.
Силы притяжения между структурными единицами относительно слабые, поэтому связи легко разрушаются. Например, йод возгоняется — переходит из твердого состояния в газообразное при комнатной температуре.
Ионная
В узлах расположены ионы — заряженные частицы. Классический пример вещества с этим типом кристаллической решеткой — поваренная соль или хлорид натрия.
Катионы — положительно заряженные частицы. В электрическом поле они перемещаются к отрицательному полюсу источника тока (катоду). Отрицательные ионы движутся к аноду, имеющему заряд «+».
Кристаллы поваренной соли
Ионная решетка характерна для солей, оксидов и гидроксидов металлов I–III групп периодической системы, большой группы соединений металлических элемент из других групп. Такие вещества обычно твердые и тугоплавкие.
Ионы высвобождаются при расплавлении и растворении. Расплавы и растворы являются электролитами, проводниками электрического тока, более слабыми, по сравнению с металлами.
Металлическая
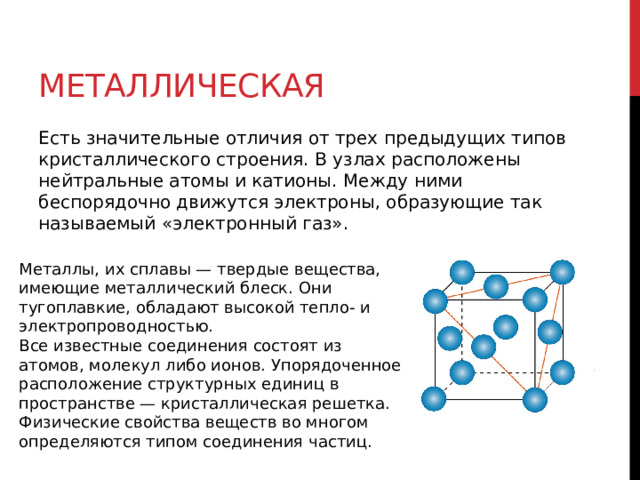
Есть значительные отличия от трех предыдущих типов кристаллического строения. В узлах расположены нейтральные атомы и катионы. Между ними беспорядочно движутся электроны, образующие так называемый «электронный газ».
Металлы, их сплавы — твердые вещества, имеющие металлический блеск. Они тугоплавкие, обладают высокой тепло- и электропроводностью.
Все известные соединения состоят из атомов, молекул либо ионов. Упорядоченное расположение структурных единиц в пространстве — кристаллическая решетка. Физические свойства веществ во многом определяются типом соединения частиц.
Заключение
Труднее разрушается атомная, легче — молекулярная кристаллическая решетка. Чтобы «освободить» частицы в составе ионного кристалла, достаточно растворить или расплавить вещество. Особенностью металлической решетки является наличие «электронного газа», высокая электропроводность веществ.
Задание для подготовки к егэ
Кристаллическая решетка. Строение вещества
Из предложенного перечня выберите два вещества с одинаковым типом кристаллической решетки.
Ответ: 24.
Задание для подготовки к егэ
Кристаллическая решетка. Строение вещества
Из предложенного перечня выберите два вещества молекулярного строения.
Ответ: 15.
Задание для подготовки к егэ
Характеристика связи в веществе
Из предложенного перечня выберите два соединения, в которых присутствует ионная химическая связь.
Ответ: 13.
Выполнить задания в решу егэ
Вариант № 5508743
Или переходить по ссылке https:// chem-ege.sdamgia.ru/test?id=5508743
Тематический тест на химию водорода и галогенов.
Задание №1
Из предложенного списка простых веществ выберите те, которые являются газами при обычных условиях. Число верных ответов может быть любым.
1) йод
2) хлор
3) фтор
4) бром
5) водород
Решение
Ответ: 235
Задание №2
Из предложенного списка простых веществ выберите те, которые являются твердыми при обычных условиях. Число верных ответов может быть любым.
1) водород
2) хлор
3) йод
4) фтор
5) бром
Решение
Ответ: 3
Задание №3
Из предложенного списка простых веществ выберите те, которые не являются газами при обычных условиях. Число верных ответов может быть любым.
1) бром
2) водород
3) фтор
4) йод
5) хлор
Решение
Ответ: 14
Задание №4
Из предложенного списка соединений выберите те, в которых атомы водорода находятся в низшей степени окисления. Число верных ответов может быть любым.
- 1. NaHCO3
- 2. KHS
- 3. CaH2
- 4. Fe(OH)SO4
- 5. NH3
Решение
Ответ: 3
Задание №5
Из предложенного списка соединений выберите те, в которых атомы водорода находятся в высшей степени окисления. Число верных ответов может быть любым.
- 1. LiNH2
- 2. NaH
- 3. BaH2
- 4. RbHS
- 5. NH4Cl
Решение
Ответ: 145
Задание №6
Из предложенного списка соединений выберите те, в которых атомы галогенов находятся в высшей степени окисления. Число верных ответов может быть любым.
- 1. KClO
- 2. Mg(ClO4)2
- 3. NaBrO3
- 4. KIO4
- 5. Cl2O5
Решение
Ответ: 24
Задание №7
Из предложенного списка соединений выберите те, в которых атомы галогенов не находятся в высшей степени окисления. Число верных ответов может быть любым.
- 1. Ca(ClO4)2
- 2. HBrO3
- 3. NF3
- 4. NH4Cl
- 5. I2O5
Решение
Ответ: 2345
Задание №8
Из предложенного списка соединений выберите те, в которых атомы галогенов находятся в степени окисления +1. Число верных ответов может быть любым.
- 1. NF3
- 2. PBr3
- 3. Ca(ClO)Cl
- 4. HClO2
- 5. S2Cl2
Решение
Ответ: 3
Задание №9
Из предложенного списка соединений выберите те, в которых атомы галогенов находятся в степени окисления +5. Число верных ответов может быть любым.
- 1. PCl5
- 2. KClO3
- 3. FeCl2
- 4. KBrO3
- 5. I2O5
Решение
Ответ: 245
Задание №10
Из предложенного списка соединений выберите те, в которых атомы галогенов находятся в степени окисления -1. Число верных ответов может быть любым.
- 1. NH4I
- 2. Cl2
- 3. BF3
- 4. S2Br2
- 5. Ca(ClO)Cl
Решение
Ответ: 1345
[adsp-pro-3]
Задание №11
Из предложенного списка оксидов выберите два, с которыми может взаимодействовать водород.
- 1. Al2O3
- 2. FeO
- 3. MgO
- 4. NiO
- 5. Na2O
Решение
Ответ: 24
Задание №12
Из предложенного списка оксидов выберите два, с которыми не может взаимодействовать водород.
- 1. CuO
- 2. Fe2O3
- 3. Cu2O
- 4. Cs2O
- 5. SO2
Решение
Ответ: 45
Задание №13
Из предложенного списка оксидов выберите два, с которыми может взаимодействовать водород.
- 1. P2O5
- 2. MgO
- 3. Li2O
- 4. ZnO
- 5. Fe3O4
Решение
Ответ: 45
Задание №14
Из предложенного списка оксидов выберите два, с которыми не может взаимодействовать водород.
- 1. PbO
- 2. H2O
- 3. BaO
- 4. ZnO
- 5. FeO
Решение
Ответ: 23
Задание №15
Из предложенного списка оксидов выберите два, с которыми может взаимодействовать водород.
- 1. CO
- 2. CaO
- 3. SrO
- 4. Rb2O
- 5. Cu2O
Решение
Ответ: 15
Задание №16
Из предложенного списка веществ выберите два, с которыми может взаимодействовать водород.
1) хлор
2) железо
3) вода
4) литий
5) ртуть
Решение
Ответ: 14
Задание №17
Из предложенного списка веществ выберите два, с которыми может взаимодействовать фтор.
1) фторид серы(VI)
2) хлорид фосфора(V)
3) фтороводород
4) бромоводород
5) фторид алюминия
Решение
Ответ: 24
Задание №18
Из предложенного списка веществ выберите два, с которыми может взаимодействовать хлор.
1) хлорид серебра
2) азот
3) хлорид железа(II)
4) сероводород
5) хлорид магния
Решение
Ответ: 34
Задание №19
Из предложенного списка веществ выберите два, с которыми может взаимодействовать бром.
1) азот
2) едкое кали
3) азотная кислота
4) бромид железа(III)
5) фосфор
Решение
Ответ: 25
Задание №20
Из предложенного списка веществ выберите два, с которыми может взаимодействовать йод.
1) бромоводород
2) гашеная известь
3) песок
4) едкий натр
5) аргон
Решение
Ответ: 24
[adsp-pro-3]
Задание №21
Из предложенного списка веществ выберите два, с которыми не может взаимодействовать водород.
1) оксид натрия
2) оксид цинка
3) оксид меди(II)
4) оксид бария
5) оксид хрома(II)
Решение
Ответ: 14
Задание №22
Из предложенного списка веществ выберите два, с которыми не может взаимодействовать хлор.
1) алмаз
2) водород
3) хлорид меди(I)
4) кислород
5) бромоводород
Решение
Ответ: 14
Задание №23
Из предложенного списка веществ выберите два, с которыми не может взаимодействовать бром.
1) алюминий
2) оксид цинка
3) гидроксид рубидия
4) фосфор
5) кислород
Решение
Ответ: 25
Задание №24
Из предложенного списка веществ выберите два, с которыми не может взаимодействовать йод.
1) бромид калия
2) йодид меди(I)
3) йодид хрома(II)
4) водород
5) едкое кали
Решение
Ответ: 12
Задание №25
Из предложенного списка веществ выберите два, с которыми может взаимодействовать хлор.
1) нитрат меди
2) серная кислота
3) азотная кислота
4) сероводородная кислота
5) йодоводородная кислота
Решение
Ответ: 45
Задание №26
Из предложенного списка веществ выберите два, с которыми может взаимодействовать водород.
1) литий
2) платина
3) ртуть
4) цезий
5) песок
Решение
Ответ: 14
Задание №27
Из предложенного списка веществ выберите два, с которыми не может взаимодействовать хлор.
1) бромид цинка
2) йодид никеля
3) хлорид фосфора(III)
4) фторид натрия
5) бертолетова соль
Решение
Ответ: 45
Задание №28
Из предложенного списка веществ выберите два, с которыми может взаимодействовать бром.
1) сера
2) оксид азота(IV)
3) негашеная известь
4) вода
5) неон
Решение
Ответ: 14
Задание №29
Из предложенного списка веществ выберите два, с которыми не может взаимодействовать йод.
1) сульфат магния
2) гидроксид цезия
3) фосфат натрия
4) гидроксид стронция
5) едкий натр
Решение
Ответ: 13
Задание №30
Из предложенного списка веществ выберите два, с которыми не может взаимодействовать водород.
1) железная окалина
2) поташ
3) негашеная известь
4) сажа
5) угарный газ
Решение
Ответ: 23
[adsp-pro-3]
Задание №31
Из приведенных пар веществ выберите ту, в которой возможно химическое взаимодействие. Запишите уравнение протекающей реакции.
1) хлорид алюминия + бром
2) нитрат магния + хлор
3) бромид свинца(II) + хлор
4) фторид калия + сера
5) бромид цинка + йод
Решение
Ответ: PbBr2 + Cl2 = PbCl2 + Br2
Задание №32
Из приведенных пар веществ выберите ту, в которой возможно химическое взаимодействие. Запишите уравнение протекающей реакции.
1) бертолетова соль + бромат калия
2) поваренная соль + нитрат серебра
3) йод + кислород
4) хлорид фосфора(III) + йод
5) хлорид натрия + бром
Решение
Ответ: NaCl + AgNO3 = AgCl + NaNO3
Задание №33
Из приведенных пар веществ выберите ту, в которой возможно химическое взаимодействие. Запишите уравнение протекающей реакции.
1) хлор + кислород
2) бром + азот
3) литий + водород
4) йод + кислород
5) водород + песок
Решение
Ответ: 2Li + H2 = 2LiH
Задание №34
Из приведенных пар веществ выберите ту, в которой возможно химическое взаимодействие. Запишите уравнение протекающей реакции.
1) гидроксид алюминия + водород
2) гидроксид натрия + кислород
3) гидроксид калия + поваренная соль
4) гидроксид цезия + йод
5) гидроксид лития + азот
Решение
Ответ: 6CsOH + 3I2 = 5CsI + CsIO3 + 3H2O
Задание №35
Из приведенных пар веществ выберите ту, в которой возможно химическое взаимодействие. Запишите уравнение протекающей реакции.
1) серная кислота + хлор
2) азотная кислота + водород
3) фосфорная кислота + бром
4) сероводородная кислота + бром
5) плавиковая кислота + бром
Решение
Ответ: H2S + Br2 = 2HBr + S
Задание №36
Из приведенных пар веществ выберите ту, в которой возможно химическое взаимодействие. Запишите уравнение протекающей реакции.
1) соляная кислота + сульфид меди(II)
2) плавиковая кислота + фторид серебра
3) бромоводородная кислота + гашеная известь
4) йодоводородная кислота + медь
5) хлороводородная кислота + серебро
Решение
Ответ: Ca(OH)2 + 2HBr = CaBr2 + 2H2O
Задание №37
Из приведенных пар веществ выберите ту, в которой возможно химическое взаимодействие. Запишите уравнение протекающей реакции.
1) хлорид натрия + фосфор
2) бромид калия + сера
3) фторид лития + цинк
4) хлорат калия + сера
5) бромат калия + бром
Решение
Ответ: 2KClO3 + 3S = 2KCl + 3SO2
Задание №38
Из приведенных пар веществ выберите ту, в которой возможно химическое взаимодействие. Запишите уравнение протекающей реакции.
1) хлорид фосфора(III) + хлор
2) бромид кремния(IV) + бром
3) йодид железа(II) + йод
4) хлорид натрия + бром
5) бромид цинка + йод
Решение
Ответ: PCl3 + Cl2 = PCl5
Задание №39
Из приведенных пар веществ выберите ту, в которой возможно химическое взаимодействие. Запишите уравнение протекающей реакции.
1) хлорид натрия + вода
2) бромид калия + вода
3) гидрид лития + вода
4) иодид серебра + вода
5) хлорид цезия + вода
Решение
Ответ: LiH + H2O = LiOH + H2
Задание №40
Из приведенных пар веществ выберите ту, в которой возможно химическое взаимодействие. Запишите уравнение протекающей реакции.
1) алмаз + бром
2) азот + хлор
3) аргон + йод
4) фосфор + йод
5) железо + водород
Решение
Ответ: 2P + 3I2 = 2PI3
[adsp-pro-3]
Задание №41
В заданной схеме превращений
CuSO4 CuI
Y
Веществами X и Y являются соответственно
1) хлорид меди(I)
2) йодид свинца
3) хлороводород
4) хлорид меди(II)
5) йодид натрия
Решение
Ответ: 54
Задание №42
В заданной схеме превращений
MnO2 X
KClO3
Веществами X и Y являются соответственно
1) хлорид марганца(IV)
2) калий
3) едкое кали
4) оксид калия
5) хлор
Решение
Ответ: 53
Задание №43
В заданной схеме превращений
X Br2
Y
Веществами X и Y являются соответственно
1) бромат калия
2) нитрат калия
3) бромид фосфора(V)
4) фосфор
5) бромид натрия
Решение
Ответ: 53
Задание №44
В заданной схеме превращений
X Y
X
Веществами X и Y являются соответственно
1) бромид калия
2) бром
3) бромоводород
4) бромат калия
5) бертолетова соль
Решение
Ответ: 24
Задание №45
В заданной схеме превращений
KClO3 X
Y
Веществами X и Y являются соответственно
1) перхлорат калия
2) кислород
3) оксид хлора(V)
4) хлорид калия
5) хлор
Решение
Ответ: 45
Задание №46
В заданной схеме превращений
Fe3O4 Fe
FeCl2
Веществами X и Y являются соответственно
1) хлороводород
2) водород
3) хлор
4) хлорид натрия
5) хлорат калия
Решение
Ответ: 21
Задание №47
В заданной схеме превращений
X Y
CuBr2
Веществами X и Y являются соответственно
1) йодид калия
2) йодид стронция
3) йод
4) йодид меди(I)
5) йодид меди(II)
Решение
Ответ: 34
Задание №48
В заданной схеме превращений
KOH X
P2O5
Веществами X и Y являются соответственно
1) бертолетова соль
2) поваренная соль
3) фосфорная кислота
4) фосфор
5) кислород
Решение
Ответ: 14
Задание №49
В заданной схеме превращений
AgF KF
HF
Веществами X и Y являются соответственно
1) нитрат калия
2) йодид калия
3) азотная кислота
4) кремниевая кислота
5) водород
Решение
Ответ: 23
Задание №50
В заданной схеме превращений
KI X
NaIO3
Веществами X и Y являются соответственно
1) кислород
2) едкий натр
3) углекислый газ
4) йод
5) йодоводород
Решение
Ответ: 42
[adsp-pro-3]
Задание №51
Запишите уравнение взаимодействия между водородом и цезием. В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: 2Cs + H2 = 2CsH
Задание №52
Запишите уравнение взаимодействия между водородом и кальцием. В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: Ca + H2 = CaH2
Задание №53
Запишите уравнение взаимодействия между водородом и хлором. В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: H2 + Cl2 = 2HCl
Задание №54
Запишите уравнение взаимодействия между водородом и оксидом железа(III). В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: Fe2O3 + 3H2 = 2Fe + 3H2O
Задание №55
Запишите уравнение взаимодействия между водородом и оксидом меди(I). В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: Cu2O + H2 = 2Cu + H2O
Задание №56
Запишите уравнение взаимодействия между фтором и кремнием. В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: Si + 2F2 = SiF4
Задание №57
Запишите уравнение взаимодействия между избытком хлора и фосфором. В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: 2P + 5Cl2 = 2PCl5
Задание №58
Запишите уравнение взаимодействия между недостатком хлора и фосфором. В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: 2P + 3Cl2 = 2PCl3
Задание №59
Запишите уравнение взаимодействия между хлором и железом. В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: 2Fe + 3Cl2 = 2FeCl3
Задание №60
Запишите уравнение взаимодействия между хлором и медными опилками. В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: Cu + Cl2 = CuCl2
[adsp-pro-3]
Задание №61
Запишите уравнение взаимодействия между хлором и холодным раствором едкого натра. В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: 2NaOH + Cl2 = NaCl + NaClO + H2O
Задание №62
Запишите уравнение взаимодействия между хлором и горячим раствором гидроксида цезия. В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: 6CsOH + 3Cl2 = 5CsCl + CsClO3 + 3H2O
Задание №63
Запишите уравнение взаимодействия между бромом и алюминием. В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: 2Al + 3Br2 = 2AlBr3
Задание №64
Запишите уравнение взаимодействия между избытком брома и фосфором. В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: 2P + 5Br2 = 2PBr5
Задание №65
Запишите уравнение взаимодействия между бромом и горячим раствором гашеной извести.
Решение
Ответ: 6Ca(OH)2 + 6Br2 = 5CaBr2 + Ca(BrO3)2 + 6H2O
Задание №66
Запишите уравнение взаимодействия между бромом и йодидом алюминия. В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: 2AlI3 + 3Br2 = 2AlBr3 + 3I2
Задание №67
Запишите уравнение взаимодействия между хлором и раствором сероводорода. В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: H2S + 4Cl2 + 4H2O = H2SO4 + 8HCl
Задание №68
Запишите уравнение взаимодействия между бромом и раствором сероводорода. В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: H2S + Br2 = S + 2HBr
Задание №69
Запишите уравнение взаимодействия между йодом и медью. В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: 2Cu + I2 = 2CuI
Задание №70
Запишите уравнение взаимодействия между избытком йода и фосфором. В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: 2P + 3I2 = 2PI3
[adsp-pro-3]
Задание №71
Запишите уравнение взаимодействия между бертолетовой солью и избытком концентрированной соляной кислоты.
Решение
Ответ: KClO3 + 6HCl = KCl + 3Cl2 + 3H2O
Задание №72
Запишите уравнение взаимодействия между бертолетовой солью и фосфором. В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: 5KClO3 + 6P = 5KCl + 3P2O5
Задание №73
Запишите уравнение каталитического разложения хлората натрия. В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: 2NaClO3 = 2NaCl + 3O2
Задание №74
Запишите уравнение термического разложения бертолетовой соли. В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: 4KClO3 = KCl + 3KClO4
Задание №75
Запишите уравнение взаимодействия между хлоратом калия, оксидом хрома(III) и едким кали при сплавлении. В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: KClO3 + Cr2O3 + 4KOH = KCl + 2K2CrO4 + 2H2O
Задание №76
Запишите уравнение взаимодействия между перманганатом калия и концентрированной соляной кислотой. В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: 2KMnO4 + 16HCl = 2KCl + 2MnCl2 + 5Cl2 + 8H2O
Задание №77
Запишите уравнение взаимодействия между оксидом марганца(IV) и бромоводородной кислотой. В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: MnO2 + 4HBr = MnBr2 + Br2 + 2H2O
Задание №78
Запишите уравнение взаимодействия между дихроматом калия и концентрированной соляной кислотой при нагревании. В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: K2Cr2O7 + 14HCl = 2KCl + 2CrCl3 + 3Cl2 + 7H2O
Задание №79
Запишите уравнение взаимодействия между перекисью водорода и йодидом калия в присутствии серной кислоты. В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: 2KI + H2O2 + H2SO4 = K2SO4 + I2 + 2H2O
Задание №80
Запишите уравнение взаимодействия между йодидом калия и раствором медного купороса. В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: 4KI + 2CuSO4 = 2K2SO4 + 2CuI + I2
[adsp-pro-3]
Задание №81
Запишите уравнение взаимодействия между йодидом натрия и раствором хлорного железа. В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: 2NaI + 2FeCl3 = 2FeCl2 + I2 + 2NaCl
Задание №82
Запишите уравнение взаимодействия между твердой поваренной солью и концентрированной серной кислотой при нагревании. В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: 2NaCl + H2SO4 = Na2SO4 + 2HCl
или
NaCl + H2SO4 = NaHSO4 + HCl
Задание №83
Запишите уравнение взаимодействия между твердым бромидом калия и концентрированной серной кислотой при нагревании. В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: 2KBr + 2H2SO4 = K2SO4 + SO2 + Br2 + 2H2O
Задание №84
Запишите уравнение взаимодействия между твердым йодидом калия и концентрированной серной кислотой при нагревании. В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: 8KI + 5H2SO4 → 4K2SO4 + H2S + 4I2 + 4H2O
Задание №85
Запишите уравнение взаимодействия кварцевого песка и избытка плавиковой кислоты. В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: SiO2 + 4HF = SiF4 + 2H2O
Задание №86
Установите соответствие между веществом и набором реагентов, с каждым из которых оно может взаимодействовать.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
|
А) водород Б) хлор В) негашеная известь |
1) калий, фосфор, вода 2) стронций, сера, кислород 3) цинк, натрий, ксенон 4) соляная кислота, вода, углекислый газ |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 214
Задание №87
Установите соответствие между веществом и набором реагентов, с каждым из которых оно может взаимодействовать.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
|
А) плавиковая кислота Б) соляная кислота В) азотная кислота |
1) едкий натр, медь, сера 2) гидроксид цезия, нитрат серебра, оксид алюминия 3) гидроксид рубидия, оксид свинца(II), кварц 4) гашеная известь, азот, фосфорная кислота |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 321
Задание №88
Установите соответствие между веществом и набором реагентов, с каждым из которых оно может взаимодействовать.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
|
А) поваренная соль Б) бертолетова соль В) бром |
1) фосфор, азот, вода 2) нитрат серебра, серная кислота (конц.), фтор 3) сера, графит, соляная кислота 4) железо, водород, вода |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 234
Задание №89
Установите соответствие между веществом и набором реагентов, с каждым из которых оно может взаимодействовать.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
|
А) гидрид кальция Б) фторид серебра В) йодид лития |
1) хлор, вода, бром 2) фосфат калия, хлор, бром 3) соляная кислота, нитрат бария, медь 4) вода, аргон, хлор |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 132
Задание №90
Установите соответствие между веществом и набором реагентов, с каждым из которых оно может взаимодействовать.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
|
А) бромид лития Б) йодид калия В) фторид аммония |
1) нитрат магния, едкое кали, гашеная известь 2) нитрат свинца, фторид серебра, сульфат меди 3) нитрат калия, сульфат алюминия, цинк 4) нитрат серебра, хлор, фосфат натрия |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 421
[adsp-pro-3]
Задание №91
Рассчитайте суммарный объем газов (н.у.), которые выделятся при полном разложении смеси 12,6 г дихромата аммония и 24,5 г бертолетовой соли в присутствии катализатора. Ответ приведите в литрах и округлите до сотых.
Решение
Ответ: 7,84
Пояснение:
Запишем уравнения реакций:
(NH4)2Cr2O7 = N2 + Cr2O3 + 4H2O (I)
2KClO3 = 2KCl + 3O2 (II)
ν((NH4)2Cr2O7) = m/M = 12,6 / 252 = 0,05 моль
Исходя из уравнения реакции (I):
ν(N2) = ν((NH4)2Cr2O7) = 0,05 моль
ν(KClO3) = m/M = 24,5 / 122,5 = 0,2 моль
Исходя из уравнения реакции (II):
ν(O2) = 3⋅ν(KClO3)/2 = 3⋅0,2/2 = 0,3 моль
Рассчитаем суммарное количество молей азота и кислорода:
ν(N2+O2) = ν(N2) + ν(O2) = 0,05 моль + 0,3 моль = 0,35 моль
Тогда,
V(N2+O2) = ν(N2+O2) ⋅ Vm = 0,35⋅22,4 = 7,84 л
Задание №92
Вычислите массу воды, необходимую для реакции с 21 г гидрида кальция. Ответ приведите в граммах и округлите до целых.
Решение
Ответ: 18
Задание №93
Определите массовую долю хлорида калия в растворе, полученном при пропускании 2,24 л хлора через 280 г горячего 20%-ного раствора едкого кали. Ответ приведите в процентах и округлите до десятых.
Решение
Ответ: 4,3
Задание №94
Навеску йода массой 12,7 г смешали с 28 г железных опилок и нагревали до прекращения реакции. Полученную смесь обработали 300 мл воды, осадок отделили. Вычислите массовую долю вещества в полученном растворе. Ответ приведите в процентах и округлите до сотых.
Решение
Ответ: 4,91
Пояснение:
Йод, в отличие от других галогенов окисляет железо до степени окисления +2. То есть протекает реакция:
Fe + I2 = FeI2
ν(I2) = m/M = 12,7/254 = 0,05 моль
ν(Fe) = m/M = 28/56 = 0,5 моль
В избытке железо, поэтому считаем количество продукта (йодида железа) по йоду:
ν(FeI2) = ν(I2) = 0,05 моль
Йодид железа не реагирует с водой, а просто растворяется в ней. Поэтому осадок в условии задачи – это просто непрореагировавшее железо.
Таким образом, после добавления воды мы просто получаем водный раствор йодида железа (II).
Рассчитаем массу йодида железа (II):
m(FeI2) = ν ⋅ M = 0,05 ⋅ 310 = 15,5 г
Тогда, масса полученного раствора будет равна:
mр-ра(FeI2) = m(FeI2) + m(H2O) = 15,5 г + 300 г = 315,5 г,
а массовая доля йодида железа будет составлять:
ω(FeI2) = 100 ⋅ m(FeI2) /mр-ра(FeI2) = 100% ⋅ 15,5/315,5 = 4,91 %
Задание №95
Навеску бертолетовой соли обработали избытком концентрированной соляной кислоты. Объем выделившегося газа составил 6,72 л. Рассчитайте объем кислорода, который можно получить при каталитическом разложении такой же навески исходного вещества. Ответ приведите в литрах и округлите до сотых.
Решение
Ответ: 3,36
Задание №96
Навеску бертолетовой соли массой 2,45 г полностью разложили в присутствии катализатора. Полученный твердый остаток смешали с 100 г 8,5% раствора нитрата серебра. Определите суммарную массовую долю солей в полученном растворе. Ответ приведите в процентах и округлите до сотых.
Решение
Ответ: 7,22
Задание №97
Навеску смеси железных и алюминиевых опилок массой 8,3 г нагревали в токе хлора до прекращения реакции. Полученный твердый остаток растворили в воде и обработали избытком раствора питьевой соды. Рассчитайте объем выделившегося газа, если массовая доля алюминия в исходной смеси равна 32,53. Ответ приведите в литрах и округлите до сотых.
Решение
Ответ: 13,44
Задание №98
При взаимодействии навески оксида меди(II) и избытка водорода при нагревании образовался твердый остаток. Данное вещество нагревали в токе хлора, полученный продукт растворили в 100 мл воды. При пропускании в раствор сероводорода выпало 9,6 г осадка. Определите массовую долю кислоты в растворе над осадком. Ответ приведите в процентах и округлите до десятых.
Решение
Ответ: 6,8
Задание №99
Вычислите объем хлора, необходимый для полного окисления 100 мл 5%-ного раствора сульфида натрия (плотность 1,05 г/см3). Ответ приведите в литрах и округлите до целых.
Решение
Ответ: 6
Задание №100
Рассчитайте массу простого вещества, образующегося при взаимодействии 160 г 10% раствора сульфата меди и 200 мл 20% раствора йодида калия (плотность 1,15 г/см3). Ответ приведите в граммах и округлите до десятых.
Решение
Ответ: 12,7
[adsp-pro-10]
Разберем задания №3 из вариантов ЕГЭ за 2016 год.
Перед решением советуем повторить тему «Виды химической связи».
Задания с решениями.
Задание №1.
Соединения с ковалентной неполярной связью расположены в ряду:
1. O2, Cl2, H2
2. HCl, N2, F2
3. O3, P4, H2O
4. NH3, S8, NaF
Объяснение: нам нужно найти такой ряд, в котором будут только простые вещества, так как ковалентная неполярная связь образуется только между атомами одного и того же элемента. Правильный ответ — 1.
Задание №2.
Вещества с ковалентной полярной связью указаны в ряду:
1. CaF2, Na2S, N2
2. P4, FeCl2, NH3
3. SiF4, HF, H2S
4. NaCl, Li2O, SO2
Объяснение: здесь нужно найти ряд, в котором только сложные вещества и, к тому же, все неметаллы. Правильный ответ — 3.
Задание №3.
Водородная связь характерна для
1. Алканов 2. Аренов 3. Спиртов 4. Алкинов
Объяснение: водородная связь образуется между ионом водорода и электроотрицательным ионом. Такой набор, среди перечисленных, есть только у спиртов.
Правильный ответ — 3.
Задание №4.
Химическая связь между молекулами воды
1. Водородная
2. Ионная
3. Ковалентная полярная
4. Ковалентная неполярная
Объяснение: между атомами О и Н в воде образуется ковалентная полярная связь, так как это два неметалла, а вот между молекулами воды связь водородная. Правильный ответ — 1.
Задание №5.
Только ковалентные связи имеет каждое из двух веществ:
1. CaO и C3H6
2. NaNO3 и CO
3. N2 и K2S
4. CH4 и SiO2
Объяснение: соединения должны состоять только из неметаллов, то есть правильный ответ — 4.
Задание №6.
Веществом с ковалентной полярной связью является
1. О3 2. NaBr 3. NH3 4. MgCl2
Объяснение: ковалентная полярная связь образуется между атомами разных неметаллов. Правильный ответ — 3.
Задание №7.
Неполярная ковалентная связь характерна для каждого из двух веществ:
1. Воды и алмаза
2. Водорода и хлора
3. Меди и азота
4. Брома и метана
Объяснение: неполярная ковалентная связь характерна для соединения атомов одного и того же элемента-неметалла. Правильный ответ — 2.
Задание №8.
Какая химическая связь образуется между атомами элементов с порядковыми номерами 9 и 19?
1. Ионная
2. Металлическая
3. Ковалентная полярная
4. Ковалентная неполярная
Объяснение: это элементы — фтор и калий, то есть неметалл и металл соответственно, между такими элементами может образоваться только ионная связь. Правильный ответ — 1.
Задание №9.
Веществу с ионным типом связи отвечает формула
1. NH3 2. HBr 3. CCl4 4. KCl
Объяснение: ионная связь образуется между атомом металла и атомом неметалла, то есть правильный ответ — 4.
Задание №10.
Одинаковый вид химической связи имеют хлороводород и
1. Аммиак
2. Бром
3. Хлорид натрия
4. Оксид магния
Объяснение: хлороводород имеет ковалентную полярную связь, то есть нам нужно найти вещество, состоящее из двух разных неметаллов — это аммиак.
Правильный ответ — 1.
Автор решения: Лунькова Е.Ю.
Задания для самостоятельного решения.
1. Водородные связи образуются между молекулами
1. Фтороводородная кислота
2. Хлорметан
3. Диметиловый эфир
4. Этилена
2. Соединению с ковалентной связью соответствует формула
1. Na2O 2. MgCl2 3. CaBr2 4. HF
3. Вещество с ковалентной неполярной связью имеет формулу
1. H2O 2. Br2 3. CH4 4. N2O5
4. Веществом с ионной связью является
1. CaF2 2. Cl2 3. NH3 4. SO2
5. Водородные связи образуются между молекулами
1. Метанола
2. Метана
3. Ацетилена
4. Метилформиата
6. Ковалентная неполярная связь характерна для каждого из двух веществ:
1. Азота и озона
2. Воды и аммиака
3. Меди и азота
4. Брома и метана
7. Ковалентная полярная связь характерна для вещества
1. KI 2. CaO 3. Na2S 4. CH4
8. Ковалентная неполярная связь характерна для
1. I2 2. NO 3. CO 4. SiO2
9. Веществом с ковалентной полярной связью является
1. Cl2 2. NaBr 3. H2S 4. MgCl2
10. Ковалентная неполярная связь характерна для каждого из двух веществ:
1. Водорода и хлора
2. Воды и алмаза
3. Меди и азота
4. Брома и метана
В данной заметке использовались задания из сборника ЕГЭ 2016-го года под редакцией А.А. Кавериной.
Ковалентная связь – связь между
двумя атомами, которые соединяются друг с другом за счет образования ОБЩЕЙ
электронной пары.
Существует два
возможных механизма
образования общей электронной пары:
·
обменный
механизм, когда каждый из взаимодействующих атомов предоставляет
в пару по одному электрону,
·
донорно-акцепторный
механизм, если один из атомов предоставляет электронную ПАРУ, а
другой – пустую (вакантную) орбиталь.

‼ По донорно-акцепторному механизму образованы
связи в следующих веществах:
1.
Все комплексные соединения, например: K3[Al(OH)6]
2.
Соли аммония и аминов: NH4Cl и т.п.
3.
Азотная кислота, нитраты.
4.
Газы СО- угарный газ, О3 – озон.
Электроотрицательность
(ЭО) –
способность атома притягивать электроны при образовании химической связи.
Таким образом, электрон сместится к атому того элемента, который имеет
большую электроотрицательность.
Возможно три случая
для двух атомов А и В, образующих связь: А — В
1)
ЭО (А) = ЭО(В) (разность электроотрицательностей равна нулю).
Общая электронная пара не смещена ни к одному из атомов. Не возникает
ПОЛЮСОВ, электронная плотность у обоих атомов одинакова.
Это НЕПОЛЯРНАЯ ковалентная связь.
‼Примеры неполярной ковалентной связи: а) двухатомные
простые вещества: H–H, F–F,
б)
симметричные молекулы типа Н2О2 ( Н-О-О-Н) – связь
между двумя атомами кислорода и т.п.
2) ЭО (А) > ЭО(В). При образовании ковалентной связи электронная
пара смещена к более электроотрицательному атому А, на нём возникает
частичный отрицательный заряд, а на В – частичный положительный.
Такая связь называется ковалентной ПОЛЯРНОЙ.
‼ Такой тип связи характерен для молекул (или
частей молекул), состоящих из двух и более неметаллов (HCl, H2O,
СН3СООН).
Чем больше разность ЭО, тем выше полярность
связи (при этом электронная пара принадлежит
обоим атомам). Например, в ряду НСl à HBr à HI полярность связи уменьшается.
3) ЭО (А) >> ЭО(В). Разность электроотрицательностей настолько
велика, что атом В (металл) ОТДАЁТ свой электрон атому В (неметалл).
Возникают ИОНЫ — катион В+ и анион А—.
Такая связь называется ИОННОЙ.
Ионная
связь
– предельный случай ковалентной полярной связи.
‼Такой тип
связи характерен для соединений металлов с неметаллами, оксидов металлов,
оснований и солей, в том числе солей органических и солей аммония.
В ионном кристалле нет
молекул. Каждый ион окружен определенным числом ионов другого знака.
Ионная
связь характеризуется ненаправленностью и ненасыщенностью. Вещества с
ионной связью имеют ионную кристаллическую решетку.
‼Необходимо помнить, что
существуют вещества, в молекуле которых одновременно присутствуют и ионные, и
ковалентные связи (например, NaOH, KNO3).
3. Металлическая связь возникает в
простых веществах – металлов между положительно заряженными
ионами металла и свободно движущимися электронами («электронный газ»).
Наличие такого свободного движения электронов является причиной хорошей
тепло- и электропроводности металлов.
Атомы металлов отличаются от атомов других элементов тем, что сравнительно
слабо удерживают свои внешние электроны. Поэтому эти электроны покидают свои
атомы, превращая их в положительно заряженные ионы. «Обобществленные»
электроны передвигаются в пространстве между катионами металлов и удерживают
их вместе.
_________________________________________________________
Водородная связь – это связь не внутри молекулы, а между молекулами или между независимыми частями
молекул.
Водородная связь – возникает между сильно электроотрицательными атомами
(обычно водорода или фтора, реже азота) и атомом водорода другой молекулы или
части молекулы:
(сплошной чертой обозначена
ковалентная связь, точками – водородная связь).
Наличие водородных связей приводят к аномальному повышению температур
кипения у веществ, в которых она присутствует.
Температуры
кипения водородных соединений неметаллов VIА группы
|
|
|
tкип, oС |
Сильные водородные связи между молекулами воды препятствуют ее плавлению и
испарению.
Если водородная связь
объединяет части одной молекулы, то говорят о внутримолекулярной водородной связи. Это особенно характерно
для многих органических соединений, например, для салициловой кислоты.
Если же водородная связь
образуется между атомом водорода одной молекулы и атомом неметалла другой
молекулы (межмолекулярная водородная
связь), то молекулы образуют довольно прочные пары, цепочки,
кольца.
Уксусная, муравьиная и другие
карбоновые кислоты и в жидком, и в газообразном состоянии существуют в виде димеров:
Необходимые для образования водородных связей атомы кислорода и азота
содержат все углеводы, белки, нуклеиновые кислоты.
Известно, например, что глюкоза, фруктоза и сахароза прекрасно растворимы в
воде. Не последнюю роль в этом играют водородные связи, образующиеся в
растворе между молекулами воды и многочисленными OH-группами углеводов.
‼ Вещества, между молекулами которых есть
водородные связи:
1. Вода, лёд.
2. Фтороводород, раствор фтороводорода (плавиковая кислота).
3. Растворы аммиака
NH3
и аминов – между азотом аммиака
(амина) и атомами водорода воды.
4. Органические вещества,
имеющие гидроксильную группу: спирты, фенолы,
карбоновые кислоты.
5. Растворы
углеводов – моносахаридов и
дисахаридов.
6. Белки.
ВАЛЕНТНОСТЬ
–
число связей, образованных данным атомом в данной молекуле.
Например, в молекуле SO3 у серы 6
связей, т.е. сера в этой молекуле имеет валентность VI.

Валентные возможности атомов – весь набор
возможных валентностей.
Они определяются числом неспаренных электронов и возможных
донорно-акцепторных связей (ДАС).
Высшая возможная валентность элементов (без учёта ДАС), как правило, равнa номеру
группы.
Исключения:
А)
азот, кислород, фтор.
Б)
элементы VIII группы (в
главной подгруппе для гелия, неона и в побочной подгруппе для элементов
триад)
В)
элементы I группы
побочной подгруппы – медь, серебро, золото (у них высшая валентность больше
номера группы).
Степень окисления
–
гипотетический заряд у атома в молекуле, рассчитанный, исходя
из предположения об ионном характере всех связей и из того, что в целом
молекула электронейтральна.
Пример:
+1 +6 -2
K2 Cr2 O7 (+1)
∙2 + (+6) ∙2 + (-2) ∙7 = 0
Длина, энергия (прочность) и полярность связи.
Длина связи – расстояние между ядрами атомов в соединении.
Она
зависит:
А)
от радиусов атомов, образующих связь
Б)
от кратности связи (одинарная, двойная, тройная).
Обычно
чем короче связь, тем она прочнее.
Связь
считается прочной, если ее энергия превышает 500 кДж/моль (например, 942
кДж/моль для N2), слабой — если ее энергия меньше 100 кДж/моль
(например, 69 кДж/моль для NO2).
|
HF |
HCl |
HBr |
HI |
|
|
Длина |
92 |
128 |
141 |
160 |
|
Энергия |
565 |
431 |
364 |
217 |
Чем больше кратность связи, тем она прочнее:
тройная>двойная >одинарная.
Энергии связей между атомами углерода.
|
Связь |
Энергия |
|
С-С |
343 |
|
С=С |
615 |
|
С≡С |
812 |
Полярность ковалентной связи
Полярность химической связи зависит от разности электроотрицательностей связываемых
атомов.
Чем больше разность электроотрицательностей двух атомов
в связи, тем она более полярная.
Для ионной связи существует понятие степень ионности, которое тоже
зависит от того, насколько велика разность электроотрицательностей атомов.
По характеру перекрывания различают сигма
σ- и пи- связи — π.
σ-связь- это
связь, в которой перекрывание атомных орбиталей происходит вдоль
оси, связывающей ядра атомов.
Сигма
связь может образовываться всеми типами орбиталей.

Между
двумя атомами в химической частице возможна только одна σ-связь.
При перекрывании параллельных друг другу атомных орбиталей
перпендикулярно оси связи образуются π-связи.

Пи-связь:
дополнительная к сигма связи. Одинарная связь – всегда сигма-связь. Двойная
связь – состоит из 1 сигма и 1 пи-связи.
Тройная
связь: 1 сигма и 2 пи-связи.
|
Одинарная (σ) |
Двойная (σ+π) |
Тройная (σ + π + π) |
|
С–С С–Н С–О H–Cl |
С=O С=С О=О |
С≡С С≡N N≡N |
Гибридизация
Если атом связан с другими атомами ОДИНАКОВЫМИ СВЯЗЯМИ, но при их образовании
участвуют орбитали разного типа, то используется метод ГИБРИДИЗАЦИИ.
Пример: Молекула СН4
имеет форму правильного тетраэдра, в ней все 4 связи имеют одинаковую длину,
прочность, находятся под одинаковыми углами друг к другу.
Однако
у четырёхвалентного атома углерода электроны расположены на трёх р-орбиталях
и одной s-орбитали. Они
разные по энергии, форме и расположены в пространстве иначе.
Для объяснения используется понятие ГИБРИДИЗАЦИИ:
из четырёх атомных орбиталей образуются 4 новых,
гибридных орбитали, которые в пространстве располагаются НА
МАКСИМАЛЬНОМ УДАЛЕНИИ ДРУГ ОТ ДРУГА. Это правильный тетраэдр, углы между
связями равны 109° 29´.
Так как в образовании четырёх связей участвуют одна s и три р-оболочки, то
такой тип гибридизации обозначается sp3
В
зависимости от числа и типа орбиталей, которые принимают участие в
гибридизации, отличают следующие типы гибридизации:
1) sp-гибридизация. Участвуют одна s-орбиталь и одна р-орбиталь. Молекула
имеет линейную структуру, валентный угол – 1800.
2) sp2-гибридизация. Участвуют одна s-орбиталь и две р-орбитали. Молекула
располагается в плоскости (концы гибридных орбиталей направлены к вершинам
равностороннего треугольника), валентный угол – 1200.
3) sp3-гибридизация. Участвуют одна s-орбиталь и три р-орбитали. Молекула
имеет тетраэдрическую форму, валентный угол – 109,280.
Как
определить тип гибридизации?
1.
В гибридизации участвуют сигма-связи и НЕПОДЕЛЁННЫЕ ИОННЫЕ ПАРЫ.
2.
Общее число участвующих орбиталей сигма-связей + электронных пар = числу
гибридных орбиталей и определяет тип гибридизации.
Задание: определить
тип гибридизации атома углерода в молекуле фосгена.
O=C – Cl
Cl
1)
углерод образует 2 одинарные связи (это сигма-связи) и одну двойную связь
(сигма+пи).Все 4 электрона углерода участвуют в образовании этих связей.
2)
таким образом, в гибридизации примут участие ТРИ СИГМА-связи. Это sp2—гибридизация, молекула
имеет форму плоского треугольника. Пи-связь располагается перпендикулярно
плоскости этого треугольника.