Пройти тестирование по этим заданиям
Вернуться к каталогу заданий
Версия для печати и копирования в MS Word
1
Тип 20 № 89
Установите соответствие между формулой соли и продуктом, образующимся на инертном аноде при электролизе ее водного раствора: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Источник: Яндекс: Тренировочная работа ЕГЭ по химии. Вариант 1.
2
Установите соответствие между формулой вещества и продуктом, образующимся на катоде при электролизе его водного раствора: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ПРОДУКТ ЭЛЕКТРОЛИЗА,
ОБРАЗУЮЩИЙСЯ НА КАТОДЕ
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Источник: Яндекс: Тренировочная работа ЕГЭ по химии. Вариант 2.
3
Установите соответствие между формулой соли и продуктом, образующимся на инертном аноде при электролизе её водного раствора: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
4
Установите соответствие между формулой вещества и продуктом, который образуется на инертном аноде в результате электролиза водного раствора этого вещества: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ПРОДУКТ НА АНОДЕ
1) хлор
2) оксид серы(IV)
3) оксид углерода(IV)
4) азот
5) кислород
6) оксид азота(IV)
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
5
Установите соответствие между формулой соли и продуктом, образующимся на катоде при электролизе ее водного раствора: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ПРОДУКТ НА КАТОДЕ
1) водород
2) алюминий
3) ртуть
4) медь
5) кислород
6) натрий
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Пройти тестирование по этим заданиям
- ЕГЭ по химии
Электролиз расплавов и растворов (солей, щелочей, кислот) — задания № 20 ЕГЭ по химии в формате экзамена 2022 года.
40 заданий с ответами.
→ скачать задания
Источник: vk.com/chem4you
Примеры заданий:
Установите соответствие между формулой вещества и способом его электролитического получения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
А) Al
Б) F2
В) S
Г) K
1) электролиз раствора сульфида
2) электролиз раствора сульфата
3) электролиз расплава оксида в растворе криолита
4) электролиз расплава фторида
5) электролиз раствора фторида
6) электролиз раствора ацетата
Установите соответствие между формулами солей и продуктами, которые выделяются на инертном катоде при их электролизе в указанных условиях: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
А) NaF (распл.)
Б) AgNO3 (р-p)
В) MnSO4 (р-р)
Г) RbCl (р-р)
1) кислород
2) водород
3) металл
4) металл, водород
5) галоген
6) оксид неметалла, кислород
Смотрите также:
При электролизе расплавов или водных растворов солей протекают окислительно-восстановительные реакции на электродах (аноде и катоде). В статье рассмотрены расчетные задачи, в которых основной химической реакцией является электролиз — основные приемы и типы решения таких задач.
Какие именно процессы протекают при электролизе и как составлять уравнения химических реакций, протекающих при электролизе, вы можете узнать из статьи.
При решении задач на электролиз необходимо учитывать, что растворенное вещество может подвергнуться электролизу не полностью. Если вещество полностью разложилось под действием тока, далее может протекать электролиз воды по уравнению:
2H2O → O2 + 2H2
При действии тока на растворы некоторых веществ (например, соли активных металлов и кислородсодержащих кислот, щелочи, кислородсодержащие кислоты) количество этих веществ фактически не меняется, т.к. протекающие на катоде и аноде процессы приводят к электролизу воды.
Электролиза с растворимыми электродами в ЕГЭ по химии пока нет.
1. Провели электролиз водного раствора нитрата серебра с инертным анодом. Масса восстановленного на катоде серебра оказалась равной 2,16 г. Какой объём газа (н.у.) выделился на аноде? Вычислите массовую долю кислоты в полученном растворе, если масса раствора 250 г.
Решение и ответ:
Запишем уравнение электролиза раствора нитрата серебра:
4AgNO3 + 2H2O → 4Ag + 4HO3 + O2
Количество вещества серебра, образовавшегося на катоде:
n(Ag) = m/M = 2,16 г/108 г/моль = 0,02 моль
На аноде выделился кислород. Количество кислорода можем определить из количества серебра по уравнению реакции:
n(O2) = 1/4·n(Ag) = 1/4 · 0,02 = 0,005 моль
Объем кислорода:
V(O2) = n·Vm = 0,005·22,4 = 0,112 л
Количество вещества азотной кислоты:
n(HNO3) = n(Ag) = 0,02 моль
m(HNO3) = n·M = 0,02 моль·63 г/моль = 1,26 г
Массовая доля азотной кислоты в полученном растворе:
ω(HNO3) = m(HNO3)/*mр-ра = 1,26/250 = 0,005 = 0,5%
Ответ: V(O2) = 0,112 л, ω(HNO3) = 0,5%
2. Провели полный электролиз 200 г раствора хлорида калия с ω(KCl) = 7,45%. К полученному раствору добавили 50 г раствора фосфорной кислоты с ω(H3PO4) = 19,6%. Определите формулу образовавшейся при этом соли.
Решение и ответ:
Запишем уравнение электролиза раствора хлорида калия:
2KCl + 2H2O → 2KOH + Cl2 + H2
При полном электролизе вступит в реакцию весь хлорид калия. Определим массу и количество вещества хлорида калия:
m(KCl) = mр-ра(KCl) ·ω(KCl) = 200 г · 0,075 = 14,9 г
n(KCl) = m/M =14,9 г / 74,5 г/моль = 0,2 моль
Определим количество образовавшейся щелочи:
n(KOH) = n(KCl) = 0,2 моль
Определим количество фосфорной кислоты:
m(H3PO4) = mр-ра(H3PO4) ·ω(H3PO4) = 50 г · 0,196 = 9,8 г
n(H3PO4) = m/M =9,8 г / 98 г/моль = 0,1 моль
При взаимодействии фосфорной кислоты с щелочью возможно образование трех типов солей:
H3PO4 + KOH → KH2PO4 + H2O
H3PO4 + 2KOH → K2HPO4 + 2H2O
H3PO4 + 3KOH → K3PO4 + 3H2O
При соотношении кислоты и щелочи n(H3PO4):n(KOH) = 0,1:0,2 или 1:2 протекает вторая реакция и образуется гидрофосфат калия. Количество вещества гидрофосфата калия равно:
n(K2HPO4) = n(H3PO4) = 0,1 моль
Ответ: K2HPO4
3. В процессе электролиза 500 мл раствора гидроксида натрия с ω(NaОН) = 4,6% (ρ = 1,05 г/мл) массовая доля NaОН в растворе увеличилась до 10%. Вычислите объёмы газов (н.у.), выделившихся на электродах.
Решение и ответ:
Уравнение реакции, которая протекает при электролизе раствора гидроксида натрия:
2H2O → O2 + 2H2
Фактически, на катоде восстанавливается водород, на аноде окисляется кислород. Количество щелочи в растворе при этом не изменяется. Определим количество щелочи:
mр-ра(NaOH) = Vр-ра(NaOH) ·ρ(NaOH) = 500 мл · 1,05 г/мл = 525 г
m(NaOH) = mр-ра(NaOH) ·ω(NaOH) = 525 г · 0,046 = 24,15 г
n(NaOH) = m/M =24,15 г / 40 г/моль = 0,604 моль
За счет чего же меняется массовая доля? Все очень просто — за счет электролиза воды. Зная, что масса гидроксида натрия не изменилась, найдем массу конечного раствора:
mр-ра,2(NaOH) = m(NaOH) / ω(NaOH) = 24,15 г / 0,1 = 241,5 г
Количество воды, которая подверглась электролизу:
m(H2O) = mр-ра,1(NaOH) – mр-ра,2(NaOH) = 525 – 241,5 = 283,5 г
n(H2O) = m/M =283,15 г / 18 г/моль = 15,75 моль
Из уравнения электролиза определим количество вещества водорода и кислорода и их массу:
n(H2) = n(H2O) = 15,75 моль
V(H2) = n·Vm =15,75 моль · 22,4 л/моль = 352,8 л
n(О2) = 1/2·n(H2O) = 7,875 моль
V(O2) = n·Vm = 7,875 моль · 22,4 л/моль = 176,4 л
Ответ: V(H2) = 352,8 л, V(O2) = 176,4 л
4. При электролизе (с инертным анодом) 235 г раствора нитрата меди (II) с ω(Cu(NO3)2) = 20% на катоде выделилось 9,6 г металла. Вычислите объём газа (н.у.), выделившегося на аноде, и массовые доли кислоты и соли в оставшемся растворе.
5.При электролизе раствора хлорида натрия на катоде выделилось 13,44 л водорода (н.у.). Хлор, выделившийся на аноде, поглотили горячим раствором гидроксида калия. Рассчитайте количества солей – хлорида калия и хлората калия, − образовавшихся в растворе в результате реакции.
6. В результате электролиза раствора хлорида натрия получили раствор, содержащий 20 г гидроксида натрия. Газ, выделившийся на аноде, полностью прореагировал с 500 мл раствора йодида калия. Рассчитайте объём газа (н.у.), выделившегося на аноде и массовую долю йодида калия в растворе.
7. При электролизе 200 г раствора хлорида натрия с массовой долей соли 17,55% из раствора выделилось 3,36 л хлора (н.у.). Определите массовые доли веществ в растворе после прекращения электролиза.
8. При проведении электролиза 500 г 16% раствора сульфата меди (II) процесс прекратили, когда на аноде выделилось 1,12 л газа. Из полученного раствора отобрали порцию массой 98,4 г. Вычислите массу 20%-ного раствора гидроксида натрия, необходимого для полного осаждения ионов меди из отобранной порции раствора.
Решение.
Во-первых, составляем уравнение реакции электролиза раствора сульфата меди. Как это делать, подробно описано в статье Электролиз.
2CuSO4 + 2H2O → 2Cu + 2H2SO4 + O2
Находим массу чистого сульфата меди:
m(CuSO4) = mраствора*ω(CuSO4) = 500*0,16 = 80 г
Количество вещества сульфата меди:
n(CuSO4) = m/M = 80/160 = 0,5 моль
Видно, что на аноде должно выделиться 0,25 моль газа, или 5,6 л.
Однако, в условии сказано, что выделилось только 1,12 л газа. Следовательно, сульфат меди прореагировал не полностью, а только частично.
Находим количество и массу кислорода, который выделился на аноде:
n(O2) = V/Vm = 1,12/22,4 = 0,05 моль,
m(O2) = n*M = 0,05*32 = 1,6 г.
Следовательно, в электролиз вступило 0,1 моль сульфата меди.
В растворе осталось 0,4 моль сульфата меди. При этом образовалось 0,1 моль серной кислоты массой 9,8 г и 0,1 моль меди выпало в осадок (масса меди 6,4 г).
При этом масса полученного раствора после электролиза mр-ра2 равна:
mр-ра2 = 500 – 1,6 – 6,4 = 492 г
Из полученного раствора отобрали порцию массой 98,4 г. При этом количество растворенных веществ поменялось. Зато не поменялась их массовая доля. Найдем массовую долю сульфата меди ω(CuSO4)2 и серной кислоты ω(H2SO4) в растворе, который остался после электролиза:
m(CuSO4)ост = n*M = 0,4*160 = 64 г
ω(CuSO4)2 = m(CuSO4)2/*mр-ра2 = 64/492 = 0,13 = 13%
ω(H2SO4) = m(H2SO4)/*mр-ра2 = 9,8/492 = 0,02 = 2%
Найдем массу и количество серной кислоты и массу сульфата меди в порции массой mр-ра3 = 98,4 г, которую мы отобрали:
m(CuSO4)3 = ω(CuSO4)2*mр-ра3 = 0,13*98,4 = 12,79 г
m(H2SO4)2 = ω(H2SO4)*mр-ра3 = 0,02*98,4 = 1,97 г
n(CuSO4) = m/M = 12,79/160 = 0,08 моль
n(H2SO4) = m/M = 1,97/98 = 0,02 моль
Чтобы осадить ионы меди, гидроксид натрия должен прореагировать и с серной кислотой в растворе, и с сульфатом меди:
H2SO4 + 2NaOH = Na2SO4 + 2H2O
CuSO4 + 2NaOH = Cu(OH)2 + 2H2O
В первой реакции израсходуется 0,04 моль гидроксида натрия, во второй реакции 0,16 моль гидроксида натрия. Всего потребуется 0,2 моль гидроксида натрия. Или 8 г чистого NaOH, что соответствует 40 г 20%-ного раствора.
Ответ: масса раствора 40 г.
Задача из досрочного ЕГЭ по химии-2020 на электролиз:
9. Через 640 г 15%-ного раствора сульфата меди(II) пропускали электрический ток до тех пор, пока на аноде не выделилось 11,2 л (н.у.) газа. К образовавшемуся раствору добавили 665,6 г 25%-ного раствора хлорида бария. Определите массовую долю хлорида бария в полученном растворе. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения
искомых физических величин).
Уравнения реакций:
2CuSO4 + 2H2O = 2Cu↓ + 2H2SO4 + O2↑ (электролиз)
2H2O = 2H2↑ + O2↑ (электролиз)
BaCl2 + H2SO4 = BaSO4↓ + 2HCl
Количество вещества реагентов и масса продуктов реакций:
m(CuSO4) = 640 · 0,15 = 96 г n(CuSO4 ) = 96 / 160 = 0,6 моль
n(O2) = 11,2 / 22,4 = 0,5 моль
n(Cu) = n(CuSO4) = 0,6 моль
m(Cu) = 0,6 · 64 = 38,4 г
n(H2SO4) = n(CuSO4 ) = 0,6 моль
n(O2 [1]) = 0,5n(CuSO4) = 0,3 моль
n(O2 [2]) = 0,5 – 0,3 = 0,2 моль
n(H2O прореаг.) = 2n(O2 [2]) = 0,4 моль
m(H2O прореаг.) = 0,4 · 18 = 7,2 г
m(O2 [1]) = 32 · 0,3 = 9,6 г
m(BaCl2) = 665,6 · 0,25 = 166,4 г
n(BaCl2) = 166,4 / 208 = 0,8 моль
n(BaCl2 прореаг.) = n(H2SO4) = 0,6 моль
n(BaCl2 осталось) = 0,8 – 0,6 = 0,2 моль
m(BaCl2 осталось) = 0,2 · 208 = 41,6 г
n(BaSO4) = n(BaCl2 прореаг.) = 0,6 моль
m(BaSO4) = 0,6 · 233 = 139,8 г
Массовая доля хлорида бария в растворе:
m(р-ра) = 640 + 665,6 – 38,4 – 7,2 – 139,8 – 9,6 = 1110,6 г
ω(BaCl2) = 41,6 / 1110,6 = 0,037, или 3,7 %
Ответ: ω(BaCl2) = 3,7 %
10. В результате электролиза раствора хлорида натрия получили раствор, содержащий 20 г гидроксида натрия. Газ, выделившийся на аноде, полностью прореагировал с 500 мл раствора иодида калия. Рассчитайте объём газа (н.у.) и молярную концентрацию использованного раствора иодида калия.
11. При электролизе 200 г раствора гидроксида натрия с ω(NaОН) = 4% на аноде выделилось 44,8 л (н.у.) кислорода. Какой объём водорода выделился на катоде, и какой стала массовая доля NaOH в растворе после электролиза?
12. При электролизе 200 г раствора хлорида натрия с массовой долей соли 17,55% из раствора выделилось 3,36 л хлора (н.у.). Определите массовые доли веществ в растворе после прекращения электролиза.
13. При электролизе (с инертным анодом) 235 г раствора нитрата меди(II) с ω(Cu(NO3)2) = 20% на катоде выделилось 9,6 г металла. Вычислите объём газа (н.у.), выделившегося на аноде, и массовые доли кислоты и соли в оставшемся
растворе.
14. При электролизе 900г 3%-ного раствора нитрата натрия на аноде выделилось 90л (н.у.) кислорода. Определите массовую долю нитрата натрия в растворе после окончания электролиза.
15. Какую массу свинца можно получить при электролизе 200г раствора нитрата свинца с массовой долей 10%?
16. Для нейтрализации кислоты, образовавшейся после электролиза нитрата серебра, потребовалось 145,5мл 10%-ного раствора гидроксида натрия с плотностью 1,1г/мл. Определите массу выделившегося на катоде серебра.
Ответ: 43,2г
17. После электролиза 500г водного раствора сульфата меди масса раствора уменьшилась на 8г. Оставшийся раствор нацело прореагировал с 8,96л (н.у.) сероводорода. Определите массовую долю сульфата серебра в исходном растворе и массовые доли веществ, оставшихся в растворе после электролиза.
18. После электролиза с инертными электродами 500г водного раствора сульфата меди с массовой долей 16% масса раствора уменьшилась на 16г. Определите массу меди, выделившейся на катоде и массовые доли веществ, оставшихся в растворе после электролиза.
19. После электролиза 250 г раствора нитрата ртути (II) с массовой долей соли 19,5% масса раствора уменьшилась на 20,22%. Определите массы веществ, выделившихся на электродах, и молярную концентрацию веществ в конечном растворе, если его плотность составила 1,06 мл.
20. В результате электролиза 400мл 20%-ного раствора CuSO4 с плотностью 1,2г/мл на аноде выделилось 4,48л (н.у.) газа. Определите массы веществ, выделившихся на электродах и массовые доли веществ в конечном растворе.
21. После электролиза 200г 2%-ного водного раствора гидроксида натрия массовая доля гидроксида натрия увеличилась на 0,44%. Определите количества веществ, выделившихся на катоде и аноде.
22. При электролизе соли металла, проявляющего в своих соединениях степени окисления +2 и +3, на катоде было получено 2,6 г металла, а на аноде выделился 1,68 л (н.у.) газа с плотностью по водороду 35,5. Определите формулу соли, которая подверглась электролизу.
Ответ: CrCl3
23. 150 г раствора, содержащего 8% сульфата меди (II) и 11,7% хлорида натрия, подвергли электролизу. Электролиз прекратили, когда на катоде выделилось 1,12л (н.у.) водорода. Определите, какие вещества находятся в растворе после электролиза, а также их количество.
24. Раствор, содержащий по 0,2 моль нитрата меди (II), хлорида калия и сульфата рубидия, подвергли электролизу до полного выделения меди. Определите объёмы газов, выделившихся на электродах, и количества веществ в полученном растворе. Какова среда конечного раствора?
25. Раствор, содержащий 0,1моль нитрата ртути (II), 0,3 моль хлорида калия и 0,2моль сульфата натрия подвергли электролизу до полного выделения хлора. Определите объёмы газов, выделившихся на электродах и количества веществ в полученном растворе. Какова среда полученного раствора?
Другие задачи на электролиз:
26. Электролиз 282 г 40%-ного раствора нитрата меди (II) остановили после того, когда масса раствора уменьшилась на 32 г. К образовавшемуся раствору добавили 140 г 40%-ного раствора гидроксида натрия. Определите массовую долю щелочи в полученном растворе.
27. При проведении электролиза 340 г 20%-ного раствора нитрата серебра (I) процесс прекратили, когда на аноде выделилось 1, 12 л газа. Из полученного раствора отобрали порцию массой 79,44 г. Вычислите массу 10%-ного раствора хлорида натрия, необходимого для полного осаждении ионов серебра из отобранной порции раствора.
28. При проведении электролиза 312 г 15%-ного раствора хлорида натрия процесс прекратили, когда на катоде выделилось 6,72 л газа. Из полученного раствора отобрали порцию массой 58,02 г. Вычислите массу 20%-ного раствора сульфата меди (II), необходимого для полного осаждения гидроксид-ионов из отобранной порции раствора.
29. Электролиз 640 г 15%-ного раствора сульфата меди (II) остановили после того, когда масса раствора уменьшилась на 32 г. К образовавшемуся раствору добавили 400 г 20%-ного раствора гидроксида натрия. Определите массовую долю щелочи в полученном растворе.
30. При проведении электролиза 360 г 18,75% раствора хлорида меди (II) процесс прекратили, когда на аноде выделилось 4,48 л газа. Из полученного раствора отобрали порцию массой 22,2 г. Вычислите массу 20 %-ного раствора гидроксида натрия, необходимого для полного осаждения ионов меди из отобранной порции раствора.
31. При проведении электролиза 624 г 10%-ного раствора хлорида бария процесс прекратили, когда на катоде выделилось 4,48 л газа. Из полученного раствора отобрали порцию массой 91,41 г. Вычислите массу 10%-ного раствора карбоната натрия, необходимого для полного осаждения ионов бария из отобранной порции раствора.
32. При проведении электролиза 500 г 16%-ного раствора сульфата меди (II) процесс прекратили, когда на аноде выделилось 1,12 л газа. К образовавшемуся раствору прибавили 53 г 10%-ного раствора карбоната натрия. Определите массовую долю сульфата меди (II) в полученном растворе.
33. Через 200 г раствора поваренной соли, содержащего 17,55 мас. % NaСl, некоторое время пропускали постоянный ток. Выделилось 3,36 л хлора (н.у.). Определите концентрации веществ в мaс.% в полученном растворе.
34. При электролизе 188 г 50 мас. % раствора нитрата меди (II) на катоде выделилось 19,2 г металла. Найти объем газа (н.у.), выделившегося на аноде, и концентрации кислоты и соли в массовых процентах в электролизере.
35. После электролиза 250 г раствора нитрата ртути (II) с массовой долей соли 19,5 % масса раствора уменьшилась на 10,85 г. Определите количества веществ, выделившихся на электродах и массовые доли веществ в оставшемся растворе.
36. 50 г водного раствора сульфата меди подвергли электролизу, при этом на аноде выделилось 2,8 л газа (н.у.). Определите массовую долю сульфата меди в исходном растворе, если известно, что после электролиза масса раствора составила 42,4 г.
37. Определите состав раствора (в массовых долях), полученного в результате электролиза 100 г раствора сульфата меди, если известно, что во время электролиза на аноде выделилось 2,8 л газа (н.у.), а масса раствора после электролиза составила 92,4 г.
38. 117 г раствора хлорида натрия с массовой долей соли 5 % в течение некоторого времени подвергали электролизу. При этом на электродах выделилось 8,96 л газов (н.у.). Определите состав раствора после электролиза (в массовых долях).
39. Для проведения электролиза (на инертных электродах) взяли 500 г 16%-ного раствора сульфата меди(II). После того как на аноде выделилось 1,12 л (н.у.) газа, процесс остановили. К образовавшемуся в процессе электролиза раствору добавили 53 г 10%-ного раствора карбоната натрия. Определите массовую долю сульфата меди(II) в полученном растворе.
2CuSO4 + 2H2O = 2Cu + 2H2SO4 + O2 (электролиз)
Na2CO3 + H2SO4 = Na2SO4 + CO2 + H2O
Ответ: w(CuSO4) = 11,79%
40. Для проведения электролиза (на инертных электродах) взяли 500 г 16%-ного раствора сульфата меди(II). После того как на аноде выделилось 1,12 л (н.у.) газа, процесс остановили. Из полученного раствора отобрали порцию массой 98,4 г. Вычислите массу 20%-ного раствора гидроксида натрия, который нужно добавить к отобранной порции раствора до полного осаждения ионов меди.
2CuSO4 + 2H2O = 2Cu + 2H2SO4 + O2 (электролиз)
H2SO4 + 2NaOH = Na2SO4 + 2H2O
CuSO4 + 2NaOH = Cu(OH)2 + Na2SO4
Ответ: m(раствора NaOH) = 40 г
41. Для проведения электролиза (на инертных электродах) взяли 135 г 40%-ного раствора хлорида меди(II). После того как масса раствора уменьшилась на 27 г, процесс остановили. К образовавшемуся раствору добавили 160 г 30%-ного раствора гидроксида натрия. Определите массовую долю щёлочи в полученном растворе.
CuCl2 = Cu + Cl2 (электролиз)
CuCl2 + 2NaOH = Cu(OH)2 + 2NaCl
Ответ: w(NaOH) = 12,88%
42. Для проведения электролиза (на инертных электродах) взяли 390 г 15%-ного раствора хлорида натрия. После того как масса раствора уменьшилась на 21,9 г, процесс остановили. К образовавшемуся раствору добавили 160 г 20%-ного раствора сульфата меди(II). Определите массовую долю хлорида натрия в полученном растворе.
2NaCl + 2H2O = H2 + 2NaOH + Cl2 (электролиз)
CuSO4 + 2NaOH = Cu(OH)2 + Na2SO4
Ответ: w(NaCl) = 4,6%
43. Для проведения электролиза (на инертных электродах) взяли 340 г 20%-ного раствора нитрата серебра. После того как на аноде выделилось 1,12 л (н.у.) газа, процесс остановили. Из полученного раствора отобрали порцию массой 79,44 г. Вычислите массу 10%-ного раствора хлорида натрия, необходимого для полного осаждения ионов серебра из отобранной порции раствора.
4AgNO3 + 2H2O = 4Ag + 4HNO3 + O2 (электролиз)
AgNO3 + NaCl = AgCl + NaNO3
Ответ: m(раствора NaCl) = 29,25 г
44. Для проведения электролиза (на инертных электродах) взяли 170 г 40%-ного раствора нитрата серебра. После того как на аноде выделилось 1,12 л (н.у.) газа, процесс остановили. К образовавшемуся в процессе электролиза раствору добавили 175,5 г 10%-ного раствора хлорида натрия. Определите массовую долю хлорида натрия в полученном растворе.
4AgNO3 + 2H2O = 4Ag + 4HNO3 + O2 (электролиз)
AgNO3 + NaCl = AgCl + NaNO3
Ответ: w(NaCl) = 2%
45. Для проведения электролиза (на инертных электродах) взяли 282 г 40%-ного раствора нитрата меди(II). После того как масса раствора уменьшилась на 32 г, процесс остановили. К образовавшемуся раствору добавили 140 г 40%-ного раствора гидроксида натрия. Определите массовую долю щёлочи в полученном растворе.
2Cu(NO3)2 + 2H2O = 2Cu + 4HNO3 + O2 (электролиз)
HNO3 + NaOH = NaNO3 + H2O
Cu(NO3)2 + 2NaOH = Cu(OH)2 + 2NaNO3
Ответ: w(NaOH) = 2,16%
46. Для проведения электролиза (на инертных электродах) взяли 640 г 15%-ного раствора сульфата меди(II). После того как масса раствора уменьшилась на 32 г, процесс остановили. К образовавшемуся раствору добавили 400 г 20%-ного раствора гидроксида натрия. Определите массовую долю щёлочи в полученном растворе.
2CuSO4 + 2H2O = 2Cu + 2H2SO4 + O2 (электролиз)
H2SO4 + 2NaOH = Na2SO4 + 2H2O
CuSO4 + 2NaOH = Cu(OH)2 + Na2SO4
Ответ: w(NaOH) = 3,2%
47. Для проведения электролиза (на инертных электродах) взяли 234 г 20%-ного раствора хлорида натрия. После того как на катоде выделилось 6,72 л (н.у.) газа, процесс остановили. К образовавшемуся в процессе электролиза раствору добавили 160 г 20%-ного раствора сульфата меди(II). Определите массовую долю щёлочи в полученном растворе.
2NaCl + 2H2O = H2 + 2NaOH + Cl2 (электролиз)
CuSO4 + 2NaOH = Cu(OH)2 + Na2SO4
Ответ: w(NaOH) = 2,3%
48. Для проведения электролиза (на инертных электродах) взяли 470 г 20%-ного раствора нитрата меди(II). После того как масса раствора уменьшилась на 24 г, процесс остановили. К образовавшемуся раствору добавили 212 г 10%-ного раствора карбоната натрия. Определите массовую долю нитрата меди(II) в полученном растворе.
2Cu(NO3)2 + 2H2O = 2Cu + 4HNO3 + O2 (электролиз)
Na2CO3 + 2HNO3 = 2NaNO3 + CO2 + H2O
Ответ: w(Cu(NO3)2) = 5,79%
49. Для проведения электролиза (на инертных электродах) взяли 360 г 18,75%-ного раствора хлорида меди(II). После того как на аноде выделилось 4,48 л (н.у.) газа, процесс остановили и отобрали порцию полученного раствора массой 22,2 г. Вычислите массу 20%-ного раствора гидроксида натрия, необходимого для полного осаждения ионов меди из отобранной порции раствора.
CuCl2 = Cu + Cl2 (электролиз)
CuCl2 + 2NaOH = Cu(OH)2 + 2NaCl
Ответ: m(раствора NaOH) = 8 г
50. Для проведения электролиза (на инертных электродах) взяли 376 г 30%-ного раствора нитрата меди(II). После того как на аноде выделилось 4,48 л (н.у.) газа, процесс остановили. К образовавшемуся в процессе электролиза раствору добавили 224 г 25%-ного раствора гидроксида натрия. Определите массовую долю щёлочи в полученном растворе.
2Cu(NO3)2 + 2H2O = 2Cu + 4HNO3 + O2 (электролиз)
HNO3 + NaOH = NaNO3 + H2O
Cu(NO3)2 + 2NaOH = Cu(OH)2 + 2NaNO3
Ответ: w(NaOH) = 1,46%
51. Для проведения электролиза (на инертных электродах) взяли 624 г 10%-ного раствора хлорида бария. После того как на катоде выделилось 4,48 л (н.у.) газа, процесс остановили. Из полученного раствора отобрали порцию массой 91,41 г. Вычислите массу 10%-ного раствора карбоната натрия, необходимого для полного осаждения ионов бария из отобранной порции раствора.
BaCl2 + 2H2O = H2 + Ba(OH)2 + Cl2 (электролиз)
Ba(OH)2 + Na2CO3 = BaCO3 + 2NaOH
BaCl2 + Na2CO3 = BaCO3 + 2NaCl
Ответ: m(раствора Na2CO3) = 47,7 г
52. Для проведения электролиза (на инертных электродах) взяли 312 г 15%-ного раствора хлорида натрия. После того как на катоде выделилось 6,72 л (н.у.) газа, процесс остановили и отобрали порцию полученного раствора массой 58,02 г. Вычислите массу 20%-ного раствора сульфата меди(II), необходимого для полного осаждения гидроксид-ионов из отобранной порции раствора.
2NaCl + 2H2O = H2 + 2NaOH + Cl2 (электролиз)
CuSO4 + 2NaOH = Cu(OH)2 + Na2SO4
Ответ: m(раствора CuSO4) = 48 г
53. Для проведения электролиза (на инертных электродах) взяли 340 г 20%-ного раствора нитрата серебра. После того как масса раствора уменьшилась на 23,2 г, процесс остановили. К образовавшемуся раствору добавили 175,5 г 20%-ного раствора хлорида натрия. Определите массовую долю хлорида натрия в полученном растворе.
4AgNO3 + 2H2O = 4Ag + 4HNO3 + O2 (электролиз)
AgNO3 + NaCl = AgCl + NaNO3
Ответ: w(NaCl) = 5,05%
53. Для проведения электролиза (на инертных электродах) взяли 270 г 20%-ного раствора хлорида меди(II). После того как на аноде выделилось 4,48 л (н.у.) газа, процесс остановили. К образовавшемуся в процессе электролиза раствору добавили 120 г 20%-ного раствора гидроксида натрия. Определите массовую долю щёлочи в полученном растворе.
CuCl2 = Cu + Cl2 (электролиз)
CuCl2 + 2NaOH = Cu(OH)2 + 2NaCl
Ответ: w(NaOH) = 2,3%
54. Для проведения электролиза (на инертных электродах) взяли 360 г 15%-ного раствора хлорида меди(II). После того как на аноде выделилось 4,48 л (н.у.) газа, процесс остановили. Из полученного раствора отобрали порцию массой 66,6 г. Вычислите массу 10%-ного раствора гидроксида натрия, необходимого для полного осаждения ионов меди из отобранной порции раствора.
CuCl2 = Cu + Cl2 (электролиз)
CuCl2 + 2NaOH = Cu(OH)2 + 2NaCl
Ответ: m(раствора NaOH) = 32 г
55. Для проведения электролиза (на инертных электродах) взяли 170 г 15%-ного раствора хлорида лития. После того как на аноде выделилось 2,24 л (н.у.) газа, процесс остановили. К образовавшемуся в процессе электролиза раствору добавили 410 г 16%-ного раствора фосфата натрия. Определите массовую долю фосфата натрия в полученном растворе.
2LiCl + 2H2O = H2 + 2LiOH + Cl2 (электролиз)
3LiOH + Na3PO4 = Li3PO4 + 3NaOH
3LiCl + Na3PO4 = Li3PO4 + 3NaCl
Ответ: w(Na3PO4) = 6%
56. Для проведения электролиза (на инертных электродах) взяли 624 г 10%-ного раствора хлорида бария. После того как на катоде выделилось 4,48 л (н.у.) газа, процесс остановили. К образовавшемуся раствору добавили 265 г 20%-ного раствора карбоната натрия. Определите массовую долю карбоната натрия в полученном растворе.
BaCl2 + 2H2O = H2 + Ba(OH)2 + Cl2 (электролиз)
Ba(OH)2 + Na2CO3 = BaCO3 + 2NaOH
BaCl2 + Na2CO3 = BaCO3 + 2NaCl
Ответ: w(Na2CO3) = 2,6%
57. Для проведения электролиза (на инертных электродах) взяли 240 г 40%-ного раствора сульфата меди(II). После того как на аноде выделилось 4,48 л (н.у.) газа, процесс остановили. К образовавшемуся в процессе электролиза раствору добавили 665,6 г 25%-ного раствора хлорида бария. Определите массовую долю хлорида бария в полученном растворе.
2CuSO4 + 2H2O = 2Cu + 2H2SO4 + O2 (электролиз)
H2SO4 + BaCl2 = BaSO4 + 2HCl
CuSO4 + BaCl2 = BaSO4 + CuCl2
Ответ: w(BaCl2) = 5,67%
58. Для проведения электролиза (на инертных электродах) взяли 372,5 г 20%-ного раствора хлорида калия. После того как масса раствора уменьшилась на 29,2 г, процесс остановили. К образовавшемуся раствору добавили 152 г 20%-ного раствора сульфата железа(II). Определите массовую долю хлорида калия в полученном растворе.
2KCl + 2H2O = H2 + 2KOH + Cl2 (электролиз)
FeSO4 + 2KOH = Fe(OH)2 + K2SO4
Ответ: w(KCl) = 3,12%
59. Для проведения электролиза (на инертных электродах) взяли 80 г 20%-ного раствора сульфата меди(II). После того как на аноде выделилось 0,896 л (н.у.) газа, процесс остановили. К образовавшемуся раствору добавили 28 г порошка железа. Определите массовую долю сульфата железа(II) в полученном растворе.
2CuSO4 + 2H2O = 2Cu + 2H2SO4 + O2 (электролиз)
Fe + CuSO4 = FeSO4 + Cu
Fe + H2SO4 = FeSO4 + H2
Ответ: w(FeSO4) = 19,5%
60. Для проведения электролиза (на инертных электродах) взяли 340 г 40%-ного раствора нитрата серебра. После того как масса раствора уменьшилась на 46,4 г, процесс остановили. К образовавшемуся раствору добавили 207,5 г 40%-ного раствора иодида калия. Определите массовую долю иодида калия в полученном растворе.
4AgNO3 + 2H2O = 4Ag + 4HNO3 + O2 (электролиз)
AgNO3 + KI = AgI + KNO3
Ответ: w(KI) = 4,08%
61. Для проведения электролиза (на инертных электродах) взяли 180 г 37,5%-ного раствора хлорида меди(II). После того как на аноде выделилось 6,72 л (н.у.) газа, процесс остановили. Из полученного раствора отобрали порцию массой 55,8 г. Вычислите массу 10%-ного раствора сульфида натрия, необходимого для полного осаждения ионов меди из отобранной порции раствора.
CuCl2 = Cu + Cl2 (электролиз)
CuCl2 + Na2S = CuS + 2NaCl
Ответ: m(раствора Na2S) = 62,4 г
62. Для проведения электролиза (на инертных электродах) взяли 270 г 20%-ного раствора хлорида меди(II). После того как масса раствора уменьшилась на 40,5 г, процесс остановили. К образовавшемуся раствору добавили 70 г 40%-ного раствора гидроксида калия. Определите массовую долю щёлочи в полученном растворе.
CuCl2 = Cu + Cl2 (электролиз)
CuCl2 + 2KOH = Cu(OH)2 + 2KCl
Ответ: w(KOH) = 5,8%
63. Для проведения электролиза (на инертных электродах) взяли 640 г 20%-ного раствора сульфата меди(II). После того как на аноде выделилось 5,6 л (н.у.) газа, процесс остановили. К образовавшемуся раствору добавили 65 г порошка цинка. Определите массовую долю сульфата цинка в полученном растворе.
2CuSO4 + 2H2O = 2Cu + 2H2SO4 + O2 (электролиз)
Zn + CuSO4 = ZnSO4 + Cu
Zn + H2SO4 = ZnSO4 + H2
Ответ: w(ZnSO4) = 20,4%
По теме: методические разработки, презентации и конспекты
Решение вероятностных задач в формате ЕГЭ
В данной методической разработке представлены приемы решения вероятностных задач в формате ЕГЭ, а также примеры задач подобного типа….
Диагностическая (контрольная) работа по теме «Задачи на дроби» (6 класс) в формате ФГОС ООО
Структура и содержание контрольной работы соответствуют требованиям ФГОС ООО к предметным и метапредметным образовательным результатам….
Методическая разработка по теме: «Решение задач формата ГИА в электронных таблицах»
Методическая разработка по теме: «Решение задач формата ГИА в электронных таблицах». Рекомендации учащимся 9 классов при подготовке к выполнению заданий.Задачи на применение электронных таблиц с …
Методическая разработка «Контрольные работы по математике 5-7 класс как базовые задачи для подготовки к экзамену в формате ОГЭ»
Авторская подборка контрольных работ по математике 5-7 класс для подготовки к экзамену в формате ОГЭ…
Задачи по геометрии в формате ОГЭ для контроля знаний и подготовки к экзаменам в 9 классе,
Подбор задач в формате ОГЭ для контроля и отработки умений решать. 7 вариантов по 5 задач с №9 по № 13 взяты из образовательного портала для подготовки к экзаменов учащихся 9 классов,…
Конспект урока по физике «Ток в электролитах. Явление электролиза. Закон электролиза»
Методическая разработка содержит конспект урока по физике с использованием технологий развития критического мышления. Тема урока »Ток в электролитах. Явление электролиза.Закон электролиза&quo…
Урок-занятие элективного учебного предмета «На пути к созданию текста» в 9 классе Тема занятия: Создание текстов формата ОГЭ. Цель занятия: написать сочинения формата С15-1, С15-2, С15-3 Задачи:
Конспект урока-занятия учебного элективного предмета «Путь к создани текста». Занятие направлено на анализ текста с целью написания трёх видов сочинений формата ОГЭ, адресовано учащимся 9 кл…
Региональный конкурс «Лучшая методическая разработка»
Номинация №3 «Лучшая авторская разработка комплекта учебно-методических материалов/ методических рекомендаций»
Методическая разработка: Тренажер по подготовке к ЕГЭ по химии «Решение задач на электролиз растворов и расплавов электролитов»
Разработала: Сластная Оксана Анатольевна, учитель химии и биологии
МБОУ «Мишелёвская СОШ №19»
2022
Оглавление
Немного теории 3
Задание 20 7
Задание 20 для самостоятельной работы 10
Задание 31 13
Задание 31 для самостоятельной работы 14
Задание 32 14
Задание 32 для самостоятельной работы 15
Ответы к заданиям для самостоятельной работы 16-17
Немного теории
Электролиз – совокупность окислительно-восстановительных процессов, протекающих на катоде и аноде при пропускании электрического тока через растворы или расплавы электролитов.
Катод–отрицательно заряженный электрод, к которому притягиваются катионы.
Анод– положительно заряженный электрод, к которому притягиваются анионы.
Инертные электроды состоят из вещества, не участвующего в реакции электролиза
Катион – положительно заряженный ион.
Анион – отрицательно заряженный ион











Задание 20
1. Установите соответствие между формулой соли и продуктом, образующимся на инертном аноде при электролизе ее водного раствора: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
|
ФОРМУЛА СОЛИ |
ПРОДУКТ НА АНОДЕ |
|
|
А) Б) В) Г) |
1) 2) 3) 4) 5) 6) |
|
А |
Б |
В |
Г |
|
3 |
5 |
3 |
4 |
2. Установите соответствие между формулой соли и продуктом, образующимся на катоде при электролизе ее водного раствора: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
|
ФОРМУЛА СОЛИ |
ПРОДУКТ НА КАТОДЕ |
||
|
A) Б) B) Г) |
1) водород 2) алюминий 3) ртуть 4) медь 5) кислород 6) натрий |
||
|
А |
Б |
В |
Г |
|
1 |
3 |
4 |
1 |
3. Установите соответствие между названием вещества и способом его получения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
|
НАЗВАНИЕ ВЕЩЕСТВА |
ПОЛУЧЕНИЕ ЭЛЕКТРОЛИЗОМ |
||
|
A) литий Б) фтор B) серебро Г) магний |
1) раствора 2) расплава 3) раствора 4) раствора 5) расплава 6) расплава |
||
|
А |
Б |
В |
Г |
|
2 |
2 |
4 |
6 |
4. Установите соответствие между формулой соли и продуктом, образующимся на катоде при электролизе её водного раствора: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
|
ФОРМУЛА СОЛИ |
ПРОДУКТ НА КАТОДЕ |
|
|
A) Б) B) Г) |
1) 2) 3) 4) 5) 6) |
|
А |
Б |
В |
Г |
|
2 |
2 |
1 |
1 |
5. Установите соответствие между формулой соли и продуктом, образующимся на инертном аноде при электролизе её водного раствора: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
|
ФОРМУЛА СОЛИ |
ПРОДУКТ НА АНОДЕ |
||
|
А) Б) В) Г) |
1) метан 2) сернистый газ 3) кислород 4) водород 5) бром 6) этан |
||
|
А |
Б |
В |
Г |
|
3 |
6 |
5 |
3 |
6. Установите соответствие между формулой соли и уравнением процесса, протекающего на катоде при электролизе её водного раствора: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
|
ФОРМУЛА СОЛИ |
УРАВНЕНИЕ КАТОДНОГО ПРОЦЕССА |
||
|
A) Б) B) Г) |
1) 2) 3) 4) 5) 6) |
||
|
А |
Б |
В |
Г |
|
2 |
6 |
5 |
6 |
7. Установите соответствие между формулой соли и схемой процесса, протекающего на инертном аноде при электролизе её водного раствора: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
|
ФОРМУЛА СОЛИ |
СХЕМА ПРОЦЕССА НА АНОДЕ |
||
|
A) Б) B) Г) |
1) 2) 3) 4) 5) 6) |
||
|
А |
Б |
В |
Г |
|
3 |
3 |
2 |
2 |
8. Установите соответствие между формулой вещества и простым веществом, которое образуется на катоде в результате электролиза его водного раствора: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
|
ФОРМУЛА ВЕЩЕСТВА |
ПРОДУКТ ЭЛЕКТРОЛИЗА |
||
|
A) Б) B) Г) |
1) 2) 3) 4) 5) 6) |
||
|
А |
Б |
В |
Г |
|
2 |
3 |
6 |
2 |
9. Установите соответствие между формулой вещества и продуктом, который образуется на инертном аноде в результате электролиза водного раствора этого вещества: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
|
ФОРМУЛА ВЕЩЕСТВА |
ПРОДУКТ ЭЛЕКТРОЛИЗА НА АНОДЕ |
||
|
А) Б) В) Г) |
1) хлор 2) оксид серы(IV) 3) водород 4) натрий 5) кислород |
||
|
А |
Б |
В |
Г |
|
1 |
5 |
5 |
5 |
10. Установите соответствие между формулой соли и продуктом, образующимся на инертном аноде при электролизе её водного раствора: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
|
ФОРМУЛА СОЛИ |
ПРОДУКТ НА АНОДЕ |
||
|
A) Б) B) Г) |
1) метан 2) сернистый газ 3) кислород 4) водород 5) бром 6) этан |
||
|
А |
Б |
В |
Г |
|
3 |
6 |
5 |
3 |
Задание 20 для самостоятельной работы
1. Установите соответствие между формулой соли и схемой процесса, протекающего на инертном аноде при электролизе её водного раствора: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
|
ФОРМУЛА СОЛИ |
СХЕМА ПРОЦЕССА НА АНОДЕ |
||
|
A) Б) B) Г) |
1) 2) 3) 4) 5) 6) |
||
|
А |
Б |
В |
Г |
2. Установите соответствие между формулой вещества и продуктом, выделяющимся на аноде при электролизе водного раствора этого вещества: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
|
ФОРМУЛА ВЕЩЕСТВА |
АНОДНЫЙ ПРОДУКТ |
||
|
А) Б) В) Г) |
1) кислород 2) металл 3) иод 4) фтор 5) углекислый газ 6) хлор |
||
|
А |
Б |
В |
Г |
3. Установите соответствие между формулой вещества и продуктом, выделяющимся на катоде при электролизе водного раствора этого вещества: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
|
ФОРМУЛА СОЛИ |
КАТОДНЫЙ ПРОДУКТ |
||
|
А) Б) В) Г) |
1) натрий 2) барий 3) алюминий 4) медь 5) водород 6) кислород |
||
|
А |
Б |
В |
Г |
4. Установите соответствие между названием металла и электролитическим способом его получения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
|
МЕТАЛЛ |
СПОСОБ ПОЛУЧЕНИЯ |
||
|
А) калий Б) медь В) хром Г) кальций |
1) электролиз водного раствора сульфата 2) электролиз расплавленного хлорида 3) электролиз расплавленного нитрата 4) электролиз водного раствора гидроксида |
||
|
А |
Б |
В |
Г |
5. Установите соответствие между формулой вещества и продуктом, выделяющимся на катоде при электролизе водного раствора этого вещества: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
|
ФОРМУЛА ВЕЩЕСТВА |
КАТОДНЫЙ ПРОДУКТ |
||
|
А) Б) В) Г) |
1) кислород 2) только металл 3) только водород 4) металл и водород 5) азот 6) хлор |
||
|
А |
Б |
В |
Г |
6. Установите соответствие между названием металла и промышленным электролитическим способом его получения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
|
МЕТАЛЛ |
СПОСОБ ПОЛУЧЕНИЯ |
||
|
A) кальций Б) серебро B) натрий Г) свинец |
1) электролиз водного раствора хлорида 2) электролиз водного раствора нитрата 3) электролиз расплавленного нитрата 4) электролиз расплавленного хлорида |
||
|
А |
Б |
В |
Г |
7. Установите соответствие между формулой соли и продуктами электролиза водного раствора этой соли, которые выделились на инертных электродах: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
|
ФОРМУЛА СОЛИ |
ПРОДУКТЫ ЭЛЕКТРОЛИЗА В РАСТВОРЕ |
||
|
A) Б) В) Г) |
1) 2) 3) 4) 5) |
||
|
А |
Б |
В |
Г |
8. Установите соответствие между веществом и возможным способом его получения путём электролиза: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
|
ВЕЩЕСТВО |
ПОЛУЧЕНИЕ ЭЛЕКТРОЛИЗОМ |
||
|
А) водород Б) хлор В) калий Г) алюминий |
1) расплава 2) раствора 3) водного раствора 4) водного раствора 5) водного раствора |
||
|
А |
Б |
В |
Г |
Задание 31
1. При электролизе водного раствора нитрата меди(II) получили металл. Металл обработали концентрированной серной кислотой при нагревании. Выделившийся в результате газ прореагировал с сероводородом с образованием простого вещества. Это вещество нагрели с концентрированным раствором гидроксида калия. Напишите молекулярные уравнения четырех описанных реакций.
Решение:
2. Газ, выделившийся на аноде при электролизе раствора хлорида натрия, ввели в колбу с нагретым фосфором. Полученную в колбе жидкость растворили в воде. Образовавшийся раствор обесцвечивает бромную воду. Напишите уравнения четырёх описанных реакций.
Решение:
1. (электролиз)
2.
3.
4.
3. Провели электролиз раствора нитрата меди(II). Выделившийся газ прореагировал с натрием. Полученное вещество растворили в холодной воде. К образовавшемуся раствору добавили раствор сульфата хрома(III) и нагрели. При этом окраска раствора изменилась на жёлтую. Напишите уравнения описанных реакций.
Решение:
Задание 31 для самостоятельной работы
1. Газ, выделившийся на аноде при электролизе раствора хлорида натрия, собрали в колбу, в которую затем опустили небольшой кусочек нагретого фосфора. После окончания реакции в колбу добавили воду и получили раствор, при добавлении к которому нитрата серебра выпал белый творожистый осадок. Напишите уравнения четырёх описанных реакций.
2. При электролизе водного раствора нитрата меди(II) получили металл. Металл обработали концентрированной серной кислотой при нагревании. Выделившийся в результате газ прореагировал с сероводородом с образованием простого вещества. Это вещество нагрели с концентрированным раствором гидроксида калия. Напишите уравнения четырёх описанных реакций.
3. Раствор нитрата меди (II) подвергли электролизу на инертном аноде. Выделившееся на катоде простое вещество растворили в концентрированной серной кислоте, при этом наблюдали выделение бесцветного газа с резким запахом. Газ собрали и пропустили через раствор сероводородной кислоты, в результате чего в осадок выпало простое вещество желтого цвета. Это вещество прореагировало с расплавленным гидроксидом калия. Напишите уравнения четырёх описанных реакций.
Задание 32
1. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
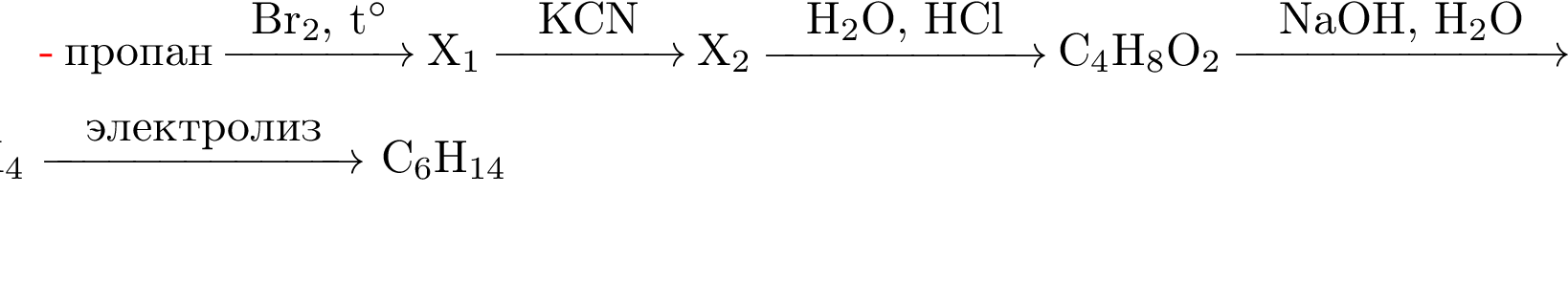
Решение:
1.
2.
3.
4.
5. 
2. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
→
→
→
→
Решение. 1)
2)
3)
4)
5)
Задание 32 для самостоятельной работы
1.Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
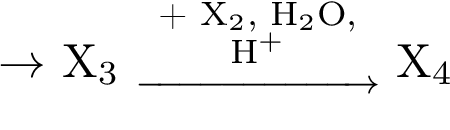
Ответы к заданиям для самостоятельной работы:
Задание 20.
|
№ задания |
А |
Б |
В |
Г |
|
1 |
3 |
3 |
2 |
2 |
|
2 |
3 |
1 |
6 |
1 |
|
3 |
5 |
5 |
5 |
4 |
|
4 |
2 |
1 |
1 |
2 |
|
5 |
3 |
2 |
3 |
4 |
|
6 |
4 |
2 |
4 |
2 |
|
7 |
3 |
3 |
5 |
4 |
|
8 |
4 |
4 |
1 |
2 |
Задание 31.
1. Решение:
1) (электролиз)
2)
3)
4)
2. Решение:
1) (электролиз)
2)
3)
4)
3. Решение:
1)
2)
3)
4)
Задание 32.
-
Решение:
1) 
2)
3) 
4) 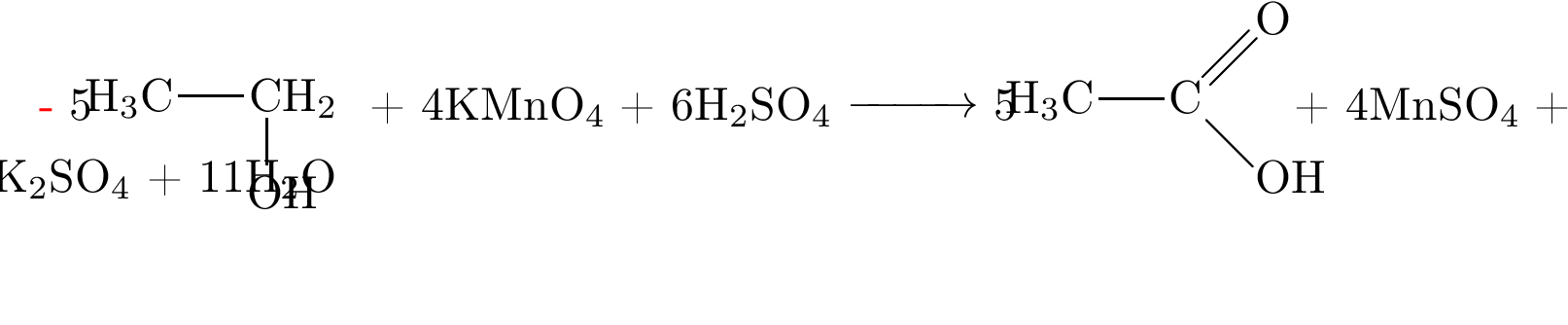
5) 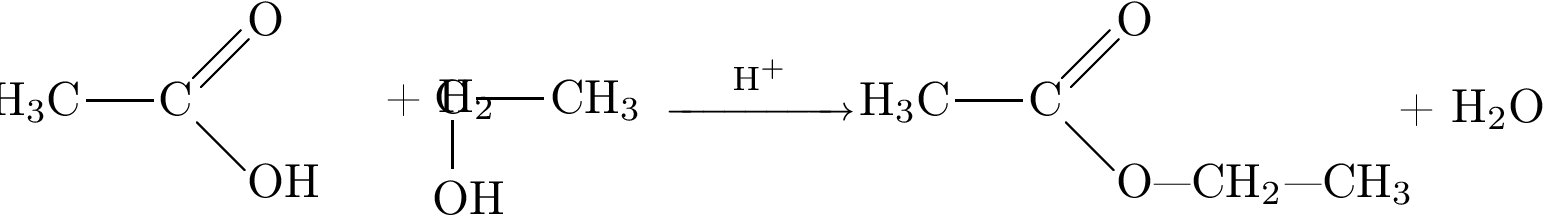
Электролиз (греч. elektron — янтарь + lysis — разложение) — химическая реакция, происходящая при прохождении постоянного тока через
электролит. Это разложение веществ на их составные части под действием электрического тока.
Процесс электролиза заключается в перемещении катионов (положительно заряженных ионов) к катоду (заряжен отрицательно), и отрицательно
заряженных ионов (анионов) к аноду (заряжен положительно).

Итак, анионы и катионы устремляются соответственно к аноду и катоду. Здесь и происходит химическая реакция. Чтобы успешно решать задания
по этой теме и писать реакции, необходимо разделять процессы на катоде и аноде. Именно так и будет построена эта статья.
Катод
К катоду притягиваются катионы — положительно заряженные ионы: Na+, K+, Cu2+, Fe3+,
Ag+ и т.д.
Чтобы установить, какая реакция идет на катоде, прежде всего, нужно определиться с активностью металла: его положением в электрохимическом
ряду напряжений металлов.

Если на катоде появился активный металл (Li, Na, K) то вместо него восстанавливаются молекулы воды, из которых выделяется водород. Если металл средней
активности (Cr, Fe, Cd) — на катоде выделяется и водород, и сам металл. Малоактивные металлы выделяются на катоде в чистом виде (Cu, Ag).
Замечу, что границей между металлами активными и средней активности в ряду напряжений считается алюминий. При электролизе на катоде металлы
до алюминия (включительно!) не восстанавливаются, вместо них восстанавливаются молекулы воды — выделяется водород.
В случае, если на катод поступают ионы водорода — H+ (например при электролизе кислот HCl, H2SO4) восстанавливается
водород из молекул кислоты: 2H+ — 2e = H2
Анод
К аноду притягиваются анионы — отрицательно заряженные ионы: SO42-, PO43-, Cl—, Br—,
I—, F—, S2-, CH3COO—.

При электролизе кислородсодержащих анионов: SO42-, PO43- — на аноде окисляются не анионы, а молекулы
воды, из которых выделяется кислород.
Бескислородные анионы окисляются и выделяют соответствующие галогены. Сульфид-ион при оксилении окислении серу. Исключением является фтор — если он
попадает анод, то разряжается молекула воды и выделяется кислород. Фтор — самый электроотрицательный элемент, поэтому и является исключением.
Анионы органических кислот окисляются особым образом: радикал, примыкающий к карбоксильной группе, удваивается, а сама карбоксильная группа (COO)
превращается в углекислый газ — CO2.
Примеры решения
В процессе тренировки вам могут попадаться металлы, которые пропущены в ряду активности. На этапе обучения вы можете пользоваться расширенным рядом
активности металлов.

Теперь вы точно будете знать, что выделяется на катоде 
Итак, потренируемся. Выясним, что образуется на катоде и аноде при электролизе растворов AgCl, Cu(NO3)2, AlBr3,
NaF, FeI2, CH3COOLi.

Иногда в заданиях требуется записать реакцию электролиза. Сообщаю: если вы понимаете, что образуется на катоде, а что на аноде,
то написать реакцию не составляет никакого труда. Возьмем, например, электролиз NaCl и запишем реакцию:
NaCl + H2O → H2 + Cl2 + NaOH (обычно в продуктах оставляют именно запись «NaOH», не подвергая его дальнейшему электролизу)
Натрий — активный металл, поэтому на катоде выделяется водород. Анион не содержит кислорода, выделяется галоген — хлор. Мы пишем уравнение, так
что не можем заставить натрий испариться бесследно 
Запишем реакцию электролиза для CuSO4:
CuSO4 + H2O → Cu + O2 + H2SO4
Медь относится к малоактивным металлам, поэтому сама в чистом виде выделяется на катоде. Анион кислородсодержащий, поэтому в реакции выделяется
кислород. Сульфат-ион никуда не исчезает, он соединяется с водородом воды и превращается в серую кислоту.
Электролиз расплавов
Все, что мы обсуждали до этого момента, касалось электролиза растворов, где растворителем является вода.
Перед промышленной химией стоит важная задача — получить металлы (вещества) в чистом виде. Малоактивные металлы (Ag, Cu) можно легко получать
методом электролиза растворов.
Но как быть с активными металлами: Na, K, Li? Ведь при электролизе их растворов они не выделяются на катоде в чистом виде, вместо них восстанавливаются
молекулы воды и выделяется водород. Тут нам как раз пригодятся расплавы, которые не содержат воды.

В безводных расплавах реакции записываются еще проще: вещества распадаются на составные части:
AlCl3 → Al + Cl2
LiBr → Li + Br2
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
За это задание ты можешь получить 1 балл. На решение дается около 7 минут. Уровень сложности: повышенный.
Средний процент выполнения: 76.2%
Ответом к заданию 20 по химии может быть последовательность цифр, чисел или слов. Порядок записи имеет значение.
Задача 1
Установите соответствие между формулой соли и продуктами, образующимися на инертных электродах при электролизе водного раствора этой соли: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА СОЛИ | ПРОДУКТЫ ЭЛЕКТРОЛИЗА |
| А) $NaNO_3$ Б) $CH_3COONa$ В) $BaBr_2$ Г) $Cu(NO_3)_2$ |
1) $H_2$, $O_2$ 2) $H_2$, $C_2H_6$, $NaHCO_3$ 3) металл, $O_2$ 4) металл, $NO_2$ 5) Ba, $Br_2$ 6) $H_2$, $Br_2$ |
Запишите выбранные цифры под соответствующими буквами.
Решение
A) Протекает электролиз воды. Продукты $H_2$ и $O_2$
Б) $2 CH_3COONa + 2 H_2O → C_2H_6 + 2 NaHCO_3 + H_2$
В) $BaBr_2 + H_2O → Br_2 + Н_2 + Ba(OH)_2$
Г) $2Cu(NO_3)_2 + 2H_2O → 2Cu + O_2 + 4HNO_3$
Ответ: 1263
Задача 2
Установите соответствие между названием вещества и способом его электролитического получения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| НАЗВАНИЕ ВЕЩЕСТВА | ПОЛУЧЕНИЕ ЭЛЕКТРОЛИЗОМ |
| А) натрий Б) фтор В) алюминий Г) кислород |
1) расплава NaCl 2) водного раствора NaF 3) водного раствора $AlCl_3$ 4) раствора $Al_2O_3$ в расплавленном криолите 5) расплава NaF 6) водного раствора NaCl |
Запишите выбранные цифры под соответствующими буквами.
Решение
А: Натрий очень активный металл, поэтому из водного раствора его не получить электролитически, а вот из расплава NaCl, можно, как и из расплава NaF, но фторид дороже и фтор быстро разрушает анод, так что используют хлорид.
Б: Фтор можно получить только электролизом расплава соли.
В: Алюминий достаточно активен, так что в растворе он разрядит вместо себя водород из воды, так что нам подходит только 4 вариант.
Г: Фторид-ион при электролизе в растворе проявляет свойства такие же, как остатки кислород содержащих кислот.
Ответ: 1542
Задача 3
Установите соответствие между формулой соли и уравнением процесса, протекающего на аноде при электролизе её водного раствора: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА СОЛИ | УРАВНЕНИЕ АНОДНОГО ПРОЦЕССА |
| А) $Al(NO_3)_3$ Б) $CuCl_2$ В) $SbCl_3$ Г) $Cu(NO_3)_2$ |
1) $2H_2O – 4ē = O_2^{0} + 4H^{+}$ 2) $2H_2O + 2ē = H_2^{0} + 2OH^{–}$ 3) $2Cl^{–} – 2ē = Cl_2^{0}$ 4) $Sb^{3+} + 3ē = Sb^{0}$ 5) $Cl^{–} + 4H_2O – 8ē = ClO_4^{-} + 8H^{+}$ 6) $4NO_3^{–} – 4ē = 2N_2O + 5O_2^{0}$ |
Запишите выбранные цифры под соответствующими буквами.
Решение
A) Нитрат-анион – остаток кислородосодержащей кислоты, следовательно, на аноде окисляются атомы кислорода молекул воды — строка 1.
Б) Хлорид-анион – бескислородный остаток, следовательно, на аноде окисляется сам хлорид-ион — строка 3.
В) Как в Б.
Г) Как в А
Ответ: 1331
Задача 4
Установите соответствие между формулой вещества и продуктами, образующимися на инертных электродах при электролизе водного раствора этого вещества: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА ВЕЩЕСТВА | ПРОДУКТЫ ЭЛЕКТРОЛИЗА |
| А) $Pb(NO_3)_2$ Б) NaBr В) $AlCl_3$ Г) $CuSO_4$ |
1) водород, галоген 2) водород, кислород 3) металл, кислород 4) металл, водород, кислород 5) металл, оксид серы(IV) |
Запишите выбранные цифры под соответствующими буквами.
Решение
А) $Pb(NO_3)_2$ — нитрат свинца — соль металла средней активности и кислородсодержащей кислоты, при электролизе его водного раствора образуется металл, водород и кислород.
Б) NaBr — бромид натрия — соль активного металла и бескислородной кислоты, при электролизе его водного раствора образуется галоген и водород.
В) $AlCl_3$ — хлорид алюминия — соль активного металла и бескислородной кислоты, при электролизе его водного раствора образуется галоген и водород.
Г) $CuSO_4$ — сульфат меди (II) — соль неактивного металла и кислородсодержащей кислоты, при электролизе его водного раствора образуется металл и кислород.
Ответ: 4113
Задача 5
Установите соответствие между формулой соли и продуктами, образующимися на инертных электродах при электролизе водного раствора этой соли: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА СОЛИ | ПРОДУКТЫ ЭЛЕКТРОЛИЗА |
| А) $CuSO_4$ Б) AgF В) $K_2S$ Г) NaBr |
1) водород, кислород 2) водород, галоген 3) металл, кислород 4) металл, галоген 5) водород, сера |
Запишите выбранные цифры под соответствующими буквами.
Решение
А) $CuSO_4$ — соль малоактивного металла и кислородсодержащей кислоты. Выделяется металл и кислород.
Б) AgF — фторид серебра — соль малоактивного металла и фтороводородной кислоты, выделяется металл и кислород.
В) Калий — активный металл, поэтому на катоде будет водород, а сульфид — остаток некислородосодержащей кислоты, на аноде образуется сера.
Г) NaBr — соль активного металла и бескислородной кислоты. Выделяется водород и бром.
Ответ: 3352
Задача 6
Установите соответствие между формулой соли и продуктами, образующимися на инертных электродах при электролизе водного раствора этой соли: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА СОЛИ | ПРОДУКТЫ ЭЛЕКТРОЛИЗА |
| А) $CaI_2$ Б) $Na_2CO_3$ В) AgF Г) $AuF_3$ |
1) металл, кислород 2) металл, галоген 3) водород, кислород 4) водород, галоген 5) водород, углекислый газ 6) металл, углекислый газ |
Запишите выбранные цифры под соответствующими буквами.
Решение
А) $CaI_2$ — йодид кальция, соль активного металла и и бескислородной кислоты, при электролизе водного раствора образуется $I_2$ и $H_2$.
Б) $Na_2CO_3$ — карбонат натрия — соль активного металла и кислородсодержащей кислоты, при электролизе водного раствора образуется $O_2$ и $H_2$.
В) AgF — фторид серебра — соль неактивного металла и фтороводородной кислоты, выделяется металл и кислород.
Г) $AuF_3$ — фторид золота — соль неактивного металла и фтороводородной кислоты, выделяется металл и кислород.
Ответ: 4311
Задача 7
Установите соответствие между формулой вещества и продуктами, образующимися на инертных электродах при электролизе водного раствора этого вещества: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА ВЕЩЕСТВА | ПРОДУКТЫ ЭЛЕКТРОЛИЗА |
| А) $NiSO_4$ Б) $LiClO_4$ В) LiCl Г) $AgNO_3$ |
1) металл, кислород 2) водород, хлор 3) водород, кислород 4) металл, оксид азота(IV) 5) металл, галоген |
Запишите выбранные цифры под соответствующими буквами.
Решение
А) $NiSO_4$ — соль металла средней активности и кислородсодержащей кислоты. Выделяется металл и кислород.
Б) $LiClO_4$ — соль активного металла и кислородсодержащей кислоты. Выделяется водород и кислород.
В) LiCl — соль активного металла и бескислородной кислоты. Выделяется водород и хлор.
Г) $AgNO_3$ — соль малоактивного металла и кислородсодержащей кислоты. Выделяется металл и кислород.
Ответ: 1321
Задача 8
Установите соответствие между формулой вещества и продуктами, образующимися на инертных электродах при электролизе водного раствора этого вещества: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА ВЕЩЕСТВА | ПРОДУКТЫ ЭЛЕКТРОЛИЗА |
| А) $Cu(NO_3)_2$ Б) $Na_2S$ В) $AlCl_3$ Г) $ZnSO_4$ |
1) Cu, $O_2$ 2) Cu, $NO_2$ 3) $H_2$, S 4) $H_2$, $Cl_2$ 5) Zn, $H_2$, $O_2$ 6) Zn, $H_2$, S |
Запишите выбранные цифры под соответствующими буквами.
Решение
A) $Cu(NO_3)_2$ — соль малоактивного металла и кислородсодержащей кислоты. Выделяется металл (Cu) и кислород.
Б) $Na_2S$ — соль активного металла и бескислородной кислоты, образуется водород и сера.
В) $AlCl_3$ — соль активного металла и бескислородной кислоты, образуется водород и хлор.
Г) $ZnSO_4$ — соль металла средней активности и кислородсодержащей кислоты, образуется металл (цинк), водород и кислород.
Ответ: 1345
Задача 9
Установите соответствие между формулой вещества и продуктами, образующимися на инертных электродах при электролизе его водного раствора: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛЫ ВЕЩЕСТВ | ПРОДУКТЫ ЭЛЕКТРОЛИЗА |
| А) $CaCl_2$ Б) $Fe(NO_3)_2$ В) $K_2SO_4$ Г) $FeCl_2$ |
1) $Ca, O_2, Cl_2$ 2) $Fe, H_2, Cl_2$ 3) $K, H_2, SO_3$ 4) $Fe, H_2, O_2$ 5) $H_2, Cl_2$ 6) $H_2, O_2$ |
Запишите выбранные цифры под соответствующими буквами.
Решение
Продукты электролиза определяются положением металла в ряду активности и природой аниона
1) $CaCl_2$ — хлорид кальция — образован катионами $Ca^{2+}$ (кальций находится в ряду активности левее алюминия) и бескислородными анионами Cl–.
Катодная реакция: $2H_2O + 2ē = H_2^{0} + 2OH^–$
Анодная реакция: $2Cl^{–} – 2ē = Cl_2^0$
Вывод: продукты электролиза $H_2$, $Cl_2$; ответ А — 5.
2) $Fe(NO_3)_2$ — нитрат железа(II) — образован катионами $Fe^{2+}$ (железо находится в ряду активности между алюминием и водородом) и кислородсодержащими анионами $NO_3^{–}$.
Катодные реакции: $Fe^{2+} + 2ē = Fe^0$
$2H_2O + 2ē = H_2^{0} + 2OH^–$
Анодная реакция: $2H_2O – 4ē = O_2^{0} + 4H^+$
Вывод: продукты электролиза Fe, $H_2$, $O_2$; ответ Б — 4.
3) $K_2SO_4$ — сульфат калия — образован катионами $K^+$ (калий в ряду активности находится левее, чем алюминий) и кислородсодержащими анионами $SO_4^{2–}$. Уравнения катодного и анодного процессов:
Катодная реакция: $2H_2O + 2ē = H_2^{0} + 2OH^–$
Анодная реакция: $2H_2O – 4ē = O_2^{0} + 4H^+$
Вывод: продукты электролиза $H_2$, $O_2$; ответ В — 6.
4) $FeCl_2$ — хлорид железа(II) — образован катионами $Fe^{2+}$ (железо находится между алюминием и водородом в ряду активности) и бескислородными анионами $Cl^–$.
Катодные реакции: $Fe^{2+} + 2ē = Fe^0$
$2H_2O + 2ē = H_2^{0} + 2OH^–$
Анодная реакция: $2Cl^{–} – 2ē = Cl_2^0$
Вывод: продукты электролиза Fe, $H_2$, $Cl_2$; ответ Г — 2.
Ответ: 5462
Задача 10
Установите соответствие между формулой соли и уравнением процесса, протекающего на угольном аноде при электролизе её водного раствора: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА СОЛИ | УРАВНЕНИЕ АНОДНОГО ПРОЦЕССА |
| А) KCl Б) $AlBr_3$ В) $CuSO_4$ Г) $AgNO_3$ |
1) $2H_2O – 4ē = O_2 + 4H^{+}$ 2) $2H_2O + 2ē = H_2 + _2OH^–$ 3) $2Cl^– – 2ē = Cl^{0}_2$ 4) $2Br^– – 2ē = Br^{0}_2$ 5) $2SO_4^{2–} – 2ē = S_2O_8^{2–}$ 6) $2NO^{–}_3 – 2ē = 2NO_2 + O_2$ |
Запишите выбранные цифры под соответствующими буквами.
Решение
Процесс окисления на аноде определяется материалом, из которого изготовлен анод, и природой аниона.
1) KCl — хлорид калия — содержит бескислородные анионы $Cl^–$; анодный процесс:
$2Cl^{–} – 2ē = Cl_2^0$
Вывод: ответ А — 3.
2) $AlBr_3$ — бромид алюминия — содержит бескислородные анионы $Br^–$; анодный процесс:
$2Br^{–} – 2ē = Br_2^0$
Вывод: ответ Б — 4.
3) $CuSO_4$ — сульфат меди(II) — содержит кислородсодержащие анионы $SO_4^{2–}$; анодная реакция:
$2H_2O – 4ē = O_2^0 + 4H^{+}$
Вывод: ответ В — 1.
4) $AgNO_3$ — нитрат серебра — содержит кислородсодержащие анионы $NO_3^–$; анодный процесс:
$2H_2O – 4ē = O_2^0 + 4H^{+}$
Вывод: ответ Г — 1.
Ответ: 3411
Задача 11
Установите соответствие между формулой соли и продуктами, образующимися на инертных электродах при электролизе её водного раствора: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА СОЛИ | ПРОДУКТЫ ЭЛЕКТРОЛИЗА |
| А) $Mg(NO_3)_3$ Б) LiBr В) $Al(NO_3)_3$ Г) KCl |
1) водород, кислород 2) кислород, металл 3) оксид азота(IV), водород 4) оксид азота(II), металл 5) галоген, водород 6) металл, галоген |
Запишите выбранные цифры под соответствующими буквами.
Решение
Продукты восстановления в водных растворах определяются положением металла в ряду активности:
1) если металл более активный, чем алюминий (и сам алюминий), то будет восстанавливаться вода с выделением водорода:
2) если металл малоактивный (находится в ряду активности правее водорода), то будут восстанавливаться катионы металла:
3) для металлов промежуточной активности будет происходить восстановление как катионов металла, так и воды.
а) анионы бескислородных кислот ($Cl^–$, $Br^–$, $I^–$, $S^{2–}$) окисляются с образованием простых веществ
б) анионы кислородсодержащих кислот и фторид-ионы в водных растворах не окисляются, происходит окисление молекул воды с выделением кислорода:
А) $Mg(NO_3)_2$ — нитрат магния — образован катионами магния (находится в ряду активности левее алюминия) и анионами кислородсодержащей кислоты.
Катодная реакция: $2H_2O + 2ē = H_2^0 + 2OH^–$
Анодная реакция: $2H_2O – 4ē = O_2^{0}+ 4H^+$
Вывод: выделяются водород и кислород (ответ А — 1).
Б) LiBr — бромид лития — содержит катионы лития $Li^+$ (литий Li в ряду активности находится левее, чем алюминий Al) и бескислородные анионы $Br^–$.
Катодная реакция: $2H_2O + 2ē = H_2^{0} + 2OH^–$
Анодная реакция: $2Br^{–} – 2ē = Br_2^0$
Вывод: выделяются водород и галоген (бром) (ответ Б — 5).
В) $Al(NO_3)_3$ — нитрат алюминия — образован катионами алюминия и анионами кислородсодержащей кислоты.
Катодная реакция: $2H_2O + 2ē = H_2^{0} + 2OH^–$
Анодная реакция: $2H_2O – 4ē = O_2^{0}+ 4H^+$
Вывод: выделяются водород и кислород (ответ В — 1).
Г) KCl — хлорид калия — образован катионами калия $K^+$ (калий K в ряду активности находится левее, чем алюминий Al) и бескислородными анионами $Cl^–$.
Катодная реакция: $2H_2O + 2ē = H_2^{0} + 2OH^–$
Анодная реакция: $2Cl^{–} – 2ē = Cl_2^0$
Вывод: выделяются водород и галоген (хлор) (ответ Г — 5).
Ответ: 1515







