Пройти тестирование по 10 заданиям
Пройти тестирование по всем заданиям
Вернуться к каталогу заданий
Версия для печати и копирования в MS Word
1
Из предложенного перечня веществ выберите два вещества, с каждым из которых железо реагирует без нагревания.
1) хлорид цинка
2) сульфат меди(II)
3) концентрированная азотная кислота
4) разбавленная соляная кислота
5) оксид алюминия
Запишите в поле ответа номера выбранных веществ.
Источник: Демонстрационная версия ЕГЭ—2017 по химии
2
Из предложенного перечня веществ выберите два вещества, с каждым из которых реагирует медь.
1) хлорид цинка (р-р)
2) сульфат натрия (р-р)
3) разбавленная азотная кислота
4) концентрированная серная кислота
5) оксид алюминия
Запишите в поле ответа номера выбранных веществ.
3
Из предложенного перечня растворов выберите два раствора, в которых протекает химическая реакция.
1)
2)
3)
4)
5)
Запишите в поле ответа номера выбранных растворов.
Источник: РЕШУ ЕГЭ, Яндекс: Тренировочная работа ЕГЭ по химии. Вариант 1.
4
Из предложенного перечня веществ выберите два вещества, с каждым из которых йод не реагирует, в отличие от хлора.
1) алюминий
2) железо
3) бромид магния
4) бромид натрия
5) фторид натрия
Запишите в поле ответа номера выбранных веществ.
Источник: РЕШУ ЕГЭ, Яндекс: Тренировочная работа ЕГЭ по химии. Вариант 2.
5
Из предложенного перечня выберите две пары веществ, которые взаимодействуют с водой при обычной температуре.
1) кислород и сера
2) фтор и калий
3) кремний и кальций
4) железо и медь
5) натрий и барий
Запишите в поле ответа номера выбранных пар веществ.
Источник: РЕШУ ЕГЭ
Пройти тестирование по этим заданиям
Тренажер задания 31 из ЕГЭ по химии щелочноземельных металлов, задачи на неорганическую химию (мысленный эксперимент) из экзамена ЕГЭ по химии, задания 31 по химии щелочноземельных металлов с текстовыми решениями и ответами.
1. К нерастворимой в воде соли белого цвета, которая встречается в природе в виде широко используемого в строительстве и архитектуре минерала, прилили раствор соляной кислоты, в результате соль растворилась, и выделился газ, при пропускании которого через известковую воду выпал осадок белого цвета; осадок растворился при дальнейшем пропускании газа. При кипячении полученного раствора выпадает осадок. Напишите уравнения описанных реакций.
СаСО3 + 2HCl = CaCl2 + CO2↑ + H2O
Ca(OH)2 + CO2 = CaCO3↓ + H2O
CaCO3 + CO2 + H2O = Ca(HCO3)2
2. Кальций растворили в воде. При пропускании через полученный раствор сернистого газа образуется осадок белого цвета, который растворяется при пропускании избытка газа. Добавление к полученному раствору щелочи приводит к образованию осадка белого цвета. Напишите уравнения описанных реакций.
Ca + 2H2O = Ca(OH)2 + H2↑
Ca(OH)2 + SO2 = CaSO3↓ + H2O
CaSO3 + SO2 + H2O = Ca(HSO3)2
Ca(HSO3)2 + Ca(OH)2 = 2CaSO3↓ + 2H2O
3. Раствор, полученный при пропускании сернистого газа через бромную воду, нейтрализовали гидроксидом бария. Выпавший осадок отделили, смешали с коксом и прокалили. При обработке продукта прокаливания хлороводородной кислотой выделился газ с запахом тухлых яиц. Напишите уравнения описанных реакций.
SO2 + Br2 + 2H2O = 2HBr + H2SO4
H2SO4 + Ba(OH)2 = BaSO4↓ + 2H2O
BaS + 2HCl = ВaCl2 + H2S↑
4. Кальций нагрели в атмосфере водорода. Продукт реакции обработали водой, выделяющийся газ пропустили над нагретым оксидом цинка, а в раствор добавили кальцинированную соду. Напишите уравнения описанных реакций.
СаH2 + 2H2O = Ca(OH)2 + H2↑
Ca(OH)2 + Na2CO3 = CaCO3↓ + 2NaOH
5. Через баритовую воду пропускали углекислый газ. В полученный раствор добавили гидроксид бария, продукт реакции отделили и растворили в ортофосфорной кислоте.
Напишите уравнения описанных реакций.
Ba(OH)2 + CO2 = BaCO3 + H2O
BaСО3 + CO2 + H2O = Вa(HCO3)2
Вa(HCO3)2 + Ba(OH)2 = 2BaCO3↓ + 2H2O
BaCO3 + 2Н3РО4 = СО2 + H2O + Ba(Н2РО4)
6. Через раствор, полученный при гашении извести, пропустили газ, который образуется при получении негашеной извести из известняка; в результате выделяется белый осадок. При действии уксусной кислоты на полученный осадок выделяется тот же газ, который образуется при прокаливании карбоната кальция. Напишите уравнения описанных реакций.
СаО + Н2О = Са(ОН)2
Ca(OH)2 + CO2 = CaCO3↓ + H2O
CaCO3 + 2СН3СООН = (СН3СОО)2Са + СО2 ↑ + H2O
7. Негашеную известь «погасили» водой. В полученный раствор пропустили газ, который выделяется при кальцинировании гидрокарбоната натрия, при этом наблюдали образование и последующее растворение осадка. Напишите уравнения описанных реакций.
CaO + H2O = Ca(OH)2
Ca(OH)2 + CO2 = CaCO3↓ + H2O
CaCO3 + CO2 + H2O = Ca(HCO3)
8. Вещество, образующееся при сплавлении магния с кремнием, обработали водой, в результате образовался осадок и выделился бесцветный газ. Осадок растворили в соляной кислоте, а газ пропустили через раствор перманганата калия, при этом образовались два нерастворимых в воде бинарных вещества. Напишите уравнения описанных реакций.
Mg2Si + 4H2O = 2Mg(OH)2↓ + SiH4↑
Mg(OH)2 + 2HCl = MgCl2 + 2H2O
3SiH4 + 8KMnO4 = 8MnO2 ↓ + 3SiO2 ↓ + 8KOH + 2H2O
9. Магниевую стружку нагрели в атмосфере азота и продукт реакции последовательно обработали кипящей водой, растворами серной кислоты и нитрата бария. Напишите уравнения описанных реакций
Mg3N2 + 6H2O(гор.) = 3Mg(OH)2↓ + 2NH3↑
Mg(OH)2 + H2SO4 = MgSO4 + 2H2O
MgSO4 + Ba(NO3)2 = BaSO4↓ + Mg(NO3)2
10. Негашеную известь прокалили с избытком кокса. Продукт реакции после обработки водой используется для поглощения сернистого и углекислого газов. Напишите уравнения описанных реакций.
CaO + 3C = CaC2 + CO
CaC2 + 2H2O = Ca(OH)2 + C2H2↑
Ca(OH)2 + CO2 = CaCO3↓ + H2O
или Ca(OH)2 + 2CO2 = Ca(HCO3)2
Ca(OH)2 + SO2 = CaSO3↓ + H2O
или Ca(OH)2 + 2SO2 = Ca(HSO3)2
11. Магний нагрели в сосуде, наполненном газообразным аммиаком. Образовавшееся вещество растворили в концентрированном растворе бромоводородной кислоты, раствор выпарили и остаток нагрели до появления запаха, после чего добавили раствор щелочи. Напишите уравнения описанных реакций.
Mg3N2 + 8HBr = 3MgBr2 + 2NH4Br
MgBr2 + 2NaOH = Mg(OH)2↓ + 2NaB
12. Магниевый порошок смешали с кремнием и нагрели. Продукт реакции обработали холодной водой и выделяющийся газ пропустили через горячую воду. Образовавшийся осадок отделили, смешали с едким натром и нагрели до плавления. Напишите уравнения описанных реакций.
Mg2Si + 4H2O(хол.) = 2Mg(OH)2↓ + SiH4↑
SiH4+ 2H2O(гор.) = SiO2 + 4Н2
13. Простое вещество, полученное при нагревании фосфата кальция с коксом и оксидом кремния, сплавили с металлическим кальцием. Продукт реакции обработали водой, а выделяющийся газ собрали и сожгли в избытке кислорода. Напишите уравнения описанных реакций.
Ca3P2 + 6H2O = 3Ca(OH)2↓ + 2PH3↑
2PH3 + 4O2 = P2O5 + 3H2O
14. Фосфат кальция прокалили с углём в присутствии речного песка. Образовавшееся простое вещество прореагировало с избытком хлора. Полученный продукт внесли в избыток раствора гидроксида калия. На образовавшийся раствор подействовали известковой водой. Напишите уравнения описанных реакций.
2P + 5Cl2 = 2PCl5
PCl5 + 8KOH = K3PO4 + 5KCl + 4H2O
2K3PO4 + 3Ca(OH)2 = Ca3(PO4)2↓ + 6KOH
15) Металлический кальций прокалили в атмосфере азота. Продукт реакции обработали водой, выделившийся при этом газ пропустили в раствор нитрата хрома (III). Выпавший в ходе процесса серо-зеленый осадок обработали щелочным раствором пероксида водорода. Напишите уравнения описанных реакций.
3Ca + N2 = Ca3N2
Ca3N2 + 6H2O = 3Ca(OH)2 + 2NH3↑
3NH3 + 3H2O + Cr(NO3)3 = Cr(OH)3↓ + 3NH4NO3
2Cr(OH)3 + 3H2O2 + 4KOH = 2K2CrO4 + 8H2O
16) Смесь порошков нитрита калия и хлорида аммония растворили в воде и раствор осторожно нагрели. Выделившийся газ прореагировал с магнием. Продукт реакции внесли в избыток раствора соляной кислоты, при этом выделение газа не наблюдалось. Полученную магниевую соль в растворе обработали карбонатом натрия. Напишите уравнения описанных реакций.
3Mg + N2 = Mg3N2
Mg3N2 + 8HCl = 3MgCl2 + 2NH4Cl
2MgCl2 + 2Na2CO3 + H2O = (MgOH)2CO3↓ + CO2↑ + 4NaCl
17) Магний растворили в разбавленной азотной кислоте, причем выделение газа не наблюдалось. получившийся раствор обработали избытком раствора гидроксида калия при нагревании. Выделившийся при этом газ сожгли в кислороде. Напишите уравнения описанных реакций.
4Mg + 10HNO3(оч. разб.) = 4Mg(NO3)2 + NH4NO3 + 3H2O
Mg(NO3)2 + 2KOH = Mg(OH)2↓ + 2KNO3
4NH3 + 3O2 = 2N2 + 6H2O
18) Нитрат натрия сплавили с оксидом хрома (III) в присутствии карбоната натрия. Выделившийся при этом газ прореагировал с избытком гидроксида кальция с выпадением осадка белого цвета. Осадок растворили в избытке раствора бромоводородной кислоты и в полученный раствор добавили раствор нитрата серебра до прекращения выпадения осад-ка. Напишите уравнения описанных реакций.
3NaNO3 + Cr2O3 + 2Na2CO3 = 2Na2CrO4 + 2CO2↑ + 3NaNO2
CO2 + Ca(OH)2 = CaCO3↓ + H2O
CaCO3 + 2HBr = CaBr2 + CO2↑ + H2O
CaBr2 + 2AgNO3 = 2AgBr↓ + Ca(NO3)2
19) Фосфид кальция обработали соляной кислотой. Выделившийся газ сожгли в закрытом сосуде, продукт горения полностью нейтрализовали раствором гидроксида калия. К полученному раствору прилили раствор нитрата серебра. Напишите уравнения описанных реакций.
Ca3P2 + 6HCl = 3CaCl2 + 2PH3↑
2PH3 + 4O2 = P2O5 + 3H2O
P2O5 + 6KOH = 2K3PO4 + 3H2O
K3PO4 + 3AgNO3 = Ag3PO4↓ + 3KNO
20) Оксид кремния прокалили с большим избытком магния. Полученную смесь веществ обработали водой. При этом выделился газ, который сожгли в кислороде. Твердый продукт сжигания растворили в концентрированном растворе гидроксида цезия. Напишите уравнения описанных реакций.
SiO2 + 2Mg = 2MgO + Si
2Mg + Si = Mg2Si или
SiO2 + 4Mg = 2MgO + Mg2Si
Mg2Si + 4H2O = 2Mg(OH)2↓ + SiH4↑
SiH4 + 2O2 = SiO2 + 2H2O
SiO2 + 2CsOH = Cs2SiO3 + H2O
21) Магний нагрели в атмосфере азота. При добавлении к полученному веществу воды выделился газ, который пропустили над нагретым оксидом свинца (II). Полученное твердое вещество темного цвета растворили в разбавленной азотной кислоте. Напишите уравнения описанных реакций.
3Mg + N2 = Mg3N2
Mg3N2 + 6H2O = 3Mg(OH)2 + 2NH3
2NH3 + 3PbO = 3Pb + N2 + 3H2O
3Pb + 8HNO3 = 3Pb(NO3)2 + 2NO + 4H2O
22) Щавелевую кислоту нагрели с небольшим количеством концентрированной серной кислоты. Выделившийся газ сначала пропустили над нагретым оксидом меди (II), а полученный газ пропустили через раствор гидроксида кальция до тех пор, пока первоначально выпавший осадок не растворился. Напишите уравнения описанных реакций.
CO + CuO = Cu + CO2
CO2 + Ca(OH)2 = CaCO3 + H2O
CaCO3 + CO2 + H2O = Ca(HCO3)2
23) Барий растворили в воде. К полученному раствору добавили сульфат калия, выпавший осадок отфильтровали, после чего через горячий фильтрат пропустили газообразный хлор. Реакционную массу выпарили, а затем прокалили до образования одной соли. Напишите уравнения описанных реакций.
Ba + 2H2O = Ba(OH)2 + H2
Ba(OH)2 + K2SO4 = BaSO4↓ + 2KOH
6KOH + 3Cl2 → 5KCl + KClO3 + 3H2O
2KClO3 → 2KCl + 3O2
24) Магний растворили в разбавленной азотной кислоте. К полученному раствору последовательно добавили гидроксид натрия, бромоводородную кислоту, фосфат натрия. Напишите уравнения описанных реакций.
4Mg + 10HNO3(разб.) = 4Mg(NO3)2 + N2O + 5H2O
Mg(NO3)2 + 2NaOH = Mg(OH)2↓ + 2NaNO3
Mg(OH)2 + 2HBr = MgBr2 + 2H2O
3MgBr2 + 2Na3PO4 = Mg3(PO4)2↓ + 6NaBr
25) Барий растворили в разбавленной азотной кислоте, при этом выделился бесцветный газ – несолеобразующий оксид. Полученный раствор разделили на три части. Первую выпарили досуха, полученный осадок прокалили. Ко второй части добавили раствор сульфата натрия до прекращения выделения осадка; к третьей добавили раствор карбоната натрия. Напишите уравнения описанных реакций.
4Ba + 10HNO3(разб.) = Ba(NO3)2 + N2O + 5H2O
Ba(NO3)2 → Ba(NO2)2 + O2
Ba(NO3)2 + Na2SO4 = BaSO4↓ + 2NaNO3
Ba(NO3)2 + Na2CO3 = BaCO3↓ + 2NaNO3
26) Сульфат бария сплавили с коксом. Твердый остаток растворили в соляной кислоте, выделившийся газ вступил в реакцию оксидом серы (IV), а раствор – с сульфитом натрия. Напишите уравнения описанных реакций.
BaSO4 + 4C → BaS + 4CO
BaS + 2HCl = ВaCl2 + H2S↑
H2S + SO2 = 2H2O + 3S↓
BaCl2 + Na2SO3 = BaSO3↓ + 2NaCl
1 вариант
Для выполнения заданий 1-3 используйте
следующий ряд химических элементов. Ответом в заданиях является
последовательность цифр, под которыми указаны химические элементы в данном
ряду.
1) Cu
2) Al 3)
Ag 4) B 5) Ga
1.
Определите, атомы каких из указанных в
ряду элементов имеют конфигурацию внешнего энергетического уровня ns1
(n-1)
d10
2.
Из указанных в ряду элементов выберите три
элемента, которые в периодической системе элементов Д. И. Менделеева находятся
в одной группе и расположите их в порядке увеличения радиуса
3. Из
указанных в ряду элементов выберите два, которые имеют степень окисления +1
4.
Установите соответствие между формулой вещества и его принадлежностью к
определенному классу/группе неорганических соединений
А) гидроксид марганца (VII)
1) кислота
Б) гидроксохлорид меди (II)
2) средняя соль
В) гидроксид хрома (II)
3) основная соль
Г) перманганат
калия 4) амфотерный гидроксид
5) кислая соль
6) основание
5.
Из предложенного перечня выберите два вещества, которые взаимодействуют как с
медью, так и с цинком.
1) раствор NaOH
4) раствор AgF
2) раствор MgCl2
5) разбавленная H2SO4
3) раствор HNO3
6.
Из предложенного перечня выберите две пары веществ с каждым из которых
реагирует оксид алюминия.
1) K2SiO3 и
Fe
4)BaO и NaOH
2) CO и
Cu 5) H2SO4 и
Na2CO3
3)N2O и K2CO3
7.
В раствор с веществом Х добавили металл Y.
В результате наблюдали выделение бесцветного горючего газа. Из предложенного
перечня выберите вещества Х и Y,
которые могут вступать в описанную реакцию.
1) железо 4)
гидроксид натрия
2) магний 5)
азотная кислота (конц.)
3) цинк
8.
Задана следующая схема превращений:
Fe2O3
à X à Y àFe2O3
1) Fe(OH)3
2) Fe(NO3)3
3) Fe(OH)2
4)FeCl2
5) FeS
9.
Установите соответствие между уравнением реакции и свойством, которое проявляет
элемент хром в этой реакции.
УРАВНЕНИЕ
РЕАКЦИИ СВОЙСТВО ХРОМА
А) 2CrCl3
+ 3Na2CO3
+ 6H2O
= 2Cr(OH)3+3CO2+6NaCl 1) является окислителем
Б) 2CrCl3 + Zn = 2CrCl2
+ ZnCl2 2) является
восстановителем
В)2CrCl3 +3Cl2+16KOH
=2K2CrO4 +12KCl+8H2O 3) является
и окислителем, и восстановителем
4) не изменяет степень окисления
Запишите выбранные цифры под
соответствующими буквами.
10)
Установите соответствие между названием вещества и формулами реагентов, с
которыми оно может реагировать.
А) магний 1) O2,
HCl,
SiO2
Б) хлор 2) H2,
Mg,
Ca(OH)2
В) азот 3)
Ca,
N2,
O2
Г) цинк
4) O2, Ca, Li
5) NaOH,
O2, CuSO4
11)
Какой объём газа выделится при взаимодействии 128 г меди с концентрированной
азотной кислотой.( ответ запишите с точностью до десятых_
12)Из
раствора гидроксида натрия массой 110 г и с массовой долей вещества 10%
выпарили 9 г воды и добавили 4 г того же вещества. Массовая доля вещества в
полученном растворе равна ________%.
13.Оксид алюминия
массой 10,2 г сплавили с карбонатом натрия массой 21,5 г. Весь плав растворили
в 250 мл хлороводородной кислоты (плотностью 1,10 г/мл) с массовой долей 20%.
Рассчитайте массовую долю хлороводорода в полученном растворе.
14.
Для выполнения задания используйте следующий перечень веществ: оксид марганца (II), хлорат калия,
гидроксид калия, фторид калия, фторид серебра (I). Допустимо использование водных растворов
веществ.
Из предложенного перечня веществ выберите вещества, между
которыми возможна окислительно восстановительная реакция, и запишите уравнение
этой реакции. Составьте электронный баланс, укажите окислитель и
восстановитель.
15. Для выполнения задания
используйте следующий перечень веществ: оксид марганца (II), хлорат калия,
гидроксид калия, фторид калия, фторид серебра(I). Допустимо использование водных растворов
веществ.
Из предложенного перечня веществ выберите вещества, между
которыми возможна реакция ионного обмена. Запишите молекулярное, полное и
сокращённое ионное уравнения этой реакции.
16.Порошок хрома растворили в разбавленной азотной кислоте при
нагревании. К полученному раствору добавили избыток раствора карбоната натрия.
Выделившийся осадок отфильтровали и растворили в избытке щёлочи. Через
полученный раствор пропускали хлор в течение длительного времени, в результате
чего раствор приобрёл жёлтый цвет. Напишите
уравнения четырёх описанных реакций.
2 вариант
Для выполнения заданий 1-3 используйте
следующий ряд химических элементов. Ответом в заданиях является
последовательность цифр, под которыми указаны химические элементы в данном
ряду.
2) Au
2) C 3)
Si 4) Cu 5) Pb
1.
Определите, атомы каких из указанных в
ряду элементов имеют конфигурацию внешнего энергетического уровня ns1
(n-1)
d10
2.
Из указанных в ряду элементов выберите три
элемента, которые в периодической системе элементов Д. И. Менделеева находятся
в одной главной подгруппе и расположите их в порядке увеличения радиуса
3. Из
указанных в ряду элементов выберите два, у которых высшая степень окисления не
равна номеру группы
4.
Установите соответствие между формулой вещества и его принадлежностью к
определенному классу/группе неорганических соединений
А) гидроксид железа(III)
1) кислородсодержащая кислота
Б) гидроксид кальция (II)
2) средняя соль
В) гидроксид хрома (II)
3) основная соль
Г) гидроксид хлора (III)
4) амфотерный гидроксид
5) кислая соль
6) основный гидроксид
5.
Из предложенного перечня выберите два вещества, которые взаимодействуют как с
медью, так и с алюминий.
1) раствор NaOH
4) при обычных условиях с азотом
2) раствор HCl
5) могут реагировать с кислородом
3) раствор HNO3
6.
Из предложенного перечня выберите две пары веществ с каждым из которых
реагирует оксид цинка.
1) Na2SiO3 и
Pb
4)BaSO4 и NaOH
2) NO и
Al 5) HNO3 и
NaHCO3
3)CaO и O2
7.
В раствор с веществом Х добавили раствор соли Y.
В результате наблюдали выделение осадка белого цвета, который современем меняет
окраску. Из предложенного перечня выберите вещества Х и Y,
которые могут вступать в описанную реакцию.
1) нитрат железа (III)
4) гидроксид натрия
2) гидроксид
магния 5) серная кислота
3) сульфат железа (II)
8.
Задана следующая схема превращений :
FeSO4
à X à Y àFe
1) Fe(OH)3
2) FeO 3) Fe(OH)2 4)FeI3 5) Fe3(PO4)2
9
Установите соответствие между реагирующими веществами и продуктами, которые
образуются при взаимодействии этих веществ: к каждой позиции, обозначенной
буквой, подберите соответствующую позицию, обозначенную цифрой.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
ПРОДУКТЫ РЕАКЦИИ
А) Pb + HNO3(разб.)
1) Pb(NO3)2
+ H2
Б)
Pb + HNO3(конц.) 2)
Pb(NO3)2 + NO2 + H2O
В) Na[Al(OH)4] + CO2(изб.) 3)
Pb(NO3)2 + NO + H2O
Г) Na[Al(OH)4] + HCl(изб.) 4)
Na2CO3 + Al2(CO3)3 + H2O
5) NaHCO3 + Al(OH)3
6) NaCl + AlCl3 + H2O
10 Запишите
выбранные цифры под соответствующими буквами
Установите соответствие между уравнением
реакции и свойством, которое проявляет элемент марганец в этой реакции.
УРАВНЕНИЕ
РЕАКЦИИ СВОЙСТВО МАРГАНЦА
А) MnCl2+Cl2
+ 4KOH
= MnO2+
4KCl
+2H2O
1) является окислителем
Б) MnO2
+ 4HCl
= MnCl2+
Cl2
+ 2H2O
2) является восстановителем
В) MnCl2 + (NH4)2S
= MnS + 2NH4Cl 3) является и окислителем, и восстановителем
4)не изменяет степень окисления
11.
Из
раствора гидроксида натрия массой 110 г и с массовой долей вещества 10%
выпарили 9 г воды и добавили 4 г того же вещества. Массовая
доля вещества в полученном растворе равна ________%.
12.
Через горячий раствор едкого кали пропустили 672 л
(н.у.) хлора. Какая масса бертолетовой соли теоретически может образоваться.
13.
Медь,
выделившаяся в результате реакции 2,6 г цинка с 160 г 5%-ного раствора сульфата
меди (II), полностью прореагировала с 20 мл разбавленной азотной кислоты (ρ = 1,055
г/мл). Определите массову долю нитрата меди (II) в полученном растворе.
14 Для
выполнения задания используйте следующий перечень веществ: сульфат железа (II),
нитрат калия, перманганат калия, хлорид натрия, дигидроортофосфат стронция.
Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите
вещества, между которыми возможна окислительно-восстановительная реакция, и
запишите уравнение этой реакции. Составьте электронный баланс, укажите
окислитель и восстановитель.
15 Для
выполнения задания используйте следующий перечень веществ: сульфат железа (II),
нитрат калия, перманганат калия, хлорид натрия, дигидроортофосфат стронция. Допустимо
использование водных растворов веществ.
Из предложенного перечня веществ выберите
вещества, между которыми возможна реакция ионного обмена. Запишите
молекулярное, полное и сокращённое ионное уравнения этой реакции.
16 Оксид
хрома (III) сплавили с карбонатом натрия в атмосфере кислорода. Выделившийся
газ поглотили известковой водой, а твёрдый остаток растворили в воде и к
полученному раствору добавили гидроксид бария. Выпал ярко-жёлтый осадок,
который растворяется в азотной кислоте с образованием оранжевого раствора. Напишите
уравнения четырёх описанных реакций.
МЕТАЛЛЫ, ИХ СВОЙСТВА, ПОЛУЧЕНИЕ, ПРИМЕНЕНИЕ. ЭЛЕКТРОЛИЗ.
1. С водой не реагирует:
1) магний 2) бериллий 3) барий 4) стронций
2. Реакции разбавленной азотной кислоты с медью соответствует уравнение:
1) 3 Cu + 8 HNO3 = 3 Cu(NO3)2 + 2 NO + 4 H2O
2) Cu + 2 HNO3 = Cu(NO3)2 + H2
3) Cu + 2 HNO3 = CuO + NO2 + H2O
4) Cu + HNO3 = CuO + NH4NO3 + H2O
3. Сравните процессы, протекающие на электродах при электролизе расплава и раствора хлорида натрия.
4. При электролизе раствора AgNO3 на катоде выделяется:
1) серебро 2) водород 3) серебро и водород 4) кислород и водород
5. При электролизе раствора хлорида калия на катоде происходит:
1) восстановление воды 2) окисление воды
3) восстановление ионов калия 4) окисление хлора
6. Какой процесс происходит на медном аноде при электролизе раствора бромида натрия?
1) окисление воды 2) окисление ионов брома
3) окисление меди 4) восстановление меди
7. Реакция возможна между:
1) Ag и K2SO4 (раствор) 2) Zn и KCl (раствор)
3) Mg и SnCl2 (раствор) 4) Ag и CuSO4 (раствор)
8. В какой последовательности восстанавливаются данные металлы при электролизе растворов их солей?
1) Au , Cu , Ag , Fe 2) Cu , Ag , Fe , Au
3) Fe , Cu , Ag , Au 4) Au , Ag , Cu , Fe
9. С концентрированной HNO3 без нагревания не взаимодействует:
1) Cu 2) Ag 3) Zn 4) Fe
10. Азотная кислота накапливается в электролизёре при пропускании электрического тока через водный раствор
1) нитрата кальция 2) нитрата серебра 3) нитрата алюминия 4) нитрата цезия
11. Из приведенных ниже металлов наиболее активным является:
1) бериллий 2) магний 3) кальций 4) барий
12. Железо реагирует с каждым из двух веществ:
1) хлоридом натрия и азотом 2) кислородом и хлором
3) оксидом алюминия и карбонатом калия 4) водой и гидроксидом алюминия
13. С водой при комнатной температуре реагирует каждый из двух металлов:
1) барий и медь 2) алюминий и ртуть 3) кальций и литий 4) серебро и натрий
14. При сплавлении алюминия с гидроксидом натрия образуется:
1) NaAlO2 2) AlH3 3) Na[Al(OH)4] 4) Al2O3
15. С разбавленной HNO3 без нагревания не взаимодействует:
1) Cu 2) Ag 3) Zn 4) Pt
16. Водород не вытесняется из кислот:
1) хромом 2) железом 3) медью 4) цинком
17. Медь растворяется в разбавленном водном растворе кислоты:
1) серной 2) соляной 3) азотной 4) фтороводородной
18. Медные изделия, находящиеся в контакте с воздухом, постепенно покрываются зелёным налётом, основным ком-
понентом которого является:
1) CuO 2) CuCO3 3) Cu(OH)2 4) (CuOH)2CO3
19. При нагревании магния в атмосфере азота:
1) реакция не идёт 2) образуется нитрид магния
3) образуется нитрит магния 4) образуется нитрат магния
20. При обычной температуре магний не взаимодействует с:
А) водой
Б) растворами щелочей
В) разбавленными H2SO4 и HNO3
Г) концентрированными H2SO4 и HNO3
Д) серой
Ответ: ____________________ . (Запишите соответствующие буквы в алфавитном порядке.)
21. При комнатной температуре хром взаимодействует с:
А) HCl (разб.) Б) Н2О В) H2SO4 (разб.) Г) N2 Д) Н2
Ответ: ____________________ . (Запишите соответствующие буквы в алфавитном порядке.)
22. При электролизе водного раствора KI не образуется:
1) K 2) KOH 3) H2 4) I2
23. Вещество, из которого образуются одинаковые продукты при электролизе водного раствора и расплава, имеет
формулу:
1) CuCl2 2) KВr 3) NaOH 4) NaCl
24. Газообразные вещества будут выделяться на катоде и аноде при электролизе водного раствора:
1) AgNO3 2) KNO3 3) CuCl2 4) HgCl2
25. При электролизе раствора Cr2(SO4)3 на катоде выделяется:
1) кислород 2) водород и хром 3) хром 4) кислород и хром 26. Два инертных электрода опустили в стакан, содержащий смесь водных растворов солей с одинаковой концентра-
цией AgNO3 , Cu(NO3)2 , Hg(NO3)2 , NaNO3 . Первыми при электролизе будут восстанавливаться частицы:
1) Hg+2 2) Ag+ 3) Cu+2 4) H2O
27. При электролизе разбавленного водного раствора Ni(NO3)2 на катоде выделяется:
1) Ni 2) O2 3) Ni и H2 4) H2 и O2
28. Азотная кислота накапливается в электролизёре при пропускании электрического тока через водный раствор
1) нитрата калия 2) нитрата алюминия 3) нитрата магния 4) нитрата меди
29. Выделение кислорода происходит при электролизе водного раствора соли:
1) MgCl2 2) CuSO4 3) NaBr 4) FeBr2
30. При электролизе водного раствора нитрата серебра на катоде образуется:
1) Ag 2) NO2 3) NO 4) H2
31. Кальций в промышленности получают:
1) электролизом раствора СаСl2 2) электролизом расплава СаСl2
3) электролизом раствора Са(ОН)2 4) действием более активного металла на водные растворы солей
32. При электролизе раствора иодида натрия у катода окраска лакмуса в растворе:
1) красная 2) синяя 3) фиолетовая 4) жёлтая
33. При электролизе водного раствора нитрата калия на аноде выделяется:
1) О2 2) NO2 3) N2 4) H2
34. Водород образуется при электролизе водного раствора:
1) CaCl2 2) CuSO4 3) Hg(NO3)2 4) AgNO3
35. При взаимодействии лития с водой образуется водород и:
1) оксид 2) пероксид 3) гидрид 4) гидроксид
36. Металлические свойства слабее всего выражены у:
1) натрия 2) магния 3) кальция 4) алюминия
37. Верны ли следующие суждения о щелочных металлах?
А. Во всех соединениях они имеют степень окисления +1.
Б. С неметаллами они образуют соединения с ионной связью.
1) верно только А 2) верно только Б
3) верны оба суждения 4) оба суждения не верны
38. При комнатной температуре хром взаимодействует с:
1) H2SO4 (р-р) 2) Н2О 3) N2 4) O2
39. При взаимодействии хрома с соляной кислотой образуются:
1) CrCl2 и Н2 2) CrCl3 и Н2О 3) CrCl2 и Н2О 4) CrCl3 и Н2
40. Медь не взаимодействует с:
1) разбавленной HNO3 2) концентрированной HNO3
3) разбавленной HCl 4) концентрированной H2SO4
41. Какой из металлов не вытесняет водород из разбавленной серной кислоты?
1) железо 2) хром 3) медь 4) цинк
42. Наиболее энергично реагирует с водой:
1) Al 2) Mg 3) Ca 4) K
43. При обычных условиях с водой реагирует:
1) Mg 2) Ca 3) Pb 4) Zn
44. В результате реакции кальция с водой образуются:
1) СаО и Н2 2) Са(ОН)2 и Н2 3) СаН2 и О2 4) Са(ОН)2 и О2
45. Химическая реакция не происходит между:
1) Zn и HCl 2) Al и HCl 3) Mg и H2SO4 (разб.) 4) Аg и H2SO4 (разб.)
46. Соляная кислота реагирует с:
1) Cu 2) Zn 3) Ag 4) Hg
47. Для алюминия при обычных условиях возможно взаимодействие с:
А) HgCl2 Б) СаО В) CuSO4 Г) HNO3 (конц.) Д) Na2SO4 E) Fe3O4
Ответ: ____________________ . (Запишите соответствующие буквы в алфавитном порядке.)
48. Установите соответствие между исходными веществами и продуктами окислительно-восстановительных реакций.
ИСХОДНЫЕ ВЕЩЕСТВА ПРОДУКТЫ РЕАКЦИИ
1) Fe + Cl2 → A) FeSO4 + H2
2) Fe + HCl → Б) Fe2(SO4)3 + H2
3) Fe + H2SO4 (разб.) → В) Fe2(SO4)3 + SO2 + H2O
4) Fe + H2SO4 (конц.) → Г) FeCl2 + H2
Д) FeCl3 + H2
Е) FeCl3
49. Напишите уравнения реакций, протекающих на катоде и аноде, и общее уравнение электролиза водного
раствора сульфата меди(II) на инертных электродах.
50. Напишите уравнения реакций, протекающих на катоде и аноде, и общее уравнение электролиза водного раствора
хлорида бария на инертных электродах.
51. Напишите уравнения реакций, протекающих на катоде и аноде, и общее уравнение электролиза водного раствора
иодида калия на инертных электродах.
52. Напишите уравнения реакций, протекающих на катоде и аноде, и общее уравнение электролиза водного раствора
серной кислоты на инертных электродах.
53. Напишите уравнения реакций, протекающих на катоде и аноде, и общее уравнение электролиза водного раствора
бромида лития на инертных электродах.
54. При обычных условиях кальций реагирует с:
1) кислородом 2) углеродом 3) серой 4) азотом
55. Напишите уравнения реакций, протекающих на катоде и аноде, и общее уравнение электролиза водного раствора
нитрата калия на инертных электродах.
56. Напишите уравнения реакций, протекающих на катоде и аноде, и общее уравнение электролиза водного раствора
сульфата натрия на инертных электродах.
57. При обычной температуре медь реагирует с:
1) водой 2) кислородом 3) хлороводородной кислотой 4) азотной кислотой
58. Напишите уравнения реакций, протекающих на катоде и аноде, и общее уравнение электролиза водного раствора
гидроксида калия на инертных электродах.
59. В разбавленной серной кислоте растворяется:
1) Cu 2) Zn 3) Ag 4) Au
60. Напишите уравнения реакций, протекающих на катоде и аноде, и общее уравнение электролиза водного раствора
азотной кислоты на инертных электродах.
61. При нагревании медь реагирует с:
1) водородом 2) сероводородной кислотой
3) разбавленной серной кислотой 4) концентрированной серной кислотой
62. Напишите уравнения реакций, протекающих на катоде и аноде, и общее уравнение электролиза водного раствора
гидроксида бария на инертных электродах.
Потапова Е.В. (МКОУ «СОШ № 1» , г. Юхнов Юхновского района Калужской области)

Тест рассчитан на проверку усвоенных знаний по теме «Металлы», а также подготовку к ЕГЭ.
В тест включены вопросы:
-на выбор одного верного ответа,
-несколько верных ответов,
-установление соответсвия,
-установления последовательности,
-ввод текста,
-ввод числового значения.
Инструкция к тесту
Будьте внимательны с заданиями с написанием слов: слова вписываются без пробелов,без запятых.
Ввод числового значения в номере 18 , округляется до десятых , например 2,5
Ввод числового значения в номере 20 вписывается без пробелов ,без запятых, по возрастанию.
Не забудьте указать свои данные ФИО.
Желаю удачи!
Количество вопросов в тесте:
20
-
При взаимодействии каких веществ водород не выделяется?
1) Zn и H2SO4(разб.) 2) Al и NaOH(конц.)
3) Cu и HNO3(конц.) 4) Zn и NaOH(конц.)
-
В результате реакции кальция с водой образуются
1) СaO и H2 2) Ca(OH)2 и H2 3) CaH2 и O2 4) Ca(OH)2 и O2
-
С водой при комнатной температуре взаимодействует каждый из двух оксидов:
1) Fe2O3 и MgO 2) CuО и СаО 3) Na2О и СаО 4) Al2O3 и ВеО
-
При нагревании медь реагирует с
1) водородом 2) сероводородной кислотой
3) разбавленной серной кислотой 4) концентрированной серной кислотой
-
Какой из металлов вытесняет медь из сульфата меди (II)?
1) Zn 2) Ag 3) Hg 4) Au
-
Гидроксид кальция реагирует с каждым из двух веществ:
1) HCl и CO2 2) HNO3 и MgO 3) НCl и KOH 4) BaCl2 и NaOH
-
Гидроксид цинка может реагировать со всеми веществами пары
1) сульфат кальция, оксид серы (VI) 2) гидроксид натрия (р-р), соляная кислота
3) вода, хлорид натрия 4) сульфат бария, гидроксид железа (III)
-
В схеме превращений FeCl3→X1FeCl2→X2FeCl3 веществами «Х1» и «Х2» могут быть соответственно
1) H2 и HCl 2) HCl и NaCl 3) HCl и Cl2 4) Fe и Cl2
-
С разбавленной соляной кислотой при обычных условиях не взаимодействует
1) Cu(OH)2 2) CuO 3) Cu 4) CuCO3
-
Водород не вытесняется из кислот
1) хромом 2) железом 3) медью 4) цинком
-
При обычных условиях практически осуществима реакция между медью и
1) водой 2) нитратом ртути(II)(р-р) 3) сульфатом алюминия(р-р) 4) соляной кислотой(разб.)
-
При обычной температуре медь реагирует с
1) водой 2) кислородом 3) хлороводородной кислотой 4) азотной кислотой
-
С водой при комнатной температуре реагирует каждый из двух металлов:
1) барий и медь 2) алюминий и ртуть 3) кальций и литий 4) натрий и серебро
-
С гидроксидом натрия реагирует:
1) хлорид лития 2) сульфат натрия 3) нитрат меди (II) 4) оксид серы (IV)
5) хлор 6) оксид меди (II) 7) серная кислота
-
Оксиды металлов со степенью окисления + 6 и выше являются
1) несолеобразующими 2) основными 3) амфотерными 4) кислотными
-
Верны ли следующие суждения о свойствах оксида хрома (III)?
А. Оксид хрома (III) проявляет амфотерные свойства.
Б. Оксид хрома (III) проявляет только восстановительные свойства.
1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения неверны
-
При взаимодействии кальция с водой образуются(-ется)
1) Ca(OH)2 и H2 2) CaO и H2 3) Ca(OH)2 4) CaO и Н2О2
-
Оксид цинка взаимодействует с каждым из двух веществ:
1) NaOH и Cu(OH)2 2) Al(OH)3 и H2O 3) KOH и HNO3 4) K2SO4 и P2O5
-
При комнатной температуре хром взаимодействует с
1) HCl (разб.) 2) H2O 3) H2SO4 (разб.) 4) N2 5) H2
-
Установите соответствие между исходными веществами и продуктами их взаимодействия.
ИСХОДНЫЕ ВЕЩЕСТВА ПРОДУКТЫ РЕАКЦИИ
А) Fe+ Cl2 → 1) FeSO4 + H2
Б) Fe + HCl → 2) Fe2(SO4)3 + H2
В) Fe + H2SO4 (разбавл.) → 3) Fe2(SO4)3 + SO2 + H2O
Г)Fe + H2SO4 (конц.) 4) FeCl2 + H2
5) FeCl3 + H2
6) FeCl3
-
При взаимодействии меди с концентрированной серной кислотой образуются:
1) сульфат меди (II), оксид серы (IV), вода 2) сульфат меди (II), вода
3) оксид меди (II), оксид серы (IV), вода 4) сульфат меди (I), вода, оксид серы (IV)
-
Гидроксид алюминия взаимодействует с каждым из двух веществ:
1) HNO3 и NaCl 2) HCl и LiOH 3) KOH и Na2SO4 4) NaOH и CaCl2
-
Амфотерным оксидом является
1) NO 2) Fe2O3 3) СаO 4) SO2
-
Медь не взаимодействует с
1) разбавленной HNO3 2) концентрированной HNO3
3) разбавленной HCl 4) концентрированной H2SO4
-
Цинк вытесняет каждый из перечисленных металлов из растворов их солей:
1) Mg, Al, Na 2) Ca, Cu, Ag 3) Fe, Cu, Ag 4) Mg, Ba, Ag
-
В водном растворе протекает реакция между
1) Cu и ZnCl2 2) Zn и CuSO4 3) Fe и Al(NO3)3 4) Ag и FeSO4
-
Установите соответствие между реагирующими веществами и продуктами реакции.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА ПРОДУКТЫ РЕАКЦИИ
А) Al и KOH(р-р) 1) гидроксид алюминия и сера
Б) Al и H2SO4(разб.) 2) гидроксид алюминия и сероводород
В) Al2S3 и H2O 3) тетрагидроксоалюминат калия и водород
Г) Al и H2O 4) сульфат алюминия и водород
5) алюминат калия и оксид алюминия
6) гидроксид алюминия и водород
-
При взаимодействии хрома с соляной кислотой образуются
1) CrCl2 и Н2 2) CrCl3 и Н2О 3) CrCl2 и Н2О 4) CrCl3 и Н2
-
Оксид алюминия взаимодействует с каждым из двух веществ:
1) NO и CO2 2) Cu(OH)2 и CuO 3) Na2O и NaOH 4) KCl и HCl
-
Только при высокой температуре с водой реагирует
1) K 2) Zn 3) Ag 4) Sr
-
В реакцию с оксидом цинка вступает каждое из двух веществ:
1) О2 и SO3 2) H2 и H2S 3) Na2O и HCl 4) CuO и NaCl
-
Установите соответствие между исходными веществами и продуктами реакции.
ИСХОДНЫЕ ВЕЩЕСТВА ПРОДУКТЫ РЕАКЦИИ
А) Fe + Cl2 1) FeCl2
Б) Fe + HCl 2) FeCl3
В) FeO + HCl 3) FeCl2 + H2
Г) Fe2O3 + HCl 4) FeCl3 + H2
5) FeCl2 + H2O
6) FeCl3 + H2O
-
К оснóвным оксидам не относится
1) Mn2O7 2) MgO 3) Ag2O 4) CaO
-
Установите соответствие между реагирующими веществами и продуктами реакции.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА ПРОДУКТЫ РЕАКЦИИ
А) Cu и HNO3(разб.) 1) сульфат меди(II), оксид серы(IV) и вода
Б) CuS и O2 2) нитрат меди(II), оксид азота(II) и вода
В) Cu и HNO3(конц.) 3) сульфит меди(II), оксид серы(VI) и вода
Г) Cu и H2SO4(конц.) 4) оксид меди(II) и оксид серы(IV)
5) нитрат меди(II), оксид азота(IV) и вода
6) оксид меди(II) и оксид серы(VI)
-
При взаимодействии концентрированной серной кислоты с медью при нагревании образуется
1) сера 2) водород 3) оксид серы(IV) 4) оксид серы(VI)
-
Алюминий может реагировать с
1) сульфатом магния 2) хлоридом натрия 3) нитратом кальция 4) гидроксидом натрия
-
Установите соответствие между реагирующими веществами и продуктами их взаимодействия.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА ПРОДУКТЫ ВЗАИМОДЕЙСТВИЯ
А) Zn(OH)2+KOH→сплавл.to 1) Zn(NO3)2 + H2
Б) Zn(OH)2 + KOH(р-р) 2) Zn(NO3)2 + H2O
В) Zn(OH)2 + HNO3 3) K2ZnO2+ H2O
Г) Zn(OH)2 → 4) K2[Zn(OH)4]
5) ZnO + H2
6) ZnO + H2O
-
Медь может вступать во взаимодействие с водным раствором
1) гидроксида натрия 2) хлорида кальция 3) нитрата цинка 4) азотной кислоты
-
В схеме превращений ZnO → X1 → X2 → Zn(OH)2 веществами «Х1» и «Х2» могут быть соответственно
1) ZnS и ZnSO4 2) ZnSO4 и ZnCl2 3) Zn(OH)2 и Zn 4) ZnCO3 и Zn3(PO4)2
-
Цинк взаимодействует с раствором
1) CuSO4 2) MgCl2 3) Na2SO4 4) CaCl2
-
В схеме превращений Ва → X1 → X2 → Ва(NO3)2 веществами Х1 и Х2 являются соответственно
1) Ва(OH)2 и ВаCl2 2) Ва(OH)2 и ВаSO4 3) ВаCl2 и ВаSO4 4) ВаCl2 и ВаO
-
Какой из металлов не вытесняет водород из разбавленной серной кислоты?
1) железо 2) хром 3) медь 4) цинк
-
Какой из металлов вытесняет железо из сульфата железа (II)?
1) Cu 2) Zn 3) Sn 4) Hg
-
В схеме превращений
веществом «X» является
1) CuO 2) Cu 3) Cu(OH)2 4) CuCl2
-
С водой без нагревания реагирует
1) цинк 2) медь 3) железо 4) литий
-
Оксид кальция взаимодействует с каждым из двух веществ:
1) HCl и H2O 2) Cu и CuCl2 3) NaOH и H2O 4) MgO и MgSO4
-
Степень окисления хрома в его амфотерных соединениях равна
1) + 6 2) + 2 3) + 3 4) + 1
-
Медь взаимодействует с каждым из двух веществ:
1) H2SO4(конц.) и Cl2 2) NaOH и ZnCl2
3) H2SO4(разб.) и NH3 4) HCl(разб.) и Ca(NO3)2
-
Водород образуется при взаимодействии
1) Н2SO4(конц.) и Cu 2) HNO3(конц.) и Mg
3) Н2SO4(разб.) и Zn 4) HNO3(разб.) и Ag
-
С гидроксидом алюминия взаимодействует каждое из двух веществ:
1) H3PO4 и CuS 2) KNO3 и SiO2
3) NaCl и Na2CO3 4) HNO3 и Ba(OH)2
-
Оксид лития взаимодействует с
1) СО 2) СО2 3) NO 4) CaO
-
С гидроксидом калия взаимодействует каждое из двух веществ:
1) HNO3 и CO2 2) MgO и H2SO4
3) SO2 и K2SO4 4) Al2O3 и NaOH
-
Среди перечисленных веществ:
А) Na2O Б) Сr2O3 В) CaO Г) Al2O3 Д) Rb2O Е) ZnO
к оснóвным оксидам относят:
1) АВД 2) АВЕ 3) БГЕ 4) ВГЕ
-
Взаимодействие натрия с водой относится к реакциям
1) соединения 2) замещения 3) обмена 4) разложения
-
При сплавлении алюминия с гидроксидом натрия образуется
1) NaAlO2 2) AlH3 3) Na[Al(OH)4] 4) Al2O3
-
При прокаливании Cr(OН)3 образуется вода и
1) oксид хрома (II) 2) oксид хрома (III) 3) oксид хрома (IV) 4) хром
-
Оксид кальция взаимодействует с каждым из трех веществ:
1) кислород, вода, серная кислота 2) соляная кислота, углекислый газ, вода
3) оксид магния, оксид серы (IV), аммиак 4) железо, азотная кислота, оксид фосфора (V)
-
Как гидроксид натрия, так и гидроксид железа(III) взаимодействуют с
1) СО2 2) CuCl2(р-р) 3) H2SO4 4) SiО2
-
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Сu Cu(NO3)2
Cu(OH)2
X
Cu
CuSO4.
Укажите условия протекания реакций.
-
Гидроксид кальция вступает в реакцию с
1) MgO 2) BaCl2 3) NO 4) H2S
Материал по химии
- Какие реакции нужно знать, чтобы решить ЕГЭ по химии?
- 1) Взаимодействие металлов с кислородом
- 2) Взаимодействие металлов с водой
- 3) Амфотерные металлы
- 4) Амфотерные оксиды и гидроксиды
- 5) Комплексные соли
- 6) Амфотерные соли
- 7) Углерод на ЕГЭ
-
Азот на ЕГЭ
- 9) Фосфор на ЕГЭ
- 10) Сера на ЕГЭ
- 11) Замещение неметаллов
- 12) Взаимодействие неметаллов с другими неметаллами
- 13) Медь и её соединения
- 14) Серебро и его соединения
- 15) Хром и его соединения
- 16) Железо и его соединения
- 17) Соединения марганца
- 18) Неметаллы с щелочами
- 19) Кислотные оксиды с щелочами
- 20) Гидриды, фосфиды, нитриды, сульфиды, карбиды
- 21) Гидролиз бинарных соединений с ковалентной полярной связью
- 22) Взаимный гидролиз
В данном материале мы рассмотрим только те реакции неорганической химии, что выходят за пределы свойств классов (солей, кислот, оксидов, оснований) и часто встречаются в 8 задании. В материале Вы познакомитесь с самыми популярными реакциями, которые встречаются на экзамене.
Какие реакции нужно знать, чтобы решить ЕГЭ по химии?
1) Взаимодействие металлов с кислородом
- Натрий, как и другие щелочные металлы (кроме лития), а также барий, при взаимодействии с кислородом образуют пероксиды или надпероксиды:
2Na + O2 = Na2O2
Причем, для натрия более характерен пероксид, а для калия – надпероксид:
K + O2 = KO2
- Пероксиды реагируют с холодной и горячей водой по-разному: с холодной водой происходит реакция обмена:
Na2O2 + 2H2O = 2NaOH + H2O2
В горячей воде происходит окислительно-восстановительная реакция:
2Na2O2 + H2O = 4NaOH + O2↑
2) Взаимодействие металлов с водой
Основные продукты при взаимодействии металлов с водой можно представить в виде следующей схемы:
Задание 8 ЕГЭ по химии
- Активные металлы, такие как натрий, калий, кальций, легко реагируют с водой, вытесняя водород. Реакции относятся к экзотермическим (проходят с выделением большого количества тепла), натрий и калий так активно реагируют с водой, что при контакте происходит их возгорание.
2Na + 2H2O = 2NaOH + H2↑
- Магний и алюминий тоже образуют гидроксиды, но для реакции необходимо нагревание. Алюминий берут в виде амальгамы.
Mg + 2H2O = Mg(OH)2 + H2↑
- Металлы средней активности требуют нагревания для взаимодействия с водой, при этом образуется оксид, а не гидроксид:
Zn + H2O = ZnO + H2↑
- Железо при взаимодействии с водой образует окалину (смесь оксида железа II и оксида железа III):
3Fe + 4H2O = Fe3O4 + 4H2
- На влажном воздухе железо превращается в бурый гидроксид железа III:
2Fe + 3H2O + 3O2 = 2Fe(OH)3
Задание в формате ЕГЭ с ответом:
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- K + H2O →
- K2O + H2O →
- K + O2 →
- K2O2 + H2Oхолод. →
- KOH
- K2O
- KOH + H2O2
- KOH + H2
- KO2
Пример задания из КИМ ЕГЭ:
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- Ba + O2 →
- BaO + H2O →
- Ba + H2O →
- BaO2 + H2O (горяч.) →
- Ba(OH) 2 + O2
- BaO2
- Ba(OH) 2
- BaO
- Ba(OH) 2 + H2
От активности металла зависит продукт реакции
3) Амфотерные металлы
Алюминий, цинк и бериллий отличаются от других металлов тем, что могут вступать во взаимодействие с концентрированными растворами щелочей, понятие «амфотерные металлы» использовано для облегчения поиска, такое понятие не совсем верно.
2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2
Zn + 2NaOH + 2H2O = Na2[Zn(OH)4] + H2
Be + 2NaOH + 2H2O = Na2[Be(OH)4] + H2
4) Амфотерные оксиды и гидроксиды
Амфотерные оксиды и гидроксиды реагируют с концентрированными растворами щелочей, причем продукт зависит от агрегатного состояния исходной щелочи: если она твердая, то применяют сплавление и образуется средняя соль, если же щелочь дана в растворенном виде, то образуется комплексная соль. Эти различия очень часто встречаются в задании 8 на ЕГЭ по химии!
- При сплавлении:
Al2O3 + 2NaOH = 2NaAlO2 + H2O↑
Al(OH)3 + NaOH = NaAlO2 + 2H2O↑
- При растворении в концентрированной щелочи:
BeO + 2KOH + H2O = K2[Be(OH)4]
Be(OH)2 + 2KOH = K2[Be(OH)4]
Можно брать любую щелочь и любой амфотерный оксид или гидроксид.
- Амфотерные оксиды, при сплавлении с солями, вытесняют летучие кислотные оксиды:
Na2CO3 + Al2O3 = 2NaAlO2 + CO2↑
K2SO3 + ZnO = K2ZnO2 + SO2↑
Задание по образцу ФИПИ:
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- Be + KOH р-р →
- BeO + KOH р-р →
- BeO + KOH тв. →
- Be(OH) 2 + KOH тв. →
- K2 [Be(OH) 4] + H2O
- K2 [Be(OH) 4] + H2
- K2O + Be(OH) 2
- K2 [Be(OH) 4]
- K2BeO2 + H2O
5) Комплексные соли
- Комплексные соли разлагаются при нагревании с потерей воды:
Na[Al(OH)4] = NaAlO2 + 2H2O
K2[Zn(OH)4] = K2ZnO2 + 2H2O
- Комплексные соли реагируют с сильными кислотами в двух вариантах (при избытке и при недостатке кислоты):
Na[Al(OH)4] + HCl = NaCl + H2O + Al(OH)3↓ (при недостатке кислоты)
Na[Al(OH)4] + 4HCl = NaCl + AlCl3 + 4H2O (при избытке кислоты)
- Комплексные соли реагируют со слабыми кислотами и летучими кислотными оксидами, получаемые сульфиды, карбонаты, сульфиты алюминия неустойчивы, поэтому вместо них записывают гидроксид амфотерного металла:
2Na[Al(OH)4] + H2S = Na2S + 2Al(OH)3 + 2H2O (при недостатке сероводородной кислоты)
Na[Al(OH)4] + H2S = NaHS + Al(OH)3 + H2O (при избытке сероводородной кислоты)
2Na[Al(OH)4] + CO2 = Na2CO3 + 2Al(OH)3 + H2O (при недостатке углекислого газа)
Na[Al(OH)4] + CO2 = NaHCO3 + Al(OH)3 (в условиях избытка углекислого газа)
Попробуйте решить задание ЕГЭ:
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- Na2 [Zn(OH) 4] нагревание →
- Na2 [Zn(OH) 4] + H2S изб. →
- Na2 [Zn(OH) 4] + H2S нед. →
- NaOH тв. + Zn(OH) 2 →
- NaHS + ZnS + H2O
- Na2S + Zn(OH) 2 + H2O
- Na2ZnO2 + H2O
- Na2S + Zn + H2O
- Na2ZnO2 + H2
6) Амфотерные соли
Термин «амфотерные соли» некорректен, однако за последний месяц было более четырех тысяч запросов с таким сочетанием слов, под амфотерными солями школьник понимает соли, в анионе которого стоит амфотерный металл, а также комплексные соли, описанные выше. На самом деле, соли в которых амфотерный металл принадлежит аниону следует относить к самым обычным средним солям. Рассмотрим свойства некоторых из них, например, цинката натрия (Na2ZnO2) и алюмината калия (KAlO2).
- Реагируют с сильными кислотами:
Na2ZnO2 + 4HCl = 2NaCl + ZnCl2 + 2H2O
2KAlO2 + 4H2SO4 = K2SO4 + Al2(SO4)3 + 4H2O
Б) Растворяются в воде с образованием соответствующей комплексной соли:
KAlO2 + 2H2O = K[Al(OH)4]
- Также под амфотерными солями школьники подразумевают соли, содержащие в катионе металл в третьей валентности (что тоже является неверным, это средние соли) или цинк и бериллий, такие соли могут по-разному реагировать с растворами щелочей, например:
AlCl3 + 3NaOH = 3NaCl + Al(OH)3 (недостаток щелочи, разбавленный раствор щелочи)
AlCl3 + 4NaOH = NaCl + Na[Al(OH)4] (избыток щелочи, концентрированный раствор щелочи)
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- Na2BeO2 + H2SO4 →
- Na2 [Be(OH) 4] + H2SO4 изб. →
- Na2 [Be(OH) 4] + H2SO4 нед. →
- Na2BeO2 + H2O →
- Na2SO4 + BeSO4 + H2O
- Na2SO4 + Be(OH) 2
- Na2SO4 + Be(OH) 2 + H2O
- Na2 [Be(OH) 4]
- NaOH + BeSO4 + H2O
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- AlCl3 + KOH разб. →
- AlCl3 + K2CO3 р-р →
- AlCl3 + KOH конц. →
- Al2O3 + K2CO3 тв. →
- Al(OH) 3 + KCl
- KCl + KAlO2 + H2O
- KAlO2 + CO2
- K[Al(OH) 4] + KCl
- Al(OH) 3 + KCl + CO2
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- Ba(OH) 2 нед. + AlCl3 →
- Ba(OH) 2 изб. + AlCl3 →
- Ba(AlO2)2 + HCl →
- Ba[Al(OH) 4]2 + HCl изб. →
- Ba(OH) 2 + AlCl3 + H2O
- BaCl2 + Ba[Al(OH) 4]2
- BaCl2 + AlCl3 + H2O
- BaCl2 + Al(OH) 3 + H2O
- BaCl2 + Al(OH) 3
7) Углерод на ЕГЭ
В задании 8 часто встречаются гидрокарбонаты, рассмотрим их важнейшие свойства на примере гидрокарбоната кальция.
Гидрокарбонаты, как и другие кислые соли, при взаимодействии с щелочами, оксидами, солями, кислотами и при нагревании часто превращаются в средние соли.
- Разложение при нагревании:
Ca(HCO3)2 → CaCO3 + CO2 + H2O
- Взаимодействие с щелочами:
Ca(HCO3)2 + Ca(OH)2 → 2CaCO3 + 2H2O
Ca(HCO3)2 + 2NaOH → CaCO3 + Na2CO3 + 2H2O
- Взаимодействие с кислотами:
Ca(HCO3)2 + 2HCl → CaCl2 + 2CO2 + 2H2O
- Реакция с карбонатами. Эти реакции идут с образованием кислых солей, необходимый для их образования водород поступает из воды, поэтому составители используют такие обозначения как CO2 р-р или CaCO3 влажн., реакция идет по следующей схеме:
CaCO3 + CO2 + H2O → Ca(HCO3)2
- Углекислый газ
Восстановление углерода активными металлами и углеродом:
CO2 + 2Mg → 2MgO + C
CO2 + C → 2CO
- Реакции с монооксидом углерода:
- CO или угарный газ – хороший восстановитель, реагирует с окислителями:
CO + CuO = CO2 + Cu
CO + Cl2 = COCl2
CO + Br2 = COBr2
2CO + O2 = 2CO2
- Монооксид углерода проявляет и окислительные свойства:
СO + H2 = CH3OH
- Вступает в реакции без изменения степени окисления:
CO + NaOHтв. = HCOONa (при сплавлении)
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- KHCO3 + Ca(OH) 2 →
- Mg(HCO3)2 + H2CrO4 →
- MgCO3 + H2CrO4 →
- Ca(HCO3)2 + KOH →
- Cr2O3 + MgCO3 + H2O
- KOH + Ca(HCO3)2
- CaCO3 + K2CO3 + H2O
- MgCrO4 + H2O + CO2
- CaO + K2CO3 + H2O
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- Mg + CO2 →
- MgO + CO2 →
- Mg(HCO3)2 + NaOH →
- MgCl2 + Na2CO3 →
- MgO + C
- MgCO3
- Mg + CO
- MgCO3 + Na2CO3 + H2O
- MgCO3 + NaCl
 Азот на ЕГЭ
Азот на ЕГЭ
Очень популярной в заданиях ЕГЭ по химии является азотная кислота, в отличие от обычных кислот, в качестве окислителя выступает не протон водорода, а азот в высшей степени окисления.
В общем, схему реакции кислоты с металлами можно представить в следующем виде:
HNO3 + Me → Me+x(NO3)x + H2O + особый продукт
Особые продукты зависят от характера металла, приведем из в виде таблицы:
Таблица – свойства азотной кислоты
|
Реагент |
HNO3 концентрированная |
HNO3 разбавленная |
|
Активные металлы (металлы IA и IIА-группы в таблице Менделеева) |
N2O (редко NO) |
NH4NO3 (редко N2 или NH3) |
|
Неактивные металлы Cu, Ag, Hg |
NO2 |
NO |
|
Cr, Al, Fe |
На холоде реакция не идёт в следствие пассивации, При нагревании образуется NO2, а металл приобретает степень окисления +3 |
NO (редко N2, N2O) |
|
Металлы средней активности (все остальные металлы, например, Zn, Ni, Co) |
NO2 |
NO (редко N2, N2O) |
|
Au, Pt |
Реакция не идет |
Реакция не идет |
- Примеры реакций металлов с азотной кислотой:
4HNO3 разб. + Al = Al(NO3)3 + NO + 2H2O (при любой температуре)
6HNO3 конц. + Al = Al(NO3)3 + 3NO2 + 3H2O (реакция идет только при нагревании)
10HNO3 разб. + 4Mg = 4Mg(NO3)2 + NH4NO3 + 3H2O
10HNO3 конц. + 4Mg = 4Mg(NO3)2 + N2O + 5H2O
- C другими восстановителями азотные кислоты ведут себя аналогичным образом: у концентрированной продуктом является NO2, а у разбавленной – NO:
FeO + 4HNO3 конц. = Fe(NO3)3 + NO2 + 2H2O
3FeO + 10HNO3 разб. = 3Fe(NO3)3 + NO + 5H2O
- Азотная кислота реагирует и с неметаллами, например, с серой и углеродом:
6HNO3 конц. + S = H2SO4 + 6NO2 + 2H2O
4HNO3 конц. + С = CO2 + 4NO2 + 2H2O
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- CuO + HNO3 конц. →
- CuO + HNO3 разб. →
- Cu + HNO3 конц. →
- Cu + HNO3 разб. →
- Cu(NO3)2 + H2O + NO2
- CuO + NO2 + O2
- Cu(NO3)2 + H2O
- Cu(NO3)2 + H2O + NO
- CuNO3 + H2O + NO
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- FeO + HNO3 конц. →
- Fe + HNO3 конц. tºC →
- Fe(NO3)2 + HNO3 конц. →
- FeO + HNO3 разб. →
- Fe(NO3)2 + H2O + NO2
- Fe(NO3)3 + H2O + NO2
- Fe(NO3)2 + H2O + NO
- Fe(NO3)3 + H2O + NO
- Fe(NO3)2 + H2O
9) Фосфор на ЕГЭ
- Фосфор выступает в роли окислителя и восстановителя в реакции с щелочами:
4P + 3NaOH + 3H2O → 3NaH2PO2 + PH3↑
Это одна из самых популярных окислительно-восстановительных реакций с фосфором на ЕГЭ по химии.
- оксид фосфора III реагирует с холодными растворами щелочей и водой без изменения степени окисления:
P2O3 + 2KOH + H2O → 2KH2PO3
P2O3 + 3H2O → 2H3PO3 (или HPO2)
- Соединения фосфора III – хорошие восстановители, стремятся превратиться в соединения фосфора V:
P2O3 + окислитель → PO43‒ + продукты восстановления
P2O3 + 4KMnO4 + 10KOH → 2K3PO4 + 4K2MnO4 + 5H2O
P2O3 + 4HNO3 + H2O → 2H3PO4 + 4NO2
- Оксид фосфора V реагирует с водой, образуя ряд кислот:
P2O5 + H2O → 2HPO3 – метафосфорная (в сильном недостатке воды)
P2O5 + 2H2O → H4P2O7 – пирофосфорная (в небольшом недостатке воды)
P2O5 + 3H2O → 2H3PO4 – ортофосфорная (в избытке воды)
- Фосфаты могут образовывать кислые соли, при взаимодействии с фосфорной кислотой:
2K3PO4 + H3PO4 → 3K2HPO4
K3PO4 + 2H3PO4(большой избыток) → 3KH2PO4
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- NaH2PO4 + NaOH нед. →
- NaH2PO4 + NaOH изб. →
- NaH2PO4 изб. + NaOH →
- NaH2PO4 нед. + NaOH →
- Na3PO4 + H2O
- NaH2PO3 + H2O
- Na3PO4 + P2O5
- NaH2PO2 + H2O
- Na2HPO4 + H2O
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- P2O5 + H2O нед. →
- P2O3 + KOH →
- P + KOH →
- P2O5 нед. + H2O →
- K2HPO3 + H2O
- KH2PO2 + PH3
- HPO3
- H3PO4
- HPO2
10) Сера на ЕГЭ
Таблица ‒ Серная кислота
|
Свойства |
Разбавленная H2SO4 |
Концентрированная H2SO4 |
|
Окислительные свойства |
Окислитель за счет протона водорода |
Окислитель за счет серы |
|
Активные металлы |
2Na + H2SO4 = Na2SO4 + H2 |
8Na + 5H2SO4 = 4Na2SO4 + 4H2O + H2S↑ |
|
Металлы средней активности |
Zn + H2SO4 = ZnSO4 + H2 |
3Zn + 4H2SO4 = 3ZnSO4 + 4H2O + S↓ (в зависимости от концентрации кислоты может выделиться SO2 или H2S) |
|
Al, Cr, Fe |
Как с другими металлами до водорода: Fe + H2SO4 = FeSO4 + H2 |
На холоде реакция не идет (пассивация), при нагревании: 2Fe + 6H2SO4 = Fe2(SO4)3 + 6H2O + 3SO2 |
|
Металлы средней активности |
Реакция не идет, так как эти металлы не могут вытеснить водород |
Cu + 2H2SO4 = CuSO4 + 2H2O + SO2 |
- Обменная реакция с концентрированной серной кислотой:
NaCl + H2SO4 конц. = NaHSO4 + HCl↑ (при сильном нагревании)
Остальные обменные реакции стандартны и в этом материале рассмотрены не будут.
- Сероводород:
SO2 + 2H2S = 3S↓ + 2H2O
2H2S + 3O2 = 2H2O + 2SO2 (кислород в избытке)
2H2S + O2 = 2H2O + 2S↓ (кислород в недостатке)
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- KCl тв. + H2SO4 конц. →
- KI + H2SO4 конц. →
- Fe + H2SO4 конц. tºC →
- FeO + H2SO4 конц. →
- Cl2 + K2SO4 + H2O
- KHSO4 + HI
- KHSO4 + HCl
- I2 + K2SO4 + H2S
- Fe2 (SO4)2 + H2O + SO2
- FeSO4 + H2O
11) Замещение неметаллов
Часто в задании 8 ЕГЭ по химии встречается замещение брома на хлор, или йода на хлор или бром. Галогены могут вытеснять друг друга и другие неметаллы из соединений. Чтобы понимать, какие неметаллы могут вытеснить другие неметаллы, нужно помнить о том, что в ПС Д.И. Менделеева элементы стоят таким образом, что чем правее и выше стоит элемент, тем сильнее проявляются его неметаллические свойства, и тем выше его электроотрицательность. Более электроотрицательные неметаллы могут вытеснять менее электроотрицательные. Так, хлор и бром стоят выше в таблице Менделеева, чем йод, поэтому могут вытеснить его из соединений:
2NaI + Br2 = 2NaBr + I2
2KI + Cl2 = 2KCl + I2
Хлор может вытеснить бром:
2NaBr + Cl2 = 2NaCl + Br2
Йод не может вытеснить другие галогены, так как расположен в ПС ниже хлора, брома и фтора, но йод может вытеснить те элементы-неметаллы, что стоят левее в Периодической системе, например, серу:
H2S + I2 = 2HI + S
Можно использовать ряд электроотрицательности неметаллов, на реальном ЕГЭ его не будет, легче запомнить Периодический закон, тем более что эти знания также нужны для выполнения задания 2 ЕГЭ по химии.
12) Взаимодействие неметаллов с другими неметаллами
Более электроотрицательные неметаллы могут окислить менее электроотрицательные неметаллы. То есть те элементы, которые стоят в ПС выше и правее отнимают электроны у тех неметаллов, которые стоят ниже и левее.
Например, хлор, бром и фтор могут окислить йод, серу, фосфор (наиболее популярные на ЕГЭ реакции). В таблице представлены наиболее популярные продукты:
Таблица – взаимодействие неметаллов
|
Восстановители |
Окислители |
|||||
|
F2 |
Cl2 |
Br2 |
I2 |
O2 |
S |
|
|
I2 |
IF7 IF5 |
ICl5 ICl3 ICl |
IBr5 IBr3 IBr |
‒ |
‒ |
‒ |
|
S |
SF6 |
SCl4 |
SBr4 |
‒ |
SO2 |
‒ |
|
P |
PF5 |
PCl5 PCl3 |
PBr5 PBr3 |
PI3 |
P2O3 P2O5 |
P2S3 P2S5 |
|
Si |
SiF4 |
SiCl4 |
SiBr4 |
SiI4 |
SiO2 |
SiS2 |
|
H2 |
HF |
HCl |
HBr |
HI |
H2O |
H2S |
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- S + O2 →
- SO2 + O2 →
- H2S + SO2 →
- S + P →
- S + H2O
- SO2
- P2S3
- SO3
- S3P2
13) Медь и её соединения
2CuCl2 + 4KI = 2CuI↓ + I2 + 4KCl
Cu(OH)2 + 4NH3 = [Cu(NH3)4](OH)2 – темно-синий комплекс
Cu2O + 4NH3 + H2O = 2[Cu(NH3)2]OH – прозрачный раствор
3CuO + 2NH3 = 3Cu + N2 + 3H2O
14) Серебро и его соединения
AgCl + 2NH3 = [Ag(NH3)2]Cl
8AgNO3 + PH3 + 4H2O = H3PO4 + 8Ag + 8HNO3
15) Хром и его соединения
- Соединения хрома II – хорошие восстановители, при взаимодействии с окислителями превращаются в соединения хрома III
4CrO + O2 = 2Cr2O3
CrO + 4HNO3 = Cr(NO3)3 + 2H2O + NO2
- соединения хрома III проявляют как окислительные, так и восстановительные свойства:
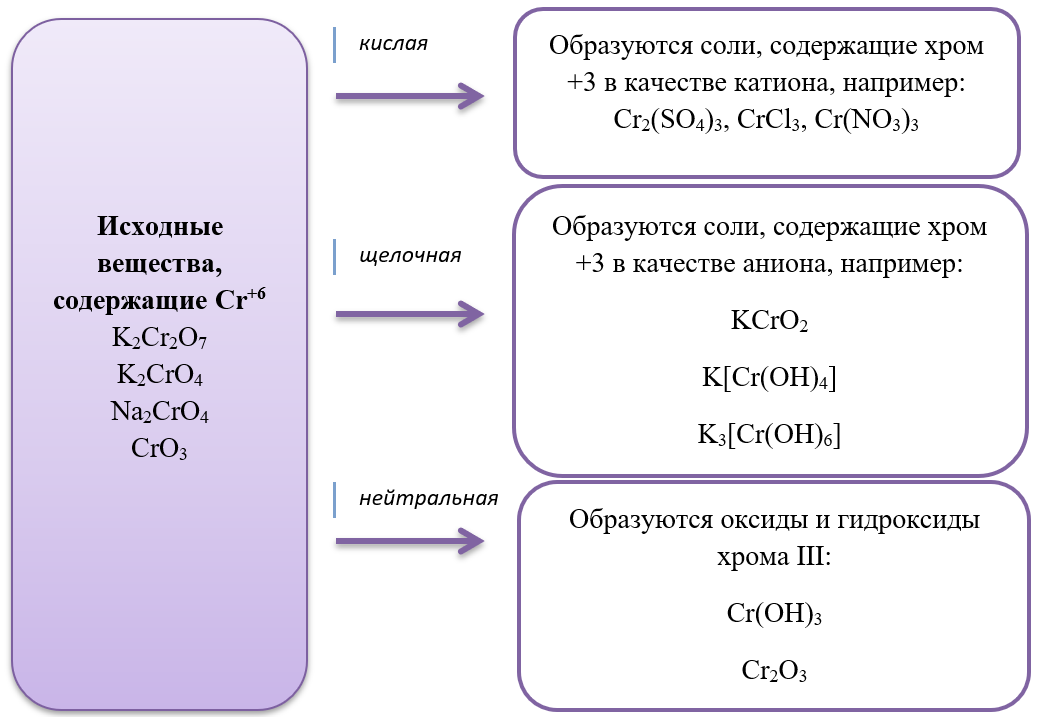
2Na3[Cr(OH)6] + 3Br2 + 4NaOH = 6NaBr + 8H2O + 2Na2CrO4 (хром в степени окисления +3 является восстановителем)
2CrCl3 + H2 = 2CrCl2 + 2HCl (хром в степени окисления +3 является восстановителем)
- Дихроматы – соли, окрашивающие растворы в оранжевый цвет и хроматы – соли желтого цвета устойчивы в разных средах: в кислой среде устойчивы оранжевые дихроматы, а в щелочной – желтые хроматы. В зависимости от среды, они могут взаимно превращаться:
Хромат превращается в дихромат в кислой среде, раствор меняет цвет с желтого на оранжевый.
2Na2CrO4 + H2SO4 = Na2Cr2O7 + Na2SO4 + H2O
Дихромат превращается в хромат в щелочной среде, раствор меняет цвет с оранжевого на желтый.
K2Cr2O7 + 2KOH = 2K2CrO4 + H2O
В ЕГЭ по химии стали уже традиционными задания с соединениями хрома, особенно с дихроматами, в основном встречается их окислительно-восстановительные свойства:
16) Железо и его соединения
- Железо реагирует с концентрированной азотной и серной кислотой только при нагревании, с разбавленными кислотами реагирует при нормальных условиях, например:
Fe + 6HNO3 конц = Fe(NO3)3 + 3NO2 + 3H2O (при нагревании)
- Взаимодействие железа с галогенами и галогенводородами:
Таблица – Железо с галогенами и галогеноводородами
|
С галогенами |
С галогенводородом |
|
2Fe + 3Cl2 = 2FeCl3 |
Fe + 2HCl = FeCl2 + H2 |
|
2Fe + 3Br2 = 2FeBr3 |
Fe + 2HBr = FeBr2 + H2 |
|
Fe + I2 = FeI2 |
Fe + 2HI = FeI2 + H2 |
- Соединения двухвалентного железа – хорошие восстановители, с окислителями превращаются в соединения трехвалентного железа:
FeO + 4HNO3 конц = Fe(NO3)3 + NO2 + 2H2O
2FeCl2 + Cl2 = 2FeCl3
4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3
- Железная окалина – двойной оксид Fe3O4 или FeO·Fe2O3, проявляет как окислительные (за счет оксида железа III), так и восстановительные (за счет железа II) свойства, а также растворяется в кислотах, образуя две соли (железа II и железа III)
Fe3O4 + 4H2SO4 разб. = FeSO4 + Fe2(SO4)3 + 4H2O (оксиды железа растворились в разбавленной серной кислоте без изменения степени окисления)
Fe3O4 + 8KI + 4H2SO4 = 3FeI2 + 4K2SO4 + I2 + 4H2O (железная окалина проявляет окислительные свойства за счет наличия железа III)
Fe3O4 + 10HNO3конц = 3Fe(NO3)3 + NO2 + 5H2O (железная окалина проявляет восстановительные свойства за счет железа II)
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- Fe + I2 →
- Fe + Cl2 →
- Fe + HCl →
- Fe + O2 →
- FeI3
- FeCl2
- FeI2
- FeCl3
- FeO
- Fe3O4
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- Fe + CuSO4 →
- Fe + H2SO4 р-р →
- Fe + H2SO4 конц. tºC →
- Fe + H2O + O2 →
- FeSO4 + Cu
- FeSO4 + H2
- Fe2(SO4)3 + Cu
- Fe2 (SO4)3 + H2
- Fe2(SO4)3 + SO2 + H2O
- Fe(OH) 3
17) Соединения марганца
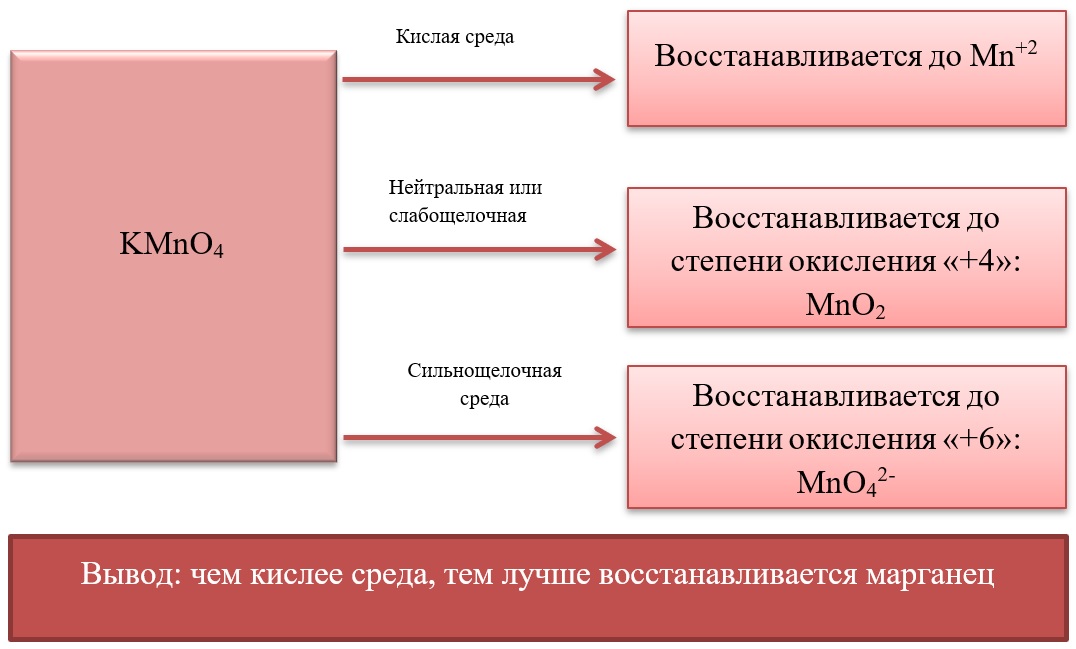
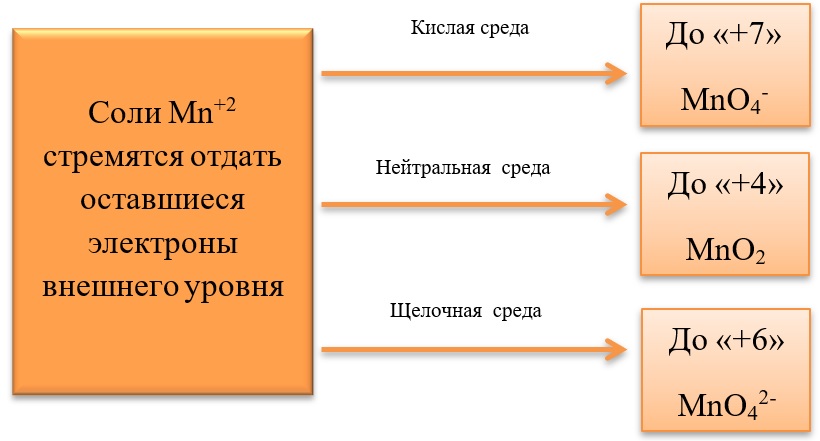
- Марганец в степени окисления +7 проявляет окислительные свойства. Продукты его восстановления зависят от среды:
Примеры реакция перманганата калия:
2KMnO4 + 5Na2SO3 + 3H2SO4 = 2MnSO4 + 5Na2SO4 + K2SO4 + 3H2O
2KMnO4 + 6KI + 4H2O = 2MnO2 + 3I2 + 8KOH
2KMnO4 + SO2 + 4KOH = K2SO4 + 2K2MnO4 + 2H2O
- Марганец в степени окисления +4 проявляет как окислительные. Так и восстановительные свойства.
Окислительные свойства чаще проявляет в кислой среде, восстанавливаясь до катиона +2.
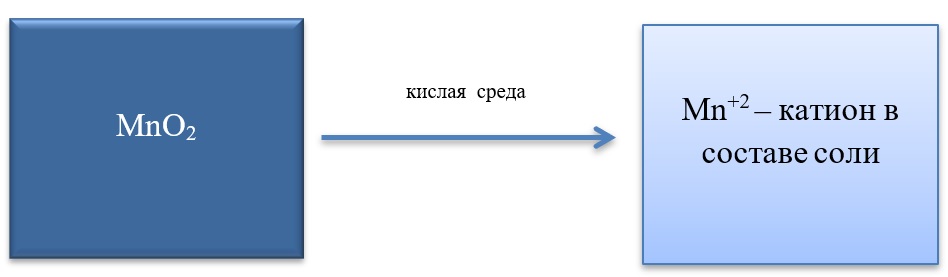
MnO2 + 4HCl = MnCl2 + Cl2 + 2H2O
MnO2 + 2KI + 2H2SO4 = MnSO4 + I2 + K2SO4 + 2H2O
MnO2 + H2O2 + H2SO4 → O2 + MnSO4 + 2H2O
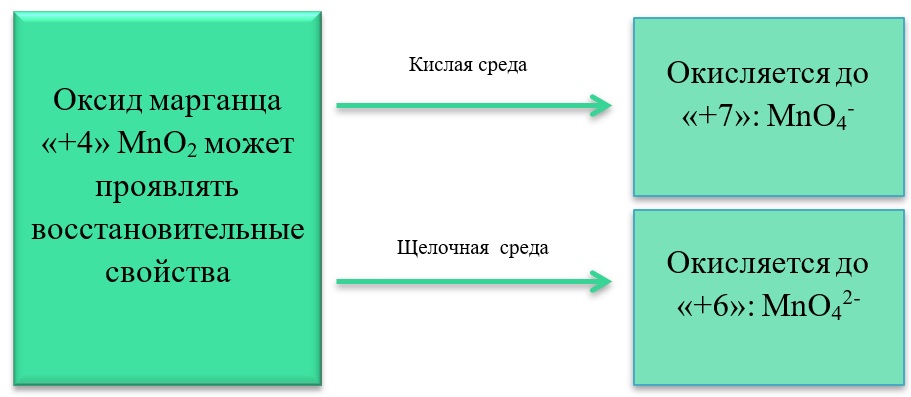
В) Марганец в степени окисления +4 проявляет и восстановительные свойства, окисляясь до +6 в щелочной среде, и до +7 в кислой:
MnO2 + Br2 + 4KOH = K2MnO4 + 2KBr + 2H2O
- Соединения марганца II, например, MnSO4 проявляет как окислительные, так и восстановительные свойства.
Окислительные свойства проявляет в реакциях с более активными металлами, например, с алюминием:
3MnSO4 + 2Al = 3Mn + Al2(SO4)3
Восстановительные свойства проявляет при взаимодействии с типичными окислителями.
2MnSO4 + 5PbO2 + 3H2SO4 = 2HMnO4 + 5PbSO4 + 2H2O
3MnSO4 + 2KMnO4 + 2H2O = 5MnO2 + K2SO4 + 2H2SO4
3MnSO4 + 2KClO3 + 12KOH = 3K2MnO4 + 2KCl + 3K2SO4 + 6H2O
18) Неметаллы с щелочами
- Галогены с щелочами:
Хлор, бром и йод реагируют с щелочами при разных условиях. На холоде окисления галогена происходит чаще до степени окисления +1 (восстановление в любых условиях происходит до степени окисления ‒1). Описать данную реакцию можно уравнением:
Г2 + 2NaOH = NaГ + NaГO + H2O (вместо гидроксида натрия можно взять любую щелочь, содержащую одновалентный металл: K, Cs, Rb)
2Г2 + 2Ca(OH)2 = CaГ2 + Ca(ГO)2 + 2H2O (вместо гидроксида кальция можно брать гидроксид бария и стронция).
Где Г = I, Cl, Br
Например:
Cl2 + 2NaOH = NaCl + NaClO + H2O
2Cl2 + 2Ca(OH)2 = CaCl2 + Ca(ClO)2 + 2H2O
При нагревании окисление галогена часто проходит до степени окисления +5:
3Г2 + 6NaOH = 5NaГ + NaГO3 + 3H2O
6Г2 + 6Ca(OH)2 = 5CaГ2 + Ca(ГO3)2 + 6H2O
Например:
3Cl2 + 6NaOH = 5NaCl + NaClO3 + 3H2O
6Cl2 + 6Ca(OH)2 = 5CaCl2 + Ca(ClO3)2 + 6H2O
Обращайте внимание на температуру, от Вашей внимательности зависят Ваши баллы на ЕГЭ по химии!
- Сера, селен и теллур тоже реагируют с щелочами по одной схеме:
3Э + 6NaOH = 2Na2Э + Na2ЭO3 + 3H2O
3Э + 3Ca(OH)2 = 2CaЭ + CaЭO3 + 3H2O
Например:
3S + 6NaOH = 2Na2S + Na2SO3 + 3H2O
3S + 3Ca(OH)2 = 2CaS + CaSO3 + 3H2O
- Фосфор с щелочами:
4P + 3NaOH + 3H2O = 3NaH2PO2 + PH3↑
- Кремний с щелочами:
Si + 2NaOH + H2O = Na2SiO3 + 2H2
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- S + NaOH →
- SO2 + NaOH →
- SO3 + NaOH →
- H2S + NaOH →
- NaHS + S + H2O
- Na2SO4 + H2O
- Na2S + Na2SO3 + H2O
- Na2SO3 + H2O
- Na2S + H2O
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- P + NaOH →
- P2O3 + NaOH →
- P2O5 + NaOH изб. →
- P2O5 + NaOH нед. →
- NaH2PO2
- NaH2PO3
- Na3P
- Na3PO4
- NaH2PO4
19) Кислотные оксиды с щелочами
Кислотные оксиды реагируют с щелочами, образуя соль и воду, к нестандартным реакциям относят взаимодействие диоксида азота с щелочами, продукты которого зависят от наличия в среде кислорода:
2NO2 + 2NaOH = NaNO2 + NaNO3 + H2O
4NO2 + 4NaOH + O2 = 4NaNO3 + 2H2O
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- NaOH + Cl2O →
- NaOH + NO2 + O2 →
- NaOH + Cl2O3 →
- NaOH + HNO3 →
- NaClO + H2O
- NaCl + HCl
- NaClO2 + H2O
- NaNO3 + H2O
- NaNO2 + NaNO3 + H2O
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- NaOH + SO2 →
- NaOH + SO3 →
- NaOH + NO2 →
- NaOH + P2O5 →
- NaNO3 + NaNO2 + H2O
- Na2SO4 + H2O
- NaNO2 + H2O
- NaH2PO4
- NaH2PO3
- Na2SO3 + H2O
20) Гидриды, фосфиды, нитриды, сульфиды, карбиды
Многие неметаллы реагируют с активными металлами, образуя соли или солеподобные вещества, легко гидролизующиеся в воде или кислотах.
Для начала рассмотрим схемы образования этих веществ. В них неметалл часто проявляет низшую степень окисления (значение низшей степени окисления легко определяется по номеру группы: для этого от номера группы нужно отнять 8, например, для азота это будет 5 ‒ 8 = ‒3)
Таблица – Степени окисления, которые принимают неметаллы при взаимодействии с активными металлами:
|
С |
Si |
N и P |
S, Se, Te |
F, Cl, Br, I |
|
‒4 (с Na, K, Al) ‒1 (с Ca, Mg) |
‒4 |
‒3 |
‒2 |
‒1 |
|
Карбиды |
Силициды |
Нитриды и фосфиды |
Сульфиды, селениды, теллуриды |
Фториды, хлориды, бромиды, йодиды |
Степени окисления активных металлов равны номеру группы, в которой они стоят в ПС.
4Na + C = Na4C
4Al + 3C = Al4C3
Ca + 2C = CaC2
4K + Si = K4Si
3Ca + N2 = Ca3N2
3K + P = K3P
2Al + 3S = Al2S3
Ba + Cl2 = BaCl2
Практически все эти вещества, за исключением некоторых сульфидов и галогенидов (хлоридов, бромидов, йодидов, фторидов) неустойчивы в растворах и подвергаются мгновенному гидролизу, который стоит рассматривать как обычную обменную реакцию с водой:
K3P + 3HOH = 3KOH + PH3↑
Na4Si + 4HOH = 4NaOH + SiH4↑
Ca3N2 + 6HOH = 3Ca(OH)2 + 2NH3↑
Продукт гидролиза карбидов зависит от степени окисления углерода в исходном веществе: если она равна ‒1, то образуется ацетилен (C2H2), а если ‒4, то метан (CH4).
Al4C3 + 12HOH = 4Al(OH)3 + 3CH4↑
CaC2 + 2HOH = Ca(OH)2 + C2H2↑
Так же происходит их кислотный гидролиз:
Al4C3 + 12HCl = 4AlCl3 + 3CH4↑
Ba3P2 + 3H2SO4 = 3BaSO4 + 2PH3↑
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- MgC2 + H2O →
- Na4C + H2O →
- Mg3P2 + H2O →
- Na3P + H2O →
- NaOH + C2H2
- Mg(OH) 2 + CH4
- Mg(OH) 2 + PH3
- NaOH + CH4
- Mg(OH) 2 + C2H2
- NaOH + PH3
21) Гидролиз бинарных соединений с ковалентной полярной связью
При гидролизе бинарных соединений неметаллов важно помнить, что степень окисления неметаллов не изменяется, из неметалла с положительной степенью окисления образуется кислотный гидроксид (кислородсодержащая кислота), из отрицательно заряженного неметалла образуется бескислородная кислота:
PCl5 + 4H2O = H3PO4 + 5HCl
SF6 + 4H2O = H2SO4 + 6HF
ICl3 + 2H2O = HIO2 + 3HCl
Для образования гидроксидов неметаллов можно воспользоваться следующей таблицей:
|
Степень окисления неметалла |
Э+1 |
Э+3 |
Э+4 |
Э+5 |
Э+6 |
Э+7 |
|
Соответствующая кислота (кислотный гидроксид) |
НЭО |
HЭO2 Или H3ЭO3 |
H2ЭO3 |
HЭO3 Или H3ЭO4 |
H2ЭO4 |
HЭO4 |
|
Примеры |
HClO |
HClO2 H3PO3 |
H2SO3 |
HIO3 H3PO4 |
H2SO4 |
HClO4 |
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- ICl + H2O →
- ICl3 + H2O →
- ICl5 + H2O →
- ICl7 + H2O →
- HClO3 + HI
- HIO + HCl
- HIO4 + HCl
- HIO2 + HCl
- HIO3 + HCl
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- PCl3 + H2O →
- SCl4 + H2O →
- SiCl4 + H2O →
- PCl5 + H2O →
- H2SO4 + HCl
- H2SiO3 + HCl
- H3PO3 + HCl
- SO2 + HCl
- HPO3 + HCl
22) Взаимный гидролиз
При взаимодействии некоторых солей могут образоваться новые соли, неустойчивые в растворах, в таких случаях в таблице растворимости на пересечении катиона и аниона мы видим прочерк (не существует или необратимо разлагается водой), например, сульфид алюминия:
Сульфид алюминия образуется в реакциях между растворимыми сульфидами и солями алюминия:
3Na2S + 2AlCl3 = 6NaCl + Al2S3
Но данная запись неверна, так как сульфида алюминия не существует в растворах, записываем уравнение гидролиза этой соли:
Al2S3 + 6HOH = 2Al(OH)3↓ + 3H2S↑
Объединим первое уравнение со вторым(левую часть первого уравнение соединяем с левой частью второго уравнения, а правую с правой, все коэффициенты сохраняем):
3Na2S + 2AlCl3 + Al2S3 + 6H2O = 6NaCl + Al2S3 + 2Al(OH)3↓ + 3H2S↑
Сокращаем сульфид алюминия, так как он есть и в правой части реакции, и в левой:
3Na2S + 2AlCl3 + 6H2O = 6NaCl + 2Al(OH)3↓ + 3H2S↑ — так выглядит реакция взаимодействия растворов сульфида натрия и хлорида алюминия.
Рассмотрим еще один пример — взаимодействие карбоната калия и нитрата железа III:
3K2CO3 + 2Fe(NO3)3 = Fe2(CO3)3 + 6KNO3
Образовавшийся карбонат железа III разлагается в воде:
Fe2(CO3)3 + 3H2O = 2Fe(OH)3↓ + 3CO2↑
Соединяем два уравнения:
3K2CO3 + 2Fe(NO3)3 + Fe2(CO3)3 + 3H2O = Fe2(CO3)3 + 6KNO3 + 2Fe(OH)3↓ + 3CO2↑
Сокращаем карбонат железа III с обеих сторон:
3K2CO3 + 2Fe(NO3)3 + 3H2O = 6KNO3 + 2Fe(OH)3↓ + 3CO2↑
Взаимный гидролиз попался мне на реальном досрочном ЕГЭ по химии 2022 во второй части!
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- CrCl3 + NaOH изб. →
- CrCl3 + NaOH нед. →
- CrCl3 + Na2S р-р →
- Cr2O3 + Na2SO3 →
- Cr(OH) 3 + NaCl + SO2
- NaCl + Cr(OH) 3
- Cr(OH) 3 + NaCl + H2S
- NaCrO2 + SO2
- Na3 [Cr(OH) 6] + NaCl
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- AlCl3 + K2CO3 р-р →
- AlCl3 + KOH изб. →
- AlCl3 + KOH нед. →
- Al2O3 + K2CO3 →
- KCl + K[Al(OH) 4]
- Al(OH) 3 + KCl + CO2
- Al2 (CO3)3 + KCl
- KAlO2 + CO2
- Al(OH) 3 + KCl



 Азот на ЕГЭ
Азот на ЕГЭ