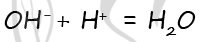Тематический тест на химические свойства азотной кислоты, нитратов и соединений фосфора.
Задание №1
Из приведенного списка простых веществ выберите два таких, которые взаимодействуют с концентрированной азотной кислотой при нагревании.
1) золото
2) серебро
3) азот
4) железо
5) аргон
Решение
Ответ: 24
Задание №2
Из приведенного списка простых веществ выберите два таких, которые не взаимодействуют с концентрированной азотной кислотой при нагревании.
1) медь
2) сера
3) хлор
4) фосфор
5) платина
Решение
Ответ: 35
Задание №3
Из приведенного списка простых веществ выберите два таких, которые взаимодействуют с концентрированной азотной кислотой только при нагревании.
- 1. Al
- 2. Fe
- 3. Ne
- 4. Cu
- 5. Zn
Решение
Ответ: 12
Задание №4
Из приведенного списка простых веществ выберите два таких, которые не взаимодействуют с концентрированной азотной кислотой без нагревания.
- 1. Cr
- 2. Cu
- 3. Al
- 4. Mn
- 5. Cl2
Решение
Ответ: 13
Задание №5
Из приведенного списка простых веществ выберите два таких, которые взаимодействуют с концентрированной азотной кислотой при нагревании.
- 1. S
- 2. P
- 3. N2
- 4. Au
- 5. Pt
Решение
Ответ: 12
Задание №6
Из приведенного списка сложных веществ выберите два таких, которые взаимодействуют с концентрированной азотной кислотой при нагревании.
- 1. H2O
- 2. H2S
- 3. NO2
- 4. ZnS
- 5. Fe(NO3)3
Решение
Ответ: 24
Задание №7
Из приведенного списка сложных веществ выберите два таких, которые не взаимодействуют с концентрированной азотной кислотой при нагревании.
- 1. Cu2O
- 2. CuO
- 3. CO2
- 4. SO3
- 5. FeO
Решение
Ответ: 34
Задание №8
Из приведенного списка сложных веществ выберите два таких, которые взаимодействуют с концентрированной азотной кислотой при нагревании.
1) нитрат меди(II)
2) нитрат железа(II)
3) нитрат железа(III)
4) нитрат аммония
5) нитрит калия
Решение
Ответ: 25
Задание №9
Из приведенного списка сложных веществ выберите два таких, которые не взаимодействуют с концентрированной азотной кислотой при нагревании.
- 1. CuS
- 2. CuSO4
- 3. Na2SO3
- 4. KHSO4
- 5. FeS2
Решение
Ответ: 24
Задание №10
Из приведенного списка сложных веществ выберите два таких, которые взаимодействуют с концентрированной азотной кислотой при нагревании.
- 1. PH3
- 2. P2O3
- 3. H3PO4
- 4. H2SO4
- 5. NO2
Решение
Ответ: 12
[adsp-pro-3]
Задание №11
Из приведенного списка веществ выберите два таких, которые могут образоваться при взаимодействии азотной кислоты с различными восстановителями.
- 1. NO
- 2. O2
- 3. H2
- 4. NO2
- 5. NH3
Решение
Ответ: 14
Задание №12
Из приведенного списка веществ выберите два таких, которые не могут образоваться при взаимодействии азотной кислоты с различными восстановителями.
- 1. H2
- 2. NH4NO3
- 3. NO2
- 4. NO
- 5. O2
Решение
Ответ: 15
Задание №13
Из приведенного списка веществ выберите два таких, которые могут взаимодействовать с расплавом нитрата калия.
1) сера
2) азот
3) кислород
4) углерод
5) фторид натрия
Решение
Ответ: 14
Задание №14
Из приведенного списка веществ выберите два таких, которые не могут взаимодействовать с расплавом нитрата калия.
1) кислород
2) оксид хрома(III)
3) оксид азота(IV)
4) оксид марганца(IV)
5) сера
Решение
Ответ: 13
Задание №15
Из приведенного списка веществ выберите два таких, которые могут взаимодействовать с расплавом нитрата калия.
1) аргон
2) оксид хрома(III)
3) азот
4) хлор
5) фосфор
Решение
Ответ: 25
Задание №16
Из приведенного списка веществ выберите те, которые образуются при разложении нитрата калия. Число верных ответов может быть любым.
1) кислород
2) оксид металла
3) металл
4) оксид азота(IV)
5) оксид азота(I)
6) вода
7) соль
Решение
Ответ: 17
Задание №17
Нитрат алюминия прокалили.
Впишите в поле ответа уравнение проведенной реакции, используя в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: 4Al(NO3)3 = 2Al2O3 + 12NO2 + 3O2
Задание №18
Нитрат аммония прокалили.
Впишите в поле ответа уравнение проведенной реакции, используя в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: NH4NO3 = N2O + 2H2O
Задание №19
Нитрат серебра прокалили.
Впишите в поле ответа уравнение проведенной реакции, используя в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: 2AgNO3 = 2Ag + 2NO2 + O2
Задание №20
Из приведенного списка веществ выберите те, которые образуются при разложении нитрата железа(III). Число верных ответов может оказаться любым.
1) кислород
2) оксид металла
3) металл
4) соль
5) оксид азота(I)
6) вода
7) оксид азота(IV)
Решение
Ответ: 127
[adsp-pro-3]
Задание №21
Из приведенного перечня выберите пару реагентов, между которыми возможна реакция.
1) разбавленная азотная кислота + медь
2) концентрированная азотная кислота + платина
3) разбавленная азотная кислота + хлор
4) концентрированная азотная кислота + бром
5) разбавленная азотная кислота + азот
Впишите в поле ответа уравнение данной реакции, используя в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: 8HNO3 + 3Cu = 3Cu(NO3)2 + 2NO + 4H2O
Задание №22
Из приведенного перечня выберите пару реагентов, между которыми возможна реакция.
1) нитрат калия + сульфат калия (раствор)
2) нитрат калия + хлорид меди(II) (раствор)
3) нитрат натрия + сера (расплав)
4) нитрат натрия + углерод (раствор)
5) нитрат рубидия + кислород (расплав)
Решение
Ответ: 2NaNO3 + S = 2NaNO2 + SO2
Задание №23
Из приведенного списка пар реагентов выберите ту, в которой возможно химическое взаимодействие. В ответ запишите уравнение реакции с коэффициентами. Если взаимодействие невозможно ни где, то запишите в ответ (-).
- 1. CuCl2 + HNO3(разб.)
- 2. CuSO4 + HNO3(разб.)
- 3. CuS + HNO3(конц.)
- 4. Cu(NO3)2 + HNO3(разб.)
- 5. CuBr2 + HNO3(разб.)
Решение
Ответ: CuS + 8HNO3(конц) = CuSO4 + 8NO2 + 4H2O
Задание №24
Из приведенного перечня выберите пару реагентов, между которыми возможна химическая реакция.
1) нитрат меди + сульфат калия (раствор)
2) нитрат аммония + хлорид калия (раствор)
3) нитрат натрия + оксид хрома(III) + едкий натр (расплав)
4) нитрат натрия + железная окалина (раствор)
5) нитрат рубидия + гашеная известь (расплав)
Впишите в поле ответа уравнение проведенной реакции, используя в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: 3NaNO3 + Cr2O3 + 4NaOH = 2Na2CrO4 + 3NaNO2 + 2H2O
Задание №25
Железо растворили в горячей концентрированной азотной кислоте.
Впишите в поле ответа уравнение проведенной реакции, используя в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: Fe + 6HNO3 = Fe(NO3)3 + 3NO2 + 3H2O
Задание №26
Медь растворили в разбавленной азотной кислоте.
Впишите в поле ответа уравнение проведенной реакции, используя в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: 3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4H2O
Задание №27
Медь растворили в концентрированной азотной кислоте.
Впишите в поле ответа уравнение проведенной реакции, используя в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: Cu + 4HNO3 = Cu(NO3)2 + 2NO2 + 2H2O
Задание №28
Запишите уравнение реакции термического разложения нитрата магния.
Используйте в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: 2Mg(NO3)2 = 2MgO + 4NO2 + O2
Задание №29
Серу растворили в концентрированной азотной кислоте.
Впишите в поле ответа уравнение проведенной реакции, используя в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: S + 6HNO3 = H2SO4 + 6NO2 + 2H2O
Задание №30
К раствору, содержащему нитрат натрия и гидроксид натрия добавили металлический алюминий. Наблюдали образование газа с резким запахом.
Впишите в поле ответа уравнение проведенной реакции, используя в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: 3NaNO3 + 8Al + 5NaOH + 18H2O = 8Na[Al(OH)4] + 3NH3
[adsp-pro-3]
Задание №31
Фосфор растворили в концентрированной азотной кислоте.
Впишите в поле ответа уравнение проведенной реакции, используя в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: P + 5HNO3 = H3PO4 + 5NO2 + H2O
Задание №32
Смесь порошков оксида хрома (III), гидроксида калия и нитрата калия подвергли совместному прокаливанию.
Впишите в поле ответа уравнение проведенной реакции, используя в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: 3KNO3 + Cr2O3 + 4KOH = 2K2CrO4 + 3KNO2 + 2H2O
Задание №33
В расплавленный нитрат калия поместили уголь.
Впишите в поле ответа уравнение проведенной реакции, используя в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: 2KNO3 + C = 2KNO2 + CO2
Задание №34
Магний растворили в очень разбавленной азотной кислоте. При протекании этой реакции газ не выделялся.
Впишите в поле ответа уравнение проведенной реакции, используя в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: 4Mg + 10HNO3 = 4Mg(NO3)2 + NH4NO3 + 3H2O
Задание №35
Вычислите массу твердого остатка, полученного при разложении 188 г нитрата меди, если в процессе выделилось 5,6 л кислорода. Ответ укажите в граммах и округлите до целых.
В поле ответа введите только число (без единиц измерения).
Решение
Ответ: 134
Задание №36
Рассчитайте объем газов, образовавшихся при разложении 85 г нитрата серебра. Ответ укажите в литрах и округлите до десятых.
В поле ответа введите только число (без единиц измерения).
Решение
Ответ: 16,8
Задание №37
При внесении 20 г смеси песка и медных опилок в 75%-ный раствор азотной кислоты выделилось 8,96 л бурого газа. Определите массовую долю песка в исходной смеси. Ответ укажите в процентах и округлите до целых.
В поле ответа введите только число (без единиц измерения).
Решение
Ответ: 36
Задание №38
Навеску смеси нитратов серебра и меди прокалили до постоянной массы. Полученный твердый остаток может прореагировать с 365 г 10%-ного раствора соляной кислоты. Определите массу исходной смеси, если массовая доля нитрата серебра в ней составляла 20%. Ответ укажите в граммах и округлите с точностью до десятых.
В поле ответа введите только число (без единиц измерения).
Решение
Ответ: 117,5
Задание №39
Электролиз 100 г раствора нитрата серебра проводили до тех пор, пока не прекратилось образование металла на катоде. Рассчитайте массовую долю соли в исходном растворе, если на аноде выделилось 224 мл газа. Ответ укажите в процентах и округлите с точностью до десятых.
В поле ответа введите только число (без единиц измерения).
Решение
Ответ: 6,8
Задание №40
Из приведенного списка соединений выберите те, в которых фосфор проявляет степень окисления -3. Число верных ответов может быть любым.
- 1. PCl3
- 2. H3PO3
- 3. PH3
- 4. POCl3
- 5. K3P
Решение
Ответ: 35
[adsp-pro-3]
Задание №41
Из приведенного списка соединений выберите те, в которых фосфор проявляет степень окисления +1. Число верных ответов может быть любым.
- 1. P4
- 2. Mg3P2
- 3. H3PO2
- 4. KH2PO4
- 5. KH2PO2
Решение
Ответ: 35
Задание №42
Из приведенного списка соединений выберите те, в которых фосфор проявляет степень окисления +3. Число верных ответов может быть любым.
- 1. H3PO3
- 2. PCl5
- 3. P2O5
- 4. PH3
- 5. AlP
Решение
Ответ: 1
Задание №43
Из приведенного списка соединений выберите те, в которых фосфор проявляет степень окисления +5. Число верных ответов может быть любым.
- 1. HPO3
- 2. H3PO3
- 3. H4P2O7
- 4. Ca3(PO4)2
- 5. POCl3
Решение
Ответ: 1345
Задание №44
Из приведенного списка соединений выберите те, в которых фосфор проявляет высшую и низшую степень окисления соответственно.
- 1. PH3
- 2. P2O3
- 3. HPO3
- 4. K2HPO3
- 5. PBr3
Решение
Ответ: 31
Задание №45
Из приведенного списка простых веществ выберите два таких, c которыми взаимодействует фосфор.
1) золото
2) калий
3) азот
4) хлор
5) водород
Решение
Ответ: 24
Задание №46
Из приведенного списка простых веществ выберите два таких, c которыми не взаимодействует фосфор.
1) бром
2) медь
3) фтор
4) сера
5) графит
Решение
Ответ: 25
Задание №47
Из приведенного списка простых веществ выберите два таких, c которыми взаимодействует фосфор.
1) литий
2) кислород
3) азот
4) серебро
5) водород
Решение
Ответ: 12
Задание №48
Из приведенного списка простых веществ выберите два таких, c которыми не взаимодействует фосфор.
1) кальций
2) барий
3) железо
4) хлор
5) аргон
Решение
Ответ: 35
Задание №49
Из приведенного списка простых веществ выберите два таких, c которыми взаимодействует фосфор.
1) кислород
2) иод
3) азот
4) свинец
5) водород
Решение
Ответ: 12
Задание №50
Из приведенного списка сложных веществ выберите два таких, c которыми взаимодействует фосфор.
1) гидроксид калия
2) гидроксид алюминия
3) гидроксид меди
4) гидроксид бария
5) гидроксид бериллия
Решение
Ответ: 14
[adsp-pro-3]
Задание №51
Из приведенного списка сложных веществ выберите два таких, c которыми не взаимодействует фосфор.
- 1. HCl
- 2. HBr
- 3. HNO3
- 4. H2SO4
- 5. NaOH
Решение
Ответ: 12
Задание №52
Из приведенного списка сложных веществ выберите два таких, c которыми взаимодействует фосфор.
- 1. HF
- 2. NaF
- 3. HNO3
- 4. KCl
- 5. H2SO4
Решение
Ответ: 35
Задание №53
Из приведенного списка сложных веществ выберите два таких, c которыми не взаимодействует фосфор.
- 1. Zn(OH)2
- 2. Ba(OH)2
- 3. Be(OH)2
- 4. Sr(OH)2
- 5. Ca(OH)2
Решение
Ответ: 13
Задание №54
Из приведенного списка сложных веществ выберите два таких, c которыми взаимодействует фосфор.
1) вода
2) соляная кислота
3) едкий натр
4) серная кислота
5) кремниевая кислота
Решение
Ответ: 34
Задание №55
Из приведенного перечня выберите пару реагентов, между которыми возможна реакция.
1) фосфор + кальций
2) фосфор + аргон
3) фосфор + азот
4) фосфор + серебро
5) фосфор + водород
В поле ответа введите уравнение этой реакции, используя в качестве разделителя левой и правой части знак равенства.
Решение
Ответ: 2P + 3Ca = Ca3P2
Задание №56
Из приведенного перечня выберите пару реагентов, между которыми возможна реакция.
1) фосфин + гашеная известь
2) фосфин + пирит
3) фосфин + поташ
4) фосфин + сероводород
5) фосфин + кислород
В поле ответа введите уравнение этой реакции, используя в качестве разделителя левой и правой части знак равенства.
Решение
Ответ: 2PH3 + 4O2 = P2O5 + 3H2O
Задание №57
Из приведенного перечня выберите пару реагентов, между которыми возможна реакция.
1) оксид фосфора(V) + хлор
2) оксид фосфора(V) + кислород
3) оксид фосфора(III) + кислород
4) оксид фосфора(III) + водород
5) оксид фосфора(V) + хлороводород
В поле ответа введите уравнение реакции, используя в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: P2O3 + O2 = P2O5
Задание №58
Установите соответствие между названием вещества и набором реагентов, с каждым из которых оно может взаимодействовать.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
|
А) фосфор Б) азотная кислота В) фосфат натрия |
1) сера, гидроксид калия, нитрат железа(II) 2) водород, нитрат свинца, сульфат цинка 3) натрий, кислород, сера 4) фосфорная кислота, нитрат серебра, серная кислота |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 314
Задание №59
Установите соответствие между названием вещества и набором реагентов, с каждым из которых оно может взаимодействовать.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
|
А) фосфин Б) нитрат бария В) бромид фосфора(V) |
1) HNO3(конц.), O2, H2O2 2) Zn, H2, N2 3) Cl2, H2O, KOH 4) K2SO4, K3PO4, AgF |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 143
Задание №60
Установите соответствие между названием вещества и набором реагентов, с каждым из которых оно может взаимодействовать.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
|
А) оксид фосфора (III) Б) гидрокарбонат аммония В) фосфат натрия |
1) HI, O2, H2O2 2) NaH2PO4, HNO3, AgNO3 3) KOH, Ca(OH)2, HCl 4) H2SO4(конц.), HNO3(конц.), O2 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 432
[adsp-pro-3]
Задание №61
Установите соответствие между названием вещества и набором реагентов, с каждым из которых оно может взаимодействовать.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
|
А) P2O3 Б) H3PO4 В) Cu(NO3)2 |
1) HNO3, O2, H2O 2) H2S, Fe, KI 3) Ca3(PO4)2, KOH, Ba(OH)2 4) KHSO4, K3PO4, KF |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 132
Задание №62
Установите соответствие между названием вещества и набором реагентов, с каждым из которых оно может взаимодействовать.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
|
А) нитрат свинца Б) фосфор В) фосфат натрия |
1) HNO3, O2, Cl2 2) H2S, Fe, KI 3) CaO, RbOH, Ba(OH)2 4) H2SO4, H3PO4, LiNO3 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 214
Задание №63
Вычислите объем фосфина, который необходим для получения 49 г фосфорной кислоты при действии концентрированной азотной кислоты. Ответ укажите в литрах и округлите до десятых.
В поле ответа введите только число (без единиц измерения).
Решение
Ответ: 11,2
Задание №64
Определите массу осадка, который выпадет при добавлении 8,2 г фосфата натрия в избыток раствора хлорида кальция. Ответ укажите в граммах и округлите до сотых.
В поле ответа введите только число (без единиц измерения).
Решение
Ответ: 7,75
Задание №65
Навеску фосфора массой 31 г сожгли в некотором количестве кислорода. В результате была получена смесь из двух сложных веществ, которую затем растворили в воде. Определите массовую долю оксида фосфора(V) в продуктах сгорания фосфора, если полученный раствор может полностью обесцветить 63,2 г 5% раствора перманганата калия, подкисленного серной кислотой. Ответ укажите в процентах и округлите до десятых.
В поле ответа введите только число (без единиц измерения).
Решение
Ответ: 96,1
Задание №66
Смесь порошков карбоната калия и карбоната серебра массой 20 г растворили в необходимом количестве азотной кислоты. При добавлении к полученному раствору избытка фосфата натрия выпало 4,19 г осадка. Определите массовую долю карбоната калия в изначальной смеси. Ответ укажите в процентах и округлите до десятых.
В поле ответа введите только число (без единиц измерения).
Решение
Ответ: 79,3
Задание №67
Вычислите массу фосфора, которую можно получить при взаимодействии 31 г фосфата кальция с избытком угля и песка. Ответ укажите в граммах и округлите до десятых.
В поле ответа введите только число (без единиц измерения).
Решение
Ответ: 6,2
Задание №68
Образец фосфида натрия массой 10 г полностью гидролизовали. Рассчитайте объем кислорода, необходимый для полного окисления газообразного продукта реакции. Ответ укажите в литрах и округлите до сотых.
В поле ответа введите только число (без единиц измерения).
Решение
Ответ: 4,48
Задание №69
Навеску фосфора полностью окислили избытком азотной кислоты. Вычислите массу навески, если для поглощения газообразных продуктов реакции потребовалось 20 мл 10% раствора гидроксида натрия (плотность 1,1 г/мл). Ответ приведите в миллиграммах и округлите до целых.
В поле ответа введите только число (без единиц измерения).
Решение
Ответ: 341
Задание №70
Рассчитайте объем сернистого газа, который можно получить при окислении концентрированной серной кислотой 11,2 л фосфина. Ответ укажите в литрах и округлите с точностью до десятых.
В поле ответа введите только число (без единиц измерения).
Решение
Ответ: 44,8
[adsp-pro-3]
Задание №71
Вычислите массу 20% раствора гидроксида калия, необходимую для полной нейтрализации продуктов гидролиза 41,7 г хлорида фосфора(V). Ответ укажите в граммах и округлите до целых.
В поле ответа введите только число (без единиц измерения).
Решение
Ответ: 448
Задание №72
Смесь песка и порошка магния массой 10 г нагрели с избытком фосфора. Полученную смесь обработали водой, при этом выделилось 1,12 л газа. Вычислите массовую долю песка в исходной смеси. Ответ укажите в процентах и округлите до целых.
В поле ответа введите только число (без единиц измерения).
Решение
Ответ: 82
Задание №73
Запишите уравнение взаимодействия гидрофосфата натрия с гидроксидом натрия.
Используйте в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: Na2HPO4 + NaOH = Na3PO4 + H2O
Задание №74
Фосфид кальция обработали избытком раствора соляной кислоты.
В поле ответа введите уравнение проведенной реакции, используя в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: Ca3P2 + 6HCl = 3CaCl2 + 2PH3
Задание №75
Запишите уравнение взаимодействия фосфата натрия с дигидрофосфатом натрия.
Используйте в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: Na3PO4 + NaH2PO4 = 2Na2HPO4
Задание №76
Запишите уравнение взаимодействия фосфата натрия с дигидрофосфатом натрия.
Используйте в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: Na3PO4 + NaH2PO4 = 2Na2HPO4
Задание №77
Запишите уравнение взаимодействия фосфорной кислоты с гидрофосфатом натрия.
Используйте в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: Na2HPO4 + H3PO4 = 2NaH2PO4
Задание №78
Запишите уравнение взаимодействия большого избытка фосфорной кислоты с гидроксидом натрия.
Используйте в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: NaOH + H3PO4 = NaH2PO4 + H2O
Задание №79
Запишите уравнение взаимодействия фосфорной кислоты с избытком гидроксида натрия.
Используйте в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: 3NaOH + H3PO4 = Na3PO4 + 3H2O
Задание №80
Запишите уравнение взаимодействия фосфида магния с водой.
Используйте в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: Mg3P2 + 6H2O = 3Mg(OH)2 + 2PH3
[adsp-pro-3]
Задание №81
Запишите уравнение взаимодействия фосфора с кальцием.
Используйте в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: 3Ca + 2P = Ca3P2
Задание №82
Запишите уравнение взаимодействия хлорида фосфора(V) с избытком водного раствора гидроксида калия.
Используйте в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: PCl5 + 8KOH = K3PO4 + 5KCl + 4H2O
Задание №83
Запишите уравнение взаимодействия хлорида фосфора(V) с водой.
Используйте в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: PCl5 + 4H2O = H3PO4 + 5HCl
Задание №84
Запишите уравнение взаимодействия фосфора с недостатком брома.
Используйте в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: 2P + 3Br2 = 2PBr3
Задание №85
Запишите уравнение взаимодействия фосфора с концентрированной серной кислотой.
Используйте в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: 2P + 5H2SO4 = 2H3PO4 + 5SO2 + 2H2O
Задание №86
Запишите уравнение взаимодействия фосфора с концентрированной азотной кислотой.
Используйте в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: P + 5HNO3 = H3PO4 + 5NO2 + H2O
Задание №87
Запишите уравнение взаимодействия фосфора с концентрированным раствором гидроксида калия.
Используйте в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: 4P + 3KOH + 3H2O = 3KH2PO2 + PH3
Задание №88
Запишите уравнение взаимодействия фосфина с избытком хлора в водной среде.
Используйте в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: PH3 + 4Cl2 + 4H2O = H3PO4 + 8HCl
Задание №89
Запишите уравнение взаимодействия фосфина с концентрированной серной кислотой.
Используйте в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: PH3 + 4H2SO4 = H3PO4 + 4SO2 + 4H2O
Задание №90
Запишите уравнение взаимодействия фосфина с концентрированной азотной кислотой.
Используйте в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: PH3 + 8HNO3 = H3PO4 + 8NO2 + 4H2O
[adsp-pro-3]
Задание №91
Запишите уравнение взаимодействия фосфина с перекисью водорода.
Используйте в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: PH3 + 4H2O2 = H3PO4 + 4H2O
Задание №92
Фосфин пропустили через водный раствор, содержащий перманганат калия и серную кислоту.
Впишите в поле ответа уравнение осуществленной реакции, используя в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: 5PH3 + 8KMnO4 + 12H2SO4 = 5H3PO4 + 4K2SO4 + 8MnSO4 + 12H2O
Задание №93
Фосфат кальция совместно прокалили с песком и коксом.
Впишите в поле ответа уравнение осуществленной реакции, используя в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: Ca3(PO4)2 + 5C + 3SiO2 = 3CaSiO3 + 2P + 5CO
[adsp-pro-10]
Тренажер задания 31 из ЕГЭ по химии азота, задачи на неорганическую химию (мысленный эксперимент) из экзамена ЕГЭ по химии, задания 31 по химии азота с текстовыми решениями и ответами.
- Две соли содержат одинаковый катион. Термический распад первой из них напоминает извержение вулкана, при этом выделяется малоактивный бесцветный газ, входящий в состав атмосферы. При взаимодействии второй соли с раствором нитрата серебра образуется белый творожистый осадок, а при нагревании её с раствором щелочи выделяется бесцветный ядовитый газ с резким запахом; этот газ может быть получен также при взаимодействии нитрида магния с водой. Напишите уравнения описанных реакций.
(NH4)2Cr2O7 N2↑ + Cr2O3 + 4H2O
NH4Cl + AgNO3 = AgCl↓ + NH4NO3
NH4Cl + NaOH = NaCl + NH3↑ + H2O
Mg3N2 + 6H2O = 3Mg(OH)2 ↓ + 2NH3↑
- Над поверхностью налитого в колбу раствора едкого натра пропускали электрические разряды, при этом воздух в колбе окрасился в бурый цвет, который исчезал через некоторое время. Полученный раствор осторожно выпарили и установили, что твёрдый остаток представляет собой смесь двух солей. При нагревании этой смеси выделяется газ и остается единственное вещество. Напишите уравнения описанных реакций.
2NO + O2 = 2NO2
NO2 + 2NaOH = NaNO3 + NaNO2 + H2O
2NaNO3 → 2NaNO2 + O2
- В результате термического разложения дихромата аммония получили газ, который пропустили над нагретым магнием. Образовавшееся вещество поместили в воду. образовавшийся при этом газ пропустили через свежеосажденный гидроксид меди (II). Напишите уравнения описанных реакций.
(NH4)2Cr2O7 → N2↑ + Cr2O3 + 4H2O
3Mg + N2 = Mg3N2
Mg3N2 + 6H2O = 3Mg(OH)2 ↓ + 2NH3↑
4NH3 + Cu(OH)2 = [Cu(NH3)4](OH)2
- Газ, выделившийся на аноде при электролизе нитрата ртути (II), был использован для каталитического окисления аммиака. Получившийся в результате реакции бесцветный газ мгновенно вступил в реакцию с кислородом воздуха. Образовавшийся бурый газ пропустили через баритовую воду. Напишите уравнения описанных реакций.
2NO + O2 = 2NO2
4NO2 + 2Ba(OH)2 = Ba(NO3)2 + Ba(NO2)2 + 2H2O
- Йод поместили в пробирку с концентрированной горячей азотной кислотой. выделившийся газ пропустили через воду в присутствии кислорода. В полученный раствор добавили гидроксид меди (II). Образовавшийся раствор выпарили и сухой твердый остаток прокалили. Напишите уравнения описанных реакций.
I2 + 10HNO3 = 2HIO3 + 10NO2 + 4H2O
4NO2 + O2 + 2H2O = 4HNO3
2HNO3 + Cu(OH)2 = Cu(NO3)2 + 2H2O
2Cu(NO3)2 → 2CuO + O2 + 4NO2
- Продукт взаимодействия лития с азотом обработали водой. Полученный газ пропустили через раствор серной кислоты до прекращения химических реакций. Полученный раствор обработали хлоридом бария. Раствор профильтровали, а фильтрат смешали с раствором нитрита натрия и нагрели. Напишите уравнения описанных реакций.
6Li + N2 = 2Li3N
Li3N + 3H2O = 3LiOH + NH3
2NH3 + H2SO4 = (NH4)2SO4
(NH4)2SO4 + BaCl2 = BaSO4 + 2NH4Cl
NH4Cl + NaNO2 → N2 + NaCl + 2H2O
- Навеску алюминия растворили в разбавленной азотной кислоте, при этом выделилось простое вещество. К полученному раствору добавили карбонат натрия до полного прекращения выделения газа. Выпавший осадок отфильтровали и прокалили, фильтрат упарили, полученный твердый остаток сплавили с хлоридом аммония. Выделившийся газ смешали с аммиаком и нагрели полученную смесь. Напишите уравнения описанных реакций.
10Al + 36HNO3 = 10Al(NO3)3 + 3N2↑ + 18H2O
2Al(NO3)3 + 3Na2CO3 + 3H2O = 2Al(OH)3↓ + 3CO2↑ + 6NaNO3
2Al(OH)3 → Al2O3 + 3H2O
NaNO3 + NH4Cl → N2O + NaCl + 2H2O
3N2O + 2NH3 = 4N2 + 3H2O
- Две соли содержат одинаковый катион. Термический распад первой из них напоминает извержение вулкана, при этом выделяется малоактивный бесцветный газ, входящий в состав атмосферы. При взаимодействии второй соли с раствором нитрата серебра образуется белый творожистый осадок, а при нагревании ее с раствором щелочи выделяется бесцветный ядовитый газ с резким запахом; этот газ может быть получен также при взаимодействии нитрида магния с водой. Напишите уравнения описанных реакций.
(NH4)2Cr2O7 → N2 + Cr2O3 + 4H2O
NH4Cl + AgNO3 = AgCl↓ + NH4NO3
NH4Cl + NaOH = NaCl + NH3↑ + H2O
Mg3N2 + 6H2O = 2NH3↑ + 3Mg(OH)2↓
- Над поверхностью налитого в колбу раствора едкого натра пропускали электрические разряды, при этом воздух в колбе окрашивался в бурый цвет, который исчезал через некоторое время. Полученный раствор осторожно выпарили и установили, что твердый остаток представляет собой смесь двух солей. При нагревании этой смеси выделяется газ и остается единственное вещество. Напишите уравнения описанных реакций.
2NO + O2 = 2NO2
2NO2 + 2NaOH = NaNO3 + NaNO2 + H2O
2NaNO3 → 2NaNO2 + O2↑
- Смесь двух бесцветных, не имеющих цвета и запаха, газов А и Б пропустили при нагревании над катализатором, содержащим железо, и образующимся при этом газом В нейтрализовали раствором бромоводородной кислоты. Раствор выпарили и остаток нагрели с едким кали, в результате выделился бесцветный газ В с резким запахом. При сжигании газа В на воздухе образуется вода и газ А. Напишите уравнения описанных реакций.
газы – N2, H2, NH3
N2 + 3H2 = 2NH3
NH3 + HBr = NH4Br
NH4Br + KOH = KBr + H2O + NH3↑
4NH3 + 3O2 = 2N2 + 6H2O
- Азотную кислоту нейтрализовали пищевой содой, нейтральный раствор осторожно выпарили и остаток прокалили. Образовавшееся вещество внесли в подкисленный серной кислотой раствор перманганатом калия, при этом раствор обесцветился. Азотсодержащий продукт реакции поместили в раствор едкого натра и добавили цинковую пыль, при этом выделился газ с резким характерным запахом. Напишите уравнения описанных реакций.
HNO3 + NaHCO3 = NaNO3 + H2O + CO2↑
2NaNO3 → 2NaNO2 + O2↑
5NaNO2 + 2KMnO4 + 3H2SO4 = 5NaNO3 + K2SO4 + 2MnSO4 + 3H2O
NaNO3 + 4Zn + 7NaOH + 6H2O = NH3↑ + 4Na2[Zn(OH)4]
- Азотоводородную смесь нагрели до температуры 500º С и под высоким давлением пропустили над железным катализатором. Продукты реакции пропустили через раствор азотной кислоты до его нейтрализации. Образовавшийся раствор осторожно выпарили, твердый остаток прокалили и выделившийся при этом газ пропустили над медью при нагревании, в результате образовалось вещество черного цвета. Напишите уравнения описанных реакций.
N2 + 3H2 ↔ 2NH3
NH3 + HNO3 = NH4NO3
NH4NO3 → N2O↑ + 2H2O
N2O + Cu = CuO + N2↑
- Продукт взаимодействия азота и лития обработали водой. Выделившийся в результате реакции газ смешали с избытком кислорода и при нагревании пропустили над платиновым катализатором; образовавшееся газовая смесь имела бурый цвет. Напишите уравнения описанных реакций.
N2 + 6Li = 2Li3N
Li3N + 3H2O = 3LiOH + NH3↑
2NO + O2 = 2NO2
- Газовую смесь аммиака и большого избытка воздуха пропустили при нагревании над платиной и продукты реакции через некоторое время поглотили раствором едкого натра. После выпаривания раствора был получен единственный продукт. Напишите уравнения описанных реакций.
2NO + O2 = 2NO2
2NO2 + 2NaOH = NaNO3 + NaNO2 + H2O
2NaNO2 + O2 = 2NaNO3
- Через избыток раствора едкого кали пропустили бурый газ в присутствии большого избытка воздуха. В образовавшийся раствор добавили магниевую стружку и нагрели; выделившимся газом нейтрализовали азотную кислоту. Полученный раствор осторожно выпарили, твердый продукт реакции прокалили. Напишите уравнения описанных реакций.
2NO2 + O2 + 2KOH = 2KNO3 + H2O
KNO3 + 4Mg + 6H2O = NH3↑ + 4Mg(OH)2↓ + KOH
NH3 + HNO3 = NH4NO3
NH4NO3 → N2O + 2H2O
- Оксид меди (I) обработали концентрированной азотной кислотой, раствор осторожно выпарили и твердый остаток прокалили. Газообразные продукты реакции пропустили через большое количество воды и в образовавшийся раствор добавили магниевую стружку, в результате выделился газ, используемый в медицине. Напишите уравнения описанных реакций.
Cu2O + 6HNO3 = 2Cu(NO3)2 + 2NO2↑ + 3H2O
2Cu(NO3)2 → 2CuO + 4NO2↑ + O2↑
4NO2 + O2 + 2H2O = 4HNO3
4Mg + 10HNO3(разб.) = 4Mg(NO3)2 + N2O↑ + 5H2O или
4Mg + 10HNO3(оч. разб.) = 4Mg(NO3)2 + NH4NO3 + 3H2O
- Нитрид магния обработали избытком воды. При пропускании выделившегося газа через бромную воду или через нейтральный раствор перманганата калия, так и при его сжигании образуется один и тот же газообразный продукт. Напишите уравнения описанных реакций.
Mg3N2 + 6H2O = 3Mg(OH)2↓ + 2NH3↑
2NH3 + 3Br2 = N2↑ + 6HBr или
8NH3 + 3Br2 = N2↑ + 6NH4Br
2KMnO4 + 2NH3 = 2MnO2 + N2↑ + 3KOH + 3H2O
4NH3 + 3O2 = 2N2↑ + 6H2O
- Один из продуктов взаимодействия аммиака с бромом – газ, входящий в состав атмосферы, смешали с водородом и нагрели в присутствии платины. Образовавшуюся смесь газов пропустили через раствор соляной кислоты и к полученному раствору добавили при небольшом нагревании нитрит калия. Напишите уравнения описанных реакций.
2NH3 + 3Br2 = N2↑ + 6HBr или
8NH3 + 3Br2 = N2↑ + 6NH4Br
N2 + 3H2 ↔ 2NH3
NH3 + HCl = NH4Cl
NH4Cl + KNO2 = KCl + N2 + 2H2O
- Магний нагрели в сосуде, наполненном газообразным аммиаком. Образовавшееся вещество растворили в концентрированном растворе бромоводородной кислоты, раствор выпарили и остаток нагревали до появления запаха, после чего добавили раствор щелочи. Напишите уравнения описанных реакций.
2NH3 + 3Mg = Mg3N2 + 3H2
Mg3N2 + 8HBr = 3MgBr2 + 2NH4Br
NH4Br → NH3 + HBr
MgBr2 + 2NaOH = Mg(OH)2↓ + 2NaBr
- Смесь азота и водорода последовательно пропустили над нагретой платиной и через раствор серной кислоты. В раствор добавили хлорид бария и после отделения выпавшего осадка – известковое молоко и нагрели. Напишите уравнения описанных реакций.
N2 + 3H2 = 2NH3
2NH3 + H2SO4 = (NH4)2SO4
(NH4)2SO4 + BaCl2 = 2NH4Cl + BaSO4↓
2NH4Cl + Ca(OH)2 = CaCl2 + 2NH3↑ + 2H2O
- Аммиак смешали с большим избытком воздуха, нагрели в присутствии платины и через некоторое время поглотили водой. Медная стружка, добавленная в полученный раствор растворяется с выделением бурого газа. Напишите уравнения описанных реакций.
2NO + O2 = 2NO2
4NO2 + O2 + 2H2O = 4HNO3
Cu + 4HNO3(конц.) = Cu(NO3)2 + 2NO2↑ + 2H2O
- При нагревании вещества оранжевого цвета оно разлагается; среди продуктов разложения – бесцветный газ и твердое вещество зеленого цвета. Выделившийся газ реагирует с литием даже при небольшом нагревании. Продукт последней реакции взаимодействует с водой, при этом выделился газ с резким запахом, который может восстанавливать металлы, например медь из их оксидов. Напишите уравнения описанных реакций.
(NH4)2Cr2O7 → N2↑ + Cr2O3 + 4H2O
N2 + 6Li = 2Li3N
Li3N + 3H2O = 3LiOH + NH3↑
2NH3 + 3CuO = N2↑ + 3Cu + 3H2O
- Металлический кальций прокалили в атмосфере азота. Продукт реакции обработали водой, выделившийся при этом газ пропустили в раствор нитрата хрома (III). Выпавший в ходе процесса серо-зеленый осадок обработали щелочным раствором пероксида водорода. Напишите уравнения описанных реакций.
N2 + 3Ca → Ca3N2
Ca3N2 + 6H2O = 3Ca(OH)2 + 2NH3↑
3NH3 + 3H2O + Cr(NO3)3 = Cr(OH)3↓ + 3NH4NO3
2Cr(OH)3 + 3H2O2 + 4KOH = 2K2CrO4 + 8H2O
- Смесь порошков нитрита калия и хлорида аммония растворили в воде и раствор осторожно нагрели. Выделившийся газ прореагировал с магнием. Продукт реакции внесли в избыток раствора соляной кислоты, при этом выделение газа не наблюдалось. полученную магниевую соль в растворе обработали карбонатом натрия. Напишите уравнения описанных реакций.
KNO2 + NH4Cl → KCl + N2↑ + 2H2O
N2 + 3Mg → Mg3N2
Mg3N2 + 8HCl = 3MgCl2 + 2NH4Cl
2MgCl2 + 2Na2CO3 + H2O = (MgOH)2CO3↓ + CO2 + 4NaCl
- Медь растворили в концентрированной азотной кислоте. К полученному раствору добавили избыток раствора аммиака, наблюдали сначала образование осадка, а затем – его полное растворение. Полученный раствор обработали избытком соляной кислоты. Напишите уравнения описанных реакций.
Cu + 4HNO3(конц.) = Cu(NO3)2 + 2NO2↑ + 2H2O
Cu(NO3)2 + 2NH3 · H2O = Cu(OH)2↓ + 2NH4NO3
Cu(OH)2 + 2NH3 · H2O = [Cu(NH3)4](OH)2 + 4H2O
[Cu(NH3)4](OH)2 + 6HCl = CuCl2 + 4NH4Cl + 2H2O
- Магний растворили в разбавленной азотной кислоте, причем выделение газа не наблюдалось. Получившийся раствор обработали избытком раствора гидроксида калия при нагревании. Выделившийся при этом газ сожгли в кислороде. Напишите уравнения описанных реакций.
4Mg + 10HNO3 = 4Mg(NO3)2 + NH4NO3↑ + 3H2O
Mg(NO3)2 + 2KOH = Mg(OH)2↓ + 2KNO3
NH4NO3 + KOH = KNO3 + NH3↑ + H2O
4NH3 + 3O2 = 2N2↑ + 6H2O
- Нитрат калия нагрели с порошкообразным свинцом до прекращения реакции. Смесь продуктов обработали водой, а затем полученный раствор профильтровали. Фильтрат подкислили серной кислотой и обработали иодидом калия. Выделившееся простое вещество нагрели с концентрированной азотной кислотой. В атмосфере образовавшегося при этом бурого газа сожгли красный фосфор. Напишите уравнения описанных реакций.
KNO3 + Pb = KNO2 + PbO
2KNO2 + 2H2SO4 + 2KI = 2K2SO4 + 2NO + I2 + 2H2O
I2 + 10HNO3 → 2HIO3 + 10NO2 + 4H2O
10NO2 + 4P = 2P2O5 + 10NO
- Газ, образовавшийся при взаимодействии азота и водорода, разделили на две части. Первую пропустили над раскаленным оксидом меди (II), вторую сожгли в кислороде в присутствии катализатора. Образовавшийся газ в избытке кислорода превратили в газ бурого цвета. Напишите уравнения описанных реакций.
N2 + 3H2 = 2NH3
3CuO + 2NH3 = 3Cu + N2 + 3H2O
2NO + O2 = 2NO2
- Разбавленная азотная кислота прореагировала с магнием с выделением бесцветного газа. В его атмосфере сожгли графит с образованием простого и сложного вещества. простое вещество при нагревании вступило в реакцию с кальцием, а сложное прореагировало с избытком раствора гидроксида натрия. Напишите уравнения описанных реакций.
4Mg + 10HNO3 = 4Mg(NO3)2 + N2O↑ + 5H2O
2N2O + C = 2N2↑ + CO2↑
3Ca + N2 = Ca3N2
CO2 + 2NaOH = Na2CO3 + H2O
- Аммиак поглотили азотной кислотой, полученную соль нагрели до образования только двух оксидов. Один из них прореагировал с натрием, а второй при высокой температуре прореагировал с медью. Напишите уравнения описанных реакций.
NH3 + HNO3 = NH4NO3
NH4NO3 → N2O + H2O
2H2O + 2Na = 2NaOH + H2
N2O + 2CuO = N2 + Cu2O
- Оксид азота (II) доокислили кислородом. Продукт реакции поглотили раствором гидроксида калия, через полученный раствор пропускали кислород до тех пор, пока в нем не образовалась только одна соль. Образовавшуюся соль отделили и прокалили. Напишите уравнения описанных реакций.
2NO + O2 = 2NO2
2NO2 + 2KOH = KNO2 + KNO3 + H2O
2KNO2 + O2 = 2KNO3
2KNO3 → 2KNO2 + O2
- Кальций сожгли в атмосфере азота. Полученное вещество разложили кипящей водой. Выделившийся газ сожгли в кислороде в присутствии катализатора, а к суспензии прибавили раствор соляной кислоты. Напишите уравнения описанных реакций.
3Ca + N2 = Ca3N2
Ca3N2 + 6H2O = Ca(OH)2 + 2NH3
Ca(OH)2 + 2HCl = CaCl2 + 2H2O
- Азот при нагревании на катализаторе прореагировал с водородом. Полученный газ поглотили раствором азотной кислоты, выпарили досуха и полученное кристаллическое вещество разделили на две части. Первую разложили при температуре 190 – 240°С, при этом образовался только один газ и водяные пары. Вторую часть нагрели с концентрированным раствором едкого натра. Напишите уравнения описанных реакций.
N2 + 3H2 = 2NH3
NH3 + HNO3 = NH4NO3
NH4NO3 → N2O + 2H2O
NH4NO3 + NaOH = NaNO3 + NH3↑ + H2O
в условии
в решении
в тексте к заданию
в атрибутах
Категория:
Атрибут:
Всего: 582 1–20 | 21–40 | 41–60 | 61–80 | 81–100 …
Добавить в вариант
Верны ли следующие суждения о солях азотной кислоты?
А. Все соли азотной кислоты хорошо растворимы в воде.
Б. Соли азотной кислоты разлагаются при нагревании.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
Источник: ЕГЭ по химии 10.06.2013. Основная волна. Дальний Восток. Вариант 2
Рассчитайте массовую долю азотной кислоты в растворе, полученном смешением 200 мл 15%-ного раствора серной кислоты плотностью 1,2 г/мл и 150 мл 10%-ного раствора нитрата бария плотностью 1,04 г/мл.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Неизвестное органическое вещество X содержит 72,0% углерода, 12,0% водорода по массе и кислород. Это легкоплавкое твёрдое вещество. Его получают гидрированием ароматического соединения. Оно реагирует с подкисленным раствором перманганата калия, а при окислении концентрированной азотной кислотой превращается в неразветвлённую двухосновную кислоту. Определите молекулярную формулу вещества X и установите его структуру. Напишите уравнение взаимодействия с азотной кислотой (в уравнении используйте структурные формулы органических веществ).
Неизвестное органическое вещество X содержит 73,5% углерода, 10,2% водорода по массе и кислород. Это легкоплавкое твёрдое вещество. Его получают окислением кислородом неразветвлённого циклического углеводорода. Вещество X не реагирует с перманганатом калия и с аммиачным раствором оксида серебра, но при окислении концентрированной азотной кислотой превращается в неразветвлённую двухосновную кислоту. Определите молекулярную формулу вещества X и установите его структуру. Напишите уравнение взаимодействия X с азотной кислотой (в уравнении используйте структурные формулы органических веществ).
Задания Д6 № 324
Общим свойством серебра и железа является их способность растворяться в
1) воде
2) серной кислоте (р-р)
3) азотной кислоте (конц.)
4) растворе щелочи
К 100 мл 5%-ного раствора соляной кислоты (плотностью 1,02 г/мл) добавили 6,4 г карбида кальция. Сколько миллилитров 15%-ной азотной кислоты (плотностью 1,08 г/мл) следует добавить к полученной смеси для её полной нейтрализации?
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
С наибольшей скоростью гидроксид натрия взаимодействует с
1) металлическим цинком
2) сульфатом меди (II)
3) азотной кислотой
4) сульфидом железа (II)
Из предложенного перечня веществ выберите два вещества, с которыми реагирует фенол.
1) водород
2) азотная кислота
3) углекислый газ
4) 2,2-диметилпентан
5) сульфат алюминия
Запишите номера выбранных соединений.
Газ, выделившийся при взаимодействии 3,2 г меди с 100 мл 60%-ной азотной кислоты (плотностью 1,4 г/мл), растворили в 100 г 15%-ного раствора гидроксида натрия. Рассчитайте суммарную массовую долю солей в полученном растворе.
Из предложенного перечня веществ выберите два вещества, с которыми реагируют и оксид фосфора(III), и оксид натрия при нормальных условиях.
1) вода
2) гидроксид лития
3) азотная кислота
4) кислород
5) оксид углерода(IV)
Запишите в поле ответа номера выбранных веществ.
Источник: РЕШУ ЕГЭ
Для полного растворения навески сплава серебра с медью потребовалось 43,5 мл 63%-й азотной кислоты (плотность 1,38 г/мл). При добавлении к полученному раствору избытка щёлочи выпал осадок, который высушили и прокалили при высокой температуре. Масса полученного твёрдого вещества составила 25,6 г. Рассчитайте массовые доли металлов (в%) в сплаве. Запишите уравнения всех реакций и приведите вычисления.
Для выполнения задания используйте следующий перечень веществ: серебро, азотная кислота, гидрокарбонат натрия, сульфат натрия, силикат цинка. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
1
Для выполнения задания используйте следующий перечень веществ: серебро, азотная кислота, гидрокарбонат натрия, сульфат натрия, силикат цинка. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции.
Источник: РЕШУ ЕГЭ
Источник: РЕШУ ЕГЭ
Для выполнения задания используйте следующий перечень веществ: азотная кислота, сероводород, нитрат калия, хлорид натрия, нитрат свинца (II). Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
1
Для выполнения задания используйте следующий перечень веществ: азотная кислота, сероводород, нитрат калия, хлорид натрия, нитрат свинца (II). Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции.
Источник: РЕШУ ЕГЭ
Источник: РЕШУ ЕГЭ
При растворении железа в горячей концентрированной азотной кислоте выделилось 13,44 л бурого газа (в пересчёте на н. у.). Сколько граммов азотной кислоты израсходовано? Ответ представьте с точностью до десятых.
Навеску медно-цинкового сплава массой 15,42 г полностью растворили в концентрированной азотной кислоте. Весь выделившийся газ поглотили раствором гидроксида калия, при этом образовалась смесь солей общей массой 44,64 г. К раствору, полученному при взаимодействии сплава с азотной кислотой, добавили избыток разбавленной щёлочи, а выпавший осадок отфильтровали. Вычислите массовые доли металлов в сплаве и найдите массу осадка. В расчётах примите
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения и обозначения искомых физических величин).
Из предложенного перечня выберите все способа увеличить скорость реакции между бензолом и азотной кислотой.
1) нагревание
2) разбавление кислоты
3) добавление концентрированной серной кислоты
4) увеличение концентрации нитробензола
5) уменьшение давления над смесью
Запишите номера выбранных ответов.
Задания Д15 № 73
Верны ли следующие утверждения о феноле?
А. Фенол проявляет свойства сильной кислоты.
Б. Фенол реагирует как с бромной водой, так и с азотной кислотой.
1) Верно только А
2) Верно только Б
3) Верны оба утверждения
4) Оба утверждения неверны
Источник: Яндекс: Тренировочная работа ЕГЭ по химии. Вариант 1.
Задания Д8 № 499
Гидрокарбонат натрия реагирует с
1) азотной кислотой
2) нитратом калия
3) сульфатом калия
4) кислородом
Для полной нейтрализации 200 г раствора, содержащего серную и азотную кислоты, потребовалось 855 г 5,0%-го раствора гидроксида бария, при этом из раствора выпал осадок массой 34,95 г. Рассчитайте массовые доли (в%) кислот в исходном растворе.
Установите соответствие между веществами и признаком протекающей между ними реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Реагирующие вещества
А) бутадиен и бром (р-р)
Б) уксусная кислота и гидроксид меди (II)
В) этилен и перманганат калия (кислая среда)
Г) белок и азотная кислота
Признак реакции
1) растворение осадка
2) образование кирпично-красного осадка
3) обесцвечивание раствора
4) появление фиолетовой окраски раствора
5) жёлтое окрашивание
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Всего: 582 1–20 | 21–40 | 41–60 | 61–80 | 81–100 …
14715. Установите соответствие между формулой вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА ВЕЩЕСТВА
А) N2O5
Б) HNO2
В) N2O
КЛАСС/ГРУППА
1) оксид несолеобразующий
2) оксид амфотерный
3) оксид кислотный
4) кислота

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 14715.
14701. Установите соответствие между формулой вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Формула вещества
А) NaOH
Б) HNO3
В) HClO4
Г) MnO2
Класс/группа
1) гидроксид основный
2) оксид амфотерный
3) кислота
4) оксид кислотный

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 14701.
14543. Из предложенного перечня пар взаимодействующих между собой веществ выберите две пары веществ, при взаимодействии которых водород не выделяется.
1. Cu и HNO3 (конц.)2. Mg и HBr (разб.)3. Zn и H2SO4 (разб.)4. Hg и H2SO4 (конц.)5. Al и NaOH (конц.)

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 14543.
14528. Из предложенного перечня веществ выберите два вещества, которые реагируют с медью.
1. HNO3(разб.)2. K3PO43. MgCl24. HNO3(конц.)5. H2SO4(разб.)

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 14528.
7838. В пробирку с раствором щёлочи X добавили раствор вещества Y. В результате произошла реакция, которую описывает следующее сокращённое ионное уравнение:
Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанную реакцию.
1) азотная кислота
2) гидроксид меди(II)
3) сульфид калия
4) угольная кислота
5) гидроксид калия

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7838.
Для вас приятно генерировать тесты, создавайте их почаще
Муниципальное автономное
общеобразовательное учреждение- средняя общеобразовательная школа № 1 имени
В.И. Фадеева станицы Калининской
Консультация по химии
для подготовки к единому
государственному экзамену
на тему «Азотная кислота»
Выполнила:
Учитель химии
Каблучкина Наталья Борисовна
Ст. Калининская
2014г
Задачи занятия:
Обобщить
знания об азотной кислоте, полученные в курсе неорганической и органической
химии.
На
примере азотной кислоты повторить классификацию и основные свойства кислот в
свете ТЭД, закономерности протекания ОВР, реакции гидролиза и электролиза,
решение задач на растворы, по алгоритму.
Продолжить
отработку умений выполнять тестовые задания части А,В,С единого
государственного экзамена.
Оборудование:
—
опорные схемы по теории,
—
раздаточные таблицы по взаимодействию азотной кислоты с металлами,
—
тестовые задания.
Ход занятия
1. Организационный момент.
Приветствие
учащихся. Сообщение темы и цели занятия.
2.Учитель обобщает материал по данной теме с
использованием опорных схем на экране компьютера:
Азотная
кислота
НNO3 (N+5,
NIV)
— одноосновная
— кислородсодержащая
— сильный электролит
— сильный окислитель
Получают: NH3
→ NO → NO2
→HNO3
Физ. свойства:
Ж, беcцветная, дымящая,
резкий запах,
tкип.
= 860С,
Хим. свойства:
1.
Нестойкая, разлагается на свету, при t
4НNO3
→ 4NO2↑ + 2Н2О + О2↑
( желтеет при неправильном хранении)
2.
Диссоциирует НNO3
→Н+ + NO3—
кислотные свойства
+ основные, амфотерные оксиды
+ основания
+ соли слабых кислот
3.
Окисляет все металлы, кроме Аu, Pt
с образованием
трёх продуктов:
Ме + НN+5O3 → соль +
вода + ↑ соед. N+4,
N+2,
N+1,
N20
, N-3
|
HNO3 |
-не Au,Pt |
||||||
|
Концентрированная (пассивация |
Разбавленная |
||||||
|
активные |
неактивные в-ва |
неактивные в-ва |
активные |
активные |
|||
|
|
|
NO↑ |
N2↑ |
NH3 ( NH4NO3) |
|||
|
HNO3 концентрированная
|
кислота или 4HNO3 2HNO3 |
||||||
4.Реагирует
с органическими веществами( алканы, арены,
фенол, анилин, целлюлоза, белки)
реакции замещения — нитрования
НNO3
→ НО — NO2 –
нитрогруппа
СН4 + HNO3
→ СН3—
NO2 + Н2О
С6Н6 + HNO3
→ С6Н5—
NO2 + Н2О
Качественная реакция на нитраты
нитрат
+ конц. Н2SO4 + Cu → … + NO2↑
Разложение нитратов
(по
ряду активности металлов)
|
1. Металлы левее магния |
KNO3 à КNO2 + O2 |
|
2. до |
Mg(NO3) металла* + NO2 + O2 |
|
3. |
|
3.Учащиеся
задают вопросы, используя записи собственного конспекта и предложенных
опорных схем.
Например: — Что
значит пассивация?
— Какая кислота называется оксикислотой?
— Как правильно записать качественные реакции на нитраты?
— Какие соли называются силитрами?
4.
Отработка умения записывать уравнения ОВР химических
реакций и расставлять коэффициенты методом электронного баланса.
Два
ученика у доски работают с уравнениями:
Cu
+ 4HNO3(конц) = Cu(NO3)2
+ 2H2O + 2NO2
3Cu
+ 8HNO3(разб) = 3Cu(NO3)2
+ 4H2O + 2NO
5. Выполнение
учащимися тестовых заданий и задания уровня С .
Учащиеся
работают дифференцированно: 2 ученика с заданиями С у доски, 3 ученика с
заданиями В вместе, остальные с заданиями А самостоятельно. Учитель выполняет
роль консультанта.
Часть
А
1.Какой
оксид реагирует с раствором НNO3,
но не реагирует с раствором NaOH?
1)
CO 3) P2O5
2)
SO3 4) MgO
2.
Азотная кислота реагирует с каждым веществом набора:
1)
KOH и Na2СO3
2)
HCl и NaOH
3) CuO
и KNO3
4) Fe2O3
и H2SO4
3.В
схеме превращений NH3⎯→ X ⎯→ Y⎯→ НNO3 ⎯→ Y
веществами
«X» и «Y» являются соответственно
1) NO2
и NO
2) NO и NO2
3)
Н2 и Н2О
4)
HCl и H2O
4.Взаимодействие
азотной кислоты с аммиаком относится к реакциям
1)
соединения, необратимым
2)
обмена, обратимым
3)
замещения, обратимым
4)
обмена, необратимым
5.В
отличие от этилена, этан реагирует с
1)
хлором
2)
водородом
3)
азотной кислотой
4)
кислородом
6.
Наибольшее количество нитрат-ионов образуется в растворе при диссоциации 1 моль
1)
нитрата натрия
2)
нитрата меди(II)
3)
нитрата алюминия
4)
нитрата кальция
7.
Одинаковую реакцию среды имеют растворы нитрата меди(II) и
1)
хлорида кальция
2)
нитрата натрия
3)
сульфата алюминия
4)
ацетата натрия
8.
Окислительные свойства азотная кислота проявляет в реакции, схема которой:
1) НNO3+ NH3
→ NH4NO3
2) НNO3+
KOH →
KNO3+
H2O
3) НNO3 + P
→ H3 PO4
+ NO2
4) НNO3+ CuO
→ Cu(NO3)2
+ H2O
Часть
В
В-1. Установите
соответствие между формулой соли и её способностью к гидролизу.
ФОРМУЛА СОЛИ СПОСОБНОСТЬ
К ГИДРОЛИЗУ
1) NН4NO3
А) по катиону
2) Ва(NO3)2
Б) по аниону
3) Аl(NO3)3
В) по катиону и аниону
Г) гидролизу не подвергается
В-2. Установите
соответствие между формулой вещества и продуктом, который образуется на аноде в
результате электролиза водного раствора этого вещества.
|
ФОРМУЛА |
ПРОДУКТ |
|
А) AgNO3 Б) HNO3 В) NaNO3 |
1) оксид 2) азот 3) 4) |
В-3. Определите массу воды, которую надо добавить к 20
г раствора азотной
кислоты с массовой долей 70% для получения раствора
азотной кислоты
с массовой долей 5%. (Запишите число с точностью до
целых.)
Ответ: ___________ г.
В-4. Рассчитайте объём оксида азота (+4), полученный
при разложении 126 г азотной кислоты. %. (Запишите число с точностью до
десятых.)
Ответ: ___________ л.
Часть С
С-1. Используя метод электронного баланса,
составьте уравнение реакции
НNO3
+ СuS
→ СuSO4
+ … + H2O
Укажите окислитель и восстановитель.
С- 2. Сплав серебра с медью массой 0,5 кг
обработали раствором азотной кислоты. К полученному раствору добавили соляную
кислоту. Масса образовавшегося осадка равна 430 г. Определите массовую долю
серебра в сплаве.
6. Разбор
выполненных заданий:
Ответы на
задания части А с комментариями.
Ответы на
задания части В с комментариями.
Комментарии
выполненных на доске заданий части С.
12 декабря 2020
В закладки
Обсудить
Жалоба
Азотная кислота
Тест по химии.
Да/нет.
1. Степень окисления атома азота в молекуле азотной кислоты равна +5.
2. Валентность атома азота в молекуле азотной кислоты равна V.
3. Валентность атома азота в молекуле азотной кислоты равна IV.
4. Степень окисления атома азота в молекуле азотной кислоты равна + 4.
5. Чистая азотная кислота – бурая дымящаяся жидкость с резким раздражающим запахом.
6. Чистая азотная кислота – бесцветная дымящаяся жидкость без запаха.
7. Чистая азотная кислота – бесцветная дымящаяся жидкость с резким раздражающим запахом.
8. Концентрированная азотная кислота бесцветная.
9. Концентрированная азотная кислота обычно окрашена в жёлтый цвет.
10. В концентрированной азотной кислоте находится растворённый оксид азота (IV), который образуется вследствие частичного разложения азотной кислоты.
11. Азотная кислота – сильный окислитель.
12. Азотная кислота – слабый окислитель.
13. Азотная кислота полностью диссоциирует на ионы.
14. Азотная кислота реагирует с основными оксидами, образуя соль и воду.
15. Азотная кислота реагирует с основаниями.
16. Азотная кислота реагирует с солями более слабых и более летучих кислот.
17. Тлеющая лучинка в нагретой концентрированной азотной кислоте загорается из-за того, что азотная кислота разлагается при нагревании и одним из образовавшихся веществ является кислород.
18. Если концентрированная азотная кислота попадает на кожу, она окрашивает кожу в чёрный цвет.
19. Если концентрированная азотная кислота попадает на кожу, она окрашивает кожу в ярко-жёлтый цвет.
20. При взаимодействии концентрированной азотной кислоты с белками образуются вещества ярко-жёлтого цвета.
21. При взаимодействии концентрированной азотной кислоты с медью образуется оксид азота (IV) – бурый газ.
22. Разбавленная азотная кислота не реагирует с медью.
23. При взаимодействии разбавленной азотной кислоты с медью образуется оксид азота (II) – бесцветный газ.
24. Золото, платина, осмий реагируют с азотной кислотой.
25. В лаборатории азотную кислоту получают действие концентрированной серной кислоты на кристаллический нитрат натрия.
26. В промышленности азотную кислоту получают окислением аммиака кислородом воздуха без катализатора.
27. В промышленности азотную кислоту получают окислением аммиака в присутствии катализатора платины.
28. Азотную кислоту нельзя использовать для получения лекарственных веществ.
29. Из азотной кислоты получают удобрения.
30. При работе с концентрированной азотной кислотой нужно соблюдать осторожность: не допускать её попадание на кожу и одежду.
Ответы
1-да
2-нет
3-да
4-нет
5-нет
6-нет
7-да
8-нет
9-да
10-да
11-да
12-нет
13-да
14-да
15-да
16-да
17-да
18-нет
19-да
20-20
21-да
22-нет
23-да
24-нет
25-да
26-нет
27-да
28-нет
29—да
30-да
Оценка
25-30=5
20-24=4
13-19=3
0-12=2
Автор: Майорова Светлана Юрьевна.
Азотная кислота обладает большой реакционной способностью, и взаимодействует с разными веществами,- как с простыми, так и сложными, поэтому часто встречается в заданиях ОГЭ и ЕГЭ разного уровня.
Сегодня мы разберем два задания из ЕГЭ, одно из которых простое, другое посложнее, оба — на химические свойства азотной кислоты.
На следующем уроке будут две задачи, в которых будет присутствовать HNO3 .
Задание1:
Из предложенного перечня выберите два вещества, с каждым из которых реагирует как серебро, так и железо (при нагревании).
1) вода;
2) разбавленная серная кислота;
3) концентрированная азотная кислота;
4) раствор гидроксида натрия;
5) концентрированная серная кислота.
Решение:
Для того, чтобы решить это задание, необходимо вспомнить химические свойства веществ.
Серебро — это мягкий белый, блестящий переходный металл, который по химическим свойствам занимает промежуточное положение между Cu и Au;
как и медь Ag реагирует с серой и ее соединениями, а также легко растворяется в горячей концентрированной серной кислоте, разбавленной и концентрированной азотной кислотах.
Железо также как и серебро является переходным металлом, который занимает 4 место по распространенности в земной коре; он реагирует с кислородом воздуха с образованием оксидов — Fe3O4, Fe2O3, FeO (нестабилен).
Также железо образует с серой соединение железный пирит — FeS2, на первый взгляд в котором у Fe степень окисления равна +4, однако, пирит это фактически полисульфид железа, где его валентность равна II.
Важно! Железо не образует амальгамы с ртутью, как многие металлы, поэтому из него изготавливают колбы для перевозки Hg.
Fe вступает в реакции замещения с галогенами — фтором, хлором и бромом и йодом; в реакциях с сильными концентрированными кислотами (H2SO4, HNO3) реагирует только при нагревании, а с разбавленными взаимодействует без нагревания.
Отсюда, ответ 3 и 5.
Задание 2:
Установите соответствие между реагирующими веществами и признаком протекающей реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
А) сульфит калия (р-р) и азотная кислота;
Б) гидроксид алюминия и гидроксид натрия (р-р);
В) хлорид аммония (тв.) и гидроксид кальция (тв.);
Г) нитрат бария (р-р) и серная кислота.
1) растворение осадка;
2) видимых изменений не наблюдается;
3) образование осадка;
4) выделение газа;
5) обесцвечивание раствора.
Решение:
Итак, это задание не очень сложное, однако, при его выполнении нужно внимательно записать уравнения химических реакций и пользоваться таблицей растворимости.
Первая реакция — между сульфитом калия и азотной кислотой:
K2SO3 + 2HNO3 → 2KNO3 + H2O + SO2.
В продуктах реакции ты ожидал увидеть сернистую кислоту и нитрат калия, но H2SO3 неустойчива, как и угольная, поэтому распадается на оксид серы (IV) и воду; соответственно, здесь происходит выделение газа в виде SO2.
Вторая реакция — между гидроксидом алюминия и гидроксидом натрия (р-р), составим уравнение:
Al(OH)3 + NaOH → NaAlO2 + H2O,
здесь мы наблюдаем образование соли — алюмината натрия (растворимое вещество) и воды, видимых изменений не происходит.
Третья реакция — между хлоридом аммония (тв.) и гидроксидом кальция (тв.); при взаимодействии NH4Cl и гашеной извести образуется гидроксид аммония, который распадается на аммиак и воду соответственно:
2NH4Cl + Ca(OH)2 → CaCl2 + 2NH3 + 2H2O.
И, последняя реакция между нитратом бария и серной кислотой; как ты наверняка знаешь, одной из качественных реакций на соли сульфатов являются соединения бария, образуя осадок белого цвета BaSO4, который, кстати, нерастворим в кислотах
Ba(NO3)2 + H2SO4→ BaSO4↓+ 2HNO3.
Из вышеперечисленных реакций выводим ответ: 4143.
На сегодня все).