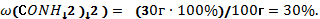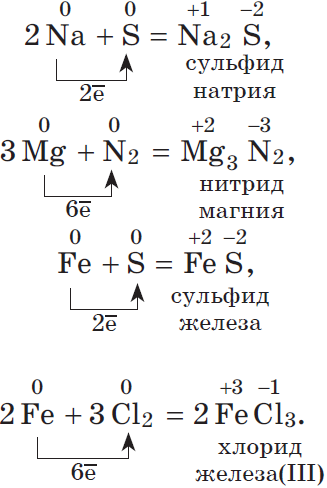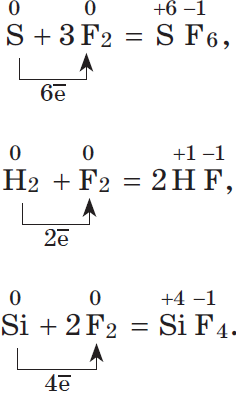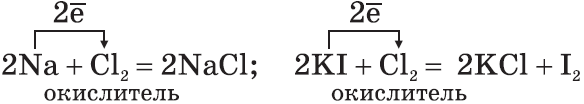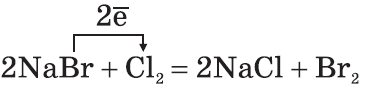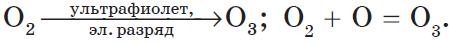Всего: 87 1–20 | 21–40 | 41–60 | 61–80 …
Добавить в вариант
Верны ли следующие утверждения о химических свойствах фосфора?
A. Фосфор может реагировать как с металлами, так и с неметаллами.
Б. Фосфор растворяется в разбавленной серной кислоте с выделением водорода.
1) верно только А
2) верно только Б
3) верны оба утверждения
4) оба утверждения неверны
Верны ли следующие суждения о свойствах серы?
А. Сера может реагировать как с металлами, так и с неметаллами.
Б. Сера растворяется в щелочах с выделением водорода.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
Верны ли следующие утверждения о свойствах кремния?
A. Кремний растворяется в щелочах с выделением водорода.
Б. Кремний может реагировать как с металлами, так и с неметаллами.
1) верно только А
2) верно только Б
3) верны оба утверждения
4) оба утверждения неверны
Верны ли следующие суждения о химических свойствах фосфора?
А. Фосфор, предварительно подожжённый на воздухе, сгорает в кислороде ярким пламенем.
Б. Красный фосфор взаимодействует с металлами.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Запишите в таблицу выбранные цифры под соответствующими буквами.
Источник: СтатГрад: Тренировочная работа 09.11.2022. Вариант ХИ2210201.
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Запишите в таблицу выбранные цифры под соответствующими буквами.
Источник: СтатГрад: Тренировочная работа 09.11.2022. Вариант ХИ2210202.
Из предложенного перечня выберите две пары веществ, с которыми реагируют сера.
1)
2)
3)
4)
5)
Запишите в поле ответа номера выбранных веществ.
Источник: РЕШУ ЕГЭ
Из предложенного перечня выберите две пары веществ, с каждым из которых реагирует сера.
1) и
2) и
3) и
4) и
5) и
Запишите в поле ответа номера выбранных пар веществ.
Источник: РЕШУ ЕГЭ
Из предложенного перечня веществ выберите два вещества, с каждым из которых взаимодействует бром.
1) хлорид калия (р-р)
2) оксид меди (II)
3) гидроксид бария (р-р)
4) иодид калия (р-р)
5) сульфат лития (р-р)
Запишите в поле ответа номера выбранных веществ.
Источник: ЕГЭ по химии 2018. Досрочная волна
Задания Д6 № 539
Верны ли следующие суждения о свойствах углерода?
А. Взаимодействие углерода с кислородом относится к экзотермическим реакциям.
Б. При полном сгорании углерода образуется оксид углерода (IV).
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
Задания Д6 № 668
Верны ли следующие суждения о свойствах углерода?
А. При обычной температуре углерод инертен.
Б. При нагревании углерод является сильным восстановителем.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
Задания Д6 № 754
Верны ли следующие суждения об окислительных свойствах азота?
А. Азот является более слабым окислителем, чем фтор.
Б. Азот является окислителем в реакции с водородом.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
Верны ли следующие утверждения о свойствах серы?
A. Сера растворяется в кислотах с выделением водорода.
Б. И высший оксид, и водородное соединение серы имеют кислотный характер.
1) верно только А
2) верно только Б
3) верны оба утверждения
4) оба утверждения неверны
Из предложенного перечня выберите две пары веществ, с которыми реагирует сера.
1)
2)
3)
4)
5)
Запишите в поле ответа номера выбранных пар веществ.
Источник: РЕШУ ЕГЭ
Из предложенного перечня выберите две пары веществ, с каждым из которых реагирует сера.
1) и
2) и
3) и
4) и
5) и
Запишите в поле ответа номера выбранных пар веществ.
Источник: РЕШУ ЕГЭ
Из предложенного перечня выберите два простых вещества, которые реагируют с щелочами.
1) фтор
2) натрий
3) водород
4) хлор
5) магний
Запишите в поле ответа номера выбранных веществ.
Источник: РЕШУ ЕГЭ
Из предложенного перечня простых веществ выберите два, которые реагируют c водой при обычных условиях.
1) кислород
2) медь
3) хром
4) барий
5) фтор
Запишите в поле ответа номера выбранных веществ.
Из предложенного перечня выберите два простых вещества, которые растворяются в щелочах, но не растворяются в соляной кислоте. Запишите номера выбранных ответов в порядке возрастания.
1)
2)
3)
4)
5)
Задания Д6 № 969
Верны ли следующие суждения о химических свойствах азота?
А. Азот реагирует с кислородом только при высокой температуре.
Б. Азот при нагревании реагирует с активными металлами.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
Верны ли следующие суждения о химических свойствах азота?
А. Азот реагирует с водородом только при высокой температуре и наличии катализатора.
Б. Одно из немногих веществ с которыми азот реагирует при комнатной температуре без участия катализатора — литий.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
Всего: 87 1–20 | 21–40 | 41–60 | 61–80 …
Единый государственный экзамен по химии
Тема «Неметаллы»
Часть 1
А1. В каком случае представлены химические знаки наиболее активных неметаллов, расположенных в порядке усиления их неметалличности:
А) N, C, B; В) F, S, Cl;
Б) Сl, O, F; Г) Si, B, H.
А2. Бор имеет кристаллическую решетку:
А) атомную; В) ионную;
Б) молекулярную; Г) металлическую.
А3. Из предложенных ниже групп формул водородных соединений неметаллов выберите ту, которая включает формулы веществ со свойствами кислот, расположенных в порядке увеличения их силы:
А) CH4, NH3, H2O; В) H2S, PH3, SiH4;
Б) HBr, HCl, HI; Г) HCl, HBr, HI.
А4. К солеобразующим оксидам относится:
А) CO; В) NO;
Б) N2O; Г) N2O5.
А5. Какой высший оксид неметалла 4 периода обладает наименее ярко выраженными кислотными свойствами:
А) SeO3; В As2O3;
Б) Mn2O7; Г) As2O5.
А6. Выберите наиболее сильную кислоту:
А) H3PO4;
Б) H3AsO4;
В) H3SbO4.
А7. Из предложенных ниже групп формул водородных соединений неметаллов выберите ту, которая содержит формулы веществ со свойствами оснований:
А) CH4, NH3, H2O; В) NH3, PH3;
Б) SiH4, HCl; Г) H2O, H2S, H2Se.
А8. Выберите наиболее сильную кислоту:
А) HClO; В) HClO3;
Б) HClO2; Г) HClO4.
А9. Кислотные свойства от оксида фосфора (V) к оксиду серы (VI) увеличиваются по следующим причинам:
А) увеличение радиуса атома;
Б) увеличение положительного заряда неметалла;
В) уменьшение электроотрицательности неметалла.
А10. По агрегатному состоянию бром является:
А) газом;
Б) жидкостью;
В) твёрдым веществом.
А11. Реакционная способность галогенов – простых веществ – в подгруппе сверху вниз с ростом порядкового номера:
А) уменьшается; В) уменьшается, а затем возрастает;
Б) увеличивается; Г) не изменяется.
А12. Только восстановительные свойства проявляет кислота:
А) HClO; В) HCl;
Б) HClO2; Г) HClO4.
А13. Соляная кислота — это:
А) водный раствор хлора;
Б) тяжелая маслянистая жидкость с желтоватым оттенком;
В) водный раствор хлороводорода;
Г) бесцветные кристаллы.
А14. Температуры плавления и кипения галогенов – простых веществ – в подгруппе сверху вниз с ростом порядкового номера:
А) уменьшаются; В) уменьшаются, а затем возрастают;
Б) увеличиваются; Г) не изменяются.
А15. Свободный хлор Cl2 может выделиться в результате реакции:
А) HCl + F2 → В) HCl + Mg →
Б) HCl + Br2 → Г) HCl + MgO →
А16. При добавлении раствора йодида натрия к раствору нитрата серебра образуется осадок:
А) жёлтого цвета;
Б) желтоватого цвета;
В) белого цвета.
А17. Наличие в растворе сульфат-ионов можно определить с помощью раствора:
А) индикатора; В) хлорида бария;
Б) гидроксида калия; Г) соляной кислоты.
А18. В водном растворе какой соли среда щелочная:
А) хлорид аммония; В) сульфат бария;
Б) карбонат калия; Г) нитрат магния.
А19. Коэффициент перед формулой окислителя в уравнении реакции, схема которой NH3 + O2 → NO + H2O равен:
А) 1; В) 3;
Б) 2; Г) 5.
А20. Для увеличения скорости реакции в 81 раз (температурный коэффициент равен 3), температуру газообразной смеси следует повысить на:
А) 40º С; В) 20º С;
Б) 30º С; Г) 50º С.
А21. Химическое равновесие реакции N2(газ) + O2(газ) ⇋2NO(газ)–Q смещается в сторону образования продукта реакции при:
А) понижении температуры; В) повышении температуры;
Б) уменьшении давления; Г) увеличении давления.
А22. Аллотропными формами одного и того же элемента являются:
А) кислород и озон; В) вода и лед;
Б) кварц и кремень; Г) сталь и чугун.
А23. В реакции цинка с концентрированной азотной кислотой окислителем является:
А) Zn2+; В) H+;
Б) NO3—; Г) Zn0.
А24. В периодической системе химических элементов Д.И.Менделеева неметаллы расположены в углу:
А) правом верхнем; В) левом верхнем;
Б) правом нижнем; Г) левом нижнем.
А25. Конечным веществом в цепочке превращений на основе азота
А) нитрат аммония; В) оксида азота (IV);
Б) оксида азота (I); Г) азотная кислота.
А26. Для того, чтобы идентифицировать углекислый газ с помощью раствора хлорида кальция, в последний надо добавить:
А) NaCl; В) HCl;
Б) NaOH; Г) Ca(NO3)2.
А27. Силан образуется в результате реакции:
А) Si + H2 →; В) Mg2Si + HCl (раствор)→;
Б) SiO2 + H2 →; Г) Si +NaOH (раствор)→.
А28. Для проведения опыта необходимо взять некоторое количество питьевой соды, на склянках же с реактивами указаны только формулы веществ. Склянку с какой этикеткой необходимо взять:
А) Na2CO3; В) KHCO3;
Б) K2CO3; Г) NaHCO3.
А29. При обработке карбоната металла кислотой образуется:
А) углерод; В) угарный газ;
Б) кислород; Г) углекислый газ.
А30. Вещество А в цепи превращений H2S→S→A→SO3 →Na2SO4
А) оксид серы (IV); В) сероводород;
Б) вода; Г) сернистая кислота.
А31. Свойство концентрированной серной кислоты отражает уравнение:
А) C + H2SO4 → CO2 + SO2 + H2O;
Б) Zn + H2SO4 → ZnSO4 + H2;
В) Ca + H2SO4 → CaSO4 + H2;
Г) Al2O3 + H2SO4 → Al2(SO4)3 + H2O.
А32. Химическая связь в молекуле фтороводорода:
А) ковалентная полярная; В) ионная ;
Б) ковалентная неполярная; Г) водородная.
А33. При обжиге пирита получается:
А) сера и оксид железа (III);
Б) сернистый газ и оксид железа (III);
В) сернистый газ и оксид железа (II);
Г) сернистый газ и железо.
А34. Кислые соли сероводородной кислоты называются:
А) гидросульфиды; В) гидросульфаты;
Б) гидросульфиты; Г) сульфиды.
А35. Соляная кислота НЕ взаимодействует с:
А) магнием; В) гидроксидом калия;
Б) ртутью; Г) карбонатом натрия.
Часть 2
В1. Какова массовая доля серы в сульфиде магния?
Ответ:_____.
В2. Высший оксид фосфора имеет формулу____________ и при растворении в воде даёт____________(формула).
В3. Самые активные неметаллы находятся в ________группе, их высшая степень окисления равна________, по отношению к металлам они выполняют функцию_____________.
В4. В сокращённом ионном уравнении реакции серной кислоты с нитратом бария сумма коэффициентом равна_______________.
В5. Запишите число нейтронов в ядре атома фосфора-31.
Ответ:_____.
В6. Соединения азота с металлами называются ____________.
В7. Что такое аллотропия (напишите определение)?
В8. Фенолфталеин в водном растворе аммиака приобретает ____________окраску.
В9. При действии электрического тока на смесь азота и кислорода можно получить соединение ________.
В10. Доказать наличие в растворе нитратов (например, нитрата натрия) можно с помощью реакций_________.
Часть 3
С1. При обработке фосфида кальция водой выделяется газ фосфин – аналог аммиака. Какой объём фосфина (измеренный при нормальных условиях) можно получить из 18,2 г фосфида кальция?
С2. При кипячении 100 см3 раствора серной кислоты, содержащего 10% H2SO4 по массе и имеющего плотность 1,07 г/см3, выпарили 50 мл воды. Опрделеите массовую долю серной кислоты в полученном растворе. Сколько моль гидроксида калия необходимо для полной нейтрализации полученного раствора H2SO4?
С3. При нагревании 126,4 г перманганата калия получили 6,72 л кислорода. Какова массовая доля неразложившегося KMnO4?
С4. Первой стадией получения азотной кислоты в промышленности является окисление аммиака кислородом. Рассчитайте объём воздуха (н.у.), который необходим для получения 1 м3 (н.у.) оксида азота (II) из аммиака, если выход продукта 75%.
С5. Реакция образования фосгена обратима:
СО(газ) + Сl2 (газ) ⇋ COCl (газ) + Q
Перечислите все условия, при которых происходит смещение равновесия в этой системе в сторону исходных веществ. Объясните действие каждого из условий.
1. Задания с выбором ответов А1-А13
I. Выбор одного правильного варианта из 4 предложенных
|
Вопрос |
Комментарий |
|
А1. Какая формула соответствует электронной конфигурации внешнего электронного уровня селена? 1. …3s23p4 2. …4s24p4 3. …3s23p6 4. …4s24p6 |
Селен находится в VI–A группе, значит, на последнем слое 6 электронов. В 4-ом периоде, значит, 4 электронных уровня. Правильный ответ 2. |
|
А2. У какого элемента ярче выражены неметаллические свойства: 1. теллур 2. сера 3. селен 4. кислород |
Все элементы VI-A группы, а в рамках группы неметаллические свойства усиливаются снизу вверх. Правильный ответ 4. |
|
А3. В каком соединении сера проявляет степень окисления +6? 1. SO2 2. H2SO3 3. H2SO4 4. Al2S3 |
Определяем степень окисления серы в каждом веществе, зная, что О-2, а Н+1. Сумма всех степеней окисления в молекуле должна быть равна 0. Правильный ответ 3. |
|
А4. Какой из перечисленных металлов не реагирует с концентрированной серной кислотой? 1. Медь 2. Цинк 3. Кальций 4. Железо |
Концентрированная серная кислота реагирует и с теми металлами, которые находятся в электрохимическом ряду напряжений правее водорода. Но она не реагирует с некоторыми металлами из-за пассивации. Среди этих металлов и железо. Правильный ответ 4. |
|
А5. В какой из приведенных пар оба вещества реагируют с разбавленной серной кислотой? 1. сера и оксид серы (IV) 2. медь и гидроксид меди (II) 3. оксид меди (II) и хлорид меди (II) 4. оксид меди (II) и гидроксид бария |
Разбавленная серная кислота взаимодействует с основными оксидами, основаниями, металлами, находящимися в ряду напряжений до водорода и с солями, если получается осадок или газ. Правильный ответ 4. |
|
А6. В качестве реагента на 1. Ba2+ 2. H+ 3. Cu2+ 4. Fe2+ |
Качественной реакцией на серную кислоту и её соли, т.е на ион Правильный ответ 1. |
|
А7. Степень окисления азота может быть: 1. +1 2. -4 3. +6 4. +7 |
Азот может проявлять степени окисления от -3 до +5. В указанном интервале подходит только вариант 1. Правильный ответ 1. |
|
А8. Сравните устойчивость водородных соединений азота и фосфора: 1. водородное соединение азота более устойчиво 2. водородное соединение азота менее устойчиво 3. оба соединения неустойчивы 4. оба соединения одинаково устойчивы |
Водородные соединения азота NH3 – аммиак, и фосфора PH3 – фосфин. PH3 фосфин самовоспламеняется на воздухе. Правильный ответ 1. |
|
А9. В каком соединении азот проявляет степень окисления +4? 1. N2O 2. NaNO2 3. NaNO3 4. NO2 |
Определяем степень окисления азота в каждом веществе, зная, что О-2, а Na+1. Сумма всех степеней окисления в молекуле должна быть равна 0. Правильный ответ 4. |
|
А10. Какую кристаллическую решетку имеет твердый аммиак? 1. атомную 2. молекулярную 3. ионную 4. металлическую |
Аммиак состоит из молекул. Правильный ответ 2. |
|
А11. Каким способом получают аммиак в лаборатории? 1. соединением азота с водородом 2. разложением солей аммония 3. восстановление оксидов азота водородом 4. взаимодействием солей аммония с гидроксидом кальция |
При промышленном производстве аммиака из водорода и азота требуются высокие температура и давление, и катализатор. 2NH4NO3 + Сa(OH)2 Правильный ответ 4. |
|
А12. С какими веществами аммиак вступает в реации соединения: 1. кислоты 2.кислород 3. щелочи 4. соли |
По определению реакции соединения, аммиак вступает в реакции соединения с кислотами, образуются соли аммония. Правильный ответ 1. |
|
А 13. Как различить растворы солей хлорида аммония и хлорида натрия? 1. по запаху 2. по действию нитрата серебра 3. по действию кислоты при нагревании 4. по действию щелочи при нагревании |
Характерным запахом обладает аммиак, а не соли аммония. Они запаха не имеют. 2NH4Cl+ Сa(OH)2 Аммиак определяется по запаху. Правильный ответ 4. |
2. Задания с кратким ответом и на соответствие В1-В10
В1. Укажите число возможных реакций, протекающих с образованием водорода, которые можно провести между следующими веществами
1. Раствор серной кислоты
2. Магний
3. Ртуть
4. Азотная кислота
5. Оксид магния
Комментарий
Для решения задач о возможности взаимодействия вещества с несколькими веществами удобно делать таблицу:
|
H2SO4 |
Mg |
Hg |
HNO3 |
MgO |
|
|
H2SO4 |
— |
MgSO4+H2↑ |
Х |
Х |
MgSO4+H2O |
|
Mg |
MgSO4+H2↑ |
— |
Х |
Водород не выделяется |
Х |
|
Hg |
Х |
Х |
— |
Водород не выделяется |
Х |
|
HNO3 |
Х |
Водород не выделяется |
Водород не выделяется |
— |
Mg(NO3)2+H2O |
|
MgO |
MgSO4+H2O |
Х |
Х |
Mg(NO3)2+H2O |
— |
Вещество не реагирует само с собой, поэтому по диагонали ставим прочерки.
Металлы и оксид магния не будут взаимодействовать между собой с образованием водорода. Обе кислоты будут взаимодействовать с основным оксидом MgO, но будет образовываться соль и вода. Азотная кислота любой концентрации является окислителем не за счет H+, а за счет N+5, поэтому при взаимодействии с металлами водород не выделится. Разбавленная серная кислота с Hg не взаимодействует, так как Hg стоит в ряду активности металлов после водорода, а с Mg выделяется водород.
Правильный ответ: одна реакция.
|
В2. Закончите реакцию взаимодействия между медью и концентрированной азотной кислотой. Коэффициент перед формулой азотной кислоты равен: 1. 2 2. 4 3. 6 4. 8 |
Cu + 4HNO3 = Cu (NO3)2 + 2NO2↑+ 2H2O N+5+е— = N+4 2 Cu0 -2е— = Cu+2 1 Правильный ответ :2. |
|
В3. Какое вещество образуется в результате цепочки превращений: Р В ответ надо записать название вещества. |
4P+5O2 = 2P2O5 P2O5 + 3H2O = 2H3PO4 2NH3 + H3РO4 = (NH4)2НРO4(гидроортофосфат аммония) Правильный ответ: гидроортофосфат аммония |
|
В4. При взаимодействии 6 л азота и 12 л водорода (н.у.) выделилось 2 л аммиака. Найдите выход аммиака от теоретически возможного. |
Объёмы газов относятся как небольшие целые числа. N2+3H2⇆2NH3 Водород находится в недостатке, вести расчёты будем относительно водорода. С 12л Н2 должно было образоваться 8л NH3. Находим теоретический выход Правильный ответ: 25%. |
|
В5. Какое вещество образуется в результате следующих превращений: NH3 |
4NH3+5O2 2NO +О2 ⇄ 2NO2 4NO2+ 2H2O + О2 ⇄ 4HNO3 NH3+ H NO3 = NH4NO3 Правильный ответ: нитрат аммония. |
|
В6. На сгорание 1м3 газа расходуется 3м3 кислорода. При этом образуется 2м3 водяных паров и 2м3 углекислого газа. Укажите молярную массу исходного газа. |
СхНу + 3О2 → 2СО2 + 2Н2О 1м3 3м3 2м3 2 м3 Из уравнения реакции видно, что весь кислород, содержащийся в воде и углекислом газе, берется из молекулярного кислорода, использующегося для окисления. Соответственно, других элементов, кроме углерода и водорода, в исходном газе нет. Значит, это углеводород. х = 2; у = 4, это этилен С2Н4. М (С2Н4) = 28 г/моль. Правильный ответ: 28 г/моль. |
|
В7. Для внесения 14 г азота на 1м2 почвы использовали нитрат аммония. Укажите массу нитрата аммония, необходимого для внесения на 1м2 почвы. |
NH4NO3 в х г содержится 14 г азота в 80г содержится 28 г азота. Решаем пропорцию х= Для внесения 14 г азота на 1м2 почвы нужно внести 40 г нитрата аммония. Правильный ответ: 40г NH4NO3 |
|
В8. Смесь меди и оксида меди (II) массой 38,4 г растворили в концентрированной серной кислоте. При этом выделился оксид серы (IV) объёмом 6,72 л (н.у.). Определите массовую долю оксида меди в смеси (в%). |
Cu + 2H2SO4 = CuSO4 + SO2↑ + 2H2O CuО + H2SO4 = CuSO4 + H2O
Правильный ответ: |
|
В9. Укажите номер периода, некоторые элементы которого образуют вещества с водородными связями. |
Водородные связи могут образовываться только в водородных соединениях наиболее электроотрицательных элементов: N, O, F и других галогенов. N, O, F находятся во втором периоде. Правильный ответ: период №2. |
|
В10. Над разогретым порошком (Х1) пропустили водород. Полученное вещество красного цвета (Х2) растворили в концентрированной серной кислоте. Полученный раствор вещества голубого цвета (Х3) нейтрализовали раствором щелочи KOH, выпал голубой осадок (Х4), который при нагревании превратился в черный порошок (Х1). Укажите молярную массу исходного и полученного вещества. |
Сульфат металла голубого цвета – это СuSO4(X3). Значит, все вещества – это соединения меди. CuSO4 + 2KOH = Cu(OH)2↓ + K2SO4 Cu(OH)2↓ CuO +H2 М(CuO) = 80 г/моль Правильный ответ: М(CuO)=80 г/моль |
3. Задания с развернутым ответом С1-С2
|
Вопрос |
Комментарий |
|
С1. Напишите уравнения реакций, которые нужно провести для осуществления следующих превращений:.
Ca(OCl)2 |
2NaBr + Cl2 → 2NaCl + Br2 NaCl + 2H2O = 2NaOH + H2↑ + Cl2↑ 3Cl2 + 6KOH(горяч., конц.) → 5KCl + KClO3 + 3H2O 2KClO3 2Ca(OH)2 + 2Cl2 → Ca(OCl)2 + CaCl2 + 2H2O |
|
С2. Массовая доля азота в удобрении составляет 14%. Весь азот входит в удобрение в составе мочевины СO(NH2)2. Вычислите массовую долю мочевины в этом удобрении. |
Пусть было 100 г удобрения. Составляем пропорцию. В 1 моль мочевины (60г) содержится 28 г азота В х г мочевины должно содержаться 14 г азота. Решаем пропорцию. х = 30 г. Отсюда следует Правильный ответ: 30%. |
Подведение итога
Вы смогли проверить свои знания по теме «ЕГЭ. Неметаллы». Вы систематизировали и закрепили знания по расширенной теме «Неметаллы», рассмотрев определенные вопросы и разобрав решения задач, которые возможны на Едином государственном экзамене.
- 23.03.2014
Публикуем теоретические и практические задания, которые необходимы при подготовке к ЕГЭ по химии.
Тема: Неметаллы главных подгрупп IV–VII групп
Весь материал соответствует кодификатору ЕГЭ по химии. В конце каждого теоретического блока публикуются практические задания с правильными ответами. Вы можете сразу же проверять качество пройденного материала.
Смотреть в PDF:
Или прямо сейчас: Скачайте в pdf файле.
Добавить комментарий
Комментарии без регистрации. Несодержательные сообщения удаляются.
Тренировочные упражнения по теме «Химические свойства металлов, неметаллов и оксидов» в формате ЕГЭ по химии (тренажер задания 6 ЕГЭ по химии).
Внимание! Перед выполнением тестов я рекомендую внимательно изучить теорию по теме «Химические свойства металлов, неметаллов и оксидов» (теория для решения задания 6 ЕГЭ по химии):
Характерные химические свойства простых веществ–металлов: щелочных, щелочноземельных, магния, алюминия; переходных металлов: меди, цинка, хрома, железа.
Характерные химические свойства простых веществ–неметаллов: водорода, галогенов, кислорода, серы, азота, фосфора, углерода, кремния.
Характерные химические свойства оксидов: основных, амфотерных, кислотных
| Задание 1 | |
| Из предложенного перечня выберите два вещества, с каждым из которых реагирует калий.
|
| Задание 2 | |
| Из предложенного перечня выберите два оксида, которые реагируют с раствором гидроксида калия.
1) CrO Запишите номера выбранных ответов. |
| Задание 3 | |
| Из предложенного перечня выберите два оксида, которые реагируют с водой.
|
| Задание 4 | |
| Из предложенного перечня выберите два вещества, с каждым из которых железо реагирует при обычных условиях.
Запишите номера выбранных ответов. |
| Задание 5 | |
| Из предложенного перечня выберите два вещества, с каждым из которых взаимодействует водород.
|
| Задание 6 | |
| Из предложенного перечня выберите два вещества, с каждым из которых взаимодействует азот.
. |
| Задание 7 | |
| Из предложенного перечня выберите два вещества, с каждым из которых взаимодействует фосфор.
. |
| Задание 8 | |
| Из предложенного перечня выберите два вещества, с каждым из которых взаимодействует оксид меди (II).
. |
| Задание 9 | |
| Из предложенного перечня выберите два вещества, с каждым из которых взаимодействует оксид кальция.
|
| Задание 10 | |
| Из предложенного перечня выберите два вещества, с каждым из которых взаимодействует оксид серы (IV).
|
| Задание 11 | |
| Из предложенного перечня выберите два вещества, с каждым из которых взаимодействует оксид цинка.
|
| Задание 12 | |
| Из предложенного перечня выберите два вещества, с каждым из которых взаимодействует сера.
|
Admin
Цель: работы является проверка знаний по теме « Неметаллы», степень подготовленности учащихся к сдаче экзамена. В работе рассматриваются не только вопросы, связанные с химическими свойствами, но и строение атома, окислительно — восстановительные процессы, реакции ионного обмена, генетическая связь, а также решение задач на разные типы.
На выполнение работы отводится 40 минут. Текстовая контрольная работа состоит из 12 заданий разного уровня сложности.
Скачать варианты заданий и ответы
1 вариант заданий
1. До завершения внешнего энергетического уровня не хватает одного электрона элементу:
- а) селену;
- б) натрию;
- в) бору;
- г) водороду;
2. Степень окисления азота в хлориде аммония соответствует:
- a) +3;
- б) -3;
- в) +4;
- г) -4.
3. Большийрадиус имеет элемент:
- а) кислород;
- б) азот;
- в) углерод;
- г) фтор.
4. Укажите неметалл с атомным типом кристаллической решетки:
- а) кремний;
- б) йод;
- в) кислород;
- г) бром.
5. Укажите пару соединений, которые относятся к кислотному и несолеобразующему оксиду:
- a) В2O3 и СO2;
- б) NO и СО;
- в) CO и N2O3;
- г) SO2 и SO3.
6. Азот имеет валентности:
- a) IV и V ;
- б) IV и III
- в) VI и III;
- г) VI, V, III
Задание 1. Из предложенного перечня выберите вещества, между которыми может протекать окислительно-восстановительная реакция. В ответе укажите только одну окислительно восстановительную реакцию. Составьте электронный баланс, укажите окислитель и восстановитель в этой реакции.
Задание 2. Из предложенного перечня выберите вещества, между которыми может протекать реакция ионного обмена. Запишите молекулярное, полное, сокращенное уравнения только одной из возможных реакций.
Задание 3. К раствору нитрата кальция добавили раствор фосфата натрия. Выпавший осадок отделили, высушили и прокалили в присутствии углерода и оксида кремния. Полученное при этом простое вещество растворили в концентрированном растворе азотной кислоты, при этом выделился бурый газ. Полученный бурый газ поглотили раствором гидроксида бария.
Задание 4. Смесь кремния и cеры массой 21 г обработали избытком концентрированного раствора гидроксида калия. В результате реакции выделился водород в количестве, достаточном для восстановления 32 г Fe2O3 до алюминия. Определите массовую долю кремния в смеси.
2 вариант заданий
1. До завершения внешнего энергетического уровня не хватает одного электрона элементу:
- а) селену;
- б) брому;
- в) бору;
- г) криптону;
2. Меньший радиус имеет элемент:
- а) кислород;
- б) углерод;
- в) азот;
- г) фтор.
3. Какую степень окисления азот проявляет в ионе аммония NH4 + :
- a) +3;
- б) -3;
- в) +4;
- г) — 4
4. Укажите вещество с атомным типом кристаллической решетки:
- а) оксид кремния (IV);
- б) оксид углерода (IV);
- в) оксид углерода (II);
- г) хлорид аммония.
5. Укажите пару соединений, которые относятся к кислотному оксиду и несолеобразующему оксиду:
- a) В2O3 и СO2;
- б) NO2 и СО;
- в) CO2 и N2O3;
- г) SO2 и SO3.
6. Степень окисления -1 всегда проявляет атом:
- а) водорода;
- б) фтора;
- в) хлора;
- г) брома.
Задание 1. Из предложенного перечня выберите вещества, между которыми может протекать окислительно-восстановительная реакция. В ответе укажите только одну окислительно восстановительную реакцию. Составьте электронный баланс, укажите окислитель и восстановитель в этой реакции.
Задание 2. Из предложенного перечня выберите вещества, между которыми может протекать реакция ионного обмена. Запишите молекулярное, полное, сокращенное уравнения только одной из возможных реакций.
Задание 3. Нитрат меди (II) прокалили, через твердый остаток оксид меди (II) пропустили оксид углерода (II). Образовавшееся в результате простое вещество растворили в концентрированном растворе азотной кислоты Полученный в результате бурый газ поглотили раствором гидроксида натрия.
Задание 4. Смесь кремния и углерода массой 10,5 г обработали избытком концентрированного раствора гидроксида натрия. В результате реакции выделился водород в количестве, достаточном для восстановления 20,4 г АI2O3 до алюминия. Определите массовую долю кремния в смеси.
- 10 тренировочный вариант ЕГЭ 2023 по химии задания и ответы
- Тренировочные варианты ЕГЭ по химии
ПОДЕЛИТЬСЯ МАТЕРИАЛОМ
*
Простые вещества — неметаллы.
В простых веществах атомы неметаллов связаны ковалентной неполярной связью. Благодаря этому формируется более устойчивая электронная система, чем у изолированных атомов. При этом образуются одинарные (например, в молекулах водорода $Н_2$, галогенов $F_2, Br_2, I_2$), двойные (например, в молекулах серы $S_2$), тройные (например, в молекулах азота $N_2$) ковалентные связи.
Как вам уже известно, простые вещества — неметаллы могут иметь:
- Молекулярное строение. При обычных условиях большинство таких веществ представляют собой газы ($H_2, N_2, O_2, F_2, Cl_2, O_3$) или твердые вещества ($I_2, P_4, S_8$), и лишь один-единственный бром ($Br_2$) является жидкостью. Все эти вещества имеют молекулярное строение, поэтому летучи. В твердом состоянии они легкоплавки из-за слабого межмолекулярного взаимодействия, удерживающего их молекулы в кристалле, и способны к возгонке.
- Атомное строение. Эти вещества образованы длинными цепями атомов ($Cn, Bn, Sin, Sen, Ten$). Из-за большой прочности ковалентных связей они, как правило, имеют высокую твердость, и любые изменения, связанные с разрушением ковалентной связи в их кристаллах (плавление, испарение), совершаются с большой затратой энергии. Многие такие вещества имеют высокие температуры плавления и кипения, а летучесть их весьма мала.
Многие элементы-неметаллы образуют несколько простых веществ — аллотропных модификаций. Как вы помните, это свойство атомов называют аллотропией. Аллотропия может быть связана и с разным составом молекул ($О_2, О_3$), и с разным строением кристаллов. Аллотропными модификациями углерода являются графит, алмаз, карбин, фуллерен.
Элементы-неметаллы, обладающие свойством аллотропии, обозначены в схеме звездочкой. Так что простых веществ — неметаллов гораздо больше, чем химических элементов — металлов. Вы знаете, что для большинства металлов, за редким исключением (золото, медь и некоторые другие), характерна серебристо-белая окраска. А вот у простых веществ — неметаллов гамма цветов значительно разнообразнее: $P, Se{аморф.}$ — желтые; $Bа{морф.}$ — коричневый; $О{2(ж)}$ — голубой; $Si, As{мет.}$ — серые; $Р_4$ — бледно-желтый; $I{1(г)}$ — фиолетово-черный с металлическим блеском; $Br{2(ж)}$ — бурая жидкость; $Cl{2(г)}$ — желто-зеленый; $F{2(г)}$ — бледно-зеленый; $S{8(т)}$ — желтая.
Несмотря на большие различия в физических свойствах неметаллов, все-таки нужно отметить и некоторые их общие черты. Все газообразные вещества, жидкий бром, а также типичные ковалентные кристаллы — диэлектрики, т.к. все внешние электроны их атомов использованы для образования химических связей. Кристаллы непластичны, и любая деформация вызывает разрушение ковалентных связей. Большинство неметаллов не имеют металлического блеска.
Общие химические свойства неметаллов.
Как мы уже отмечали, для атомов неметаллов, а следовательно, и для образованных ими простых веществ характерны как окислительные, так и восстановительные свойства.
Окислительные свойства простых веществ — неметаллов.
1. Окислительные свойства неметаллов проявляются, в первую очередь, при их взаимодействии с металлами (как вы знаете, металлы — всегда восстановители):
Окислительные свойства хлора $Cl_2$ выражены сильнее, чем у серы, поэтому и металл $Fe$, который имеет в соединениях устойчивые степени окисления $+2$ и $+3$, окисляется им до более высокой степени окисления.
2. Большинство неметаллов проявляют окислительные свойства при взаимодействии с водородом. В результате образуются летучие водородные соединения:
3. Любой неметалл выступает в роли окислителя в реакциях с теми неметаллами, которые имеют более низкое значение электроотрицательности:
Электроотрицательность серы больше, чем у фосфора, поэтому она здесь проявляет окислительные свойства:
Электроотрицательность фтора больше, чем у всех остальных химических элементов, поэтому он проявляет свойства окислителя.
Фтор $F_2$ — самый сильный окислитель из неметаллов, проявляет в реакциях только окислительные свойства.
4. Окислительные свойства неметаллы проявляют и в реакциях с некоторыми сложными веществами.
Отметим, в первую очередь, окислительные свойства неметалла кислорода в реакциях со сложными веществами:
а)${C}↖{-4}H_4+2{O_2}↖{0}→{C}↖{+4}{O_2}↖{-2}+2H_2{O}↖{-2}$
восстановитель ${C}↖{-4}-8{e}↖{-}→{C}↖{+4}|1$
окислитель ${O_2}↖{0}+4{e}↖{-}→2{O}↖{-2}|2$
б)$2{S}↖{+4}O_2+{O_2}↖{0}{→}↖{t°,кат.}2{S}↖{+6}{O_3}↖{-2}$
восстановитель ${S}↖{+4}-2{e}↖{-}→{S}↖{+6}|1$
окислитель ${O_2}↖{0}+4{e}↖{-}→2{O}↖{-2}|2$
Не только кислород, но и другие неметаллы также могут быть окислителями в реакциях со сложными веществами — неорганическими (а, б) и органическими (в, г):
а)$2{Fe}↖{+2}{Cl_2}↖{-1}+{Cl_2}↖{0}=2{Fe}↖{+3}{Cl_3}↖{-1}$
восстановитель ${Fe}↖{+2}-1{e}↖{-}→{Fe}↖{+3}|2$
окислитель ${Cl_2}↖{0}+2{e}↖{-}→2{Cl}↖{-}|1$
Сильный окислитель хлор $Cl_2$ окисляет хлорид железа (II) в хлорид железа (III);
б)$2{K}↖{+1}{I}↖{-1}+{Cl_2}↖{0}={K}↖{+1}{Cl}↖{-1}+{I_2}↖{0}$
восстановитель $2{I}↖{-1}-2{e}↖{-}→{I_2}↖{0}|1$
окислитель ${Cl_2}↖{0}+2{e}↖{-}→2{Cl}↖{-1}|1$
Хлор $Cl_2$ как более сильный окислитель вытесняет иод $I_2$ в свободном виде из раствора иодида калия;
в)${C}↖{-4}H_4+{Cl_2}↖{0}{→}↖{свет}{CH_3}↖{-2}{Cl}↖{-1}+H{Cl}↖{-1}$
восстановитель ${C}↖{-4}-2{e}↖{-}→{C}↖{-2}|1$
окислитель ${Cl_2}↖{0}+2{e}↖{-}→2{Cl}↖{-1}|1$
Галогенирование метана — характерная реакция для алканов;
г)${C}↖{-2}H_2{=}↙{водный р-р}{C}↖{-2}H_2+{Br_2}↖{0}→{C}↖{-1}H_2{Br}↖{-1}-{C}↖{-1}H_2{Br}↖{-1}$
восстановитель ${C}↖{-2}-1{e}↖{-}→{C}↖{-1}|2$
окислитель ${Br_2}↖{0}+2{e}↖{-}→2{Br}↖{-1}|1$
Вы помните, конечно, качественную реакцию на непредельные соединения — обесцвечивание бромной воды.
Восстановительные свойства простых веществ — неметаллов. При рассмотрении реакций неметаллов друг с другом мы уже отмечали, что, в зависимости от значения их электроотрицательности, один из них проявляет свойства окислителя, а другой — свойства восстановителя.
1. По отношению ко фтору все неметаллы (даже кислород) проявляют восстановительные свойства.
2. Разумеется, неметаллы, кроме фтора, служат восстановителями при взаимодействии с кислородом:
В результате реакций образуются оксиды неметаллов: несолеобразующие и солеобразующие кислотные. И хотя галогены непосредственно с кислородом не соединяются, известны их оксиды: ${Cl_2}↖{+1}{O}↖{−2}, {Cl}↖{+4}{O_2}↖{-2}, {Cl_2}↖{+7}{O_7}↖{-2}, {Br_2}↖{+1}{O}↖{-2}, {Br}↖{+4}{O_2}↖{-2}, {I_2}↖{+5}{O_5}↖{-2}$ и др., которые получают косвенным путем.
3. Многие неметаллы могут выступать в роли восстановителя в реакциях со сложными веществами — окислителями:
а)${H_2}↖{0}+{{Cu}↖{+2}O}↙{оксид}{→}↖{t°}{Cu}↖{0}+{H_2}↖{+1}C$
восстановитель ${H_2}↖{0}-2{e}↖{-}→2{H}↖{+1}|1$
окислитель ${Cu}↖{+2}+2{e}↖{-}→{Cu}↖{0}|1$
б)$6{P}↖{0}+5{K{Cl}↖{+5}O_3}↙{соль}{→}↖{t}5K{Cl}↖{-1}+3{P_2}↖{+5}O_5$
восстановитель ${P}↖{0}-5{e}↖{-}→{P}↖{+5}|6$
окислитель ${Cl}↖{+5}+6{e}↖{-}→{Cl}↖{-1}|5$
в)${C}↖{0}+4{H{NO}↖{+5}O_3}↙{кислота}{→}↖{t°}{C}↖{+4}O_2↑+4{N}↖{+4}O_2↑+2H_2O$
восстановитель ${C}↖{0}-4{e}↖{-}→{C}↖{+4}|1$
окислитель ${N}↖{+5}+1{e}↖{-}→{N}↖{+4}|4$
г)
восстановитель ${H_2}↖{0}-2{e}↖{-}→{2H}↖{+}|1$
окислитель ${C}↖{0}+2{e}↖{-}→{C}↖{-2}|1$
Существуют и такие реакции, в которых один и тот же неметалл является одновременно и окислителем, и восстановителем. Это реакции самоокисления-самовосстановления (диспропорционирования):
а)${Cl_2}↖{0}+H_2O⇄H{Cl}↖{-1}+H{Cl}↖{+1}O$
восстановитель ${Cl}↖{0}-1{e}↖{-}→{Cl}↖{+1}|1$
окислитель ${Cl}↖{0}+1{e}↖{-}→{Cl}↖{-1}|1$
б)$3{Cl_2}↖{0}+6KOH=5K{Cl}↖{-1}+K{Cl}↖{+5}O_3+2H_2O$
восстановитель ${Cl}↖{0}-5{e}↖{-}→{Cl}↖{+5}|1$
окислитель ${Cl}↖{0}+1{e}↖{-}→{Cl}↖{-1}|5$
Итак, подведем итоги. Большинство неметаллов могут выступать в химических реакциях как в роли окислителя, так и в роли восстановителя (восстановительные свойства не присущи только фтору $F_2$).
Водородные соединения неметаллов. Общим свойством всех неметаллов является образование летучих водородных соединений, в большинстве из которых неметалл имеет низшую степень окисления.
| Период | Группа | ||||
| III | IV | V | VI | VII | |
| $2$ | ${B_2H_6}↙{диборан}$ | $ {CH_4}↙{метан}$ | $ {NH_3}↙{аммиак}$ | $ {H_2O}↙{вода}$ | $ {HF}↙{фтороводород}$ |
| $3$ | ${SiH_4}↙{силан}$ | $PH_3↙{фосфин}$ | ${H_2S}↙{сероводород}$ | ${HCl}↙{хлороводород}$ | |
| $4$ | ${AsH_3}↙{арсин}$ | ${H_2Se}↙{селеноводород}$ | ${HBr}↙{бромоводород}$ | ||
| $5$ | ${H_3Te}↙{теллуроводород}$ | ${HI}↙{йодоводород}$ |
Среди приведенных формул веществ много таких, свойства, применение и получение которых вы изучали ранее: $CH_4, NH_3, H_2O, H_2S, HCl$.
Известно, что наиболее просто эти соединения можно получить непосредственно взаимодействием неметалла с водородом, т.е. синтезом:
$table 1.H_2+Cl_2=2HCl; 2.N_2+3H_2⇄2NH_3;}$ В промышленности так получают хлороводород и аммиак.
$table 3.C+2H_2=CH_4; 4.2H_2+O_2=2H_2O; 5.H_2+S⇄H_2S;}$ Синтезы метана, воды и сероводорода имеют в основном теоретическое значение.
Все водородные соединения неметаллов образованы ковалентными полярными связями, имеют молекулярное строение и при обычных условиях являются газами, кроме воды (жидкость).
Для водородных соединений неметаллов характерно различное отношение к воде. Метан и силан в ней практически нерастворимы. Аммиак при растворении в воде образует слабое основание — $NH_3·H_2O$.
При растворении в воде сероводорода, селеноводорода, теллуроводорода, а также галогеноводородов образуются кислоты с той же формулой, что и сами водородные соединения: $H_2S, H_2Se, H_2Te, HF, HCl, HBr, HI$.
Если сравнить кислотно-основные свойства водородных соединений, образованных неметаллами одного периода, например, второго ($NH_3, H_2O, HF$) или третьего ($PH_3, H_2S, HCl$), то можно сделать вывод о закономерном усилении их кислотных свойств и, соответственно, ослаблении основных. Это, очевидно, связано с тем, что увеличивается полярность связи Э—Н (где Э — неметалл).
Кислотно-основные свойства водородных соединений неметаллов одной подгруппы также отличаются. Например, в ряду галогеноводородов $HF, HCl, HBr, HI$ прочность связи Э—Н уменьшается, т. к. увеличивается длина связи. В растворах $HCl, HBr, HI$ диссоциируют практически полностью — это сильные кислоты, причем их сила увеличивается от $HF$ к $HI$. При этом $HF$ относится к слабым кислотам, что обусловлено еще одним фактором — межмолекулярным взаимодействием, образованием водородных связей $…Н—F…H—F…$. Атомы водорода связаны с атомами фтора $F$ не только своей молекулы, но еще и соседней.
Обобщая сравнительную характеристику кислотно-основных свойств водородных соединений неметаллов, сделаем вывод об усилении кислотных и ослаблении основных свойств этих веществ по периодам и главным подгруппам с увеличением атомных номеров образующих их элементов.
Кроме рассмотренных свойств, водородные соединения неметаллов в окислительно-восстановительных реакциях всегда проявляют свойства восстановителей, ведь в них неметалл имеет низшую степень окисления.
*
*
Химические свойства водорода.
В свободном состоянии водород существует в виде молекул $H_2$, атомы связаны в молекулу ковалентной неполярной связью.
Водород ($Н$) — самый легкий газ из всех газообразных веществ. Имеет самую высокую теплопроводность и самую низкую температуру кипения (после гелия). Малорастворим в воде. При температуре $–252,8°С$ и атмосферном давлении водород переходит в жидкое состояние.
1. Молекула водорода очень прочная, что делает ее малоактивной:
$H_2=2H – 432$ кДж$.
2. При обычных температурах водород вступает в реакцию с активными металлами:
$Ca+H_2=CaH_2$,
образуя гидрид кальция, и с $F_2$, образуя фтороводород:
$F_2+H_2=2HF$.
3. При высоких температурах получают аммиак:
$N_2+3H_2=2NH_3$.
и гидрид титана (металл в порошке):
$Ti+H_2=TiH_2$.
4. При поджигании водород реагирует с кислородом:
$2H_2+O_2=2H_2O+484 кДж$.
5. Водород обладает восстановительной способностью:
$CuO+H_2=Cu+H_2O$.
Химические свойства галогенов: хлор, бром, йод.
У галогенов наиболее ярко выражены свойства неметаллов.
Внешний энергетический уровень у атомов галогенов содержит семь электронов, что соответствует номеру группы Периодической системы — VII. Два электрона занимают s-орбиталь, пять — $p$-орбитали. Для элементов этой группы при увеличении числа заполненных электронами уровней размер атомов возрастает, а прочность связи с ядром снижается.
Молекулы галогенов двухатомные ($Cl_2, Br_2, I_2$). Галогены — вещества молекулярного строения. Температуры плавления и кипения веществ, состоящих из молекул, повышаются с увеличением молекулярной массы этих веществ. Хлор — газ желто-зеленого цвета, бром — красно-коричневая жидкость, йод — твердое вещество серо-фиолетового цвета. Водные растворы галогенов в воде называют хлорной, бромной и йодной водой.
1. Галогены — сильные окислители. Они окисляют простые и сложные вещества:
2. По окислительной активности каждый вышестоящий в Периодической таблице галоген является более сильным по отношению к нижестоящему. Поэтому каждый галоген вытесняет любой нижестоящий из его соединений:
3. Галогены активно реагируют с неметаллами:
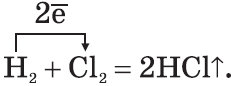
4. Галогены реагируют с водой, образуя атомарный кислород:
$H_2O+Cl_2=2HCl+O; O+O=O_2$.
5. Галогены очень активны в присутствии воды. Так, сухой хлор хранят в железных баллонах, а во влажном хлоре железо быстро ржавеет (совместное действие с водой продуктов реакции — кислоты и атомарного кислорода).
Водный раствор хлороводорода $HCl$ называют соляной, или хлороводородной, кислотой. Ей присущи все свойства кислот. Соляная кислота принимает участие в пищеварении живых организмов. В огромных масштабах соляная кислота используется во многих отраслях промышленности: химической, нефтедобывающей и нефтеперерабатывающей.
*
*
Химические свойства кислорода.
Кислород ($O$) — самый распространенный элемент на Земле. Он находится в атмосфере ($21%$ по объему), в земной коре ($92%$), в гидросфере ($89%$).
Кислород находится в VI группе Периодической системы, в главной подгруппе. Кислород проявляет во всех соединениях валентность II. Это низшая валентность из шести возможных в этой группе.
Кислород образует молекулы O2. Это газ без запаха, цвета и вкуса. Плотность кислорода при $0°С$ и давлении $1$ атм. $1,43$ г/л, что в $1,11$ раза больше плотности воздуха. Кислород малорастворим в воде. При $20°С$ и атмосферном давлении в $100$ объемах воды растворяется $3$ объема $O_2$. Температура кипения кислорода равна $–183°С$; при этой температуре и давлении $1$ атм. кислород превращается в жидкость голубого цвета.
Кислород является одним из самых активных веществ, легко вступающих в химические реакции.
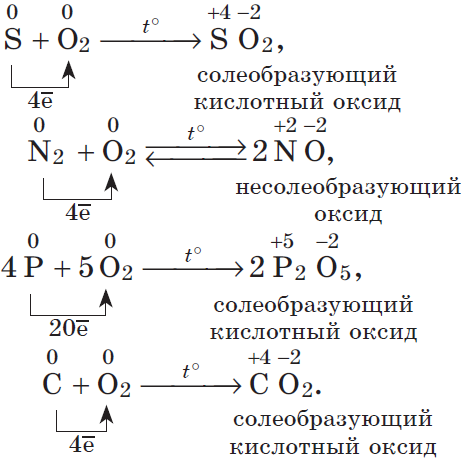
Взаимодействие веществ с кислородом называется реакцией окисления этих веществ. Кислород принимает участие в таких окислительных процессах: горение, дыхание, ржавление металлов, гниение растительных и животных останков.
Реакции окисления, сопровождающиеся выделением теплоты и света, называются реакциями горения:
а) горение простых веществ:
— неметаллов:
$C+O_2=CO_2; S+O_2=SO_2; 4P+5O_2=2P_2O_5;$
— металлов:
$3Fe+2O_2=Fe_3O_4$, или $FeO·Fe_2O_3$.
Эти процессы горения происходят быстро. Возможно и медленное горение — окисление:
$2Cu+O_2=2CuO$;
б) горение сложных веществ:
$2{C_2H_2}↙{ацетилен}+5O_2→4CO_2+2H_2O$
У кислорода есть аллотропная модификация — озон $O_3$. Он образуется под воздействием солнечного излучения или электрического разряда:
Озон обладает запахом свежести. Разный состав молекул кислорода и озона определяет их разные свойства. Молекула озона очень непрочная, легко вступает в химические реакции. Озон проявляет сильные окислительные свойства, разрушает органические вещества (резину), окисляет металлы ($Au, Pt, Ag$):
${Ag+O_3=AgO+O_2↑}↙{text «(с кислородом серебро не реагирует)» }$
Химические свойства серы.
Атомы серы, как и атомы кислорода, имеют на внешнем энергетическом уровне $6{e}↖{-}$, два из них — неспаренные. Однако по сравнению с атомами кислорода атомы серы имеют больший радиус, меньшее значение электроотрицательности, поэтому проявляют восстановительные свойства, образуя соединения со степенями окисления $+2,+4,+6$. По отношению к водороду и металлам сера проявляет окислительные свойства со степенью окисления $–2$.
Сера ($S$) — твердое кристаллическое вещество желтого цвета, имеет молекулярную кристаллическую решетку, легко плавится, в воде нерастворима. Для серы характерна аллотропия. Ромбическая сера $S_8$ — стабильная модификация. Образует кристаллы октаэдрической формы лимонно-желтого цвета с $t°{пл}=112,8°С$. Моноклинная сера имеет игольчатые кристаллы с $t°{пл}=119,3°С$, легко переходит в ромбическую. Пластическая сера имеет линейное строение молекул, темно-коричневый цвет. Ее получают при выливании расплавленной при $160°С$ серы в холодную воду — образуется резиноподобная темно-коричневая масса.
В таблице обобщены химические свойства серы и ее соединений.
Сера и ее соединения.
| Сера | Соединения серы | |
| Оксиды серы | Серная кислота | |
| 1. При обычных условиях — твердое желтое кристаллическое вещество. 2. Горит в кислороде: $S+O_2=SO_2$ (проявляет восстановительные свойства). 3. Взаимодействует с металлами и водородом: $Fe+S=FeS$ $H_2+S=H_2S$ (проявляет окислительные свойства) В природе самородная сера $S$, сульфиды: $FeS_2$ (пирит), $CuS$; сульфаты: $CaSO_4·2H_2O$ (гипс), $Na_2SO_4$ |
1. При обычных условиях $SO_2$ — газ, $SO_3$ — жидкое вещество ($t°*{пл}=16,8°С$). 2. Проявляют свойства кислотных оксидов, взаимодействуя: — с водой: $SO_2+H_2O⇄H_2SO_3$ $SO_3+H_2O=H_2SO_4$ — со щелочами: $SO_2+2NaOH=Na_2SO_3+H_2O$ $SO_3+2NaOH=Na_2SO_4+H_2O$ — с основными оксидами: $SO_3+CaO=CaSO_4$ Получение: 1) оксида серы (IV) а) в промышленности: — горение серы $S+O_2=SO_2$ — обжиг пирита $4FeS_2+11O_2=2Fe_2O_3+8SO_2$ б) в лаборатории: $Na_2SO_3+H_2SO_4=Na_2SO_4+SO_2↑+H_2O$; 2) оксида серы (VI) в промышленности — каталитическое окисление оксида серы (IV): $2SO_2+O_2=2SO_3$ |
1. При обычных условиях — бесцветная тяжелая жидкость ($ρ≈2 г/см^3$), неограниченно растворимая в воде. 2. Сильная двухосновная кислота: $H_2SO_4=H^{+}+HSO_4^{-}⇄2H^{+}+SO_4^{2-}$ 3. Взаимодействует с металлами: $Zn+H_2SO_4=ZnSO_4+H_2↑$ В концентрированной кислоте пассивируются $Al$ и $Fe$. 4. Взаимодействует со щелочами, основаниями и амфотерными гидроксидами: $H_2SO_4+2NaOH=Na_2SO_4+2H_2O$ $H_2SO_4+Cа(OH)_2=CаSO_4+2H_2O$ $3H_2SO_4+2Al(OH)_3=Al_2(SO_4)_3+6H_2O$ 5. Взаимодействует с основными и амфотерными оксидами: $H_2SO_4+CuO=CuSO_4+H_2O$ $H_2SO_4+ZnO=ZnSO_4+H_2O$ 6. Концентрированная кислота гигроскопична: 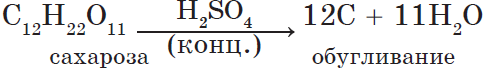 Получение в промышленности в соответствии со схемой: $FeS_2(или S){→}↖{O_2}SO_2{→}↖{O_2}SO_3{→}↖{H_2O}H_2SO_4$ |
Химические свойства азота.
Азот ($N$) — первый представитель главной подгруппы V группы Периодической системы. Его атомы содержат на внешнем энергетическом уровне пять электронов, из которых три — неспаренные. Значит, атомы азота могут присоединять три электрона, завершая внешний энергетический уровень, и вследствие этого приобретают степени окисления $–3$ в соединениях с водородом (аммиак $NH_3$) и с металлами (нитриды $Li_3N, Mg_3N_2$).
Отдавая свои внешние электроны более электроотрицательным элементам (фтору, кислороду), атомы азота приобретают степени окисления $+3$ и $+5$. Атомы азота проявляют восстановительные свойства в степенях окисления $+1, +2, +4$.
Азот существует в свободном состоянии в виде молекулы $N_2$, атомы связаны прочной ковалентной связью $N≡N$. Азот — бесцветный газ без запаха и вкуса, в атмосфере его содержится $78%$. Азот — составная часть живых организмов.
Важнейшими соединениями азота являются аммиак, азотная кислота и ее соли. Азотная кислота и аммиак производятся в промышленности в больших объемах, т.к. соли ($NH_4NO_3, KNO_3$) являются удобрениями. Азотная кислота используется для получения красителей, пластмасс, взрывчатых веществ, лекарств.
Азот — жизненно важный элемент, поэтому круговорот азота в природе обеспечивает им атмосферу, почву, растительные и живые организмы.
В таблице обобщены химические свойства азота и его соединений.
Азот и его соединения.
| Азот | Соединения азота | ||
| Аммиак | Оксиды азота | Азотная кислота | |
| 1. Очень прочная и поэтому малореакционноспособная молекула. 2. Проявляет окислительные свойства (в реакциях с водородом и металлами): $N_2+3H_2⇄2NH_3$ $N_2+3Mg=Mg_3N_2 3. Проявляет восстановительные свойства (в реакции с кислородом): $N_2+O_2=2NO$ Получение 1. В промышленности ректификацией жидкого воздуха. 2. В лаборатории термическим разложением нитрита аммония: $NH_4NO_2→↖{t°}N_2+2H_2O$ |
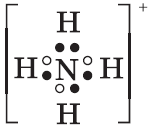
1. При н.у. бесцветный, резко пахнущий газ. 2. Взаимодействует с водой, образуя раствор слабого основания: $NH_3+H_2O⇄NH_4^{+}+OH^{–}$ 3. Схема электронного строения иона аммония: 4. Взаимодействует с кислотами: $NH_3+H^{+}=NH_4^+$ 5. Проявляет восстановительные свой ства: $2NH_3+3CuO{→}↖{t°}3Cu+3H_2O+N_2$ $4NH_3+3O_2=2N_2+6H_2O$ $4NH_3+5O_2{→}↖{кат}4NO+6H_2O$ Получение 1. В промышленности: $N_2+3H_2⇄2NH_3+92кДж$ 2. В лаборатории: $2NH_4Cl+Ca(OH)_2=CaCl_2+2NH_3↑+2H_2O$ |
1. Оксид азота (II) окисляется кислородом воздуха при комнатной температуре:
$2NO+O_2=2NO_2$ 2. Оксид азота (IV) взаимодействует с водой в присутствии кислорода: $4NO_2+O_2+2H_2O=4HNO_3$ Образуются при взаимодействии: 1) азота с кислородом при высокой температуре или в условиях электрического разряда: $N_2+O_2=2NO$ 2) аммиака с кислородом в присутствии катализатора: $4NH_3+5O_2{→}↖{кат}4NO+6H_2O;$ 3) меди с азотной кислотой: а) концентрированной: $Cu+4HNO_3=Cu(NO_3)_2+2NO_2↑+2H_2O;$ б) разбавленной: $3Cu+8HNO_3=3Cu(NO_3)_2+2NO↑+4H_2O$ |
1. Неустойчива, разлагается под действием света:
$4HNO_3=2H_2O+4NO_2↑+O_2↑$ 2. Является сильной кислотой, диссоциирует необратимо в водном растворе: $HNO_3+H_2O=H_3O^{+}+NO_3^−$ 3. Взаимодействует с основными оксидами: $CаO+2HNO_3=Cа(NO_3)_2+H_2O$ $CаO+2H^{+}=Cа^{2+}+H_2O$ 4. Взаимодействует с основаниями: $Fe(OH)_3+3HNO_3=Fe(NO_3)_3+3H_2O$ $Fe(OH)*3+3H^{+}=Fe^{3+}+3H_2O$ 5. Реагирует с металлами без выделения водорода и по-разному — в зависимости от концентрации кислоты и активности металла. Получение 1. В промышленности взаимодействием оксида азота (IV) с водой и кислородом: $4NO_2+O_2+2H_2O=4HNO_3$ 2. В лаборатории вытеснением из солей нелетучей кислотой при нагревании: $2NaNO*{3,кр}+H_2SO_4=2HNO_3+Na_2SO_4$ |
Химические свойства фосфора.
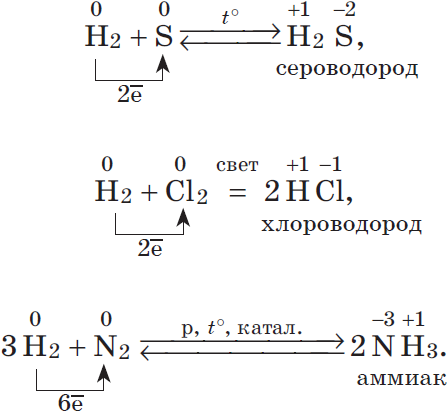
Фосфор ($P$) — аналог азота. Однако атом фосфора характеризуется большим радиусом, меньшим значением электроотрицательности и более выраженными восстановительными свойствами. У фосфора реже встречается степень окисления $–3$ (только в фосфидах $Ca_3P_2, Na_3P$), чаще фосфор в соединениях имеет степень окисления $+5$, а вот соединение фосфин ($PH_3$) — тот редкий случай, когда ковалентная связь между атомами разных элементов неполярная, т.к. электроотрицательности фосфора почти одинаковы.
Химический элемент фосфор образует несколько аллотропных модификаций. Рассмотрим два простых вещества фосфора: белый фосфор и красный фосфор. Белый фосфор имеет молекулярную кристаллическую решетку из молекул $P_4$. Он в порошкообразном состоянии воспламеняется, светится в темноте, ядовит. Красный фосфор имеет атомную кристаллическую решетку, окисляется на воздухе медленно, нерастворим, неядовит, не светится. Химические свойства фосфора и его соединений представлены в таблице.
В природе фосфор в свободном виде не встречается — только в виде соединений.
Фосфор также является составной частью тканей организма человека, животных и растений.
Фосфор и его соединения.
| Фосфор | Соединения фосфора | |
| Оксид фосфора (V) | Фосфорная кислота | |
| 1. При обычных условиях может существовать в виде двух аллотропных модификаций: красный и белый.
2. Горит в кислороде: $4P+5O_2=2P_2O_5$ (проявляет восстановительные свойства). Белый фосфор окисляется на воздухе при комнатной температуре: $P_4+3O_2=2P_2O_3$ Получение $2Ca_3(PO_4)_2+10C+6SiO_2=P_4↑+10CO↑+6CaSiO_3–Q$ |
1. При обычных условиях очень гигроскопическое твердое вещество белого цвета.
2. Проявляет свойства кислотных оксидов, взаимодействуя — с водой: $P_2O_5+3H_2O=2H_3PO_4$ — со щелочами: $P_2O_5+6NaOH=2Na_3PO_4+3H_2O$ — с основными оксидами: $P_2O_5+3CaO=Ca_3(PO_4)_2$ Получение Сжигание фосфора в избытке воздуха: $4P+5O_2=2P_2O_5$ |
1. При обычных условиях бесцветное твердое вещество, неограниченно растворимое в воде.
2. Слабая трехосновная кислота: $H_3PO_4⇄H^{+}+H_2PO_4^{-}⇄2H^{+}+HPO_4^{2−}⇄3H^{+}PO_4^{3−}$ 3. Взаимодействует со щелочами, основаниями и амфотерными гидроксидами, а также с аммиаком: $H_3PO_4+3NaOH=Na_3PO_4+3H_2O$ $2H_3PO_4+3CaO=Ca_3(PO_4)_2+3H_2O$ $Ca_3(PO_4)_2+4H_3PO_4=3Ca(H_2PO_4)_2$ 1) по реакции оксида фосфора (V) с водой: $P_2O_5+3H_2O=2H_3PO_4;$ $Ca_3(PO_4)_2+3H_2SO_4{→}↖{t°}3CaSO_4+2H_3PO_4$ |
Химические свойства углерода.
Углерод ($C$) — первый элемент главной подгруппы IV группы Периодической системы. На его высшем энергетическом уровне $4$ электрона, поэтому его атомы могут принимать четыре электрона, приобретая степень окисления $–4$, т.е. проявлять окислительные свойства, и отдавать свои электроны, проявляя восстановительные свойства, приобретая степень окисления $+4$.
О свойствах аллотропных модификаций алмаза и графита мы уже говорили ранее. Химические свойства углерода и его соединений обобщены в таблице.
Углерод — это особый химический элемент. Он — основа многообразия органических соединений, из которых построены все живые организмы на планете.
Углерод и его соединения.
| Углерод | Соединения углерода | |
| Оксид углерода (IV) | Угольная кислота | |
| 1. Имеет аллотропные модификации: алмаз, графит, карбин, фуллерен. 2. Проявляет восстановительные свойства: а) горит в кислороде: $C+O_2=CO_2+Q$ неполное сгорание: $2C+O_2=2CO+Q;$ б) взаимодействует с оксидом углерода (IV), образуя ядовитое вещество — угарный газ: $C+CO_2=2CO;$ в) восстанавливает металлы из их оксидов: $C+2CuO=CO_2+2Cu$ Получение Неполное сжигание метана: $CH_4+O_2=C+2H_2O$ |
1. Газ без запаха, цвета и вкуса, тяжелее воздуха. 2. Кислотный оксид. 3. При растворении взаимодействует с водой: $CO_2+H_2O⇄H_2CO_3$ 4. Реагирует с основаниями (известковая вода при его пропускании мутнеет): $CO2+Ca(OH)_2=CaCO_3↓+H_2O$ 5. Реагирует с основными оксидами: $CO_2+CaO=CaCO_3$ 6. Образуется в реакциях: — горения углерода в кислороде: $C+O_2=CO_2$ — окисления оксида углерода (II): $2CO+O_2=2CO_2$ — сгорания метана: $CH_4+2O_2=CO_2+2H_2O$ — взаимодействия кислот с карбонатами: $CaCO_3+2HCl=CaCl_2+CO_2↑+H_2O$ — термического разложения карбонатов и гидрокарбонатов: $CaCO_3=CaO+CO_2↑$ $2NaHCO_3=Na_2CO_3+CO_2↑+H_2O$ — окислительных биохимических процессов дыхания, гниения |
1. Непрочная молекула. Слабая двухосновная кислота. Равновесие в водном растворе: $CO_2+H_2O⇄H_2CO_3⇄H^{+}+HCO_3^{−}⇄2H^{+}+CO_3^{2−}$ 2. Взаимодействует с растворами щелочей как раствор углекислого газа в воде с образованием кислых (гидрокарбонатов) и средних (карбонатов) солей: $CO_2+NaOH=NaHCO_3$ $CO_2+2NaOH=Na_2CO_3+H_2O$ 3. Вытесняется из солей более сильными кислотами: $CaCO_3+2HCl=CaCl_2+CO_2↑+H_2O$ 4. Соли угольной кислоты подвергаются гидролизу: $2Na^{+}+CO_3^{2−}+H_2O⇄2Na^{+}+HCO_3^{−}+OH^{–}$ $CO_3^{2−}+H_2O⇄HCO_3^{−}+OH^–$ |
Химические свойства кремния.
Кремний ($Si$) — второй представитель главной подгруппы IV группы. По распространенности в природе кремний — второй после кислорода. Наиболее распространенными соединениями кремния являются диоксид кремния $SiO_2$ — кремнезем и силикаты.
Кристаллический кремний имеет структуру алмаза, очень хрупок, относится к тугоплавким веществам. При обычных условиях инертен, что объясняется прочностью его кристаллической решетки. В таблице обобщены химические свойства кремния и его соединений.
Соединения кремния служат основой производства стекла и цемента. Состав оконного стекла: $Na_2O·CaO·6SiO_2$.
Кремний и его соединения.
| Кремний | Соединения кремния | |
| Оксид кремния (IV) | Кремниевая кислота | |
| 1. Обладает полупроводниковыми свойствами. 2. Горит в кислороде: $Si+O_2=SiO_2+Q$ Получение — Восстановление оксида кремния (IV) углеродом (в промышленности): $SiO_2+2C=Si+2CO$ — порошком магния (в лаборатории): $SiO_2+2Mg=Si+2MgO$ |
1. Твердое бесцветное прозрачное вещество, легко затвердевающее в виде стекла. 2. В воде не растворяется и с водой не реагирует. 3. Как кислотный оксид взаимодействует с: а) щелочами: $SiO_2+2NaOH=Na_2SiO_3+H_2O;$ б) основными оксидами: $SiO_2+CaO=CaSiO_3$ 4. Вытесняет из солей летучие кислоты (реакции, лежащие в основе варки стекла): $SiO_2+Na_2CO_3=Na_2SiO_3+CO_2↑$ $SiO_2+CaCO_3=CaSiO_3+CO_2↑$ |
1. Очень слабая двухосновная не растворимая в воде кислота состава $mSiO_2·nH_2O(H_2SiO_3)$ 2. Разлагается уже при несильном нагревании: $H_2SiO_3=SiO_2+H_2O$ 3. Соли кремниевой кислоты (силикаты) подвергаются гидролизу: $4Na^{+}+2SiO_3^{2-}+2H_2O⇄4Na^{+}+Si_2O_5^{2−}+2OH^–$ $2SiO_3^{2-}+2H_2O⇄Si_2O_5^{2−}+2OH^–$ Получение Действие кислот на растворимые силикаты: $Na_2SiO_3+2HCl=2NaCl+H_2SiO_3↓$ |


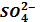 можно использовать раствор, содержащий ионы:
можно использовать раствор, содержащий ионы: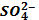 является реакция с растворимыми солями бария.
является реакция с растворимыми солями бария.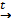 2NH3↑ + 2H2O + Сa(NO3)2.
2NH3↑ + 2H2O + Сa(NO3)2.
 …
…  …
… 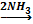 ?
?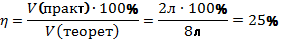
 …
… 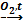 …
… 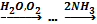 …?
…?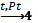 NO+6H2O
NO+6H2O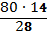 ; х = 40 (г).
; х = 40 (г).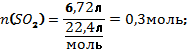
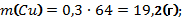
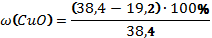 =50%
=50%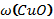 =50%
=50%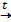 CuO + H2O
CuO + H2O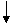 NaBr →NaCl →Cl2→ KClO3→KCl
NaBr →NaCl →Cl2→ KClO3→KCl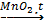 2KCl + 3O2↑
2KCl + 3O2↑