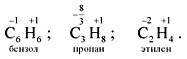14809. Рассчитайте массу (г) 80%-го технического карбида кальция, необходимого для получения 84 л (н.у.) ацетилена. (Запишите число с точностью до целых.)

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 14809.
14795. Вычислите массу твёрдого остатка (в граммах), который образуется при термическом разложении 8,4 г гидрокарбоната натрия. (Запишите число с точностью до десятых.)

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 14795.
14714. Установите соответствие между формулой вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА ВЕЩЕСТВА
А) KHCO3
Б) Ca(OH)2
В) HMnO4
КЛАСС/ГРУППА
1) основание
2) кислота
3) соль кислая
4) соль средняя

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 14714.
14712. Установите соответствие между формулой вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА ВЕЩЕСТВА
А) Mg(OH)2
Б) NH4NO3
В) CO
КЛАСС/ГРУППА
1) основание
2) оксид основный
3) соль средняя
4) оксид несолеобразующий

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 14712.
14691. Установите соответствие между формулой вещества и классом /группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА ВЕЩЕСТВА
А) Na2O2
Б) BeO
В) CO
КЛАСС/ГРУППА
1) пероксид
2) оксид основный
3) оксид амфотерный
4) оксид несолеобразующий

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 14691.
Для вас приятно генерировать тесты, создавайте их почаще
в условии
в решении
в тексте к заданию
в атрибутах
Категория:
Атрибут:
Всего: 749 1–20 | 21–40 | 41–60 | 61–80 | 81–100 | 101–120 | 121–140 | 141–160 …
Добавить в вариант
Для пропаналя характерна(-о):
1) sр-гибридизация атомов углерода
2) изменение окраски индикатора
3) восстановительные свойства
4) взаимодействие с гидроксидом меди (II)
5) взаимодействие с аммиачным раствором оксида серебра (I)
6) взаимодействие с карбоновыми кислотами
Низшую возможную степень окисления углерод имеет в
1) СаСО3
2) СО
3) СН4
4) С2Н4
Установите соответствие между названием простого вещества и формулами веществ, с каждым из которых оно может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
НАЗВАНИЕ ВЕЩЕСТВА
A) углерод
Б) кислород
B) кремний
Г) железо
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Верны ли следующие утверждения о способах получения металлов?
А. Железо в промышленности получают не в чистом виде, а в виде сплавов с углеродом.
Б. Щелочные металлы получают электролизом расплавов их соединений.
1) верно только А
2) верно только Б
3) верны оба утверждения
4) оба утверждения неверны
И углерод, и сера
1) растворяются в щелочах
2) сгорают в кислороде с образованием газообразного оксида
3) вытесняют водород из кислот
4) реагируют с водородом с образованием кислоты
Высшую возможную степень окисления углерод имеет в
1)
2)
3)
4)
Низшую возможную степень окисления углерод имеет в
1)
2)
3)
4)
Из предложенного перечня выберите два оксида, которые могут реагировать с кислородом.
1) оксид цинка
2) оксид углерода (II)
3) оксид железа (III)
4) оксид серы (IV)
5) оксид серы (VI)
Запишите в поле ответа номера выбранных веществ.
Источник: РЕШУ ЕГЭ
Из предложенного перечня веществ выберите два вещества, с каждым из которых может реагировать углерод.
1) углекислый газ
2) сульфат натрия (р-р)
3) разбавленная азотная кислота
4) концентрированная соляная кислота
5) оксид железа (III)
Запишите номера выбранных веществ.
Некоторый углеводород содержит 12,19% водорода по массе. Молекула этого углеводорода содержит один четвертичный атом углерода. Установлено, что этот углеводород может взаимодействовать с аммиачным раствором оксида серебра с образованием сероватого осадка. На основании этих данных:
1) произведите вычисления, необходимые для установления молекулярной формулы органического вещества;
2) запишите молекулярную формулу исходного органического вещества;
3) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;
4) приведите уравнение реакции его взаимодействия с аммиачным раствором оксида серебра.
Из предложенного перечня выберите два вещества, с которыми реагирует как углерод, так и калий.
1) алюминий
2) водород
3) вода
4) оксид натрия
5) оксид углерода(II)
Запишите в поле ответа номера выбранных веществ.
Источник: РЕШУ ЕГЭ, ЕГЭ по химии 10.06.2013. Основная волна. Сибирь. Вариант 1
Из предложенного перечня выберите два вещества, в молекулах которых между атомами углерода и кислорода присутствует двойная связь.
1) ацетальдегид
2) метанол
3) уксусная кислота
4) фенол
5) глицерин
Запишите в поле ответа номера выбранных веществ.
Источник: РЕШУ ЕГЭ
Из предложенного перечня выберите два вещества, в молекулах которых все атомы углерода находятся в состоянии sр2-гибридизации.
1) бутадиен-1,3
2) гексан
3) гексен
4) бензол
5) толуол
Запишите в поле ответа номера выбранных веществ.
Источник: РЕШУ ЕГЭ
Из предложенного перечня выберите все вещества, в молекулах которых все атомы углерода находятся в состоянии sp2-гибридизации.
1) бензол
2) гексан
3) гексен
4) этан
5) этен
Запишите в поле ответа номера выбранных веществ.
Источник: РЕШУ ЕГЭ
Из предложенного перечня выберите все вещества, в молекулах которых все атомы углерода находятся в состоянии sp3-гибридизации.
1) гексен-2
2) бензол
3) пропан
4) толуол
5) этан
Запишите в поле ответа номера выбранных веществ.
Источник: РЕШУ ЕГЭ
Из предложенного перечня выберите два вещества, в молекулах которых все атомы углерода находятся в состоянии sp2-гибридизации.
1) этанол
2) фенол
3) ацетилен
4) этандиол
5) этилен
Запишите в поле ответа номера выбранных веществ.
Источник: РЕШУ ЕГЭ
Из предложенного перечня выберите два оксида, которые могут реагировать с кислородом.
1) оксид цинка
2) оксид железа (III)
3) оксид серы (VI)
4) оксид углерода (II)
5) оксид азота (II)
Запишите в поле ответа номера выбранных веществ.
Источник: РЕШУ ЕГЭ
Из предложенного перечня веществ выберите два вещества, с каждым из которых может реагировать углерод.
1) нитрат калия (р-р)
2) уксусная кислота
3) углекислый газ
4) концентрированная соляная кислота
5) оксид олова (IV)
Запишите в поле ответа номера выбранных веществ.
Источник: РЕШУ ЕГЭ
Из предложенного перечня веществ выберите два вещества, с каждым из которых может реагировать углерод.
1) йодид калия (р-р)
2) уксусная кислота
3) углекислый газ
4) концентрированная соляная кислота
5) оксид олова (IV)
Запишите в поле ответа номера выбранных веществ.
Органическое вещество А содержит 57,83% углерода и 38,55% кислорода по массе, остальное – водород. Это вещество используют в производстве полимеров и синтетических волокон. Его получают окислением ароматического углеводорода Б ряда бензола кислородом воздуха. Молекулы А и Б содержат одинаковое число атомов углерода. Определите молекулярную формулу вещества А, установите его структуру и напишите уравнение его получения из вещества Б и кислорода.
Всего: 749 1–20 | 21–40 | 41–60 | 61–80 | 81–100 | 101–120 | 121–140 | 141–160 …
Тренажер задания 31 из ЕГЭ по химии углерода и кремния, задачи на неорганическую химию (мысленный эксперимент) из экзамена ЕГЭ по химии, задания 31 по химии углерода и кремния с текстовыми решениями и ответами.
- Газы, которые выделяются при нагревании угля в концентрированной азотной и серной кислотах, смешали друг с другом. Продукты реакции пропустили через известковое молоко. Напишите уравнения описанных реакций.
C + 2H2SO4(конц.) = CO2↑ + 2SO2↑ + 2H2O
C + 4HNO3(конц.) = CO2↑ + 4NO2↑ + 2H2O
SO2 + NO2 = SO3 + NO
SO3 + Ca(OH)2 = CaSO4↓ + H2O
CO2 + Ca(OH)2 = CaCO3↓ + H2O
- Негашеную известь «погасили» водой. В полученный раствор пропустили газ, который выделяется при нагревании гидрокарбоната натрия, при этом наблюдали образование и последующее растворение. Напишите уравнения описанных реакций.
CaO + H2O = Ca(OH)2
2NaHCO3 → Na2CO3 + CO2 ↑ + H2O
CO2 + Ca(OH)2 = CaCO3↓ + H2O
CaCO3 + CO2 + H2O = Ca(HCO3)2
- Газ, образовавшийся при сгорании кокса, длительное время соприкасался с раскаленным углем. Продукт реакции последовательно пропустили через слой железной руды и негашеную известь. Напишите уравнения описанных реакций осадка.
С + O2 = CO2
CO2 + C = 2CO
Fe2O3 + 3CO = 2Fe + 3CO2 или Fe3O4 + 4CO = 3Fe + 4CO2
СаО + СО2 = СаСО3
- Одно из веществ, образующихся при сплавлении оксида кремния с магнием, растворяется в щелочи. Выделяющийся газ ввели в реакцию с серой, а продукт их взаимодействия обработали хлором. Напишите уравнения описанных реакций.
SiO2 + 2Mg = 2MgO + Si
Si + 2NaOH + 2H2O = Na2SiO3 + 2H2↑
H2 + S = H2S
H2S + Cl2 = 2HCl + S↓
- Силицид магния обработали раствором хлороводородной кислоты и выделяющийся газ сожгли. Твердый продукт реакции смешали с кальцинированной содой, смесь нагрели до плавления и выдержали некоторое время. После охлаждения продукт реакции (используется под названием «жидкое стекло») растворили в воде и обработали раствором серной кислотой. Напишите уравнения описанных реакций.
Mg2Si + 4HCl = 2MgCl2 + 2SiH4↑
SiH4 + 2O2 = SiO2 + 2H2O
SiO2 + Na2CO3 = Na2SiO3 + CO2↑
Na2SiO3 + H2SO4 = Na2SO4 + H2SiO3↓
- Хлорид кремния (IV) нагрели в смеси с водородом. Продукт реакции смешали с магниевым порошком, нагрели и обработали водой, одно из образующихся веществ самовоспламеняется на воздухе. Напишите уравнения описанных реакций.
SiCl4 + 2H2 = Si + 4HCl
Si + 2Mg = Mg2Si
Mg2Si + 4H2O = 2Mg(OH)2↓ + SiH4↑
SiH4 + 2O2 = SiO2↓ + 2H2O
- Силицид магния обработали раствором соляной кислоты, продукт реакции сожгли, образовавшееся твердое вещество смешали с кальцинированной содой и нагрели до плавления. После охлаждения расплава его обработали водой и к полученному раствору добавили азотную кислоту. Напишите уравнения описанных реакций.
Mg2Si + 4HCl = 2MgCl2 + 2SiH4↑
SiH4 + 2O2 = SiO2 + 2H2O
SiO2 + Na2CO3 = Na2SiO3 + CO2↑
Na2SiO3 + 2HNO3 = 2NaNO3 + H2SiO3↓
- Магниевый порошок смешали с кремнием и нагрели. Продукт реакции обработали холодной водой, и выделяющийся газ пропустили через горячую воду. Образовавшийся осадок отделили, смешали с едким натром и нагрели до плавления. Напишите уравнения описанных реакций.
Si + 2Mg = Mg2Si
Mg2Si + 4H2O (холл.) = 2Mg(OH)2↓ + SiH4↑
SiH4 + 2H2O (гор.) = SiO2 + 4H2
SiO2 + 2NaOH = Na2SiO3 + H2O
- Кремний сожгли в атмосфере хлора. Полученный хлорид обработали водой. выделившийся при этом осадок прокалили. Затем сплавили с фосфатом кальция и углем. Напишите уравнения описанных реакций.
Si + 2Cl2 = SiCl4
SiCl4 + 3H2O = H2SiO3↓ + 4HCl
H2SiO3 → SiO2 + H2O
3SiO2 + Ca3(PO4)2 + 5C → 3CaSiO3 + 5CO + 2P
- Вещество, образующееся при сплавлении магния с кремнием обработали водой, в результате образовался и выделился бесцветный газ. Осадок растворили в соляной кислоте, а газ пропустили через раствор перманганата калия, при этом образовались два нерастворимых в воде бинарных вещества. Напишите уравнения описанных реакций.
Si + 2Mg = Mg2Si
Mg2Si + 4H2O (холл.) = 2Mg(OH)2↓ + SiH4↑
Mg(OH)2 + 2HCl = MgCl2 + 2H2O
3SiH4 + 8KMnO4 = 8MnO2↓ + 3SiO2↓ + 8KOH + 2H2O
- Продукт взаимодействия кремния с хлором легко гидролизуется. При сплавлении твердого продукта гидролиза как с каустической, так и кальцинированной содой образуется жидкое стекло. Напишите уравнения описанных реакций.
Si + 2Cl2 = SiCl4
SiCl4 + 2H2O = SiO2↓ + 4HCl
SiO2 + 2NaOH = Na2SiO3 + H2O
SiO2 + Na2CO3 = Na2SiO3 + CO2↑
- Углерод сожгли в недостатке кислорода, образовавшийся газ пропустили над оксидом меди (II). Полученное вещество сплавили с серой, а продукт этой реакции сожгли в кислороде. Напишите уравнения описанных реакций.
2С + O2 = 2CO
CO + CuO = Cu + CO2
Cu + S = CuS
2CuS + 3O2 = 2CuO + 2SO2
- Кремний сожгли в кислороде. Продукт реакции сплавили с карбонатом натрия, образовавшееся вещество обработали избытком соляной кислоты при нагревании. Осадок отфильтровали, а к фильтрату добавили раствор нитрата серебра. Напишите уравнения описанных реакций.
Si + O2 = SiO2
SiO2 + Na2CO3 = Na2SiO3 + CO2
Na2SiO3 + 2HCl = 2NaCl + H2SiO3↓
NaCl + AgNO3 = AgCl↓ + NaNO3
- Кремний растворили в концентрированном растворе гидроксида натрия. Через полученный раствор пропустили углекислый газ. Выпавший осадок отфильтровали, высушили и прокалили. Твердый остаток сплавили с магнием. Напишите уравнения описанных реакций.
Si + 2NaOH + H2O = Na2SiO3 + 2H2↑
Na2SiO3 + CO2 + H2O = Na2CO3 + H2SiO3↓
H2SiO3↓ = SiO2 + 2H2O
SiO2 + 2Mg = Si + 2MgO
Тренировочный тест на свойства соединений углерода и кремния.
Задание №1
Из приведенных соединений выберите такие, в которых атом углерода имеет отрицательную степень окисления. Число верных ответов может быть любым.
1) карбонат калия
2) карбид кальция
3) карборунд
4) графит
5) алмаз
Решение
Ответ: 23
Задание №2
Из приведенных соединений выберите те, в которых атом кремния имеет отрицательную степень окисления. Число верных ответов может быть любым.
1) силицид магния
2) силикат натрия
3) кварц
4) хлорид кремния(IV)
5) кремниевая кислота
Решение
Ответ: 1
Задание №3
Из приведенных соединений выберите те, в которых атом углерода имеет положительную степень окисления. Число верных ответов может быть любым.
1) угарный газ
2) пищевая сода
3) карбид алюминия
4) мел
5) карбид кальция
Решение
Ответ: 124
Задание №4
Из приведенных соединений выберите те, в которых атом кремния имеет положительную степень окисления. Число верных ответов может быть любым.
1) кремнезем
2) силикат калия
3) силицид натрия
4) кремниевая кислота
5) силицид кальция
Решение
Ответ: 124
Задание №5
Из приведенных соединений выберите два таких, в которых атом углерода имеет минимальную и максимальную степень окисления соответственно.
1) графит
2) карбид алюминия
3) сода
4) угарный газ
5) фуллерен
Решение
Ответ: 23
Задание №6
Из приведенного перечня простых веществ выберите два таких, которые взаимодействуют с углеродом.
1) сера
2) аргон
3) кислород
4) серебро
5) медь
Решение
Ответ: 13
Задание №7
Из приведенного перечня простых веществ выберите два таких, которые не взаимодействуют с углеродом.
1) литий
2) кальций
3) медь
4) барий
5) золото
Решение
Ответ: 35
Задание №8
Из приведенного перечня сложных веществ выберите те, которые взаимодействуют с углеродом.
- 1. HNO3
- 2. NH3
- 3. CO2
- 4. HCl
- 5. PH3
Решение
Ответ: 13
Задание №9
Из приведенного перечня сложных веществ выберите те, которые взаимодействуют с кремнием.
- 1. HF
- 2. KOH
- 3. H2O
- 4. HBr
- 5. HI
Решение
Ответ: 12
Задание №10
Из приведенного перечня сложных веществ выберите два таких, которые не могут вступать в реакцию с кремнием.
1) едкий натр
2) фосфорная кислота
3) гашеная известь
4) гидроксид алюминия
5) едкое кали
Решение
Ответ: 24
[adsp-pro-3]
Задание №11
Из приведенного перечня сложных веществ выберите два таких, которые взаимодействуют с углеродом.
1) кремнезем
2) угарный газ
3) оксид меди(I)
4) сероводород
5) хлороводород
Решение
Ответ: 13
Задание №12
Из приведенного перечня веществ выберите два таких, которые взаимодействуют с угарным газом.
- 1. H2O
- 2. O2
- 3. ZnS
- 4. FeO
- 5. H2S
Решение
Ответ: 24
Задание №13
Из приведенного перечня веществ выберите два таких, которые взаимодействуют с углекислым газом.
- 1. CO
- 2. NO2
- 3. K2O
- 4. Fe2O3
- 5. Na[Al(OH)4]
Решение
Ответ: 35
Задание №14
Из приведенного перечня веществ выберите два таких, которые способны вступать в реакцию с диоксидом кремния.
- 1. CaCO3
- 2. KBr
- 3. Fe
- 4. HF
- 5. H2O
Решение
Ответ: 14
Задание №15
Из приведенного перечня веществ выберите два таких, которые не взаимодействуют с угарным газом.
- 1. CuO
- 2. Al2O3
- 3. H2O
- 4. Fe2O3
- 5. Cl2
Решение
Ответ: 23
Задание №16
Из приведенного перечня веществ выберите два таких, которые не взаимодействуют с углекислым газом.
- 1. P2O5
- 2. LiOH
- 3. SrO
- 4. H2O
- 5. CuO
Решение
Ответ: 15
Задание №17
Из приведенного перечня веществ выберите два таких, которые не взаимодействуют с диоксидом кремния.
- 1. O2
- 2. C
- 3. CaSO3
- 4. FeS
- 5. KOH
Решение
Ответ: 14
Задание №18
Из приведенного перечня веществ выберите два таких, которые взаимодействуют с угарным газом.
1) серебро
2) кислород
3) водород
4) азот
5) соляная кислота
Решение
Ответ: 23
Задание №19
Из приведенного перечня оксидов металлов, выберите два таких, которые не способны вступать в реакцию с оксидом углерода (II)
- 1. CuO
- 2. Al2O3
- 3. Cu2O
- 4. MgO
- 5. Fe3O4
Решение
Ответ: 24
Задание №20
Из приведенного перечня веществ выберите два таких, водные растворы которых взаимодействуют с углекислым газом.
1) карбонат калия
2) нитрат аммония
3) силикат калия
4) бромид лития
5) сульфат цезия
Решение
Ответ: 13
[adsp-pro-3]
Задание №21
Через водную взвесь карбоната кальция пропустили углекислый газ, в результате чего образовался прозрачный раствор.
Впишите в поле ответа уравнение проведенной реакции, используя в качестве разделителя левой и правой части знак равенства.
Решение
Ответ: CaCO3 + H2O + CO2 = Ca(HCO3)2
Задание №22
Через водный раствор силиката калия пропустили избыток углекислого газа.
Впишите в поле ответа уравнение проведенной реакции, используя в качестве разделителя левой и правой части знак равенства.
Решение
Ответ: K2SiO3 + 2CO2 + 2H2O = 2KHCO3 + H2SiO3
Задание №23
Из приведенного перечня веществ выберите два таких, которые способны взаимодействовать с диоксидом кремния.
1) гашеная известь
2) азотная кислота
3) плавиковая кислота
4) угольная кислота
5) серная кислота
Решение
Ответ: 13
Задание №24
Из приведенного перечня веществ выберите два таких, которые не взаимодействуют с угарным газом.
1) кислород
2) хлор
3) оксид свинца
4) углекислый газ
5) фосфор
Решение
Ответ: 45
Задание №25
Из приведенного перечня металлов выберите такие, которые не могут быть получены восстановлением соответствующих оксидов угарным газом. Число верных ответов может быть любым.
- 1. Fe
- 2. Cu
- 3. Mg
- 4. Pb
- 5. Sn
Решение
Ответ: 3
Задание №26
Какие из перечисленных металлов получают взаимодействием соответствующих оксидов с углеродом или угарным газом? Число верных ответов может быть любым.
- 1. Na
- 2. Al
- 3. Ag
- 4. Zn
- 5. Ba
Решение
Ответ: 34
Задание №27
Какие из перечисленных металлов не получают взаимодействием соответствующих оксидов с углеродом или угарным газом? Число верных ответов может быть любым.
- 1. Li
- 2. Cs
- 3. Pb
- 4. Cu
- 5. Sr
Решение
Ответ: 125
Задание №28
Какие из перечисленных металлов можно получить при взаимодействии их оксида с углеродом или угарным газом? Число верных ответов может быть любым.
- 1. Zn
- 2. Cr
- 3. Na
- 4. Cu
- 5. K
Решение
Ответ: 124
Задание №29
Смесь порошков оксида алюминия и угля подвергли прокаливанию.
Впишите в поле ответа уравнение осуществленной реакции, используя в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: 2Al2O3 + 9C = Al4C3 + 6CO
Задание №30
Смесь порошков оксида кальция и угля подвергли прокаливанию.
Впишите в поле ответа уравнение осуществленной реакции, используя в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: CaO + 3C = CaC2 + CO
[adsp-pro-3]
Задание №31
Какие из перечисленных металлов не получают взаимодействием соответствующих оксидов с углеродом? Число верных ответов может быть любым.
- 1. Cu
- 2. Al
- 3. Rb
- 4. Mg
- 5. Fe
Решение
Ответ: 234
Задание №32
Из приведенного перечня солей, выберите две такие, которые в водном растворе могут реагировать с углекислым газом?
1) силикат натрия
2) фторид серебра
3) гидрокарбонат калия
4) карбонат аммония
5) сульфат бария
Решение
Ответ: 14
Задание №33
Из приведенного перечня солей, выберите две такие, которые могут взаимодействовать с диоксидом кремния?
1) хлорид кальция
2) бромид лития
3) карбонат бария
4) нитрат цинка
5) карбонат стронция
Решение
Ответ: 35
Задание №34
Какие из перечисленных реагентов не могут реагировать с углекислым газом?
1) раствор гидросульфата калия
2) раствор гидрокарбоната натрия
3) водная взвесь карбоната кальция
4) раствор карбоната натрия
5) раствора поташа
Решение
Ответ: 12
Задание №35
Из предложенного перечня солей выберите две такие, которые не могут реагировать с диоксидом кремния?
1) сульфит кальция
2) сульфат калия
3) карбонат стронция
4) карбонат цезия
5) силикат натрия
Решение
Ответ: 25
Задание №36
Из предложенного перечня солей выберите две такие, водные растворы которых могут реагировать с углекислым газом.
1) хлорид цинка
2) бромид натрия
3) нитрат серебра
4) карбонат калия
5) карбонат кальция
Решение
Ответ: 45
Задание №37
Из приведенного перечня выберите такую пару реагентов, между которыми возможна химическая реакция.
1) силикат натрия + кислород
2) силикат калия + серебро
3) силикат лития + хлорид натрия
4) силикат натрия + аммиак
5) силикат калия + соляная кислота
В поле ответа введите уравнение этой реакции, используя в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: K2SiO3 + 2HCl = 2KCl + H2SiO3
Задание №38
Из приведенного перечня выберите такую пару реагентов, между которыми возможна химическая реакция.
1) карбонат цинка + нитрат серебра
2) карбонат цинка + фосфат калия
3) карбонат цинка + серная кислота
4) карбонат цинка + железо
5) карбонат цинка + гидроксид натрия
В поле ответа введите уравнение этой реакции, используя в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: ZnCO3 + H2SO4 = ZnSO4 + CO2 + H2O
Задание №39
Из приведенного перечня выберите такую пару реагентов, между которыми возможна химическая реакция.
1) углекислый газ + нитрат бария
2) углекислый газ + веселящий газ
3) углекислый газ + магний
4) углекислый газ + угарный газ
5) углекислый газ + фосфат натрия
В поле ответа введите уравнение этой реакции, используя в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: CO2 + 2Mg = 2MgO + C
Задание №40
Из приведенного перечня выберите такую пару реагентов, между которыми возможна химическая реакция.
1) гидрокарбонат калия + сера
2) гидрокарбонат калия + кислород
3) гидрокарбонат калия + йодоводородная кислота
4) гидрокарбонат калия + углекислый газ
5) гидрокарбонат калия + хлорид кальция
В поле ответа введите уравнение этой реакции, используя в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: KHCO3 + HI = KI + CO2 + H2O
[adsp-pro-3]
Задание №41
Из приведенного перечня кислот выберите такую, которая способна реагировать с диоксидом кремния.
- 1. HI
- 2. HBr
- 3. HCl
- 4. HF
- 5. H2S
В поле ответа введите уравнение этой реакции, используя в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ:
SiO2 + 4HF = SiF4 + 2H2O
или
SiO2 + 6HF = H2[SiF6] + 2H2O
Задание №42
Из приведенного перечня веществ выберите то, которое реагирует с водным раствором карбоната натрия.
- 1. KOH
- 2. Cu
- 3. H2
- 4. HCl
- 5. CO
В поле ответа введите уравнение этой реакции, используя в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: Na2CO3 + 2HCl = 2NaCl + CO2 + H2O
Задание №43
Из приведенного перечня кислот выберите такую, с которой может реагировать аморфный углерод.
- 1. H3PO4
- 2. HNO3
- 3. H2SO4(10%-ный раствор)
- 4. CH3COOH
- 5. HCOOH
В поле ответа введите уравнение этой реакции, используя в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: C + 4HNO3 = CO2 + 4NO2 + 2H2O
Задание №44
Из приведенного перечня кислот выберите такую, с которой может реагировать аморфный углерод.
- 1. H3СO3
- 2. HF
- 3. H2SO4(конц.)
- 4. CH3COOH(конц.)
- 5. HBr
В поле ответа введите уравнение этой реакции, используя в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: C + 2H2SO4 = CO2 + 2SO2 + 2H2O
Задание №45
Из приведенного перечня веществ выберите такое, с которым может взаимодействовать кремний.
- 1. H2
- 2. H2O
- 3. Cu
- 4. Mg
- 5. Na2CO3
В поле ответа введите уравнение этой реакции, используя в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: 2Mg + Si = Mg2Si
Задание №46
Из приведенного перечня реагентов выберите такой, который вступает в реакцию с водным раствором карбоната калия.
- 1. KNO3
- 2. KCl
- 3. NaOH
- 4. AlCl3
- 5. CO
В поле ответа введите уравнение этой реакции, используя в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: 3K2CO3 + 2AlCl3 + 3H2O = 6KCl + 2Al(OH)3 + 3CO2
Задание №47
Из приведенного перечня реагентов выберите такой, который реагирует с водным раствором гидрокарбоната натрия
1) углекислый газ
2) угарный газ
3) карбонат кали
4) нитрат кальция
5) сульфат железа (III)
В поле ответа введите уравнение этой реакции, используя в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: Fe2(SO4)3 + 6NaHCO3 = 2Fe(OH)3 + 6CO2 + 3Na2SO4
Задание №48
Может ли взаимодействовать углекислый газ с углем?
Если не может, поставьте в поле ответа знак минус (-).
Если может, то впишите уравнение этой реакции, используя в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: C + CO2 = 2CO
Задание №49
Может ли взаимодействовать кремний с хлором?
Если не может, поставьте в поле ответа знак минус (-).
Если может, то впишите уравнение этой реакции, используя в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: Si + 2Cl2 = SiCl4
Задание №50
Реагирует ли хлорид кремния (IV) с водой?
Если не реагирует, поставьте в поле ответа знак минус (-).
Если реагирует, то впишите уравнение этой реакции, используя в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: SiCl4 + 3H2O = H2SiO3 + 4HCl
[adsp-pro-3]
Задание №51
Реагирует ли карбид алюминия с водой?
Если не реагирует, поставьте в поле ответа знак минус (-).
Если реагирует, то впишите уравнение этой реакции, используя в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: Al4C3 + 12H2O = 4Al(OH)3 + 3CH4
Задание №52
Запишите уравнение реакции, которая протекает при обработке хлорида кремния (IV) избытком водного раствора гидроксида калия.
Используйте в качестве разделителя левой и правой частей уравнения знак равенства.
Решение
Ответ: SiCl4 + 6KOH = K2SiO3 + 4KCl + 3H2O
Задание №53
Реагирует ли с водой карбид кремния?
Если не реагирует, поставьте в поле ответа знак минус (-).
Если реагирует, то впишите уравнение этой реакции, используя в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: —
Задание №54
Реагирует ли оксид алюминия с карбонатом калия при сплавлении.
Если не реагирует, поставьте в поле ответа знак минус (-).
Если реагирует, то впишите уравнение этой реакции, используя в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: K2CO3 + Al2O3 = 2KAlO2 + CO2
Задание №55
Реагирует ли оксид меди с карбонатом натрия при сплавлении.
Если не реагирует, поставьте в поле ответа знак минус (-).
Если реагирует, то впишите уравнение этой реакции, используя в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: —
Задание №56
Запишите уравнение реакции, протекающей между пищевой содой и бромоводородной кислотой.
Используйте в качестве разделителя левой и правой частей уравнения знак равенства.
Решение
Ответ: NaHCO3 + HBr = NaBr + CO2 + H2O
Задание №57
Запишите уравнение реакции, протекающей между водными растворами гидрокарбоната натрия и сульфата железа(III).
Используйте в качестве разделителя левой и правой частей уравнения знак равенства.
Решение
Ответ: 6NaHCO3 + Fe2(SO4)3 = 3Na2SO4 + 2Fe(OH)3 + 6CO2
Задание №58
Запишите уравнение реакции, протекающей между растворами карбоната калия и нитрата хрома(III).
Используйте в качестве разделителя левой и правой частей уравнения знак равенства.
Решение
Ответ: 3K2CO3 + 2Cr(NO3)3 + 3H2O = 6KNO3 + 2Cr(OH)3 + 3CO2
Задание №59
Запишите уравнение реакции, протекающей между пищевой содой и едким натром.
Используйте в качестве разделителя левой и правой частей уравнения знак равенства.
Решение
Ответ: NaHCO3 + NaOH = Na2CO3 + H2O
Задание №60
Запишите уравнение реакции, протекающей при пропускании избытка углекислого газа через раствор силиката натрия.
Используйте в качестве разделителя левой и правой частей уравнения знак равенства.
Решение
Ответ: Na2SiO3 + 2CO2 + 2H2O = 2NaHCO3 + H2SiO3
[adsp-pro-3]
Задание №61
Смешали водные растворы гидроксида бария и гидрокарбоната натрия. В результате был получен раствор, в котором не обнаруживаются карбонат-ионы.
Впишите в поле ответа уравнение проведенной реакции, используя в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: Ba(OH)2 + NaHCO3 = BaCO3 + NaOH + H2O
Задание №62
Смешали водные растворы гидроксида бария и гидрокарбоната натрия. В результате был получен раствор, в котором не обнаруживаются гидроксид-ионы.
Впишите в поле ответа уравнение проведенной реакции, используя в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: Ba(OH)2 + 2NaHCO3 = BaCO3 + Na2CO3 + 2H2O
Задание №63
Запишите уравнение реакции, протекающей при гидролизе силицида кальция.
Используйте в качестве разделителя левой и правой частей уравнения знак равенства.
Решение
Ответ: Ca2Si + 4H2O = 2Ca(OH)2 + SiH4
Задание №64
Силицид магния подвергли кислотному гидролизу действием избытка соляной кислоты.
Впишите в поле ответа уравнение проведенной реакции, используя в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: Mg2Si + 4HCl = 2MgCl2 + SiH4
Задание №65
Запишите уравнение реакции, протекающей между угарным газом и железной окалиной при нагревании.
Используйте в качестве разделителя левой и правой частей уравнения знак равенства.
Решение
Ответ: Fe3O4 + 4CO = 3Fe + 4CO2
Задание №66
Запишите уравнение реакции, протекающей при растворении порошка кремния в растворе едкого кали.
Используйте в качестве разделителя левой и правой частей уравнения знак равенства.
Решение
Ответ: Si + 2KOH + H2O = K2SiO3 + 2H2
Задание №67
Установите соответствие между формулой вещества и набором реагентов, с каждым из которых оно может взаимодействовать.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
|
А) P Б) C В) SiO2 |
1) KOH, HF, C 2) H2O, H2, Ba(OH)2 3) HNO3, KOH, Cl2 4) CO2, Al, FeO |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 341
Задание №68
Установите соответствие между формулой вещества и набором реагентов, с каждым из которых оно может взаимодействовать.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
|
А) SO2 Б) CO2 В) N2O |
1) S, С, Cu 2) NaOH, O2, H2O2 3) CaO, C, LiOH 4) H2O, He, Cl2 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 231
Задание №69
Установите соответствие между формулой вещества и набором реагентов, с каждым из которых оно может взаимодействовать.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
|
А) NaHCO3 Б) Na2SiO3 В) Na2SO3 |
1) H2, O2, Cu 2) KOH, HCl, HI 3) AgNO3, HCl, CO2 4) HBr, H2O2, CaCl2 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 234
Задание №70
Установите соответствие между формулой вещества и набором реагентов, с каждым из которых оно может взаимодействовать.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
|
А) BaCO3 Б) CO2 В) CO |
1) CaO, NaOH, K2CO3 2) HCl, HBr, N2 3) HNO3, HCl, SiO2 4) O2, Cl2, Cu2O |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 314
[adsp-pro-3]
Задание №71
Установите соответствие между формулой вещества и набором реагентов, с каждым из которых оно может взаимодействовать.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
|
А) Mg2Si Б) SiO2 В) Si |
1) KOH, Cl2, HF 2) KOH, CaCO3, C 3) H2O, Mg, KOH 4) HCl, H2O, H2SO4 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 421
Задание №72
Установите соответствие между формулой вещества и набором реагентов, с каждым из которых оно может взаимодействовать.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
|
А) K2SO3 Б) K2SiO3 В) CO2 |
1) HCl, H2O2, HNO3 2) CO2, HCl, HBr 3) HNO3, O2, H2 4) CaO, C, KOH |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 124
Задание №73
Установите соответствие между формулой вещества и набором реагентов, с каждым из которых оно может взаимодействовать.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
|
А) HBr Б) HNO3 В) H2SiO3 |
1) KOH, MgO, AgNO3 2) NaOH, CaO, Cu 3) LiOH, BaO, H2O 4) CsOH, SrO, HF |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 124
Задание №74
Установите соответствие между формулой вещества и набором реагентов, с каждым из которых оно может взаимодействовать.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
|
А) Br2 Б) Si В) C |
1) H2, KOH, Cu 2) O2, Na, CO2 3) H2, HCl, NO2 4) O2, HF, Cl2 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 142
Задание №75
Установите соответствие между формулой вещества и набором реагентов, с каждым из которых оно может взаимодействовать.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
|
А) Al4C3 Б) Na2SO4 В) C |
1) CO, HCl, NO2 2) O2, CO2, S 3) HBr, H2O, O2 4) BaCl2, Ca(OH)2, SrBr2 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 342
Задание №76
Установите соответствие между формулой вещества и набором реагентов, с каждым из которых оно может взаимодействовать.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
|
А) K2CO3 Б) CaSO3 В) Ca(OH)2 |
1) CO2, SiO2, H2O 2) HBr, SiO2, H2O2 3) CO2, SiO2, Na2CO3 4) HCl, SiO2, CaCl2 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 423
Задание №77
Какой объем угарного газа можно получить при взаимодействии 11,2 л углекислого газа и 9 г угля? Ответ укажите в литрах и округлите до десятых.
В поле ответа введите только число (без единиц измерения).
Решение
Ответ: 22,4
Задание №78
Какой максимальный объем углекислого газа может поглотить 50 мл 20%-ного раствора едкого натра (плотность 1,2 г/см3)? Ответ укажите в литрах и округлите до сотых.
В поле ответа введите только число (без единиц измерения).
Решение
Ответ: 6,72
Задание №79
При прокаливании образца мела массой 50 г до постоянной массы выделилось 10,08 л газа. Определите массу карбоната кальция в исходном образце. Ответ укажите в граммах и округлите до целых.
В поле ответа введите только число (без единиц измерения).
Решение
Ответ: 45
Задание №80
Определите массовую долю соли в растворе, полученном при растворении 10,6 г карбоната натрия в 93,8 г раствора концентрированной соляной кислоты. Ответ укажите в процентах и округлите до десятых.
В поле ответа введите только число (без единиц измерения).
Решение
Ответ: 11,7
[adsp-pro-3]
Задание №81
Навеску карбоната магния массой 42 г повергли частичному разложению при нагревании. Определите объем газа, который выделится при обработке полученного остатка избытком азотной кислоты, если известно, что масса остатка на 11 г меньше массы исходной навески. Ответ укажите в литрах и округлите до десятых.
В поле ответа введите только число (без единиц измерения).
Решение
Ответ: 5,6
Задание №82
Навеска карбоната бария массой 19,7 г частично разложилась при нагревании. Определите массовую долю карбоната бария в полученном твердом остатке, если известно, что он может прореагировать с 0,9 мл воды. Ответ укажите в процентах и округлите до десятых.
В поле ответа введите только число (без единиц измерения).
Решение
Ответ: 56,3
Задание №83
100 г смеси карбонатов калия и кальция прокалили до постоянной массы. Определите массовую долю карбоната калия в исходной смеси, если полученный твердый остаток может прореагировать с 9 мл воды. Ответ укажите в процентах и округлите до целых.
В поле ответа введите только число (без единиц измерения).
Решение
Ответ: 50
Задание №84
Смесь карбоната цинка и нитрата меди массой 59,5 г прокалили до постоянной массы. Определите объем угарного газа, необходимый для полного восстановления полученного твердого остатка, если известно, что он может прореагировать со 112 г 10%-ного раствора едкого кали. Ответ укажите в литрах и округлите до сотых.
В поле ответа введите только число (без единиц измерения).
Решение
Ответ: 7,84
Задание №85
Определите массу угля, необходимую для полного восстановления железа из 244,2 г руды, содержащей 95% железной окалины и инертные примеси. Ответ укажите в граммах и округлите до целых.
В поле ответа введите только число (без единиц измерения).
Решение
Ответ: 48
Задание №86
Определите, какой объем газа выделится при смешении 31,8 г карбоната натрия и 250 мл 10%-ного раствора хлорида алюминия (плотность 1,068 г/мл). Ответ округлите до сотых.
В поле ответа введите только число (без единиц измерения).
Решение
Ответ: 6,72
Задание №87
Вычислите массу пищевой соды, которую нужно прокалить для получения 5,3 г твердого остатка. Ответ укажите в граммах и округлите до десятых.
В поле ответа введите только число (без единиц измерения).
Решение
Ответ: 8,4
Задание №88
Навеску смеси оксида меди(II) и песка прокалили с избытком оксида кальция. Полученный остаток обработали избытком азотной кислоты и получили 7,8 г нерастворимого вещества. Определите массу исходной навески, если доля оксида меди в ней 25%. Ответ укажите в граммах и округлите до целых.
В поле ответа введите только число (без единиц измерения).
Решение
Ответ: 8
Задание №89
Навеску карбоната кальция массой 20 г частично разложили при нагревании. Полученный твердый остаток растворили в 100 г 30% соляной кислоты. Определите массовую долю кислоты в полученном растворе, если известно, что при прокаливании выделилось 3,36 л газа. Ответ укажите в процентах и округлите до целых.
В поле ответа введите только число (без единиц измерения).
Решение
Ответ: 14
Задание №90
Навеску гидрокарбоната калия массой 30 г частично разложили при нагревании. Определите массу 10% раствора гидроксида калия, который может прореагировать с полученным остатком, если известно, что при прокаливании выделилось 2,24 л газа. Ответ укажите в граммах и округлите до целых.
В поле ответа введите только число (без единиц измерения).
Решение
Ответ: 56
[adsp-pro-3]
Задание №91
К раствору, содержащему карбонат натрия, добавили необходимое количество хлорида хрома(III). Определите минимальный объем 20% раствора гидроксида калия (плотность 1,15 г/мл), необходимый для поглощения выделившегося газа, если известно, что из исходного раствора выпало 2,06 г осадка. Ответ укажите в миллилитрах и округлите до десятых.
В поле ответа введите только число (без единиц измерения).
Решение
Ответ: 7,3
Задание №92
Определите суммарный объем газов, который выделится при растворении навески углерода массой 6 г в избытке 80% азотной кислоты. Ответ укажите в литрах и округлите до целых.
В поле ответа введите только число (без единиц измерения).
Решение
Ответ: 56
Задание №93
Вычислите массу оксида меди, который можно восстановить газом, полученным при растворении 1,4 г кремния в избытке раствора едкого кали. Ответ укажите в граммах и округлите до целых.
В поле ответа введите только число (без единиц измерения).
Решение
Ответ: 8
Задание №94
Смесь сернистого и углекислого газа объемом 11,2 л пропустили через избыток 30% раствора перекиси водорода. При добавлении к полученному раствору хлорида бария выпало 23,3 г белого осадка. Определите объем углекислого газа в исходной смеси. Ответ укажите в литрах и округлите до сотых.
В поле ответа введите только число (без единиц измерения).
Решение
Ответ: 8,96
Задание №95
Смесь карбоната калия и сульфата натрия растворили в воде. При добавлении к полученному раствору избытка нитрата бария выпало 89,6 г осадка. Определите массу смеси, если известно, что при взаимодействии точно такой же навески смеси с избытком соляной кислоты образуется 2,24 л газа. Ответ укажите в граммах и округлите до десятых.
В поле ответа введите только число (без единиц измерения).
Решение
Ответ: 56,4
Задание №96
Определите массовую долю карбоната калия в растворе (плотность 1,05 г/мл), если известно, что 30 мл такого раствора могут прореагировать с 1,1 г углекислого газа. Ответ укажите в процентах и округлите до целых.
В поле ответа введите только число (без единиц измерения).
Решение
Ответ: 11
Задание №97
Вычислите массу азотной кислоты, необходимую для полного окисления смеси серы и углерода массой 9,2 г, если известно, что такая же навеска может прореагировать с 16 г горячего 50% раствора гидроксида натрия. Ответ укажите в граммах и округлите до десятых.
В поле ответа введите только число (без единиц измерения).
Решение
Ответ: 163,8
Задание №98
При прокаливании смеси карбонатов кальция и натрия до постоянной массы выделилось 11,2 л газа. Определите массу воды, которая может прореагировать с полученным твердым остатком. Ответ укажите в граммах и округлите до целых.
В поле ответа введите только число (без единиц измерения).
Решение
Ответ: 9
Задание №99
Рассчитайте объем углекислого газа, необходимого для полного осаждения кремниевой кислоты из 122 г 5% раствора силиката натрия. Ответ укажите в литрах и округлите до сотых.
В поле ответа введите только число (без единиц измерения).
Решение
Ответ: 2,24
Задание №100
Вычислите объем угарного газа, необходимый для восстановления твердого остатка от прокаливания 100 г смеси нитратов меди и серебра с массовой долей нитрата серебра равной 6%. Ответ укажите в литрах и округлите до десятых.
В поле ответа введите только число (без единиц измерения).
Решение
Ответ: 11,2
[adsp-pro-10]
Задания по теме «Углерод» (в формате ОГЭ)
- Неметаллические свойства у углерода более выражены,
чем неметаллические свойства
1) кислорода 2) фтора 3) хлора 4) кремния.
- Свойства оксидов в ряду CO2 →B2O3 →BeO изменяются от
1) кислотных к амфотерным 3) основных к кислотным
2) амфотерных к основным 4) основных к амфотерным
- Значения высшей и низшей степени окисления углерода соответственно равны
1) +2 и -4 2) +4 и -2 3) +2 и -4 4) +4 и -4
- В соединениях NH4HCO3 и C2H2 степени окисления углерода соответственно равны
1) – 1, + 4 2) +2, +2 3) + 2, + 4 4) + 4, — 1
- Электроотрицательность углерода больше, чем электроотрицательность
1) кислорода 2) азота 3) серы 4) кремния.
- Высшую степень окисления углерод имеет в соединении
1) Al4C3, 2) СH4, 3) Na4С, 4) CO2.
- Такую же степень окисления, как и в СН4, углерод имеет в соединении 1) СО, 2) Al4C3, 3) CaCO3, 4) CO2.
- Углерод вступает в реакцию с
- кислородом и соляной кислотой,
- оксидом железа (II) и водородом,
- сульфатом натрия и гидроксидом меди(II),
- кремниевой кислотой и хлоридом бария.
- Сколько веществ, указанных в ряду CuCl2, Fe2O3, Al(OH)3, O2 — реагируют с углеродом
1) одно, 2) два, 3) три, 4) четыре.
- Сколько веществ из указанных в ряду:
H2SO4, Ca(OH)2, CuO, H2O – реагируют с оксидом углерода (IV) при комнатной температуре?
1) 1, 2) 2, 3) 3, 4) 4.
- При добавлении раствора карбоната натрия к раствору бромоводородной кислоты
1) выпадает осадок 3) выпадает осадок и выделяется газ
2) выделяется газ 4) видимых изменений не происходит
- Углекислый газ реагирует с каждым из двух веществ:
1) KCl и O2 2) Mg(OH)2 и Na2O 3) CaSiO3 и FeS 4) SO2 и H2SO4
- С раствором карбоната калия реагирует
1) оксид магния 3) гидроксид меди (II)
2) оксид углерода (II) 4) азотная кислота
- С оксидом углерода (IV) реагирует
1) KCl, 2) Р2O5, 3) Ca(ОН)2, 4) HNO3.
- В реакцию с оксидом углерода (IV) вступает каждое из двух веществ
- фосфорная кислота и вода, 3) гидроксид натрия и вода,
- оксид магния и сера, 4) оксид железа (III) и водород.
- При взаимодействии оксида углерода (IV) с оксидом калия образуется(-ются)
- соль и кислород, 3) основание и кислород,
- основание, 4) соль.
- Формула соединения углерода, проявляющего токсичные свойства 1) NaHCO3 2) Na2CO3 3) CaCO3 4) CO
- Карбонат кальция реагирует с
1) Ba(OH)2, 2) ZnS, 3) HCl, 4) O2.
- После пропускания через раствор гидроксида калия 1,12 л углекислого газа (н.у.) получили 138 г раствора карбоната калия. Вычислите массовую долю соли в полученном растворе.
Химические свойства углерода.
Углерод ($C$) — первый элемент главной подгруппы IV группы Периодической системы. На его высшем энергетическом уровне $4$ электрона, поэтому его атомы могут принимать четыре электрона, приобретая степень окисления $–4$, т.е. проявлять окислительные свойства, и отдавать свои электроны, проявляя восстановительные свойства, приобретая степень окисления $+4$.
О свойствах аллотропных модификаций алмаза и графита мы уже говорили ранее. Химические свойства углерода и его соединений обобщены в таблице.
Углерод — это особый химический элемент. Он — основа многообразия органических соединений, из которых построены все живые организмы на планете.
Углерод и его соединения.
| Углерод | Соединения углерода | |
| Оксид углерода (IV) | Угольная кислота | |
| 1. Имеет аллотропные модификации: алмаз, графит, карбин, фуллерен. 2. Проявляет восстановительные свойства: а) горит в кислороде: $C+O_2=CO_2+Q$ неполное сгорание: $2C+O_2=2CO+Q;$ б) взаимодействует с оксидом углерода (IV), образуя ядовитое вещество — угарный газ: $C+CO_2=2CO;$ в) восстанавливает металлы из их оксидов: $C+2CuO=CO_2+2Cu$ Получение Неполное сжигание метана: $CH_4+O_2=C+2H_2O$ |
1. Газ без запаха, цвета и вкуса, тяжелее воздуха. 2. Кислотный оксид. 3. При растворении взаимодействует с водой: $CO_2+H_2O⇄H_2CO_3$ 4. Реагирует с основаниями (известковая вода при его пропускании мутнеет): $CO2+Ca(OH)_2=CaCO_3↓+H_2O$ 5. Реагирует с основными оксидами: $CO_2+CaO=CaCO_3$ 6. Образуется в реакциях: — горения углерода в кислороде: $C+O_2=CO_2$ — окисления оксида углерода (II): $2CO+O_2=2CO_2$ — сгорания метана: $CH_4+2O_2=CO_2+2H_2O$ — взаимодействия кислот с карбонатами: $CaCO_3+2HCl=CaCl_2+CO_2↑+H_2O$ — термического разложения карбонатов и гидрокарбонатов: $CaCO_3=CaO+CO_2↑$ $2NaHCO_3=Na_2CO_3+CO_2↑+H_2O$ — окислительных биохимических процессов дыхания, гниения |
1. Непрочная молекула. Слабая двухосновная кислота. Равновесие в водном растворе: $CO_2+H_2O⇄H_2CO_3⇄H^{+}+HCO_3^{−}⇄2H^{+}+CO_3^{2−}$ 2. Взаимодействует с растворами щелочей как раствор углекислого газа в воде с образованием кислых (гидрокарбонатов) и средних (карбонатов) солей: $CO_2+NaOH=NaHCO_3$ $CO_2+2NaOH=Na_2CO_3+H_2O$ 3. Вытесняется из солей более сильными кислотами: $CaCO_3+2HCl=CaCl_2+CO_2↑+H_2O$ 4. Соли угольной кислоты подвергаются гидролизу: $2Na^{+}+CO_3^{2−}+H_2O⇄2Na^{+}+HCO_3^{−}+OH^{–}$ $CO_3^{2−}+H_2O⇄HCO_3^{−}+OH^–$ |
Химические свойства кремния.
Кремний ($Si$) — второй представитель главной подгруппы IV группы. По распространенности в природе кремний — второй после кислорода. Наиболее распространенными соединениями кремния являются диоксид кремния $SiO_2$ — кремнезем и силикаты.
Кристаллический кремний имеет структуру алмаза, очень хрупок, относится к тугоплавким веществам. При обычных условиях инертен, что объясняется прочностью его кристаллической решетки. В таблице обобщены химические свойства кремния и его соединений.
Соединения кремния служат основой производства стекла и цемента. Состав оконного стекла: $Na_2O·CaO·6SiO_2$.
Кремний и его соединения.
| Кремний | Соединения кремния | |
| Оксид кремния (IV) | Кремниевая кислота | |
| 1. Обладает полупроводниковыми свойствами. 2. Горит в кислороде: $Si+O_2=SiO_2+Q$ Получение — Восстановление оксида кремния (IV) углеродом (в промышленности): $SiO_2+2C=Si+2CO$ — порошком магния (в лаборатории): $SiO_2+2Mg=Si+2MgO$ |
1. Твердое бесцветное прозрачное вещество, легко затвердевающее в виде стекла. 2. В воде не растворяется и с водой не реагирует. 3. Как кислотный оксид взаимодействует с: а) щелочами: $SiO_2+2NaOH=Na_2SiO_3+H_2O;$ б) основными оксидами: $SiO_2+CaO=CaSiO_3$ 4. Вытесняет из солей летучие кислоты (реакции, лежащие в основе варки стекла): $SiO_2+Na_2CO_3=Na_2SiO_3+CO_2↑$ $SiO_2+CaCO_3=CaSiO_3+CO_2↑$ |
1. Очень слабая двухосновная не растворимая в воде кислота состава $mSiO_2·nH_2O(H_2SiO_3)$ 2. Разлагается уже при несильном нагревании: $H_2SiO_3=SiO_2+H_2O$ 3. Соли кремниевой кислоты (силикаты) подвергаются гидролизу: $4Na^{+}+2SiO_3^{2-}+2H_2O⇄4Na^{+}+Si_2O_5^{2−}+2OH^–$ $2SiO_3^{2-}+2H_2O⇄Si_2O_5^{2−}+2OH^–$ Получение Действие кислот на растворимые силикаты: $Na_2SiO_3+2HCl=2NaCl+H_2SiO_3↓$ |
Пособие-репетитор по химии
Продолжение. Cм. в № 22/2005;
1, 2, 3, 5, 6, 8, 9, 11, 13, 15, 16, 18, 22/2006;
3, 4, 7, 10, 11, 21/2007;
2, 7, 11, 18, 19, 21/2008;
1, 3, 10, 11, 16, 21/2009;
ЗАНЯТИЕ 33
10-й класс (первый год обучения)
Углерод и его соединения
П л а н

Положение в таблице Д.И.Менделеева, строение
атома.
2. Краткая история открытия и происхождение
названия.
3. Физические свойства. Аллотропные модификации
углерода.
4. Химические свойства.
5. Нахождение в природе.
6. Основные методы получения.
7. Важнейшие соединения углерода (угарный газ,
углекислый газ, угольная кислота и ее соли).
Углерод находится в главной подгруппе IV группы
периодической системы химических элементов.
Электронная формула атома углерода имеет вид 1s22s2p2,
это р-элемент, проявляющий неметаллические
свойства. В невозбужденном состоянии углерод
проявляет валентность II, при переходе в
возбужденное состояние – IV. Характерные
степени окисления в соединениях –4, +2, +4,
например: .
С: 1s22s22p2 (валентность
II),
С*: 1s22s12p3 (валентность
IV).
Характерной особенностью углерода является
его способность к образованию
углерод-углеродных цепей, что обуславливает
существование органических молекул. Для
органических соединений понятие степени
окисления является очень условным, например:
Русское название углерода означает “рождающий
уголь”. Латинское название carboneum также
означает “уголь”.
Ф и з и ч е с к и е с в о й с т в а
Химический элемент углерод в виде
простого вещества образует несколько
аллотропных модификаций.
Алмаз – аллотропная модификация
углерода, существующая в природе и полученная
искусственным путем. По внешнему виду это
прозрачные кристаллы высокой твердости. После
обработки природных алмазов получают
драгоценный камень – бриллиант.
Кристаллическая решетка алмаза имеет
тетраэдрическое строение, расстояние между
всеми атомами углерода одинаковое, что
обусловлено их sp3-гибридизацией. В
кристаллической решетке алмаза отсутствуют
свободные электроны, поэтому алмаз не проводит
электрического тока. Химическая активность
алмаза ниже активности другой аллотропной
модификации углерода – графита.
Графит – мягкое темно-серое вещество
с металлическим блеском, жирное на ощупь. Графит
легко измельчается (порошок графита называется
сажей). Кристаллическая решетка графита имеет
слоистое строение и состоит из слоев правильных
шестиугольников, конденсированных по всем
сторонам. Атомы углерода в графите находятся в
состоянии sp2-гибридизации. В
образовании химических связей участвуют три
электрона атома углерода, а четвертый электрон
остается относительно свободным, что
обеспечивает высокую электропроводность
графита.
Карбин – аллотропная модификация
углерода, очень редко встречающаяся в природе.
Это полимер, состоящий из линейных макромолекул,
атомы углерода находятся в состоянии sp-гибридизации.
Карбин – прозрачное и бесцветное вещество,
полупроводник. В химическом отношении менее
активен, чем графит. Широкого применения не
имеет.
Фуллерен – порошок темного цвета
(после очистки перекристаллизацией – желтые
кристаллы), полупроводник. В природе эта
аллотропная модификация углерода не
встречается, получена искусственным путем, в
настоящее время изучаются свойства фуллерена.
Состоит из молекул состава С60 или С70,
атомы углерода находятся в состоянии sp2-гибридизации.
Объемная молекула фуллерена имеет
полициклическое строение, по внешнему виду
напоминает футбольный мяч.
Х и м и ч е с к и е с в о й с т в а
В химическом отношении углерод при обычных
условиях малоактивен, но при нагревании
реагирует со многими простыми и сложными
веществами. В реакциях углерод может быть как
восстановителем, так и окислителем.
Н2 (+/–)*:
C + 2H2 CH4.
О2 (+):
C + O2 CO2,
2C + O2
2CO.
Металлы (+/–):
4Al + 3C Al4C3,
2C + Ca CaC2,
Ag, Au, Pt + реакция
не идет.
Неметаллы (+/–):
С + 2S CS2,
C + 2F2 CF4.
Н2О (+):
С + Н2О (г. ) CO + H2.
Основные оксиды (+):
2PbO + C 2Pb + CO2,
CaO + C Ca + CO,
или
CaO + 3C (кокс) CaC2
+ CO.
Кислотные оксиды (–).
Основания (–).
Кислоты-неокислители (–).
Кислоты-окислители (+):
С + 2H2SO4 (конц.) = CO2 + 2SO2
+ 2H2O,
С + 4HNO3 (конц.) = CO2 + 4NO2
+ 2H2O,
3С + 4HNO3 (разб.) = 3CO2 + 4NO
+ 2H2O.
Соли (+):
В природе углерод встречается как в виде
простого вещества (см. аллотропные модификации),
так и в виде соединений, важнейшими из которых
являются: мел, мрамор, известняк (CaCO3),
доломит (CaCO3•MgCO3) и др. В атмосфере
углерод содержится в виде угарного и углекислого
газов. Соединения углерода – основные
компоненты природного топлива. Кроме того, все
органические соединения являются соединениями
углерода.
В а ж н е й ш и е с о е д и н е н и я у г л
е р о д а
Оксид углерода(II), или угарный газ (СО).
Газ без цвета, вкуса и запаха, легче воздуха,
плохо растворим в воде, токсичен. Термически
устойчив. Атомы в молекуле угарного газа связаны
двумя видами ковалентной связи: ковалентной
полярной и донорно-акцепторной (кислород
является донором, углерод – акцептором):
По химическим свойствам угарный газ является
несолеобразующим оксидом, химически достаточно
пассивен. При повышенной температуре оксид
углерода(II) взаимодействует с кислородом и
оксидами металлов, являясь сильным
восстановителем, например:
2CO + O2 2CO2,
CO + MgO Mg +
CO2.
При пропускании смеси угарного газа и хлора
через слой активированного угля можно получить
ядовитый газ фосген (химическое оружие, вызывает
паралич дыхательных путей):
CO + Cl2 COCl2.
При нагревании монооксида углерода с водородом
в присутствии катализатора при повышенном
давлении образуется метиловый спирт:
CO + 2H2 CH3OH.
При пропускании угарного газа через расплав
щелочи при высоком давлении образуется соль
муравьиной кислоты, поэтому формально монооксид
углерода можно рассматривать как ангидрид
муравьиной кислоты:
CO + KOH (расплав) HCOOK.
Лабораторный метод получения угарного
газа – разложение муравьиной кислоты при
нагревании в присутствии дегидратирующего
агента:
HCOOH CO + H2O.
Кроме того, угарный газ можно получить неполным
сжиганием кокса или восстановлением углекислого
газа раскаленным коксом (t > 1000 °С):
2C + O2 2CO,
CO2 + С 2CO.
Оксид углерода(IV), или углекислый газ (СО2).
Газ без цвета, вкуса и запаха, тяжелее
воздуха, растворим в воде (88 объемов углекислого
газа в 100 объемах воды), не поддерживает горения и
дыхания (правда, в атмосфере углекислого газа
могут гореть некоторые активные металлы, отнимая
кислород, например магний):
CO2 + 2Mg
2MgO + C.
В молекуле CO2 атом углерода образует две -связи c атомами
кислорода. В образовании -связей принимают участие две
гибридные sp-орбитали. Поэтому молекула
углекислого газа имеет линейное строение,
неполярна:
В химическом отношении диоксид углерода
проявляет все свойства кислотного оксида:
CO2 + H2O H2CO3,
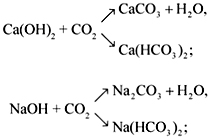
CO2 + CaO CaCO3,
CO2 + 2NaOH = Na2CO3 + H2O
или
CO2 + NaOH = NaHCO3.
Качественная реакция на углекислый газ –
пропускание его через известковую или баритовую
воду:
Ca(OH)2 + CO2 = CaCO3 + H2O,
аналогично протекает реакция с Ba(OH)2.
Углекислый газ можно получить разложением
известняка:
CaCO3 CaO +
CO2,
действием на карбонаты металлов растворами
сильных минеральных кислот:
CaCO3 + 2HCl = CaCl2 + H2O + CO2,
при полном сжигании кокса:
C + O2 CO2.
Угольная кислота (H2CO3) и ее
соли. Угольная кислота – слабая
двухосновная кислота, в свободном виде не
получена, существует только в растворе. Молекула
имеет полярное строение, атомы углерода в sp2-гибридизации.
Термически неустойчива, проявляет все свойства,
характерные для слабых кислот (даже органические
кислоты вытесняют угольную из ее солей):
H2CO3
H2O + CO2,
H2CO3 + Zn = ZnCO3 + H2,
H2CO3 + CaO = CaCO3 + H2O.
Угольная кислота, как двухосновная, образует
два типа солей: карбонаты и гидрокарбонаты:
Все карбонаты, кроме карбонатов щелочных
металлов, разлагаются при нагревании, например:
MgCO3 MgO +
CO2,
но Na2CO3 .
Качественной реакцией на карбонаты и
гидрокарбонаты является их взаимодействие с
растворами сильных минеральных кислот, например:
Na2CO3 + 2HCl = NaCl + H2O + CO2,
NaHCO3 + HCl = NaCl + H2O + CO2.
Тест по теме “Углерод и его
соединения”

концентрированную азотную кислоту до
соединения:
а) азот;
б) оксид азота(II);
в) оксид азота(IV);
г) аммиак.
2. При насыщении известковой воды
углекислым газом вначале выпадает осадок массой
20 г, который затем полностью растворяется.
Минимальный объем (в л) газа при н.у., который
необходим для этого, равен:
а) 4,48; б) 22,4; в) 11,2; г) 8,96.
3. Углерод может необратимо
взаимодействовать с:
а) кальцием; б) оксидом кальция;
в) водородом; г) серой.
4. Сколько электронов участвует в
образовании химических связей в молекуле
углекислого газа?
а) 8; б) 6; в) 4; г) 2.
5. Какие газы тяжелее воздуха?
а) Угарный газ; б) углекислый газ;
в) фосген; г) метан.
6. Сумма коэффициентов в уравнении реакции
взаимодействия углерода с концентрированной
серной кислотой равна:
а) 6; б) 8; в) 5; г) реакция невозможна.
7. Какие кислоты способны вытеснить
угольную кислоту из раствора ее соли?
а) Соляная; б) уксусная;
в) дихромовая; г) кремниевая.
8. Образец газа массой 112 г при н.у.
занимает объем 89,6 л. Определите газ.
а) Кислород; б) азот;
в) углекислый газ; г) угарный газ.
9. В молекуле угольной кислоты число -связей равно:
а) 1; б) 3; в) 5; г) 6.
10. В результате реакции
MgCO3 = MgO + CO2 – 102 кДж
поглотилось 5,1 кДж теплоты. Объем (в л)
выделившегося углекислого газа (н.у.) равен:
а) 11,2; б) 1,12; в) 2,24; г) 22,4.
Ключ к тесту
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| в | г | а, б, г | а | б, в | б | а, б, в | б, г | в | б |
Задачи и упражнения на
углерод и его соединения

о ч к и п р е в р а щ е н и й
1. Углерод —> метан —> угарный газ —>
углекислый газ —> карбонат кальция —>
гидрокарбонат кальция —> углекислый газ —>
угарный газ.
2. Оксид кальция —> карбид кальция —>
гидроксид кальция —> гидрокарбонат кальция
—> карбонат кальция —> оксид кальция.
3. Угольная кислота —> углекислый газ —>
угарный газ (+ оксид железа(II)) —> А (+ вода, +
карбонат бария) —> В —> углекислый газ.
1. Рассчитайте среднюю молярную
массу и плотность по диоксиду углерода смеси
газов, содержащей по объему 38 % фосгена и 62 %
углекислого газа (н.у.).
Ответ. M(смеси) = 64,9 г/моль; DCO2 = 1,475.
2. После прокаливания смеси карбонатов
магния и кальция масса выделившегося газа
оказалась в 1,1 раза меньше массы твердого
остатка. Определите массовые доли веществ в
исходной смеси.
Ответ. (MgCO3) = 43,3 %;
(CaCO3) = 56,7 %.
3. Через известковую воду пропустили 1,344 л
(н.у.) смеси оксидов углерода. Выпавший осадок
отфильтровали и прокалили. Масса полученного
вещества составила 1,4 г. Определите массу
исходной газовой смеси и ее относительную
плотность по воздуху.
Решение
При пропускании смеси СО и СО2 через
раствор Са(ОН)2
СО не реагирует с Са(ОН)2:
СО2 образует осадок СаСО3:
При прокаливании СаСО3 образуется СаО:
Количество вещества в смеси СО и СО2:
(смеси) = V/VM
= 1,344 / 22,4 = 0,06 моль;
(СaO) = m(CaO)
/ M(CaO) = 1,4 / 56 = 0,025 моль.
Из уравнений (2) и (3) следует:
(СaO) =
(СaCO3) =
(СO2).
Количество взятого СO2 (реакция 2)
составляет:
(СO2)
= 0,025 моль, тогда
(СO) =
0,06 – 0,025 = 0,035 моль.
m(CO2) = M(CO2) • (СO2) = 44?0,025 = 1,1 г,
m(CO) = M(CO) • (СO) = 28?0,035 = 0,98 г,
m(смеси СО и CO2) = 1,1 + 0,98 = 2,08 г.
Определим Mср смеси СО и CO2:
Mср = m(смеси) / • (смеси) = 2,08 / 0,06 = 34,7
г/моль.
Откуда
Dвозд = Mср / Mвозд
= 34,7 / 29 = 1,195.
Ответ. m(смеси) = 2,08 г; Dвозд
= 1,195.
4. Углекислый газ, полученный при полном
сгорании 4,48 л метана (н.у.), полностью поглотили
200 г 7%-го раствора гидроксида натрия.
Определите состав полученного раствора.
Ответ. NaHCO3 – 2 %; Na2CO3 –
7,6 %.
5. 400 г смеси карбоната и гидрокарбоната
натрия прокалили при 300 °С до постоянной массы,
равной 276 г. Определите массовые доли веществ в
исходной смеси.
Ответ. Na2CO3 – 16 %; NaHCO3 –
84 %.
6. Вычислите объем углекислого газа, который
добавили к 5,6 л угарного газа, если известно, что
число электронов в полученной смеси стало в 14,5
раз больше числа Авогадро. Объемы газов измерены
при н.у.
Ответ. V(CO2) = 11,2 л.
7. При разложении смеси карбонатов магния и
кальция массой 14,2 г выделилось 3,36 л (н.у.)
углекислого газа. Определите массовые доли
карбонатов в исходной смеси.
Ответ. MgCO3 – 29,6 %; CaCO3 –
70,4 %.
1. Растворение образца карбоната
кальция в соляной кислоте при 18 °С
заканчивается через 90 с, а при 38 °С такой же
образец соли растворяется за 10 с. За какое
время данный образец карбоната кальция
растворится при 48 °С?
Ответ. Зa 3,3 с.
2. Углекислый газ, образовавшийся при
сжигании 15 г угля, содержащего 20 % негорючих
примесей, пропущен через 480 г 10%-го раствора
гидроксида натрия. Рассчитайте массовые доли
образовавшихся в растворе солей.
Ответ. NaHCO3 – 13,6 %; Na2CO3 –
4,3 %.
3. Для полного осаждения карбоната кальция к
100 г 10,6%-го раствора карбоната натрия добавили
22,2%-й раствор хлорида кальция. Какую массу воды
необходимо удалить из фильтрата, чтобы получить
20%-й раствор хлорида натрия?
Р е ш е н и е
Уравнение протекающей реакции:
Na2CO3 + CaCl2 = CaCO3 + 2NaCl.
Определим количество вещества исходного Na2CO3:
(Na2CO3)
= m(р-ра Na2CO3)•(Na2CO3) / M(Na2CO3)
= 100•0,106/106 = 0,1 моль.
Из уравнения реакции:
(CaCl2)
= (Na2CO3)
= 0,1 моль,
(CaCO3)
= 0,1 моль, (NaCl) = 0,2
моль.
m(СaCl2) = (CaCl2)•M(CaCl2) = 0,1•111 = 11,1 г.
Найдем массу добавленного раствора CaCl2:
m(р-ра CaCl2) = m(CaCl2) / (CaCl2) =
11,1 / 0,222 = 50 г.
m(NaCl) = (NaCl)•M(NaCl) = 0,2•58,5 = 11,7 г.
По условию задачи в полученном растворе:
(NaCl) = 0,2 = m(NaCl) / m(р-ра),
следовательно,
m(р-ра) = 11,7 / 0,2 = 58,5 г.
m(р-ра) = m(р-ра Na2CO3) +
m(р-ра CaCl2) – m(CaCO3) – m(H2O);
m(CaCO3) = (CaCO3)•M(CaCO3) = 0,1•100 = 10 г.
Определяем массу удаленной воды:
58,5 = 100 + 50 – 10 – m(H2O),
m(H2O) = 81,5 г.
Ответ. 81,5 г воды.
4. Найдите массу раствора с массовой долей
карбоната натрия 5 % и массу декагидрата
карбоната натрия, которые потребуются для
приготовления 200 г 10%-го раствора карбоната
натрия.
Ответ. 5%-й раствор Na2CO3 –
168,75 г; Na2CO3•10H2O – 31,25 г.
5. Плотности по воздуху паров хлорида и
бромида одного и того же элемента равны
соответственно 5,31 и 11,45. Какой элемент входит в
указанные галогениды?
Ответ. Углерод.
6. При длительном прокаливании некоторой
массы гидрокарбоната двухвалентного металла
выделилось 17,92 л газа (н.у.), а масса оставшегося
вещества составила 31,8 г. Определите состав и
массу исходного гидрокарбоната.
Ответ. Cu(HCO3)2 – 74,4 г.
К а ч е с т в е н н ы е з а д а ч и
1. С какими из перечисленных ниже соединений
будет реагировать углекислый газ: негашеная
известь, гашеная известь, каустическая сода,
кристаллическая сода, магний, серная кислота,
серный ангидрид. Подтвердите свой ответ
уравнениями реакций.
Ответ. Уравнения реакций:
CaO + CO2
СaCO3;
Na2CO3•10H2O + СО2
—> NaHCO3;
Mg + CO2 MgO +
CO;
H2SO4 + CO2 …;
SO3 + CO2 ….
2. Вещество А, входящее в состав одного из
самых распространенных в земной коре минералов,
разлагается при высокой температуре на два
оксида, один из которых В всегда образуется в
процессе жизнедеятельности. При взаимодействии
вещества В с графитом при нагревании получается
токсичный для теплокровных животных газ С, без
цвета и запаха, горючий. Идентифицируйте
вещества, составьте уравнения реакций.
Ответ. Вещества: А – СaCO3,
В – СО2, C – CO.
Уравнения реакций:
СaCO3 CaO + CO2,
CO2 + C 2CO.
3. При пропускании бесцветного газа А без
запаха над простым веществом В при высокой
температуре образуется только одно вещество С,
которое восстанавливает оксид D черного цвета до
красного металла Е. Идентифицируйте вещества,
составьте уравнения реакций.
Ответ. Вещества: А – CO2,
В – С,
C – CO, D – CuO, E – Cu.
Уравнения реакций:
CO2 + C 2CO,
CuO + CO Сu + CO2.
4. При нагревании соли А, используемой в
пищевой отрасли промышленности, образуется соль
В и бесцветный газ без запаха С. При действии на
соль В соляной кислоты выделяется газ С.
Идентифицируйте вещества, составьте уравнения
реакций.
Ответ. Вещества: А – NaHCO3,
В – Na2CO3, С – CO2.
Уравнения реакций:
2NaHCO3 Na2CO3
+ H2O + CO2,
Na2CO3 + 2HCl = 2NaСl + H2O + CO2.
* Знак +/– означает,
что данная реакция протекает не со всеми
реагентами или в специфических условиях.
Продолжение следует