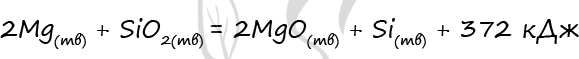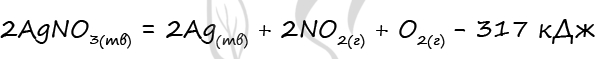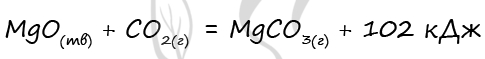Всего: 93 1–20 | 21–40 | 41–60 | 61–80 …
Добавить в вариант
Чтобы вскипятить чайник, требуется 315,2 кДж теплоты. Сколько граммов угля надо сжечь, чтобы получить такое количество теплоты? Примите, что уголь — это чистый углерод. Термохимическое уравнение сгорания углерода имеет вид
Ответ дайте в граммах и округлите до десятых.
Чтобы нагреть воздух в двухкомнатной квартире на один градус, требуется 250 кДж теплоты. Сколько литров метана (н. у.) надо сжечь, чтобы получить такое количество теплоты? Термохимическое уравнение сгорания метана имеет вид
Ответ округлите до целых.
Синтез аммиака протекает в соответствии с термохимическим уравнением реакции
Определите количество теплоты (кДж), которое выделится в результате образования 560 мл (н. у.) газообразного аммиака. (Запишите число с точностью до сотых.)
Источник: Демонстрационная версия ЕГЭ—2022 по химии, Демонстрационная версия ЕГЭ—2023 по химии
Из предложенного перечня выберите все экзотермические реакции.
1) гашение оксида кальция водой
2) термическое разложение нитрата серебра
3) нейтрализация соляной кислоты гидроксидом калия
4) синтез аммиака из простых веществ
5) синтез глюкозы из углекислого газа и воды
Запишите номера выбранных ответов в порядке возрастания.
Задания Д28 № 774
В соответствии с термохимическим уравнением
для получения 10,8 г серебра необходимо затратить теплоту в количестве
1) 31,7 кДж
2) 158,5 кДж
3) 5,3 кДж
4) 15,85 кДж
Задания Д28 № 258
В соответствии с термохимическим уравнением
при сгорании 44,8 л этена (н. у.) выделяется теплота в количестве
1) 700 кДж
2) 2800 кДж
3) 2100 кДж
4) 10 500 кДж
Реакция нейтрализации в водном растворе описывается термохимическим уравнением:
При взаимодействии гидроксида бария с соляной кислотой выделилось 11,2 кДж теплоты. Сколько граммов хлорида бария образовалось? (Запишите число с точностью до десятых.)
Задания Д28 № 30
Согласно термохимическому уравнению реакции
для получения 15 кДж теплоты потребуется оксид кальция массой
1) 3 г
2) 6 г
3) 12 г
4) 56 г
Источник: Демонстрационная версия ЕГЭ—2012 по химии
Задания Д28 № 430
В результате реакции, термохимическое уравнение которой
,
выделилось 265 кДж теплоты.
Масса образовавшегося при этом оксида меди (II) равна
1) 40 г
2) 80 г
3) 160 г
4) 190 г
Задания Д28 № 516
В соответствии с термохимическим уравнением
для получения 2111 кДж теплоты необходимо затратить кислород объемом (н. у.)
1) 100 л
2) 110 л
3) 120 л
4) 130 л
Задания Д28 № 602
В реакцию, термохимическое уравнение которой
вступило 8 г оксида магния. Количество выделившейся при этом теплоты равно
1) 102 кДж
2) 204 кДж
3) 20,4 кДж
4) 1,02 кДж
Задания Д28 № 989
Согласно термохимическому уравнению реакции
при получении 31,36 л (н. у.) оксида азота (II) количество выделившейся теплоты будет равно
1) 71,6 кДж
2) 501,2 кДж
3) 250,6 кДж
4) 224 кДж
В соответствии с термохимическим уравнением реакции
для получения 160 кДж теплоты используется вода массой
1) 9 г
2) 18 г
3) 27,2 г
4) 44,4 г
Источник: ЕГЭ по химии 10.06.2013. Основная волна. Дальний Восток. Вариант 3
В соответствии с термохимическим уравнением реакции
для получения 634 кДж теплоты потребуется аммиак количеством вещества ____ моль. (Ответ запишите с точностью до целых.)
Источник: ЕГЭ по химии 10.06.2013. Основная волна. Сибирь. Вариант 1
В результате реакции, термохимическое уравнение которой
выделилось 171 кДж теплоты. Вычислите массу гидроксида натрия, который был нейтрализован соляной кислотой. Ответ укажите в граммах с точностью до целых.
Источник: Типовые тестовые задания по химии под редакцией Ю. Н. Медведева. 2016 г.
В результате реакции, термохимическое уравнение которой
выделилось 28,5 кДж теплоты. Вычислите массу азотной кислоты, которая была нейтрализована гидроксидом калия. Ответ укажите в граммах с точностью до десятых.
Источник: Типовые тестовые задания по химии под редакцией Ю. Н. Медведева. 2016 г.
Вычислите количество теплоты, выделяющееся при разложении 51,2 г нитрита аммония в соответствии с термохимическим уравнением реакции:
Запишите число с точностью до десятых.
Источник: ЕГЭ по химии 2021. Досрочная волна. Вариант 1
Задания Д28 № 688
В соответствии с термохимическим уравнением реакции
количество теплоты, необходимое для разложения 1,7 г нитрата серебра, составляет
1) 31,7 кДж
2) 1,585 кДж
3) 3,17 кДж
4) 15,85 кДж
Задания Д28 № 731
В соответствии с термохимическим уравнением
при получении 200 г оксида магния количество выделившейся теплоты будет равно
1) 1860 кДж
2) 465 кДж
3) 620 кДж
4) 930 кДж
Задания Д28 № 817
B результате реакции, термохимическое уравнение которой
выделилось 5,74 кДж теплоты. Объём (н. у.) получившегося при этом кислорода составил
1) 100 л
2) 0,224 л
3) 1,568 л
4) 4,48 л
Всего: 93 1–20 | 21–40 | 41–60 | 61–80 …
7929. В соответствии с термохимическим уравнением
1206 кДж теплоты выделяется при горении угля массой _____ г.

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7929.
7894. В ходе реакции
выделилось 395 кДж тепла. Чему равна масса оксида серы(VI), полученного при этом?

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7894.
7859. В результате реакции, термохимическое уравнение которой
выделилось 5,74 кДж теплоты. Объём (н.у.) получившегося при этом кислорода составил _____ л. (Запишите число с точностью до сотых.)

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7859.
7824. соответствии с термохимическим уравнением
для получения 10,8 г серебра необходимо затратить теплоту в количестве ____ кДж. (Запишите число с точностью до сотых.)

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7824.
7789. В соответствии с термохимическим уравнением
при получении 200 г оксида магния количество выделившейся теплоты будет равно _____ кДж.

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7789.
7754. В соответствии с термохимическим уравнением реакции
количество теплоты, необходимое для разложения 1,7 г нитрата серебра, составляет _____ кДж (ответ округлите до сотых).

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7754.
7684. В реакцию, термохимическое уравнение которой
ступило 8 г оксида магния. Количество выделившейся при этом теплоты равно _____ кДж. (Запишите число с точностью до десятых.)

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7684.
7614. В соответствии с термохимическим уравнением
для получения 2111 кДж теплоты необходимо затратить кислород объёмом (н. у.) _____ л.

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7614.
7579. При окислении 4,8 г угля до оксида углерода(II) согласно уравнению
выделится теплота в количестве _____ кДж.

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7579.
7544. В результате реакции, термохимическое уравнение которой
выделилось 265 кДж теплоты. Масса образовавшегося при этом оксида меди(II) равна ____ г.

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7544.
Для вас приятно генерировать тесты, создавайте их почаще
Чтобы поделиться, нажимайте
Задания ЕГЭ по номерам (по темам)
Предлагаем вам Задания ЕГЭ по номерам формата ЕГЭ 2022 по химии с ответами и видео-объяснениями. Листайте ниже и выбирайте тот номер задания, который вы хотите выполнить.
- Первая часть (указывается только ответ, без решения)
1. Электронная конфигурация атома
- Часть 1 (30 заданий с ответами)
- Часть 2 (30 заданий с ответами, а для некоторых заданий — видеообъяснения)
2. Закономерности изменения химических свойств элементов. Характеристика элементов
- Часть 1 (30 заданий с ответами)
- Часть 2 (30 заданий с ответами, а для некоторых заданий — видеообъяснения)
3. Электроотрицательность, степень окисления и валентность химических элементов
- Часть 1 (30 заданий с ответами)
- Часть 2 (30 заданий с ответами, а для некоторых заданий — видеообъяснения)
4. Характеристики химических связей. Зависимость свойств веществ от их состава и строения
- Часть 1 (30 заданий с ответами)
- Часть 2 (30 заданий с ответами, а для некоторых заданий — видеообъяснения)
5. Классификация и номенклатура неорганических веществ
- Часть 1 (30 заданий с ответами) — старый формат
- Часть 2 (30 заданий с ответами, а для некоторых заданий — видеообъяснения) — старый формат
- Часть 3 (10 заданий с ответами) — новый формат 2022 года
6. Свойства оснований, амфотерных гидроксидов, кислот и солей. Ионный обмен и диссоциация
- Часть 1 (30 заданий с ответами)
- Часть 2 (30 заданий с ответами, а для некоторых заданий — видеообъяснения)
7. Свойства неорганических веществ
- Часть 1 (30 заданий с ответами)
- Часть 2 (30 заданий с ответами, а для некоторых заданий — видеообъяснения)
8. Свойства неорганических веществ
- Часть 1 (30 заданий с ответами)
- Часть 2 (30 заданий с ответами, а для некоторых заданий — видеообъяснения)
9. Взаимосвязь неорганических веществ
- Часть 1 (30 заданий с ответами)
- Часть 2 (30 заданий с ответами, а для некоторых заданий — видеообъяснения)
10. Классификация и номенклатура органических веществ
- Часть 1 (30 заданий с ответами)
- Часть 2 (30 заданий с ответами, а для некоторых заданий — видеообъяснения)
11. Теория строения органических соединений. Типы связей в молекулах органических веществ. Изомеры. Гомологи
- Часть 1 (30 заданий с ответами)
- Часть 2 (30 заданий с ответами, а для некоторых заданий — видеообъяснения)
12. Свойства углеводородов и кислородосодержащих соединений. Получение углеводородов и кислородосодержащих соединений
- Часть 1 (30 заданий с ответами) — старый формат
- Часть 2 (30 заданий с ответами, а для некоторых заданий — видеообъяснения) — старый формат
- Часть 3 (30 заданий с ответами) — старый формат
- Часть 4 (30 заданий с ответами, а для некоторых заданий — видеообъяснения) — старый формат
- Часть 5 (5 заданий с ответами) — новый формат 2022 года
13. Свойства азотсодержащих органических соединений. Белки, жиры, углеводы
- Часть 1 (30 заданий с ответами)
- Часть 2 (30 заданий с ответами, а для некоторых заданий — видеообъяснения)
14. Характерные химические свойства углеводородов. Механизмы реакций
- Часть 1 (30 заданий с ответами)
- Часть 2 (30 заданий с ответами, а для некоторых заданий — видеообъяснения)
15. Свойства спиртов, альдегидов, кислот, сложных эфиров, фенола
- Часть 1 (30 заданий с ответами)
- Часть 2 (30 заданий с ответами, а для некоторых заданий — видеообъяснения)
16. Взаимосвязь углеводородов и кислородосодержащих органических соединений
- Часть 1 (30 заданий с ответами)
- Часть 2 (30 заданий с ответами, а для некоторых заданий — видеообъяснения)
17. Классификация химических реакций в неорганической и органической химии
- Часть 1 (30 заданий с ответами)
- Часть 2 (30 заданий с ответами, а для некоторых заданий — видеообъяснения)
18. Скорость реакции, ее зависимость от различных факторов
- Часть 1 (30 заданий с ответами)
- Часть 2 (30 заданий с ответами, а для некоторых заданий — видеообъяснения)
19. Реакции окислительно-восстановительные
- Часть 1 (30 заданий с ответами)
- Часть 2 (30 заданий с ответами, а для некоторых заданий — видеообъяснения)
20. Электролиз расплавов и растворов
- Часть 1 (30 заданий с ответами)
- Часть 2 (30 заданий с ответами, а для некоторых заданий — видеообъяснения)
21. Гидролиз солей. Среда водных растворов: кислая, нейтральная, щелочная. pH
- Часть 1 (30 заданий с ответами) — старый формат
- Часть 2 (30 заданий с ответами, а для некоторых заданий — видеообъяснения) — старый формат
- Часть 3 (5 заданий с ответами) — новый формат 2022 года
22. Обратимые и необратимые химические реакции. Химическое равновесие
- Часть 1 (30 заданий с ответами)
- Часть 2 (30 заданий с ответами, а для некоторых заданий — видеообъяснения)
23. Химическое равновесие. Расчёты концентраций — новое задание 2022 года
- Часть 1 (5 заданий с ответами)
24. Качественные реакции органических и неорганических соединений
- Часть 1 (30 заданий с ответами)
- Часть 2 (30 заданий с ответами, а для некоторых заданий — видеообъяснения)
25. Химическая лаборатория. Химическая промышленность. Полимеры
- Часть 1 (30 заданий с ответами)
- Часть 2 (30 заданий с ответами, а для некоторых заданий — видеообъяснения)
26. Расчёты с использованием понятия «массовая доля вещества в растворе»
- Часть 1 (30 заданий с ответами)
- Часть 2 (30 заданий с ответами, а для некоторых заданий — видеообъяснения)
27. Расчеты теплового эффекта (по термохимическим уравнениям)
- Часть 1 (30 заданий с ответами, а для некоторых заданий — видеообъяснения)
28. Расчет массы или объёма вещества по параметрам одного из участвующих в реакции веществ. Выход продукта. Примеси. Массовая доля вещества в смеси
- Часть 1 (30 заданий с ответами)
- Часть 2 (30 заданий с ответами, а для некоторых заданий — видеообъяснения)
- Часть 3 (29 заданий с ответами, а для некоторых заданий — видеообъяснения)
- Часть 4 (5 заданий с ответами, а для некоторых заданий — видеообъяснения) — задачи, которых не было до 2022 года
- Вторая часть (оформляется подробным решением на бланках ответов)
29. Окислительно-восстановительные реакции
- Часть 1 (30 заданий с ответами)
- Часть 2 (17 заданий с ответами, реальный ЕГЭ 2018)
- Часть 3 (22 задания с ответами, а также для некоторых заданий — видеообъяснения)
- Часть 4 (23 задания с ответами, реальный ЕГЭ 2019)
- Часть 5 (33 задания с ответами, реальный ЕГЭ 2020)
30. Реакции ионного обмена
- Часть 1 (30 заданий с ответами)
- Часть 2 (17 заданий с ответами, реальный ЕГЭ 2018)
- Часть 3 (22 задания с ответами, а также для некоторых заданий — видеообъяснения)
- Часть 4 (23 заданий с ответами, реальный ЕГЭ 2019)
- Часть 5 (32 задания с ответами, реальный ЕГЭ 2020)
31. Взаимосвязь различных классов неорганических веществ: описание реакций
- Часть 1 (30 заданий с ответами)
- Часть 2 (17 заданий с ответами, реальный ЕГЭ 2018)
- Часть 3 (22 задания с ответами, а также для некоторых заданий — видеообъяснения)
- Часть 4 (23 задания с ответами, реальный ЕГЭ 2019)
- Часть 5 (36 заданий с ответами, реальный ЕГЭ 2020)
32. Взаимосвязь органических соединений
- Часть 1 (30 заданий с ответами)
- Часть 2 (17 заданий с ответами, реальный ЕГЭ 2018)
- Часть 3 (22 задания с ответами, а также для некоторых заданий — видеообъяснения)
- Часть 4 (23 задания с ответами, реальный ЕГЭ 2019)
- Часть 5 (35 заданий с ответами, реальный ЕГЭ 2020)
33. Расчёты с использованием понятий растворимость, массовая доля вещества в растворе, избыток, примеси. Расчёты массовой доли химического соединения (атомов элемента) в смеси
- Часть 1 (17 задач с решениями и видео-объяснениями, реальный ЕГЭ 2018)
- Часть 2 (30 задач с решениями и видео-объяснениями, реальный ЕГЭ 2019)
- Часть 3 (27 задач с решениями и видео-объяснениями, пробные и тренеровочные варианты)
- Часть 4 (43 задачи с решениями и видео-объяснениями, реальный ЕГЭ 2020)
- Часть 5. Задачи на «атомистику» (66 задач с видео-объяснениями, появились на ЕГЭ 2020)
- Часть 6 (16 задач с видео-объяснениями и ответами, реальный ЕГЭ 2021)
- Часть 7 (38 задач с видео-объяснениями и ответами, возможные задачи ЕГЭ 2022)
34. Нахождение молекулярной и структурной формулы органического вещества
- Часть 1 (17 задач с решениями и видео-объяснениями, реальный ЕГЭ 2018)
- Часть 2 (21 задача с решениями и видео-объяснениями, реальные ЕГЭ 2019)
- Часть 3 (27 задач с решениями и видео-объяснениями, пробные и тренеровочные варианты)
- Часть 4 (43 задачи с решениями и видео-объяснениями, реальный ЕГЭ 2020)
- Часть 5 (31 задача с решениями и видео-объяснениями, возможные задачи ЕГЭ 2022)
Задания ЕГЭ 2021, которых НЕ будет в таком формате в ЕГЭ 2022:
Химические свойства неорганических веществ
- Часть 1 (30 заданий с ответами)
- Часть 2 (30 заданий с ответами, а для некоторых заданий — видеообъяснения)
А также вы можете получить доступ ко всем видео-урокам, заданиям реального ЕГЭ с подробными видео-объяснениями, задачам и всем материалам сайта кликнув:
- Реальный вариант ЕГЭ по химии 2021. Центр
- Реальный вариант ЕГЭ по химии 2021. Сибирь
- Реальный вариант ЕГЭ по химии 2021. Урал
- Посмотреть видео-объяснения решений всех типов задач вы можете здесь, нажав на эту строку
- Просмотреть задания ЕГЭ всех лет вы можете здесь, нажав на эту строку
- Посмотреть все видео-уроки вы можете здесь, нажав на эту строку
- Прочитать всю теорию для подготовки к ЕГЭ и ЦТ вы можете здесь, нажав на эту строку
- Все видео-объяснения вы можете найти на YouTube канале, нажав на эту строку
-
Типовые
задания с решениями ЕГЭ по химии: задачи, при решении которых необходимо
осуществить расчеты по термохимическим уравнениям реакций.
Умение решать расчётные задачи является одним из
основных показателей уровня химического развития, глубины и полноты усвоения
учащимися теоретического материала, наличия у них навыков приобретённых знаний
с достаточной самостоятельностью.
Проверяемый элемент содержания заданий ЕГЭ включает расчеты объемных отношений газов при
химических реакциях, а так же расчеты по термохимическим уравнениям реакций. В
данной статье будут рассмотрены задачи второго типа.
Термохимические
уравнения включают в себя кроме химических формул тепловой эффект реакции.
Числовое значение в уравнении реакции строго соответствует количествам веществ,
участников реакции, т.е. коэффициентам. Благодаря этому соответствию,
можно установить пропорциональные отношения между количеством вещества или
массой и количеством теплоты в этой реакции.
Между
количеством теплоты, выделившимся или затраченным в ходе химической реакции, и
количеством веществ, участвующих в этой реакции, существует прямо
пропорциональная зависимость:
n:Q = n1:Q1.
Величина
постоянная для данной реакции.
Любая величина из пропорции может быть неизвестной. Задачи решаются методом
пропорции.
Например:
Термохимическое уравнение разложения малахита
(CuOH)2
CO3 = 2CuO + H 2O + CO
2 — 47 кДж
Мы
видим, что на разложение 1 моля малахита необходимо израсходовать 47 кДж, при
этом образуется 2 моля оксида меди, 1 моль воды и 1 моль углекислого газа. Если
мы затратим энергии в 2 раза больше, мы сумеем разложить 2 моля малахита, при
этом получим 4 моля оксида меди, 2 моля воды и 2 моля углекислого газа.
Аналогично
можно установить пропорциональные отношения, используя коэффициенты и
молярные массы участников реакции. 47 кДж энергии затратится на
разложение 94 г малахита, при этом выделится 160
г оксида меди, 18 г воды и 44 г углекислого газа. Пропорция несложная,
но, используя массовые числа, учащиеся часто допускают расчетные ошибки,
поэтому рекомендуется решать задачи с пропорциями через количество вещества.
Алгоритм
решения задач
Последовательность
действий:
1) Данные из
условия задачи написать над уравнением реакции
2) Под
формулой вещества написать его количество (согласно коэффициенту);
произведение молярной массы на количество вещества. Над количеством теплоты в
уравнении реакции поставить х.
3) Составить
пропорцию.
4) Вычислить
х.
5) Записать
ответ.
Пример:
Сколько теплоты
выделится при растворении 200 г оксида меди (II) (СuO) в соляной
кислоте (водный раствор HCl), если
термохимическое уравнение реакции: CuO + 2HCl = CuCl2 + H2O + 63,6
кДж
|
Последовательность выполнения действий |
Оформление решения задачи |
|
1.С |
Дано: m(СuO) = 200 Q — ? М(СuO) = 80 г/моль |
|
2. |
Решение: n = m/М n = |
|
3.Составим |
2,5 CuO + 2HCl = CuCl2 + H2O + 63,6 1 моль |
|
4. Составим |
200/80=х/63,6 |
|
5. |
х |
|
6. |
Ответ: 159 |
Задачи на
вычисления по термохимическим уравнениям. Типовые задачи и решения.
1. Количество
теплоты, которое выделится при образовании 120
г MgO в
результате реакции горения магния, термохимическое уравнение которой:
2 Mg + O2 =
2MgO + 1204 кДж, равно
а) 602 кДж б)
301 кДж в) 2408 кДж г) 1803 кДж
2. В
реакцию, термохимическое уравнение которой S
+ O2 = SO2
+ 297 кДж, вступила сера массой 1 г. Количество теплоты, выделившееся при этом,
равно:
а) 9,28 кДж б)
2,97 кДж в) 29,7 1 кДж г) 74,25 кДж
3. Какое
количество теплоты выделится при сгорании графита массой 2,4
г, если термохимическое уравнение реакции C + O2 = CO2
+ 402 кДж?
а) 984 кДж б)
40,2 кДж в) 98,4 кДж г) 80,4 кДж
4. Термохимическое
уравнение горения фосфора: 4P + 5O2 = 2P2O5 +
3010 кДж. Какое количество теплоты выделится при сгорании 62
г фосфора?
а) 6020 кДж б)
752,5 кДж в) 301кДж г) 1505 кДж
5. Какое
количество теплоты выделится при сгорании метана объемом 5,6
л (н.у.), если термохимическое уравнение реакции СН4
+ 2О2 = СО2
+ 2Н2О + 892 кДж?
а) 22,3 кДж б)
2,23 кДж в) 223 кДж г) 446 кДж
6. Сколько
теплоты выделится при растворении 200 г оксида меди (II)
(СuO) в соляной кислоте, если
термохимическое уравнение реакции: CuO
+ 2HCl = CuCl2
+ H2O
+ 63,6 кДж
а) 159 кДж б)
318 кДж в) 15,9кДж г) 636 кДж
7. В
результате реакции, термохимическое уравнение которой
2 C2H2+ 5O2 = 4CO2 +2H2O + 2610 кДж
выделилось 652,5 кДж теплоты. Масса
сгоревшего ацетилена составила:
а) 13
г б) 26 г в) 52г г) 5,2г
8. В
результате горения 48 г метана выделилось 2406 кДж теплоты. Количество теплоты,
указанное в термохимическом уравнении этой реакции составит:
а) 401 кДж б)
802 кДж в) 1203кДж г) 4812 кДж
9. На
разложение бертолетовой соли по реакции, термохимическое уравнение
которой
2KClO3 = 2KCl + 3O2 – 91 кДж,
было затрачено 182 кДж
теплоты.
Объем кислорода (при н.у.) выделившийся при этом, составил:
а) 134,4л б)
44,8л в) 89,6л г) 179,2л
10. В результате
реакции, термохимическое уравнение которой H2+ Cl2 =
2HCl + 184,36
кДж, выделилось 921,8 кДж теплоты. Объем хлора, затраченный на
образование хлороводорода (при н.у.) при этом составил:
а) 134,4л б)
112л в) 44,8л г) 96л
11.Согласно
термохимическому уравнению реакции 2СО(г) + О2(г) = 2СО2(г)
+ 566 кДж при сжигании оксида углерода (II) выделилось 424,5 кДж теплоты. Объем
(н.у.) сгоревшего газа составил
а) 66,2 л б) 33,6 л в) 44,8
л г) 12 л
12.Согласно
термохимическому уравнению реакции 3Cu + 8HNO3
= 3Cu(NO3)2
+ 2NO + 4H2O
+ 385 кДж, при получении 15,68 л NO
(н.у.), количество выделившейся теплоты составило:
а) 358 кДж б)
716 кДж в) 134,75 кДж г) 22,4 кДж
13.По термохимическому
уравнению реакции 2Сu + О2
= 2СuО + 311 кДж
вычислите. Количество теплоты, которая выделится при окислении 384
г меди, составит:
а) 622 кДж б)
716 кДж в) 466,5 кДж г) 933 кДж
14.В результате реакции, термохимическое
уравнение которой
2Cl2O7
= 2Cl2 + 7O2
+ 574 кДж, выделилось 5,74 кДж теплоты. Объем образовавшегося при этом
кислорода (н.у.) составил:
а) 100 л б)
0,224 л в) 1,568 л г) 4,48
л
15.В реакцию,
термохимическое уравнение которой MgO(тв) + CO(г) = MgCO3(тв) + 102
кДж, вступило 8 г оксида магния. Количество теплоты, выделившейся при этом, равно:
а) 102 кДж б)
204 кДж в) 20,4 кДж г) 1,02 кДж
Ответы (ключ)
|
№ |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
|
ответ |
г |
а |
в |
г |
в |
а |
а |
б |
а |
б |
б |
в |
г |
в |
в |
Подробное решение
задач.
1. Количество
теплоты, которое выделится при образовании 120
г MgO в
результате реакции горения магния, термохимическое уравнение которой:
2 Mg + O2 =
2MgO + 1204 кДж, равно
а)
602 кДж б) 301 кДж в) 2408 кДж г)
1803 кДж
|
Дано: m (Mg0) = _____________ Q -? |
Решение: 1) Определяем n = m / M n(MgO) = 2) Составляем пропорцию с учетом коэффициентов в уравнении По По |
Отсюда:
|
3 моль* |
|||
|
Х |
= |
———————— |
= 1803 кДж |
|
2моль |
Ответ: при образовании 120г
оксида магния выделится 1803 кДж энергии.
2. В
реакцию, термохимическое уравнение которой S + O2
= SO2 + 297 кДж, вступила сера массой 1
г. Количество теплоты, выделившееся при этом, равно:
а) 9,28 кДж б)
2,97 кДж в) 29,7 1 кДж г) 74,25 кДж
Дано:
m(S)
= 1 г.,
________________
Q = ?
Решение.
n
(S) = m/M n (S)=
1г/32(г/моль) = 0,031моль;
Составляем пропорцию по
термохимическому уравнению реакции:
S
+ O2 = SO2 + 297 кДж
При сгорании 1 моля S
выделится 297 кДж теплоты
При сгорании 0,031 моля S
выделится Х кДж теплоты
Х= (297 кДж* 0,031моль)/1моль
= 9,28 кДж
Ответ: 9,28 кДж
3.
Какое количество теплоты выделится при сгорании графита массой 2,4
г, если термохимическое уравнение реакции C + O2 = CO2
+ 402 кДж?
а) 984 кДж б)
40,2 кДж в) 98,4 кДж г) 80,4 кДж
Дано:
m(С) = 2,4
г.,
________________
Q = ?
Решение.
n
(С) = m/M n (С)= 2,4г/12(г/моль) =
0,2 моль;
Составляем пропорцию по
термохимическому уравнению реакции:
C + O2 = CO2
+ 402 кДж.
При сгорании 1 моля С выделится
402 кДж теплоты
При сгорании 0,2 моля С выделится
Х кДж теплоты
Х= (492 кДж* 0,2моль)/1моль =
98,4 кДж
Ответ: 98,4 кДж
4. Термохимическое
уравнение горения фосфора: 4P + 5O2 = 2P2O5 +
3010 кДж. Какое количество теплоты выделится при сгорании 62
г фосфора?
а) 6020 кДж б)
752,5 кДж в) 301кДж г) 1505 кДж
Дано:
m(Р) = 62
г.,
________________
Q = ?
Решение.
n (Р) =
m/M n (Р)= 62г/31(г/моль) =
2 моль;
Составляем пропорцию по
термохимическому уравнению реакции:
4P + 5O2
= 2P2O5 + 3010 кДж
При сгорании 4 моль Р
выделится 3010 кДж теплоты
При сгорании 2 моль Р выделится
Х кДж теплоты
Х= (3010 кДж* 2моль)/4моль
= 1505 кДж
Ответ: 1505 кДж
5. Какое
количество теплоты выделится при сгорании метана объемом 5,6
л (н.у.), если термохимическое уравнение реакции СН4 +
2О2 = СО2 + 2Н2О + 892 кДж?
а)
22,3 кДж б) 2,23 кДж в) 223 кДж г)
446 кДж
Дано:
V (СН4)
= 5,6 л
_____________
Q = ?
Решение.
5,6 л Х кДж
СН4
+ 2О2 = СО2 + 2Н2О + 892 кДж
1
моль 892 кДж
22,4 л 892
кДж
5,6
л/22,4 л = Х кДж/892 кДж
Х=
5,6 л * 892 кДж/22,4 л = 223 кДж
Ответ: при сгорании метана
объемом 5,6 л выделится 223 кДж теплоты
6. Сколько
теплоты выделится при растворении 200 г оксида меди (II)
(СuO)
в соляной кислоте, если термохимическое уравнение реакции: CuO
+ 2HCl
= CuCl2
+ H2O
+ 63,6 кДж
а) 159 кДж б)
318 кДж в) 15,9кДж г) 636 кДж
Дано:
m(СuO)
= 200 г.,
________________
Q = ?
Решение.
n (СuO)
= m/M n (СuO)=
200г/80(г/моль) = 2,5 моль;
Составляем пропорцию по
термохимическому уравнению реакции:
CuO
+ 2HCl
= CuCl2
+ H2O
+ 63,6 кДж
При растворении 1 моль СuO
выделится 63,6 кДж теплоты
При растворении 2,5
моль СuO выделится
Х кДж теплоты
Х= (63,5 кДж* 2,5моль)/1моль
= 159кДж
Ответ: 159 кДж
7. В
результате реакции, термохимическое уравнение которой
2 C2H2+ 5O2 =
4CO2 +2H2O + 2610 кДж
выделилось
652,5 кДж теплоты. Масса сгоревшего ацетилена составила:
а) 13
г б) 26 г в) 52г г) 5,2г
|
Дано: Q1 = 652,5 _____________ m(C2H2)-? |
Решение: 1) Установим По По условию Решаем
2) m = 0,5 моль * 26 г/моль = 13 |
Ответ: масса сгоревшего ацетилена 13
г.
8. В
результате горения 48 г метана выделилось 2406 кДж теплоты. Количество теплоты,
указанное в термохимическом уравнении этой реакции составит:
а) 401 кДж б)
802 кДж в) 1203кДж г) 4812 кДж
|
Дано: m(CH4)= 48г Q1 = 2406 _____________ Q -? |
Решение: 1. Запишем уравнение реакции CH4 + 2O2 = 2. Определим количество 48 n = m / M n(CH4) = 48г/ 3. По условию По Решаем пропорцию
Термохимическое CH4+ |
Ответ: 802 кДж.
9. На
разложение бертолетовой соли по реакции, термохимическое уравнение
которой
2KClO3 = 2KCl + 3O2 – 91 кДж,
было затрачено 182 кДж
теплоты. Объем кислорода (при н.у.) выделившийся при этом, составил:
а) 134,4л б)
44,8л в) 89,6л г) 179,2л
|
Дано: Q1 = 91 ___________ V (O2)-? |
Решение: 1)Установим По По условию Решаем пропорцию
2) Вычислим объем (Vm = 22,4 V(O2) = |
Ответ: объем выделившегося кислорода равен
134,4 л.
10. В
результате реакции, термохимическое уравнение которой H2+ Cl2 =
2HCl + 184,36
кДж, выделилось 921,8 кДж теплоты. Объем хлора, затраченный на
образование хлороводорода (при н.у.) при этом составил:
) 134,4л б) 112л в)
44,8л г) 96л
|
Дано: Q1 = 921,8 ___________ V (Cl2)-? |
Решение: 1)Установим По По условию Решаем пропорцию
2) Вычислим объем (Vm = 22,4 V(O2) = |
Ответ: объем вступившего в реакцию хлора
равен 112 л.
11. Согласно
термохимическому уравнению реакции 2СО(г) + О2(г) = 2СО2(г)
+ 566 кДж при сжигании оксида углерода (II) выделилось 424,5 кДж теплоты. Объем
(н.у.) сгоревшего газа составил
1) 66,2 л 2) 33,6 л 3) 44,8
л 4) 12 л
|
Дано: Q1 = 152 ___________ V (СО)-? |
Решение: 1)Установим По уравнению По условию Решаем пропорцию
2) Вычислим объем угарного (Vm = 22,4 V(O2) = |
Ответ: объем вступившего в реакцию хлора
равен 33,6 л.
12. Согласно
термохимическому уравнению реакции 3Cu + 8HNO3
= 3Cu(NO3)2 + 2NO + 4H2O + 385 кДж, при получении 15,68
л NO (н.у.), количество выделившейся теплоты составило:
а) 358 кДж б)
716 кДж в) 134,75 кДж г) 22,4 кДж
|
Дано: V(NO) = 15,68 _____________ Q -? |
Решение: 1. Определим количество вещества n = V / Vm n(NO) = 15,68/ 2. 3Cu По По условию Решаем пропорцию
|
Ответ: 134,75 кДж.
13.
По термохимическому уравнению
реакции 2Сu + О2 = 2СuО + 311 кДж вычислите. Количество теплоты, которая выделится при окислении 384
г меди, составит:
а) 622 кДж б)
716 кДж в) 466,5 кДж г) 933 кДж
|
Дано: m(Cu) = 384г _____________ Q -? |
Решение: 1. Определим количество вещества n = m / M n(Cu) = 384/ 64 2. По По условию Решаем пропорцию
|
Ответ: 933 кДж.
14.
В результате реакции, термохимическое уравнение которой
2Cl2O7 = 2Cl2 + 7O2 + 574 кДж, выделилось 5,74 кДж теплоты. Объем образовавшегося при
этом кислорода (н.у.) составил:
а) 100 л б)
0,224 л в) 1,568 л г) 4,48
л
|
Дано: Q1 = 5,74 ___________ V (О2)-? |
Решение: 1)Установим По По условию Решаем пропорцию
2) Вычислим объем угарного (Vm = 22,4 V(O2) = |
Ответ: объем образовавшегося кислорода
равен 1,568 л.
15. В реакцию,
термохимическое уравнение которой MgO(тв) + CO(г) = MgCO3(тв) + 102
кДж, вступило 8 г оксида магния. Количество теплоты, выделившейся при этом,
равно:
а) 102 кДж б)
204 кДж в) 20,4 кДж г) 1,02 кДж
|
Дано: m(MgO) = 8г _____________ Q -? |
Решение: 1. Определим количество вещества n = m / M n(MgO) = 8г/ 2. MgO(тв) + CO(г) = MgCO3(тв) + 102 По По условию Решаем пропорцию
|
Ответ: 20,4 кДж.
-
Тематические тренировочные задания ЕГЭ
Задание №28
Расчеты по термохимическим уравнениям
1.Определите количество теплоты, которое выделится при взаимодействии 280 г негашёной извести с водой в соответствии с термохимическим уравнением реакции
CaO(тв.)+H2O(ж)=Ca(OH)2(тв.)+64,8 кДж.
(Запишите число с точностью до целых).
2.В соответствии с термохимическим уравнением реакции
3Fe3O4(тв.)+8Al(тв.)=9Fe(тв.)+4Al2O3(тв.)+3330 кДж
образовалось 168 г железа. Какое количество теплоты при этом выделилось? (Запишите число с точностью до целых.)
3.В соответствии с термохимическим уравнением реакции
3Fe3O4(тв.)+8Al(тв.)=9Fe(тв.)+4Al2O3(тв.)+3330 кДж
восстановили 464 г железной окалины. Какое количество теплоты при этом выделилось? (Запишите число с точностью до целых.)
4.Для окисления глюкозы в соответствии с термохимическим уравнением реакции
C6H12O6(тв.)+6O2(г)=6CO2(г)+6H2O(г)+2800 кДж
потребовалось 9 моль кислорода. Какое количество теплоты при этом выделилось? (Запишите число с точностью до целых.)
5.Определите количество теплоты, которая выделится при сгорании 112 л (н.у.) метана в соответствии с термохимическим уравнением реакции
CH4(г)+2O2(г)=CO2(г)+2H2O(г)+802 кДж.
(Запишите число с точностью до целых.)
6.В ходе реакции, термохимическое уравнение которой
N2(г) + O2(г) = 2NO(г) – 180 кДж,
было затрачено 394 кДж теплоты. Определите объём (н.у.) получившегося при этом оксида азота(II). (Запишите число с точностью до целых.)
7.Какое количество вещества аммиака вступает в реакцию в соответствии с термохимическим уравнением
|
4NH3(r)+5O2(r)=4NO(r)+6H2O(r)+1268 кДж, |
если в результате реакции выделилось 634 кДж теплоты? (Запишите число с точностью до целых.)
8.В соответствии с термохимическим уравнением
С(тв.) + О2(г) = СО2(г) + 394 кДж
получено 422,2 кДж теплоты. Какой объём (н.у.) кислорода при этом израсходован? (Запишите число с точностью до целых.)
9.В ходе реакции, термохимическое уравнение которой
СаСО3(тв.) = СаО(тв.) + СО2(г) – 180 кДж,
было затрачено 450 кДж теплоты. Определите объём (н.у.) получившегося при этом газа. (Запишите число с точностью до целых.)
10.В соответствии с термохимическим уравнением реакции
CH4(г) + 2O2(г) = CO2(г) + 2H2O(г) + 802 кДж
выделилось 2406 кДж теплоты. Определите объём (н.у.) израсходованного кислорода. (Запишите число с точностью до десятых.)
11.При сжигании ацетилена в соответствии с термохимическим уравнением реакции
2С2H2(г) + 5О2(г) = 4СО2(г) + 2H2O(ж) + 930 кДж
выделилось 186 кДж теплоты. Какой объём (н.у.) кислорода затрачен на сжигание ацетилена? (Запишите число с точностью до десятых.)
12. В результате реакции, термохимическое уравнение которой
2H2(г) + O2(г) = 2H2O(г) + 484 кДж,
выделилось 1452 кДж теплоты. Вычислите массу образовавшейся при этом воды (в граммах). (Запишите число с точностью до целых.)
13.Дано термохимическое уравнение:
2KClO3 = 2KCl + 3O2 + 90кДж
В результате реакции выделилось 36 кДж теплоты. Сколько граммов хлората калия разложилось? Примите Аr(Cl)=35,5 . (Ответ округлите до ближайшего целого числа).