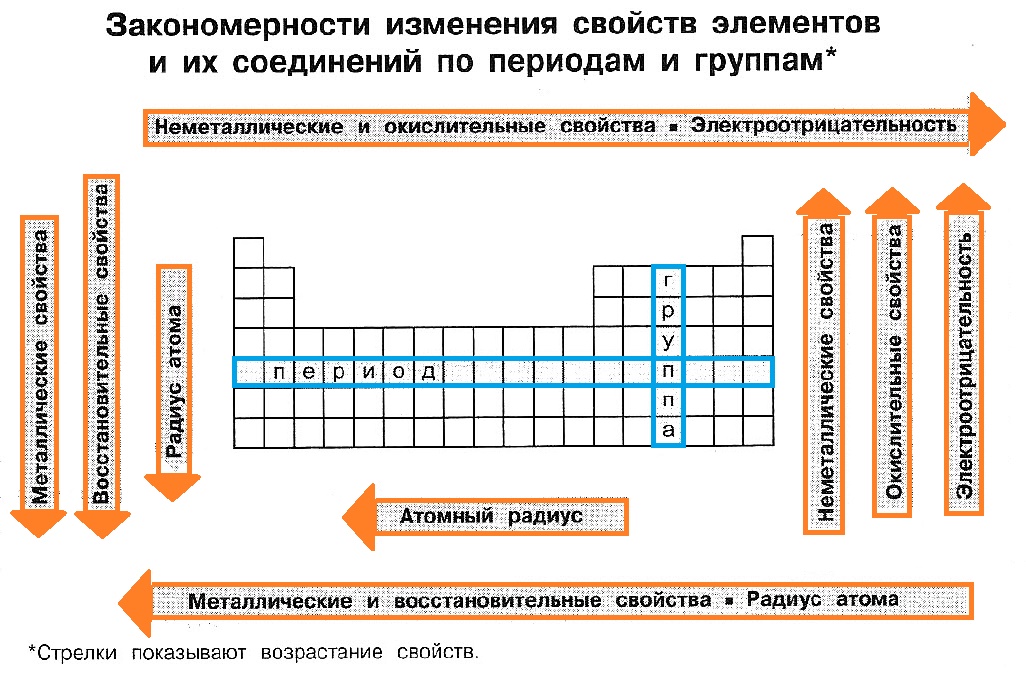
Закономерности изменения химических свойств элементов и их соединений по периодам и группам
Перечислим закономерности изменения свойств, проявляемые в пределах периодов:
— металлические свойства уменьшаются;
— неметаллические свойства усиливаются;
— степень окисления элементов в высших оксидах возрастает от $+1$ до $+7$ ($+8$ для $Os$ и $Ru$);
— степень окисления элементов в летучих водородных соединениях возрастает от $–4$ до $–1$;
— оксиды от основных через амфотерные сменяются кислотными оксидами;
— гидроксиды от щелочей через амфотерные сменяются кислотами.
Д. И. Менделеев в $1869$ г. сделал вывод — сформулировал Периодический закон, который звучит так:
Свойства химических элементов и образованных ими веществ находятся в периодической зависимости от относительных атомных масс элементов.
Систематизируя химические элементы на основе их относительных атомных масс, Менделеев уделял большое внимание также свойствам элементов и образуемых ими веществ, распределяя элементы со сходными свойствами в вертикальные столбцы — группы.
Иногда, в нарушение выявленной им закономерности, Менделеев ставил более тяжелые элементы с меньшими значениями относительных атомных масс. Например, он записал в свою таблицу кобальт перед никелем, теллур перед йодом, а когда были открыты инертные (благородные) газы, — аргон перед калием. Такой порядок расположения Менделеев считал необходимым потому, что иначе эти элементы попали бы в группы несходных с ними по свойствам элементов, в частности щелочной металл калий попал бы в группу инертных газов, а инертный газ аргон — в группу щелочных металлов.
Д. И. Менделеев не мог объяснить эти исключения из общего правила, не мог объяснить и причину причину периодичности свойств элементов и образованных ими веществ. Однако он предвидел, что эта причина кроется в сложном строении атома, внутреннее строение которого в то время не было изучено.
В соответствии с современными представлениями о строении атома, основой классификации химических элементов являются заряды их атомных ядер, и современная формулировка периодического закона такова:
Свойства химических элементов и образованных ими веществ находятся в периодической зависимости от зарядов их атомных ядер.
Периодичность в изменении свойств элементов объясняется периодической повторяемостью в строении внешних энергетических уровней их атомов. Именно число энергетических уровней, общее число расположенных на них электронов и число электронов на внешнем уровне отражают принятую в Периодической системе символику, т.е. раскрывают физический смысл номера периода, номера группы и порядкового номера элемента.
Строение атома позволяет объяснить и причины изменения металлических и неметаллических свойств элементов в периодах и группах.
Периодический закон и Периодическая система химических элементов Д. И. Менделеева обобщают сведения о химических элементах и образованных ими веществах и объясняют периодичность в изменении их свойств и причину сходства свойств элементов одной и той же группы. Эти два важнейших значения Периодического закона и Периодической системы дополняет еще одно, которое заключается в возможности прогнозировать, т.е. предсказывать, описывать свойства и указывать пути открытия новых химических элементов.
Общая характеристика металлов главных подгрупп I±III групп в связи с их положением в Периодической системе химических элементов Д. И. Менделеева и особенностями строения их атомов
Химические элементы — металлы
Большинство химических элементов относят к металлам — $92$ из $114$ известных элементов.
Все металлы, кроме ртути, в обычном состоянии — твердые вещества и имеют ряд общих свойств.
Металлы — это ковкие, пластичные, тягучие вещества, имеющие металлический блеск и способны проводить тепло и электрический ток.
Атомы элементов-металлов отдают электроны внешнего (а некоторые и предвнешнего) электронного слоя, превращаясь в положительные ионы.
Это свойство атомов металлов, как вы знаете, определяется тем, что они имеют сравнительно большие радиусы и малое число электронов (в основном от $1$ до $3$ на внешнем слое).
Исключение составляют лишь $6$ металлов: атомы германия, олова, свинца на внешнем слое имеют $4$ электрона, атомы сурьмы и висмута — $5$, атомы полония — $6$.
Для атомов металлов характерны небольшие значения электроотрицательности (от $0.7$ до $1.9$) и исключительно восстановительные свойства, т.е. способность отдавать электроны.
Вы уже знаете, что в Периодической системе химических элементов Д. И. Менделеева металлы находятся ниже диагонали бор — астат, а также выше ее, в побочных подгруппах. В периодах и главных подгруппах действуют известные вам закономерности в изменении металлических, а значит, восстановительных свойств атомов элементов.
Химические элементы, расположенные вблизи диагонали бор — астат ($Be, Al, Ti, Ge, Nb, Sb$), обладают двойственными свойствами: в одних своих соединениях ведут себя как металлы, в других проявляют свойства неметаллов.
В побочных подгруппах восстановительные свойства металлов с увеличением порядкового номера чаще всего уменьшаются.
Это можно объяснить тем, что на прочность связи валентных электронов с ядром у атомов этих металлов в большей степени влияет величина заряда ядра, а не радиус атома. Величина заряда ядра значительно увеличивается, притяжение электронов к ядру усиливается. Радиус атома при этом хотя и увеличивается, но не столь значительно, как у металлов главных подгрупп.
Простые вещества, образованные химическими элементами — металлами, и сложные металлосодержащие вещества играют важнейшую роль в минеральной и органической «жизни» Земли. Достаточно вспомнить, что атомы (ионы) элементов металлов являются составной частью соединений, определяющих обмен веществ в организме человека, животных. Например, в крови человека найдено $76$ элементов, из них только $14$ не являются металлами. В организме человека некоторые элементы- металлы (кальций, калий, натрий, магний) присутствуют в большом количестве, т.е. являются макроэлементами. А такие металлы, как хром, марганец, железо, кобальт, медь, цинк, молибден присутствуют в небольших количествах, т.е. это микроэлементы.
Особенности строения металлов главных подгрупп I–III групп.
Щелочные металлы — это металлы главной подгруппы I группы. Их атомы на внешнем энергетическом уровне имеют по одному электрону. Щелочные металлы — сильные восстановители. Их восстановительная способность и химическая активность возрастают с увеличением порядкового номера элемента (т.е. сверху вниз в Периодической таблице). Все они обладают электронной проводимостью. Прочность связи между атомами щелочных металлов уменьшается с увеличением порядкового номера элемента. Также снижаются их температуры плавления и кипения. Щелочные металлы взаимодействуют со многими простыми веществами — окислителями. В реакциях с водой они образуют растворимые в воде основания (щелочи).
Щелочноземельными элементами называются элементы главной подгруппы II группы. Атомы этих элементов содержат на внешнем энергетическом уровне по два электрона. Они являются восстановителями, имеют степень окисления $+2$. В этой главной подгруппе соблюдаются общие закономерности в изменении физических и химических свойств, связанные с увеличением размера атомов по группе сверху вниз, также ослабевает и химическая связь между атомами. С увеличением размера иона ослабевают кислотные и усиливаются основные свойства оксидов и гидроксидов.
Главную подгруппу III группы составляют элементы бор, алюминий, галлий, индий и таллий. Все элементы относятся к $p$-элементам. На внешнем энергетическом уровне они имеют по три $(s^2p^1)$ электрона, чем объясняется сходство свойств. Степень окисления $+3$. Внутри группы с увеличением заряда ядра металлические свойства увеличиваются. Бор — элемент-неметалл, а у алюминия уже металлические свойства. Все элементы образуют оксиды и гидроксиды.
Характеристика переходных элементов ± меди, цинка, хрома, железа по их положению в Периодической системе химических элементов Д. И. Менделеева и особенностям строения их атомов
Большинство элементов-металлов находится в побочных группах Периодической системы.
В четвертом периоде у атомов калия и кальция появляется четвертый электронный слой, заполняется $4s$-подуровень, так как он имеет меньшую энергию, чем $3d$-подуровень. $K, Ca — s$-элементы, входящие в главные подгруппы. У атомов от $Sc$ до $Zn$ заполняется электронами $3d$-подуровень.
Рассмотрим, какие силы действуют на электрон, который добавляется в атом при возрастании заряда ядра. С одной стороны, притяжение атомным ядром, что заставляет электрон занимать самый нижний свободный энергетический уровень. С другой стороны, отталкивание уже имеющимися электронами. Когда на энергетическом уровне оказывается $8$ электронов (заняты $s-$ и $р-$орбитали), их общее отталкивающее действие так сильно, что следующий электрон попадает вместо расположенной по энергии ниже $d-$орбитали на более высокую $s-$орбиталь следующего уровня. Электронное строение внешних энергетических уровней у калия $…3d^{0}4s^1$, у кальция — $…3d^{0}4s^2$.
Последующее прибавление еще одного электрона у скандия приводит к началу заполнения $3d$-орбитали вместо еще более высоких по энергии $4р$-орбиталей. Это оказывается энергетически выгоднее. Заполнение $3d$-орбитали заканчивается у цинка, имеющего электронное строение $1s^{2}2s^{2}2p^{6}3s^{2}3p^{6}3d^{10}4s^2$. Следует отметить, что у элементов меди и хрома наблюдается явление «провала » электрона. У атома меди десятый $d$-электрон перемещается на третий $3d$-подуровень.
Электронная формула меди $…3d^{10}4s^1$. У атома хрома на четвертом энергетическом уровне ($s$-орбиталь) должно быть $2$ электрона. Однако один из двух электронов переходит на третий энергетический уровень, на незаполненную $d$-орбиталь, его электронная формула $…3d^{5}4s^1$.
Таким образом, в отличие от элементов главных подгрупп, где происходит постепенное заполнение электронами атомных орбиталей внешнего уровня, у элементов побочных подгрупп заполняются $d$-орбитали предпоследнего энергетического уровня. Отсюда и название: $d$-элементы.
Все простые вещества, образованные элементами подгрупп Периодической системы, являются металлами. Благодаря большему числу атомных орбиталей, чем у элементов-металлов главных подгрупп, атомы $d$-элементов образуют большое число химических связей между собой и потому создают более прочную кристаллическую решетку. Она прочнее и механически, и по отношению к нагреванию. Поэтому металлы побочных подгрупп — самые прочные и тугоплавкие среди всех металлов.
Известно, если атом имеет более трех валентных электронов, то элемент проявляет переменную валентность. Это положение относится к большинству $d$-элементов. Максимальная их валентность, как у элементов главных подгрупп, равна номеру группы (хотя есть и исключения). Элементы с равным числом валентных электронов входят в группу под одним номером $(Fe, Co, Ni)$.
У $d$-элементов изменение свойств их оксидов и гидроксидов в пределах одного периода при движении слева направо, т.е. с увеличением их валентности, происходит от основных свойств через амфотерные к кислотным. Например, хром имеет валентности $+2, +3, +6$; а его оксиды: $CrO$ — основной, $Cr_{2}O_3$ — амфотерный, $CrO_3$ — кислотный.
Общая характеристика неметаллов главных подгрупп IV±VII групп в связи с их положением в Периодической системе химических элементов Д. И. Менделеева и особенностями строения их атомов
Химические элементы – неметаллы
Самой первой научной классификацией химических элементов было деление их на металлы и неметаллы. Эта классификация не утратила своей значимости и в настоящее время.
Неметаллы — это химические элементы, для атомов которых характерна способность принимать электроны до завершения внешнего слоя благодаря наличию, как правило, на внешнем электронном слое четырех и более электронов и малому радиусу атомов по сравнению с атомами металлов.
Это определение оставляет в стороне элементы VIII группы главной подгруппы — инертные, или благородные, газы, атомы которых имеют завершенный внешний электронный слой. Электронная конфигурация атомов этих элементов такова, что их нельзя отнести ни к металлам, ни к неметаллам. Они являются теми объектами, которые разделяют элементы на металлы и неметаллы, занимая между ними пограничное положение. Инертные, или благородные, газы («благородство» выражается в инертности) иногда относят к неметаллам, но формально, по физическим признакам. Эти вещества сохраняют газообразное состояние вплоть до очень низких температур. Так, гелий Не переходит в жидкое состояние при $t°= –268,9 °С$.
Инертность в химическом отношении у этих элементов относительна. Для ксенона и криптона известны соединения с фтором и кислородом: $KrF_2, XeF_2, XeF_4$ и др. Несомненно, в образовании этих соединений инертные газы выступали в роли восстановителей.
Из определения неметаллов следует, что для их атомов характерны высокие значения электроотрицательности. Она изменяется в пределах от $2$ до $4$. Неметаллы — это элементы главных подгрупп, преимущественно $р$-элементы, исключение составляет водород — s-элемент.
Все элементы-неметаллы (кроме водорода) занимают в Периодической системе химических элементов Д. И. Менделеева верхний правый угол, образуя треугольник, вершиной которого является фтор $F$, а основанием — диагональ $B — At$.
Однако следует особо остановиться на двойственном положении водорода в Периодической системе: в главных подгруппах I и VII групп. Это не случайно. С одной стороны, атом водорода, подобно атомам щелочных металлов, имеет на внешнем (и единственном для него) электронном слое один электрон (электронная конфигурация $1s^1$), который он способен отдавать, проявляя свойства восстановителя.
В большинстве своих соединений водород, как и щелочные металлы, проявляет степень окисления $+1$. Но отдача электрона атомом водорода происходит труднее, чем у атомов щелочных металлов. С другой стороны, атому водорода, как и атомам галогенов, до завершения внешнего электронного слоя недостает одного электрона, поэтому атом водорода может принимать один электрон, проявляя свойства окислителя и характерную для галогена степень окисления — $1$ в гидридах (соединениях с металлами, подобных соединениям металлов с галогенами — галогенидам). Но присоединение одного электрона к атому водорода происходит труднее, чем у галогенов.
Свойства атомов элементов – неметаллов
У атомов неметаллов преобладают окислительные свойства, т.е. способность присоединять электроны. Эту способность характеризует значение электроотрицательности, которая закономерно изменяется в периодах и подгруппах.
Фтор — самый сильный окислитель, его атомы в химических реакциях не способны отдавать электроны, т.е. проявлять восстановительные свойства.
Конфигурация внешнего электронного слоя.
| В периоде: — заряд ядра увеличивается; — радиус атома уменьшается; — число электронов на внешнем слое увеличивается; — электроотрицательность увеличивается; — окислительные свойства усиливаются; — неметаллические свойства усиливаются. |
В главной подгруппе: — заряд ядра увеличивается; — радиус атома увеличивается; — число электронов на внешнем слое не изменяется; — электроотрицательность уменьшается; — окислительные свойства ослабевают; — неметаллические свойства ослабевают. |
Другие неметаллы могут проявлять восстановительные свойства, хотя и в значительно более слабой степени по сравнению с металлами; в периодах и подгруппах их восстановительная способность изменяется в обратном порядке по сравнению с окислительной.
Химических элементов-неметаллов всего $16$! Совсем немного, если учесть, что известно $114$ элементов. Два элемента-неметалла составляют $76%$ массы земной коры. Это кислород ($49%$) и кремний ($27%$). В атмосфере содержится $0.03%$ массы кислорода в земной коре. Неметаллы составляют $98.5%$ массы растений, $97.6%$ массы тела человека. Неметаллы $C, H, O, N, S, Р$ — органогены, которые образуют важнейшие органические вещества живой клетки: белки, жиры, углеводы, нуклеиновые кислоты. В состав воздуха, которым мы дышим, входят простые и сложные вещества, также образованные элементами-неметаллами (кислород $О_2$, азот $N_2$, углекислый газ $СО_2$, водяные пары $Н_2О$ и др.).
Водород — главный элемент Вселенной. Многие космические объекты (газовые облака, звезды, в том числе и Солнце) более чем наполовину состоят из водорода. На Земле его, включая атмосферу, гидросферу и литосферу, только $0.88%$. Но это по массе, а атомная масса водорода очень мала. Поэтому небольшое содержание его только кажущееся, и из каждых $100$ атомов на Земле $17$ — атомы водорода.
Периодический закон был открыт Д.И. Менделеевым в 1868 году. Его современная формулировка: свойства химических элементов и образуемых ими
соединений (простых и сложных) находятся в периодической зависимости от величины заряда атомного ядра.
Периодический закон лежит в основе современного учения о строении вещества. Периодическая система Д.И. Менделеева является наглядным отражением
периодического закона.

В периодической таблице элементы расположены в порядке увеличения атомного заряда, группируются в «строки и столбцы» — периоды и группы.
Период — ряд горизонтально расположенных химических элементов. 1, 2 и 3 периоды называются малыми, они состоят из одного ряда элементов.
4, 5, 6 — называются большими периодами, они состоят из двух рядов химических элементов.
Группой называют вертикальный ряд химических элементов в периодической таблице. Элементы собраны в группы на основе степени окисления в
высшем оксиде. Каждая из восьми групп состоит из главной подгруппы (а) и побочной подгруппы (б).
Периодическая таблица Д.И. Менделеева содержит колоссальное число ответов на самые разные вопросы. При умелом ее использовании вы сможете
предполагать строение и свойства веществ, успешно писать химические реакции и решать задачи.

Радиус атома
Радиусом атома называют расстояние между атомным ядром и самой дальней электронной орбиталью. Это не четкая, а условная граница, которая
говорит о наиболее вероятном месте нахождения электрона.
В периоде радиус атома уменьшается с увеличением порядкового номера элементов («→» слева направо). Это связано с тем, что с увеличением номера группы
увеличивается число электронов на внешнем уровне. Запомните, что для элементов главных подгрупп номер группы равен числу электронов на внешнем уровне.
С увеличением числа электронов они становятся более скученными, так как притягиваются друг к другу сильнее: это и есть причина маленького радиуса атома.
Чем меньше электронов, тем больше у них свободы и больше радиус атома, поэтому радиус увеличивается в периоде «←» справа налево.

В группе радиус атома увеличивается с увеличением заряда атомных ядер — сверху вниз «↓». Чем больше период, тем больше электронных орбиталей вокруг атома,
соответственно, и больше его радиус.
С уменьшением заряда атома в группе радиус атома уменьшается — снизу вверх «↑». Это связано с уменьшением количества электронных орбиталей вокруг
атома. Для примера возьмем атомы бора и алюминия, элементов, расположенных в одной группе.

Период, группа и электронная конфигурация
Обратите внимание еще раз на важную деталь: элементы, находящиеся в одной группе (главной подгруппе!), имеют сходную конфигурацию внешнего уровня.
Так у бора на внешнем уровне расположены 3 электрона, у алюминия — тоже 3. Оба они в III группе.
Такая закономерность иногда может сильно облегчить жизнь, однако у элементов побочных подгрупп она отсутствует — там нужно считать электроны
«вручную», располагая их на электронных орбиталях.
Раз уж мы повели речь об электронных конфигурациях, давайте запишем их для бора и алюминия, чтобы лучше представлять их внешний уровень и увидеть
то самое «сходство»:
- B5 — 1s22s22p1
- Al13 — 1s22s22p63s23p1
Общую электронную конфигурацию для элементов III группы главной подгруппы можно записать ns2np1. Это будет работать для
бора, внешний уровень которого 2s22p1, алюминия — 3s23p1, галия — 4s24p1,
индия — 5s25p1 и таллия — 6s26p1. За «n» мы принимаем номер периода.
Правило составления электронной конфигурации, которое вы только что увидели, универсально. Если вы имеете дело с элементом главной подгруппы,
то увидев номер группы вы знаете, сколько электронов у него на внешнем уровне. Посмотрев на период, знаете номер его внешнего уровня.
Вам остается только распределить известное число электронов по s и p ячейкам, а затем подставить номер периода — и вот быстро получена
конфигурация внешнего уровня. Предлагаю посмотреть на примере ниже 

Очень надеюсь, что теперь вы знаете: только глядя на положение элемента в периодической таблице, на группу и период, в которых он расположен,
вы уже можете составить конфигурацию его внешнего уровня. Безусловно, это для элементов главных подгрупп. Повторюсь: у побочных — только «вручную».
Длина связи
Длина связи — расстояние между атомами химически связанных элементов. Очевидно, что понятия длины связи и атомного радиуса взаимосвязаны напрямую.
Чем больше радиус атома, тем больше длина связи.
Убедимся в этом на наглядном примере, сравнив длину связей в четырех веществах: HF, HCl, HBr, HI.

Чем больше радиусы атомов, которые образуют химическую связь, тем больше между ними и длина связи. Радиус атома водорода неизменен во всех трех
веществах, а в ряду F → Cl → Br → I происходит увеличение радиуса атома. Наибольшим радиусом обладает йод, поэтому самая длинная связь в молекуле HI.
Металлические и неметаллические свойства
В периоде с увеличением заряда атома металлические свойства ослабевают, неметаллические — усиливаются (слева направо «→»). В группе с увеличением
заряда атома металлические свойства усиливаются, а неметаллические — ослабевают (сверху вниз «↓»).

Сравним металлические и неметаллические свойства Rb, Na, Al, S. Натрий, алюминий и сера находятся в одном периоде. Металлические свойства возрастают
S → Al → Na. Натрий и рубидий находятся в одной группе, металлические свойства возрастают Na → Rb.
Таким образом, самые сильные металлические свойства проявляет рубидий, но с другой стороны — у него самые слабые неметаллические свойства. Сера
обладает самыми слабыми металлическими свойствами, но, если посмотреть по-другому, сера — самый сильный неметалл.
Распределение металлов и неметаллов в периодической таблице также является наглядным отображением этого правила. Если провести условную
линию, проходящую от бора до астата, то справа окажутся неметаллы, а слева — металлы.

Основные и кислотные свойства
Основные свойства в периоде с увеличением заряда атома уменьшаются, кислотные — возрастают. В группе с увеличением заряда атома основные
свойства усиливаются, а кислотные — ослабевают.
Кислотные и основные свойства противопоставлены друг другу, как противопоставлены металлические и неметаллические. Где первые усиливаются,
вторые — убывают. Все аналогично, поэтому смело ассоциируйте одни с другими, так будет гораздо легче запомнить.

Замечу, что здесь есть одно важное исключение. Как и в общем случае: исключения только подтверждают правила. В ряду галогенводородных
кислот HF → HCl → HBr → HI происходит усиление кислотных свойств (а не ослабление, как должно быть по логике нашего правила).
Это можно объяснить в темах диссоциации и химических связей. Когда мы дойдем до соответствующей темы, я напомню про HF и водородные связи между
молекулами, которые делают эту кислоту самой слабой. Сейчас воспринимайте это как исключение: HF — самая слабая из этих кислот, а
HI — самая сильная.

Восстановительные и окислительные свойства
Восстановительные свойства в периоде с увеличением заряда атома ослабевают, окислительные — усиливаются. В группе с увеличением заряда
атома восстановительные свойства усиливаются, а окислительные — ослабевают.
Ассоциируйте восстановительные свойства с металлическими и основными, а окислительные — с неметаллическими и кислотными. Так гораздо проще
запомнить 

Электроотрицательность (ЭО), энергия связи, ионизации и сродства к электрону
Электроотрицательность — способность атома, связанного с другими, приобретать отрицательный заряд (притягивать к себе электроны).
Мы уже касались ее в статье, посвященной степени окисления. Это важное свойство, ведь более ЭО-ый атом притягивает
к себе электроны и уходит в отрицательную степень окисления со знаком минус «-«.
Все перечисленные в подзаголовке свойства вместе с ЭО усиливаются в периоде с увеличением заряда атома, в группе с увеличением заряда атома
они ослабевают. Таким образом, самый электроотрицательный элемент расположен справа вверху таблицы Д.И. Менделеева — это фтор.

Для примера сравним ЭО-ость атомов Te, In, Al, P. Индий расположен в одной группе с алюминием, ЭО-ость In → Al возрастает (снизу вверх). Алюминий
расположен в одном периоде с серой, ЭО-ость возрастает Al → S (слева направо). Сравнивая серу и теллур, мы видим, что сера расположена в группе
выше теллура, значит и ее электроотрицательность тоже выше.
Энергия связи (а также ее прочность) возрастают с увеличением электроотрицательности атомов, образующих данную связь. Чем сильнее атом тянет на
себя электроны (чем больше он ЭО-ый), тем прочнее получается связь, которую он образует.
Понятию ЭО-ости «синонимичны» также понятия сродства к электрону — энергии, выделяющейся при присоединении электрона к атому, и энергии ионизации —
количеству энергии, которое необходимо для отщепления электрона от атома. И то, и другое возрастают с увеличением электроотрицательности.
Продемонстрирую на примере. Сравним энергию связи в трех молекулах: H2O, H2S, H2Se.

Высшие оксиды и летучие водородные соединения (ЛВС)
В периодической таблице Д.И. Менделеева ниже 7 периода находится строка, в которой для каждой группы указаны соответствующие высшие оксиды,
ниже строка с летучими водородными соединениями.

Для элементов главных подгрупп начиная с IV группы (в большинстве случае) максимальная степень окисления (СО) определяется по номеру группы. К примеру,
для серы (в VI группе) максимальная СО = +6, которую она проявляет в соединениях: H2SO4, SO3.
В таблице видно, что для VIa группы формула высшего оксида RO3, а, к примеру, для IIIa группы — R2O3. Напишем
высшие оксиды для веществ из VIa : SO3, SeO3, TeO3 и IIIa группы: B2O3, Al2O3,
Ga2O3.
На экзамене строка с готовыми «высшими» оксидами, как в таблице наверху, может отсутствовать. Считаю важным подготовить вас к этому. Предположим,
что эта строчка внезапно исчезла из таблицы, и вам нужно записать высшие оксиды для фосфора и углерода.

С летучими водородными соединениями (ЛВС) ситуация аналогичная: их может не быть в периодической таблице Д.И. Менделеева, которая попадется на экзамене.
Я расскажу вам, как легко их запомнить.
ЛВС характерны для IV, V, VI и VII группы. Элементы этих групп более электроотрицательны, чем водород, поэтому ходят в «-» отрицательную СО.
Минимальная степень окисления для элементов главных подгрупп, начиная с IV группы, может быть рассчитана так: номер группы — 8.
Например, для углерода минимальная СО = 4-8 = -4; для азота 5-8 = -3; для кислорода 6-8 = -2; для фтора 7-8 = -1. Для того, чтобы запомнить
ЛВС, вы должны ассоциировать IV, V, VI и VII группы с хорошо известными вам веществами: метаном, аммиаком, водой и фтороводородом.

Так как общее строение ЛВС в пределах одной группы сходно, то, вспомнив например H2O для кислорода в VI группе, вы легко
найдете формулы других ЛВС VI группы: серы — H2S, H2Se, H2Te, H2Po.
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Закономерности изменения свойств элементов
Элемент ЕГЭ: 1.2.1. Закономерности изменения свойств элементов и их соединений по периодам и группам.
Современная формулировка Периодического закона Д.И. Менделеева: свойства элементов, а также образуемых ими простых и сложных веществ находятся в периодической зависимости от заряда ядра атома, равного порядковому номеру элемента.
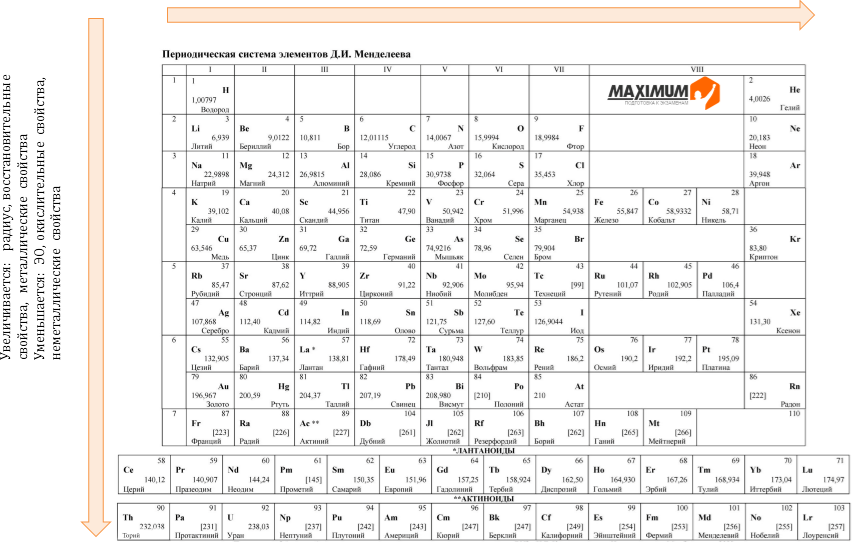
Периодическая система химических элементов — естественная классификация химических элементов, являющаяся табличным выражением Периодического закона Д.И. Менделеева. Она представляет собой таблицу, состоящую из периодов (горизонтальных рядов) и групп (вертикальных столбцов) элементов.
Периоды (горизонтальные ряды)
Период — горизонтальный ряд элементов, расположенных в порядке возрастания зарядов ядер их атомов, начинающийся щелочным металлом (1-й период — водородом) и заканчивающийся инертным газом.
Современная Периодическая система включает 7 периодов. Каждый период начинается элементом, в атоме которого впервые появляется электрон на соответствующем энергетическом уровне (водород или щелочной элемент), и заканчивается элементов, в атоме которого до конца заполнен уровень с тем же номером (благородный газ).
В группе:
- число электронов на последнем электронном уровне (ЭУ) не изменяется;
- радиусы атомов в целом возрастают;
- электроотрицательность (способность атома в соединении удерживать электроны) в целом уменьшается;
- металлические и восстановительные свойства простых веществ усиливаются;
- неметаллические и окислительные свойства простых веществ ослабевают;
- основные свойства оксидов и гидроксидов в целом усиливаются;
- кислотные свойства оксидов и гидроксидов в целом ослабевают.
Группы (вертикальные столбцы)
Группа — вертикальный ряд элементов, расположенных в порядке возрастания зарядов ядер их атомов, имеющих одинаковую электронную конфигурацию внешних энергетических уровней.
В короткопериодном варианте Периодической системы — 8 групп. Они разделены на подгруппы А (главные) и Б (побочные). Главные подгруппы содержат s- и р-элементы. Побочные подгруппы содержат d- и f-элементы.
В длиннопериодном варианте Периодической системы — 18 групп. Их обозначают или так же, как в короткопериодном варианте, или просто номерами от 1 до 18 (например, группа IA или 1, VIIБ или 17).
В периоде:
- увеличивается число электронов на последнем ЭУ (от 1 до 8);
- число ЭУ не изменяется;
- радиусы атомов в целом уменьшаются;
- электроотрицательность (способность атома в соединении удерживать электроны) увеличивается;
- металлические и восстановительные свойства простых веществ ослабевают;
- неметаллические и окислительные свойства простых веществ усиливаются;
- основные свойства оксидов и гидроксидов ослабевают;
- кислотные свойства оксидов и гидроксидов усиливаются.
Примеры работы с периодической системой
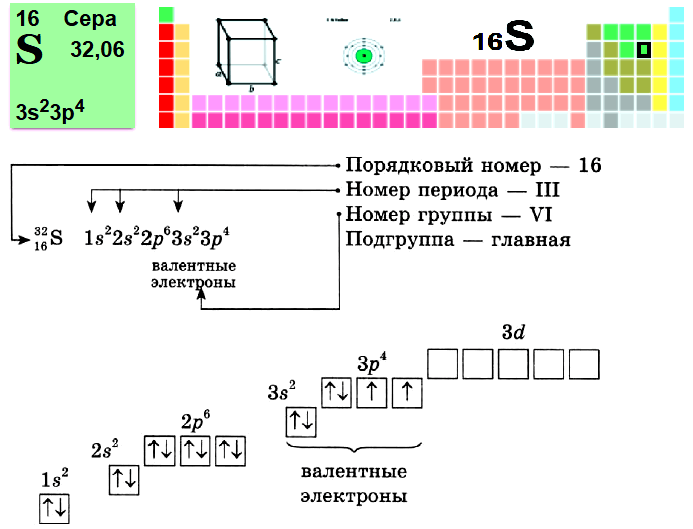
Пример № 1. Сера.
Пример № 2. Титан.
Периодическое изменение свойств элементов и их соединений (наглядно)
Распределение элементов на металлы и неметаллы
Чёткой границы нет. Есть элементы с переходными свойствами.
(с) В учебных целях использованы цитаты из пособий: «Химия / Н. Э. Варавва, О. В. Мешкова. — Москва, Эксмо (ЕГЭ. Экспресс-подготовка)» и «Химия : Новый полный справочник для подготовки к ЕГЭ / Е.В. Савинкина. — Москва, Издательство АСТ».
Вы смотрели Справочник по химии «Закономерности изменения свойств элементов и их соединений по периодам и группам». Выберите дальнейшее действие:
- Перейти к Списку конспектов по химии (по классам)
- Найти конспект в Кодификаторе ОГЭ по химии
- Найти конспект в Кодификаторе ЕГЭ по химии
- Конспект урока в 8 классе «Закономерности изменения свойств элементов и их соединений в связи с положением в Периодической системе химических элементов»
Всего: 254 1–20 | 21–40 | 41–60 | 61–80 …
Добавить в вариант
Задания Д2 № 835
Наиболее ярко выраженные неметаллические свойства проявляет
1) фтор
2) иод
3) сера
4) кремний
Наибольший радиус имеет атом
1) N
2) S
3) P
4) O
Среди перечисленных элементов наименьший радиус атома имеет
1) Li
2) Be
3) B
4) Al
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в одном периоде.
Расположите выбранные элементы в порядке возрастания их металлических свойств. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
Показать
1
Определите, атомы каких двух из указанных в ряду элементов имеют на внешнем энергетическом уровне один электрон. Запишите в поле ответа номера выбранных элементов.
Источник: РЕШУ ЕГЭ
2
Из числа указанных в ряду элементов выберите два элемента, которые проявляют высшую степень окисления, равную +2. Запишите в поле ответа номера выбранных элементов.
Источник: РЕШУ ЕГЭ
Источник: РЕШУ ЕГЭ
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в одном периоде.
Расположите выбранные элементы в порядке возрастания их неметаллических свойств. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
Показать
1
Определите, атомы каких двух из указанных в ряду элементов имеют на внешнем энергетическом уровне семь электронов. Запишите в поле ответа номера выбранных элементов.
Источник: РЕШУ ЕГЭ
2
Из числа указанных в ряду элементов выберите два элемента, которые проявляют высшую степень окисления, равную +5. Запишите в поле ответа номера выбранных элементов.
Источник: РЕШУ ЕГЭ
Источник: РЕШУ ЕГЭ
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в одном периоде.
Расположите выбранные элементы в порядке возрастания их металлических свойств. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
Показать
1
Определите, атомы каких двух из указанных в ряду элементов имеют на внешнем энергетическом уровне четыре электрона. Запишите в поле ответа номера выбранных элементов.
Источник: РЕШУ ЕГЭ
2
Из числа указанных в ряду элементов выберите два элемента, которые проявляют высшую степень окисления, равную +5. Запишите в поле ответа номера выбранных элементов.
Источник: РЕШУ ЕГЭ
Источник: РЕШУ ЕГЭ
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в одном периоде.
Расположите выбранные элементы в порядке возрастания их металлических свойств. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
Показать
1
Определите, двум атомам каких из указанных элементов до завершения внешнего уровня не хватает шести электронов. Запишите в поле ответа номера выбранных элементов.
Источник: РЕШУ ЕГЭ
2
Из числа указанных в ряду элементов выберите два элемента, которые проявляют высшую степень окисления, равную +2. Запишите в поле ответа номера выбранных элементов.
Источник: РЕШУ ЕГЭ
Источник: РЕШУ ЕГЭ
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в одном периоде.
Расположите выбранные элементы в порядке возрастания их металлических свойств. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
Показать
1
Определите, двум атомам каких из указанных элементов до завершения внешнего уровня не хватает четырех электронов. Запишите в поле ответа номера выбранных элементов.
Источник: РЕШУ ЕГЭ
2
Из числа указанных в ряду элементов выберите два элемента, которые проявляют высшую степень окисления, равную +4. Запишите в поле ответа номера выбранных элементов.
Источник: РЕШУ ЕГЭ
Источник: РЕШУ ЕГЭ
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в одном периоде.
Расположите выбранные элементы в порядке возрастания их металлических свойств. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
Показать
1
Определите, двум атомам каких из указанных элементов до завершения внешнего уровня не хватает четырех электронов. Запишите в поле ответа номера выбранных элементов.
Источник: РЕШУ ЕГЭ
2
Из числа указанных в ряду элементов выберите два элемента, которые проявляют высшую степень окисления, равную +4. Запишите в поле ответа номера выбранных элементов.
Источник: РЕШУ ЕГЭ
Источник: РЕШУ ЕГЭ
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в одном периоде.
Расположите выбранные элементы в порядке возрастания их металлических свойств. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
Показать
1
Определите, двум атомам каких из указанных элементов до завершения внешнего уровня не хватает семь электронов. Запишите в поле ответа номера выбранных элементов.
Источник: РЕШУ ЕГЭ
2
Из числа указанных в ряду элементов выберите два элемента, которые проявляют высшую степень окисления, равную +1. Запишите в поле ответа номера выбранных элементов.
Источник: РЕШУ ЕГЭ
Источник: РЕШУ ЕГЭ
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в одном периоде.
Расположите выбранные элементы в порядке возрастания их неметаллических свойств. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
Показать
1
Определите, двум атомам каких из указанных элементов до завершения внешнего уровня не хватает двух электронов. Запишите в поле ответа номера выбранных элементов.
Источник: РЕШУ ЕГЭ
2
Из числа указанных в ряду элементов выберите два элемента, которые проявляют низшую степень окисления, равную −2. Запишите в поле ответа номера выбранных элементов.
Источник: РЕШУ ЕГЭ
Источник: РЕШУ ЕГЭ
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в одном периоде.
Расположите выбранные элементы в порядке возрастания их металлических свойств. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
Показать
1
Определите, двум атомам каких из указанных элементов до завершения внешнего уровня не хватает четырех электронов. Запишите в поле ответа номера выбранных элементов.
Источник: РЕШУ ЕГЭ
2
Из числа указанных в ряду элементов выберите два элемента, которые проявляют высшую степень окисления, равную +4. Запишите в поле ответа номера выбранных элементов.
Источник: РЕШУ ЕГЭ
Источник: РЕШУ ЕГЭ
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в одном периоде.
Расположите выбранные элементы в порядке возрастания их металлических свойств. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
Показать
1
Определите, атомы каких двух из указанных в ряду элементов имеют на внешнем энергетическом уровне один электрон. Запишите в поле ответа номера выбранных элементов.
Источник: РЕШУ ЕГЭ
2
Из числа указанных в ряду элементов выберите два элемента, которые проявляют высшую степень окисления, равную +1. Запишите в поле ответа номера выбранных элементов.
Источник: РЕШУ ЕГЭ
Источник: РЕШУ ЕГЭ
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в одном периоде.
Расположите выбранные элементы в порядке возрастания их металлических свойств. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
Показать
1
Определите, атомы каких двух из указанных в ряду элементов имеют на внешнем энергетическом уровне пять электронов. Запишите в поле ответа номера выбранных элементов.
Источник: РЕШУ ЕГЭ
2
Из числа указанных в ряду элементов выберите два элемента, которые проявляют высшую степень окисления, равную +5. Запишите в поле ответа номера выбранных элементов.
Источник: РЕШУ ЕГЭ
Источник: РЕШУ ЕГЭ
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в одном периоде.
Расположите выбранные элементы в порядке возрастания их металлических свойств. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
Показать
1
Определите, атомы каких двух из указанных в ряду элементов имеют на внешнем энергетическом уровне два электрона. Запишите в поле ответа номера выбранных элементов.
Источник: РЕШУ ЕГЭ
2
Из числа указанных в ряду элементов выберите два элемента, которые проявляют высшую степень окисления, равную +2. Запишите в поле ответа номера выбранных элементов.
Источник: РЕШУ ЕГЭ
Источник: РЕШУ ЕГЭ
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в одном периоде.
Расположите выбранные элементы в порядке возрастания их металлических свойств. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
Показать
1
Определите, атомы каких двух из указанных в ряду элементов имеют на внешнем энергетическом уровне три электрона. Запишите в поле ответа номера выбранных элементов.
Источник: РЕШУ ЕГЭ
2
Из числа указанных в ряду элементов выберите два элемента, которые проявляют высшую степень окисления, равную +3. Запишите в поле ответа номера выбранных элементов.
Источник: РЕШУ ЕГЭ
Источник: РЕШУ ЕГЭ
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в одном периоде.
Расположите выбранные элементы в порядке возрастания их неметаллических свойств. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
Показать
1
Определите, атомы каких двух из указанных в ряду элементов имеют на внешнем энергетическом уровне семь электронов. Запишите в поле ответа номера выбранных элементов.
Источник: РЕШУ ЕГЭ
2
Из числа указанных в ряду элементов выберите два элемента, которые проявляют низшую степень окисления, равную −1. Запишите в поле ответа номера выбранных элементов.
Источник: РЕШУ ЕГЭ
Источник: РЕШУ ЕГЭ
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в одном периоде.
Расположите выбранные элементы в порядке возрастания их металлических свойств. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
Показать
1
Определите, атомы каких двух из указанных в ряду элементов имеют на внешнем энергетическом уровне один электрон. Запишите в поле ответа номера выбранных элементов.
Источник: РЕШУ ЕГЭ
2
Из числа указанных в ряду элементов выберите два элемента, которые проявляют высшую степень окисления, равную +1. Запишите в поле ответа номера выбранных элементов.
Источник: РЕШУ ЕГЭ
Источник: РЕШУ ЕГЭ
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в одном периоде.
Расположите выбранные элементы в порядке возрастания их металлических свойств. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
Показать
1
Определите, атомы каких двух из указанных в ряду элементов имеют на внешнем энергетическом уровне два электрона. Запишите в поле ответа номера выбранных элементов.
Источник: РЕШУ ЕГЭ
2
Из числа указанных в ряду элементов выберите два элемента, которые проявляют высшую степень окисления, равную +2. Запишите в поле ответа номера выбранных элементов.
Источник: РЕШУ ЕГЭ
Источник: РЕШУ ЕГЭ
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в одном периоде.
Расположите выбранные элементы в порядке возрастания их неметаллических свойств. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
Показать
1
Определите, атомы каких двух из указанных в ряду элементов имеют на внешнем энергетическом уровне семь электронов. Запишите в поле ответа номера выбранных элементов.
Источник: РЕШУ ЕГЭ
2
Из числа указанных в ряду элементов выберите два элемента, которые проявляют низшую степень окисления, равную −1. Запишите в поле ответа номера выбранных элементов.
Источник: РЕШУ ЕГЭ
Источник: РЕШУ ЕГЭ
Всего: 254 1–20 | 21–40 | 41–60 | 61–80 …
Периодический закон
Периодический закон — это фундаментальный закон, который был сформулирован Д.И. Менделеевым в 1869 году.
В формулировке Дмитрия Ивановича Менделеева периодический закон звучал так: «Свойства элементов, формы и свойства образуемых ими соединений находятся в периодической зависимости от величины их атомной массы.» Периодическое изменение свойств элементов Менделеев связывал с атомной массой. Понимание периодичности изменения многих свойств позволило Дмитрию Ивановичу определить и описать свойства веществ, образованных еще не открытыми химическими элементами, предсказать природные рудные источники и даже места их залегания.
Более поздние исследования показали, что свойства атомов и их соединений зависят в первую очередь от электронного строения атома. А электронное строение определяется свойствами атомного ядра. В частности, зарядом ядра атома.
Поэтому современная формулировка периодического закона звучит так:
«Свойства элементов, форма и свойства образованных ими соединений находятся в периодической зависимости от величины заряда ядер их атомов«.
Следствие периодического закона – изменение свойств элементов в определенных совокупностях, а также повторение свойств по периодам, т.е. через определенное число элементов. Такие совокупности Менделеев назвал периодами.
Периоды – это горизонтальные ряды элементов с одинаковым количеством заполняемых электронных уровней. Номер периода обозначает число энергетических уровней в атоме элемента. Все периоды (кроме первого) начинаются щелочным металлом (s-элементом), а заканчиваются благородным газом.
Группы – вертикальные столбцы элементов с одинаковым числом валентных электронов, равным номеру группы. Различают главные и побочные подгруппы. Главные подгруппы состоят из элементов малых и больших периодов, валентные электроны которых расположены на внешних ns— и np— подуровнях.
1. Периодическая система химических элементов Д.И. Менделеева
Периодическая система элементов Д. И. Менделеева состоит из семи периодов, которые представляют собой горизонтальные последовательности элементов, расположенные по возрастанию заряда их атомного ядра.
Каждый период (за исключением первого) начинается атомами щелочных металлов (Li, Na, К, Rb, Cs, Fr) и заканчивается благородными газами (Ne, Ar, Kr, Xe, Rn), которым предшествуют типичные неметаллы.
В периодах слева направо возрастает число электронов на внешнем уровне.
Как следствие,
В периодах слева направо постепенно ослабевают металлические и усиливаются неметаллические свойства.
| Пример. Выберите три элемента малых периодов и расположите эти элементы в порядке уменьшения металлических свойств.
1) Li 2) Ca 3) Cs 4) N 5) S |
| Пример. Выберите три элемента одного периода и расположите эти элементы в порядке уменьшения неметаллических свойств.
1) Be 2) Ba 3) Mg 4) N 5) F |
В первом периоде имеются два элемента – водород и гелий. При этом водород условно размещают в IA или VIIA подгруппе, так как он проявляет сходство и со щелочными металлами, и с галогенами. Как и щелочные металлы, водород является восстановителем. Отдавая один электрон, водород образует однозарядный катион H+. Как и галогены, водород – неметалл, образует двухатомную молекулу H2 и может проявлять окислительные свойства при взаимодействии с активными металлами:
2Na + H2 → 2NaH
В четвертом периоде вслед за Са расположены 10 переходных элементов (от скандия Sc до цинка Zn), за которыми находятся остальные 6 основных элементов периода ( от галлия Ga до криптона Кr). Аналогично построен пятый период. Переходными элементами обычно называют любые элементы с валентными d– или f–электронами.
Шестой и седьмой периоды имеют двойные вставки элементов. За элементом Ва расположены десять d–элементов (от лантана La — до ртути Hg), а после первого переходного элемента лантана La следуют 14 f–элементов — лантаноидов (Се — Lu). После ртути Hg располагаются остальные 6 основных р-элементов шестого периода (Тl — Rn).
В седьмом (незавершенном) периоде за Ас следуют 14 f–элементов- актиноидов (Th — Lr). В последнее время La и Ас стали причислять соответственно к лантаноидам и актиноидам. Лантаноиды и актиноиды помещены отдельно внизу таблицы.
В Периодической системе каждый элемент расположен в строго определенном месте, которое соответствует его порядковому номеру.
Элементы в Периодической системе разделены на восемь групп (I – VIII), которые в свою очередь делятся на подгруппы — главные, или подгруппы А и побочные, или подгруппы Б. Подгруппа VIIIБ-особая, она содержит триады элементов, составляющих семейства железа (Fе, Со, Ni) и платиновых металлов (Ru, Rh, Pd, Os, Ir, Pt).
Внутри каждой подгруппы элементы проявляют похожие свойства и схожи по химическому строению. А именно:
В главных подгруппах сверху вниз усиливаются металлические свойства и ослабевают неметаллические.
В зависимости от того, какая энергетическая орбиталь заполняется в атоме последней, химические элементы можно разделить на s-элементы, р-элементы, d- и f-элементы.
У атомов s-элементов заполняются s-орбитали на внешних энергетических уровнях. К s-элементам относятся водород и гелий, а также все элементы I и II групп главных подгрупп (литий, бериллий, натрий и др.). У p-элементов электронами заполняются p-орбитали. К ним относятся элементы III-VIII групп, главных подгрупп. У d-элементов заполняются, соответственно, d-орбитали. К ним относятся элементы побочных подгрупп.
Из строения атомов и электронных оболочек вытекают следующие закономерности:
Номер периода соответствует числу заполняемых энергетических уровней.
Номер группы, как правило, соответствует числу валентных электронов в атоме (т.е. электроном, способных к образованию химической связи).
Номер группы, как правило, соответствует высшей положительной степени окисления атома. Но есть исключения!
О каких же еще свойствах говорится в Периодическом законе?
Периодически зависят от заряда ядра такие характеристики атомов, как орбитальный радиус, энергия сродства к электрону, электроотрицательность, энергия ионизации, степень окисления и др.
2. Радиус атома
Рассмотрим, как меняется атомный радиус. Вообще, атомный радиус – понятие довольно сложное и неоднозначное. Различают радиусы атомов металлов и ковалентные радиусы неметаллов.
Радиус атома металла равен половине расстояния между центрами двух соседних атомов в металлической кристаллической решетке. Атомный радиус зависит от типа кристаллической решетки вещества, фазового состояния и многих других свойств.
Мы говорим про орбитальный радиус изолированного атома .
Орбитальный радиус – это теоретически рассчитанное расстояние от ядра до максимального скопления наружных электронов.
Орбитальный радиус завит в первую очередь от числа энергетических уровней, заполненных электронами.
Чем больше число энергетических уровней, заполненных электронами, тем больше радиус частицы.
Например, в ряду атомов: F – Cl – Br – I количество заполненных энергетических уровней увеличивается, следовательно, орбитальный радиус также увеличивается.
Если количество заполняемых энергетических уровней одинаковое, то радиус определяется зарядом ядра частицы.
Чем больше заряд ядра, тем сильнее притяжение валентных электронов к ядру.
Чем больше притяжение валентных электронов к ядру, тем меньше радиус частицы. Следовательно:
Чем больше заряд ядра атома (при одинаковом количестве заполняемых энергетических уровней), тем меньше атомный радиус.
Например, в ряду Li – Be – B – C количество заполненных энергетических уровней, заряд ядра увеличивается, следовательно, орбитальный радиус также уменьшается.
В группах сверху вниз увеличивается число энергетических уровней у атомов. Чем больше количество энергетических уровней у атома, тем дальше расположены электроны внешнего энергетического уровня от ядра и тем больше орбитальный радиус атома.
В главных подгруппах сверху вниз увеличивается орбитальный радиус.
В периодах же число энергетических уровней не изменяется. Зато в периодах слева направо увеличивается заряд ядра атомов. Следовательно, в периодах слева направо уменьшается орбитальный радиус атомов.
В периодах слева направо орбитальный радиус атомов уменьшается.
| Пример. Выберите три элемента, которые в Периодической системе находятся в одной группе, и расположите эти элементы в порядке увеличения радиуса атома
1) O 2) Se 3) F 4) S 5) Na |
|
Решение: В одной группе Периодической системы находятся элементы кислород O, селен Se и сера S. В группе снизу вверх атомный радиус уменьшается, а сверху вниз – увеличивается. Следовательно, правильный ответ: O, S, Se или 142. Ответ: 142 |
| Пример. Выберите три элемента, которые в Периодической системе находятся в одном периоде, и расположите эти элементы в порядке уменьшения радиуса атома
1) K 2) Li 3) F 4) B 5) Na |
|
Решение: В одном периоде Периодической системы находятся элементы литий Li, фтор F и натрий Na. В периоде слева направо атомный радиус уменьшается, а справа налево – увеличивается. Следовательно, правильный ответ: Li, B, F или 243. Ответ: 243 |
| Пример. Из указанных в ряду химических элементов выберите три р-элемента. Расположите выбранные элементы в порядке уменьшения радиуса их атомов.
1) Ca 2) P 3) N 4) О 5) Ti |
|
Решение: p-элементы это фосфор Р, азот N, кислород О. В периоде слева направо атомный радиус уменьшается, а справа налево – увеличивается. В группе — сверху вниз увеличивается. Следовательно, правильный ответ: P, N, O или 234. Ответ: 234 |
Рассмотрим закономерности изменения радиусов ионов: катионов и анионов.
Катионы – это положительно заряженные ионы. Катионы образуются, если атом отдает электроны.
Радиус катиона меньше радиуса соответствующего атома. С увеличением положительного заряда иона радиус уменьшается.
Например, радиус иона Na+ меньше радиуса атома натрия Na:
Анионы – это отрицательно заряженные ионы. Анионы образуются, если атом принимает электроны.
Радиус аниона больше радиуса соответствующего атома.
Радиусы ионов также зависят от числа заполненных энергетических уровней в ионе и от заряда ядра.
Например, радиус иона Cl– больше радиуса атома хлора Cl.
Изоэлектронные ионы – это ионы с одинаковым числом электронов. Для изоэлектронных частиц радиус также определяется зарядом ядра: чем больше заряд ядра иона, тем меньше радиус.
Например: частицы Na+ и F‒ содержат по 10 электронов. Но заряд ядра натрия +11, а у фтора только +9. Следовательно, радиус иона Na+ меньше радиуса иона F ‒.
3. Электроотрицательность
Еще одно очень важное свойство атомов – электроотрицательность (ЭО).
Электроотрицательность – это способность атома смещать к себе электроны других атомов при образовании связи. Оценить электроотрицательность можно только примерно. В настоящее время существует несколько систем оценки относительной электроотрицательности атомов. Одна из наиболее распространенных – шкала Полинга.
По Полингу наиболее электроотрицательный атом – фтор (значение ЭО≈4). Наименее элекроотрицательный атом –франций (ЭО = 0,7).
В главных подгруппах сверху вниз уменьшается электроотрицательность.
В периодах слева направо электроотрицательность увеличивается.
| Пример. Из указанных в ряду химических элементов выберите три элемента-неметалла. Расположите выбранные элементы в порядке возрастания их электроотрицательности. Запишите в поле ответа номера выбранных элементов в нужной последовательности:
1) Mg 2) P 3) O 4) N 5) Ti |
|
Решение: Элементы-неметаллы – это фосфор Р, кислород О и азот N. Электроотрицательность увеличивается в группах снизу вверх и слева направо в периодах. Следовательно, правильный ответ: P, N, O или 243. Ответ: 243 |
| Пример. Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке уменьшения их электроотрицательности.
1) As 2) P 3) Al 4) B 5) Na |
| Пример.Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке уменьшения их электроотрицательности.
1) V 2) B 3) Li 4) C 5) He |
Пример. Из указанных в ряду химических элементов выберите три элемента-неметалла. Расположите выбранные элементы в порядке возрастания их
электроотрицательности.
1) Mg 2) P 3) N 4) O 5) Ti
4. Окислительные и восстановительные свойства
Химические свойства простых веществ определяются не только электроотрицательностью, но и особенностями строения (химической связью, кристаллической решеткой и др.). Поэтому лишь с некоторой степенью упрощения можно сказать, что электроотрицательность определяет окислительные и восстановительные свойства простых веществ.
Окислительные свойства — это способность принимать электроны.
В главных подгруппах сверху вниз уменьшаются окислительные свойства простых веществ.
В периодах слева направо окислительные свойства простых веществ увеличиваются.
Важно отметить, что эти закономерности работают только в некоторых рядах, чаще всего для похожих по строению веществ.
| Пример. Из указанных в ряду химических элементов выберите три элемента-неметалла. Расположите выбранные элементы в порядке возрастания окислительных свойств соответствующих им простых веществ.
1) F 2) Al 3) Br 4) Zn 5) H |
Восстановительные свойства — это способность отдавать электроны.
В главных подгруппах сверху вниз увеличиваются восстановительные свойства простых веществ.
В периодах слева направо восстановительные свойства простых веществ уменьшаются.
А что насчет побочных подгрупп? В них расположены металлы. И как сравнивать восстановительные свойства металлов в главных подгруппах и в побочных подгруппах? Примерно сравнить восстановительные свойства простых веществ-металлов позволяет ряд активности металлов.
Слева направо восстановительные свойства металлов уменьшаются.
| Пример. Из указанных в ряду химических элементов выберите три элемента-металла. Расположите выбранные элементы в порядке возрастания восстановительных свойств этих металлов.
1) S 2) Na 3) Al 4) C 5) Mg |
| Пример. Из указанных в ряду химических элементов выберите три элемента-металла. Расположите выбранные элементы в порядке возрастания восстановительных свойств соответствующих им простых веществ. Запишите номера выбранных элементов в нужной последовательности. 1) Sn 2) K 3) B 4) C 5) Ca |
5. Сводная таблица свойств химических элементов и простых веществ
Итак, резюмируем свойства элементов и простых веществ.
Проверьте себя: как меняются по синим стрелкам следующие свойства:
| Свойство | Характер изменения |
| Металлические свойства | |
| Неметаллические свойства | |
| Окислительные свойства простых веществ | |
| Восстановительные свойства простых веществ | |
| Орбитальный радиус | |
| Электроотрицательность |
| Свойство | Характер изменения |
| Металлические свойства | увеличиваются |
| Неметаллические свойства | уменьшаются |
| Окислительные свойства простых веществ | уменьшаются |
| Восстановительные свойства простых веществ | увеличиваются |
| Орбитальный радиус | увеличивается |
| Электроотрицательность | уменьшается |
6. Кислотно-основные свойства оксидов и гидроксидов
Периодически меняются не только свойства элементов и простых веществ, но и свойства сложных соединений. Рассмотрим закономерности изменения свойств высших оксидов и гидроксидов химических элементов 3 периода.
| Na2O | MgO | Al2O3 | SiO2 | P2O5 | SO3 | Cl2O7 |
|
основные свойства уменьшаются слева направо кислотные свойства увеличиваются слева направо |
||||||
| NaOH | Mg(OH)2 | Al(OH)3 | H2SiO3 | H3PO4 | H2SO4 | HClO4 |
Легко заметить, что:
основные свойства высших оксидов и гидроксидов химических элементов увеличиваются справа налево в периоде
кислотные свойства высших оксидов и гидроксидов химических элементов увеличиваются справа налево в периоде
Аналогично изменяются свойства в главных подгруппах.
основные свойства высших оксидов и гидроксидов химических элементов увеличиваются сверху вниз в главных подгруппах
кислотные свойства высших оксидов и гидроксидов химических элементов увеличиваются снизу вверх в главных подгруппах
Проверьте себя: как меняются по синим стрелкам следующие свойства:
| Свойство | Характер изменения |
| Основные свойства высших оксидов | |
| Кислотные свойства высших оксидов | |
| Основные свойства высших гидроксидов | |
| Кислотные свойства высших гидроксидов |
| Свойство | Характер изменения |
| Основные свойства высших оксидов | увеличиваются |
| Кислотные свойства высших оксидов | уменьшаются |
| Основные свойства высших гидроксидов | увеличиваются |
| Кислотные свойства высших гидроксидов | уменьшаются |
| Пример. Из указанных в ряду химических элементов выберите три элемента, в атомах которых электронами заполнено одинаковое количество энергетических уровней, и расположите эти элементы в порядке уменьшения основных свойств их высших оксидов. Запишите в поле ответа номера выбранных элементов в нужной последовательности. 1) Li 2) N 3) Be 4) As 5) P |
| Пример. Из указанных в ряду химических элементов выберите три элемента, в атомах которых на внешнем энергетическом уровне содержится одинаковое количество электронов, и расположите эти элементы в порядке уменьшения основных свойств высших оксидов, которые образуют эти элементы.
1) Al 2) Sr 3) In 4) Tl 5) Ge |
| Пример. Из указанных в ряду химических элементов выберите три элемента, в атомах которых на внешнем энергетическом уровне содержится одинаковое количество электронов, и расположите эти элементы в порядке уменьшения основных свойств высших оксидов, которые образуют эти элементы.
1) Al 2) Sr 3) In 4) Tl 5) Ge |
| Пример.Из указанных в ряду химических элементов выберите три р-элемента. Расположите выбранные элементы в порядке уменьшения кислотных свойств их высших оксидов.
1) Zn 2) C 3) Al 4) Cl 5) Ti |
7. Кислотно-основные свойства водородных соединений
Водород образует два типа бинарных соединений — солеобразные гидриды с металлами и летучие водородные соединения с неметаллами.
Все летучие водородные соединения — газы (кроме воды) при нормальных условиях.
| CH4 — метан | NH3 — аммиак | H2O — вода | HF –фтороводород |
| SiH4 — силан | PH3 — фосфин | H2S — сероводород | HCl –хлороводород |
| AsH3 — арсин | H2Se — селеноводород | HBr –бромоводород | |
| H2Te — теллуроводород | HI –иодоводород |
Свойства летучих водородных соединений изменяются нетипично.
Кислотные свойства водородных соединений неметаллов усиливаются от NH3 к HI
Основные свойства водородных соединений усиливаются от HI к аммиаку NH3
| Пример. Из указанных в ряду химических элементов выберите три элемента, которые образуют летучие водородные соединения. Расположите выбранные элементы в порядке увеличения валентности в их летучих водородных соединениях.
1) Ne 2) Be 3) N 4) C 5) O |
| Пример. Из указанных в ряду химических элементов выберите три элемента, которые образуют летучие водородные соединения. Расположите выбранные элементы в порядке уменьшения кислотного характера их летучих водородных соединений.
1) Cl 2) Zn 3) N 4) S 5) Mg |
| Пример.Из указанных в ряду химических элементов выберите три элемента, которые образуют летучие водородные соединения. Расположите выбранные элементы в порядке уменьшения кислотного характера их летучих водородных соединений.
1) Ca 2) Cl 3) Si 4) S 5) Mn |
Тренажер по теме «Периодический закон» — 10 вопросов, при каждом прохождении новые.
Атомы элементов одной группы имеют одинаковое строение внешней электронной оболочки. Именно поэтому такие элементы имеют сходные химические свойства.
Атомы элементов одного периода имеют одинаковое число энергетических уровней.
Периодический закон: «свойства химических элементов, а также образованных ими веществ находятся в периодической зависимости от заряда ядра атома».
Закономерности изменения свойств элементов по группам и периодам:
Увеличивается: заряд, ЭО, окислительные свойства, неметаллические свойства
Уменьшается: радиус, восстановительные свойства, металлические свойства
Изменение некоторых характеристик элементов в периодах слева направо:
-
заряд ядер атомов увеличивается;
-
радиус атомов уменьшается, потому-что происходит сжатие. Ядру требуется больше энергии, чтобы удержать большое количество электронов, на внешнем уровне;
-
электроотрицательность элементов увеличивается. (Самый электроотрицательный эелемент – F);
-
количество валентных электронов увеличивается от 1 до 8 (равно номеру группы);
-
высшая степень окисления увеличивается (равна номеру группы);
-
число электронных слоев атомов постоянно, так как это число равно номеру периода;
-
металлические свойства уменьшаются, так как к концу периода распалагаются неметаллы;
-
неметаллические элементов увеличивается. (Неметалличность – это способность атомов элемента присоединять электроны).
Изменение некоторых характеристик элементов в группе сверху вниз:
-
заряд ядер атомов увеличивается;
-
радиус атомов увеличивается, потому что увеличивается число электронных слоев;
-
число энергетических уровней (электронных слоев) атомов увеличивается (равно номеру периода);
-
число электронов на внешнем слое атомов одинаково (равно номеру группы);
-
прочность связи электронов внешнего слоя с ядром уменьшается;
-
электроотрицательность уменьшается;
-
металличность элементов увеличивается, так как самый типичный металл — это Fr. (Металличность – это способность элемента отдавать электроны);
-
неметалличность элементов уменьшается.
Элементы, которые находятся в одной подгруппе, являются элементами-аналогами, т. к. они имеют некоторые общие свойства (одинаковую высшую валентность, одинаковые формы оксидов и гидроксидов и др.). Эти общие свойства объясняются строением внешнего электронного слоя.
Электроотрицательностью элемента характеризуется способность его атомов притягивать к себе электроны, которые участвуют в образовании химических связей с другими атомами в молекуле.