МОУ «Репинская СОШ»
Муниципальный конкурс «Готовимся к ЕГЭ и ГИА»
Методические пособия в помощь выпускникам
(Памятки, алгоритмы по химии)
Учитель химии БОУ «Репинская СОШ»
Ильина Татьяна Александровна
2014г
Содержание
I. Общая химия
1. Основные законы химии…………………………………………………………………3
2. Соотношения между единицами…………………..……………………………………3
3. Основные понятия химии……………………………….………………………………4
4. Строение атома…………………..……………………………………………………….5
5. Степень окисления элемента…….………………………………………………………5
6. Окислители и восстановители…………………….……………………………………6
7. Метод электронного баланса (алгоритм)………………………………………………6
8. Определение ионов……………………………………………………………………….7
9. Изменения окраски индикаторов в зависимости от среды…………………………….8
10. Химические свойства классов неорганических веществ……………………………..9
11. Химические свойства металлов……………………………………………………….10
12. Тривиальные названия некоторых неорганических веществ……………………….11
13. Номенклатура некоторых неорганических кислот и солей………………………….12
14. Основные способы получения металлов……………………….……………………..13
15. Гидролиз веществ……………………………………………..………………………..14
II. Органическая химия
1. Общие формулы органических соединений основных классов………………………..…15
2. Алгоритм составления формул изомеров алканов……………..………………………15
3. Алгоритм составления формул углеводородов по их названию……………………..16
4. Названия некоторых органических веществ……………………………………………16
5. Качественные реакции органических веществ…………………..…………………..…17
6. Именные реакции в органической химии……………………………………….……..18
7. Важнейшие свойства органических веществ……………………………………….….21
Литература …………………………………………………..………………………………….22
I. Общая химия
1. Основные законы химии
|
Закон |
Формулировка |
|
Закон сохранения массы |
Масса веществ, вступивших в реакцию, равна массе всех продуктов реакции |
|
Периодический закон |
Свойства простых веществ, а также формы и свойства соединений элементов находятся в периодической зависимости от заряда ядра элемента |
|
Закон постоянства состава |
Каждое вещество, каким бы способом оно ни было получено, всегда имеет один и тот же качественный и количественный состав |
|
Закон сохранения заряда |
Число электронов, отданных восстановителю, равно числу электронов, принятых окислителем. |
|
Закон Авогадро |
В равных объемах различных газов при одинаковых условиях (температура, и давление) содержится одинаковое число молекул |
|
Следствие из закона Авогадро |
1. При одинаковых условиях равные количества различных газов занимают равные объемы. 2. При нормальных условиях (Т = 273,15 К, Р = 1,01 . 105Па или t = 00C; P = 1атм) 1 моль любого газа занимает объем, примерно равный 22,4л. |
|
Объединенный газовый закон |
, где Р0, V0, Т0 – значения давления, объема, температуры при н.у. |
2. Соотношения между единицами
Меры массы
1 т = 103 кг 1 ц = 100 кг 1 кг = 103 г 1 г = 103 мг
Меры объема
1 м3 = 103 дм3 1 м3 = 106 см3 1 дм3 = 103 см3
1 л = 1 дм3 1 м3 = 103 л 1 л = 10-3 м3 1 л = 103см3
Меры длины
1 км = 103 м 1 м = 10 дм 1 м = 100 см
1 дм = 10 см 1 см = 10 мм
3. Основные понятия химии
|
Понятия |
Определения |
|
Массовая доля компонента А в системе С |
|
|
Массовая доля элемента(А) в химическом соединении (АхBy) |
|
|
Массовая доля растворенного вещества в растворе |
|
|
Массовая доля продукта реакции от теоретически возможного |
|
|
Объемная доля выхода газообразного продукта |
|
|
Объемная доля растворенного вещества в растворе |
|
|
Молярная (мольная) доля компонента |
ν (А) число молей компонента А в системе ν (С) – общее число молей всех компонентов системы |
|
Относительная плотность |
Отношение массы данного объема газа к массе такого же объема другого газа |
|
Молярный объем |
|
|
Молярная масса |
|
|
Плотность |
|
|
Число структурных единиц |
N = ν . NA ; NA= 6, 02. 1023 |
4. Строение атома
= = =
A = N + Z A – относительная атомная масса
N – число нейтронов
Z – порядковый номер элемента (число протонов)
Изотопы – разновидности атомов одного и того же химического элемента, имеющие одинаковый заряд ядра, но разную относительную атомную массу. (3618 Ar, 3818 Ar, 4018 Ar)
Изобары – разновидности атомов, имеющие одинаковую относительную атомную массу, но разные физические и химические свойства. ( 4018 Ar, , 4020Ca).
N= 2n2 N – максимальное число электронов на энергетическом уровне.
n- номер энергетического уровня или главное квантовое число.
5. Степени окисления элемента
Атом0 – е— = катион+ (р+ >e—) (окисляется, восстановитель, окисление)
Атом0 + е— = анион – (p+—)(восстанавливается, окислитель, восстановление)
Степень окисления кислорода -2, кроме O+2F2-1, в пероксидах -1 Н2О2-1, Na2O2-1.
Металлы – положительная степень окисления.
Алгоритм определения степени окисления в соединениях
1. Определить степень окисления у наиболее электроотрицательного атома.K2SO42-
2. Определить степень окисления у наименее электроотрицательного атома. K21+SO42-
3. Определить степень окисления у остальных атомов, так чтобы сумма всех степеней окисления была равна нулю. K21+S6+O42 — ; (+1). 2 + х.1 + (-2).4 = 0; х = +6.
6. Окислители и восстановители
|
Соединения металлов Мn+7, Mn+4, Cr+6, Pb+4 |
||
|
Галогены, О2, О3 |
Основные окислители |
Катионы благородных металлов Au, Pt |
|
Соединения неметаллов Сl+1, Cl+3, Cl+5, S+6, N+5 |
|
Металлы |
Соединения металлов |
|
|
Основные восстановители |
||
|
Неметаллы |
Соединения неметаллов |
1. Элемент с минимальной степенью окисления проявляет только восстановительные свойства.
2. Элемент с максимальной степенью окисления проявляет только окислительные свойства.
3. Элемент с промежуточной степенью окисления проявляет восстановительные свойства с более сильным окислителем; окислительные – с более сильным восстановителем.
7. Метод электронного баланса (Алгоритм составления ОРВ)
1. Составить схему химической реакции.
2. Определить и расставить степени окисления всех элементов в левой и правой частях составленной схемы.
3. Выделить элементы, у которых изменилась степень окисления в процессе реакции.
4. Составить схему электронного баланса, определить процессы окисления и восстановления. Найти наименьшее общее кратное для числа принятых и отданных электронов и коэффициенты при окислителе и восстановителе.
5. Расставить коэффициенты перед формулами веществ в уравнении реакции.
6. Проверить правильность составления уравнения, сверяя число атомов каждого элемента в левой и правой частях уравнения.
8. Определение ионов
|
Определяемый ион |
Ион, используемый для определения |
Результаты качественной реакции |
|
Ag+ |
Cl- |
Белый осадок |
|
Cu2+ |
OH— |
Голубой осадок |
|
Cu2+ |
S2- |
Черный осадок |
|
Fe2+ |
OH— |
Зеленоватый осадок, который с течением времени буреет |
|
Fe3+ |
OH— |
Бурый осадок |
|
Zn2+ |
OH— |
Белый осадок, при избытке щелочи растворяется |
|
Al3+ |
OH— |
Белый желеобразный осадок, при избытке щелочи растворяется |
|
NH4+ |
OH— |
Запах аммиака |
|
Ba2+ |
SO42- |
Белый осадок |
|
— |
Окрашивание пламени в желто-зеленый цвет |
|
|
Ca2+ |
CO32- |
Белый осадок |
|
PO43- |
Белый осадок |
|
|
— |
Окрашивание пламени в кирпично-красный цвет |
|
|
Na+ |
— |
Окрашивание пламени в желтый цвет |
|
K+ |
— |
Окрашивание пламени в фиолетовый цвет (через кобальтовое стекло) |
|
Br— |
Ag+ |
Желтоватый осадок |
|
I— |
Ag+ |
Желтый осадок |
|
SO32- |
H+ |
Выделение сернистого газа с резким запахом |
|
CO32- |
H+ |
Выделение газа без запаха, вызывающего помутнение известковой воды |
|
NО3- |
H2SO4(конц) + Cu |
Выделение бурого газа |
|
PO43- |
Ag+ |
Желтый осадок |
|
Mg2+ |
OH— |
Белый осадок |
|
Ni2+ |
OH— |
Зеленый осадок |
|
Cr3+ |
OH— |
Изумрудно-зеленый осадок |
|
Co2+ |
OH— |
Розово-фиолетовый осадок |
|
Mn2+ |
OH— |
Коричневый осадок |
|
Pb2+ |
S2- |
Черный осадок |
9. Изменение окраски индикаторов в зависимости от среды
|
Название индикатора |
Окраска индикатора в нейтральной среде |
Окраска индикатора в щелочной среде (ОН—) |
Окраска индикатора в кислотной среде (Н+) |
|
Лакмус |
Фиолетовая |
Синяя |
Красная |
|
Метиловый оранжевый |
Оранжевая |
Желтая |
Красно-розовая |
|
Фенолфталеин |
Бесцветная |
Малиновая |
Бесцветная |
10. Химические свойства классов неорганических веществ
|
Реагент |
Основный оксид |
Амфотерный оксид |
Кислотный оксид |
Щелочь |
Амфотерный гидроксид |
Кислота |
Соль |
H2O |
|
Основный оксид |
— |
соль |
соль |
— |
соль + H2O |
соль + H2O |
— |
щелочь |
|
Амфотерный оксид |
соль |
— |
соль |
соль + H2O |
— |
соль + H2O |
— |
— |
|
Кислотный оксид |
соль |
соль |
— |
соль + H2O |
соль + H2O |
— |
— |
кислота |
|
Щелочь |
— |
соль + H2O |
соль + H2O |
— |
соль + H2O |
соль + H2O |
соль + основа- ние |
диссоци- ация |
|
Амфотерный гидроксид |
соль + H2O |
— |
соль + H2O |
соль + H2O |
— |
соль + H2O |
— |
— |
|
Кислота |
соль + H2O |
соль + H2O |
— |
соль + H2O |
соль + H2O |
— |
соль + кислота |
диссоци- ация |
|
Соль |
— |
— |
— |
соль + основа- ние |
— |
соль + кислота |
соль + соль |
гидролиз |
11. Химические свойства металлов
|
Реагирующие вещества |
Свойства щелочных металлов |
Свойства щелочноземельных металлов |
Свойства бериллия, магния |
Свойства алюминия |
Свойства железа |
Свойства хрома |
|
H2, t0 |
МеН |
МеН2 |
(t0 , P) МеН2 |
— |
— |
— |
|
Hal2 |
МеHal |
МеHal2 |
МеHal2 |
AlHal3 |
FeHal3 |
СrHal3 |
|
O2, t0 |
Ме2О2(Li2O) |
МеО |
МеО |
Al2O3 |
Fe3O4 |
Сr2O3 |
|
S , t0 |
Ме2S |
МеS |
МеS |
Al2S3 |
FeS |
Cr2S3 |
|
P, t0 |
Ме3P |
— |
— |
AlP |
— |
— |
|
N2, t0 |
Ме3N |
Ме3N2 |
Ме3N2 |
AlN |
Fe3N(Fe2N, Fe4N) |
CrN |
|
C, t0 |
Me2C2 |
MeC2 |
— |
Al4C3 |
Fe3C |
— |
|
H2O |
MeOH+H2 |
Me(OH)2+H2 |
— |
Al(OH)3+H2 |
(+O2) Fe(OH)3 |
(t0) Сr2O3 +H2 |
|
NaOH(Р-Р) |
— |
— |
Na2[Be(OH)4] + H2 |
Na [Al(OH)4] +H2 |
— |
— |
|
NaOH(тв) , t0 |
— |
— |
— |
NaAlO2 + H2 |
— |
— |
|
Fe2O3 , t0 |
— |
— |
— |
Fe + Al2O3 |
— |
— |
|
HNO3(конц) |
MeNO3+N2O+H2O |
Me(NO3)2+N2O+H2O |
Me(NO3)2+N2O+H2O |
пассивирует |
пассивирует |
не реагирует |
|
HNO3(конц) , t0 |
— |
— |
— |
Al(NO3)3 + NO2 +H2O |
Fe(NO3)3 + NO2 +H2O |
Cr(NO3)3 + NO2 +H2O |
|
HNO3(разб) |
MeNO3+NH4NO3 +H2O |
Me(NO3)2+NH4NO3+H2O |
Me(NO3)2+NH4NO3+ H2O |
Al(NO3)3 + NH3 +H2O |
Fe(NO3)3 + NO +H2O |
|
|
H2SO4(конц) |
Me2SO4+H2S+H2O |
MeSO4+H2S+H2O |
MeSO4+SO2+H2O |
пассивирует |
пассивирует |
не реагирует |
|
H2SO4(конц) , t0 |
— |
— |
— |
Al2(SO4)3 +SO2+H2O |
Fe2(SO4)3+SO2+H2O |
Cr2(SO4)3+SO2+H2O |
|
H2SO4(разб) |
Me2SO4+H2 |
MeSO4+H2 |
MeSO4+H2 |
Al2(SO4)3 +H2 |
FeSO4+H2 |
|
|
HCl |
MeCl+H2 |
MeCl2+H2 |
MeCl2+H2 |
AlCl3 +H2 |
FeCl2+H2 |
CrCl2+H2 |
|
Соли |
(распл.)MeAn+Me |
— |
— |
— |
Соль Fe + Me |
— |
|
R-Hal, t0 |
R-R+MeHal |
— |
— |
— |
— |
— |
|
R-OH |
R-OMe+H2 |
— |
— |
— |
— |
— |
12. Тривиальные названия некоторых неорганических веществ
|
Название |
Состав |
|
Азурит (мин.) |
2CuC03.Cu(OH)2 |
|
Алебастр (мин.) |
CaS04. 0,5H20 |
|
Ангидрит |
CaS04 |
|
Апатит (мин.) |
3Ca3(P04)2.Ca(F, Cl)2 |
|
Арсин |
AsH3 |
|
Берлинская лазурь |
Fe4[Fe(CN)6]3 |
|
Бертолетова соль |
КСlO3 |
|
Боксит (мин.) |
А1203.2Н20 |
|
Болотная руда (мин.) |
2Fe203 • 3H20 |
|
Бура |
Na2B4O7.10H2O |
|
Бурый железняк (мин.) |
2Fe203 • 3H20 |
|
Веселящий газ |
N20 |
|
Гипс (мин.) |
CaS04.2H20 |
|
Гипс жженый |
CaSO4.0,5H2O |
|
Глауберова соль |
Na2SO4.10H2O |
|
Глинозем, корунд |
A1203 |
|
Диборан |
B2H6 |
|
Доломит |
CaC03 • MgC03 |
|
Жавелевая вода |
КСlO3 (водн. р-р) |
|
Железный колчедан (мин.), пирит |
FeS2 |
|
Известковая вода, гашеная известь |
Са(ОН)2 (водн. р-р) |
|
Известняк |
СаС03 |
|
Известь негашеная |
СаО |
|
Каломель |
Hg2Cl2 |
|
Каолин (мин.) |
А1203 • 2Si02 • 2Н20 |
|
Карборунд |
SiC |
|
Квасцы алюмокалиевые Хромовые |
KA1(S04)2.12H20 KCr(S04)2.12H20 |
|
Киноварь (мин.) |
HgS |
|
Корунд (мин.) |
A1203 |
|
Криолит |
3NaF . AlF3 |
|
Кровяная соль желтая, красная |
K4Fe(CN)6.3H20 K3Fe(CN)6 |
|
Купорос железный медный цинковый |
FeS04.7H20 CuS04.5H20 ZnS04.7H20 |
|
Ляпис |
Сплав 1 ч. AgN03 с 2 ч. KN03 |
|
Магнезия белая |
MgCO3 или 3MgC03 • Mg(OH)2 • 3H20 |
|
Малахит |
(CuOH)2CO3 |
|
Мел, мрамор, известняк, кальцит |
СаС03 |
|
Нашатырный спирт |
NH3. H2O(водн. р-р) |
|
Нашатырь |
NH4Cl |
|
Олеум |
Р-р S03 в H2S04 |
|
Плавиковая кислота |
HF |
|
Поваренная соль (мин.) |
NaCl |
|
Поташ |
K2C03 |
|
Селитра аммиачная калиевая чилийская |
NH4N03 KN03 NaN03 |
|
Силан |
SiH4 |
|
Силикагель |
Si02 |
|
Сильвинит |
NaCl. КCl |
|
Сода кальцинированная питьевая каустическая(едкий натр), каустик |
Na2C03 NaHC03 NaOH |
|
Сулема |
HgCl2 |
|
Суперфосфат двойной Суперфосфат простой |
Ca(H2P04)2.H20 Ca(H2P04)2.H20 в смеси с CaS04 |
|
Тальк (мин.) |
3MgO . 4Si02 . H20 |
|
Угарный газ |
CO |
|
«Царская водка» |
Смесь 1 ч. конц. HN03 с 3 ч. конц. HCl |
|
Фосфин |
PH3 |
13. Номенклатура некоторых неорганических кислот и солей
|
Название кислоты |
Формула кислоты |
Название средней соли |
|
Азотистая |
HNO2 |
Нитрит |
|
Азотная |
HNO3 |
Нитрат |
|
Кремниевая |
H2SiO3 |
силикат |
|
Марганцовая |
HMnO4 |
Перманганат |
|
Марганцовистая |
H2MnO4 |
Манганат |
|
Фосфорная (орто) |
H3PO4 |
Фосфат |
|
Фосфористая (метафосфорная) |
HPO3 |
Фосфит (метафосфат) |
|
Фосфорноватистая |
H3PO2 |
Гипофосфиты |
|
Хлорноватистая |
HClO |
Гипохлорит |
|
Хлористая |
HClO2 |
Хлорит |
|
Хлорноватая |
HClO3 |
Хлорат |
|
Хлорная |
HClO 4 |
Перхлорат |
|
Соляная |
HCl |
Хлорид |
|
Хромовая |
H2CrO4 |
Хромат |
|
Хромистая |
HCrO2 |
Хромит |
|
Двухромовая |
H2Cr2O7 |
Дихромат |
|
Иодноватая |
HIO3 |
Иодаты |
|
Иодная |
H5IO6 |
Периодаты |
14. Основные способы получения металлов
Металлургия – наука о методах и процессах производства металлов из руд.
1. Пирометаллургия – получение металлов из руд реакциями восстановления при высоких температурах (t0).
Из оксидов:
Восстановители: С, СО, Н2:
ZnO + C Zn + CO
Алюминотермия:
Сr2О3 + 2Аl 2Сr + Аl2О3
Из сульфидов:
2ZnS + 3О2 2ZnO + 2SО2 ;
ZnO + C Zn + CO .
2. Гидрометаллургия – получение металлов из растворов их солей:
CuO + H2SO4(р-р) = CuSO4 + H2O;
CuSO4 + Fe = FeSO4 + Cu.
3. Электрометаллургия – получение металлов, основанное на электролизе растворов и расплавов солей.
2NaCl 2Na0 +
15. Гидролиз веществ
Гидролиз – реакция обменного (гидролитического) разложения веществ водой.
Гидролизу подвергаются многие вещества:
карбиды: СаС2 + 2Н2О = Са(ОН)2 + С2Н2
нитриды: Mg3N2 + 6Н2О = 3Mg(ОН)2 + 2NH3
фосфиды: Ca3P2 + 6Н2О = 3Ca(ОН)2 + 2PH3
галогениды: SiCl4 + 3Н2О = H2SiO3 + 4HCl
углеводы: сахароза + вода = глюкоза + фруктоза
сложные эфиры, в т.ч. жиры:
сложный эфир + вода карбоновая кислота + спирт
Гидролиз соли – процесс обменного взаимодействия ионов соли с молекулами воды
Случаи гидролиза солей
|
Кислота |
Основание |
|
|
Сильный электролит |
Слабый электролит |
|
|
Сильная |
Гидролиз не идет. Среда нейтральная. Цвет индикаторов не изменяется |
Гидролиз по катиону. Среда кислая. Красная окраска лакмуса |
|
Слабая |
Гидролиз по аниону. Среда щелочная. Малиновая окраска фенолфталеина |
Гидролиз и по катиону, и по аниону. Среда может быть различной. Окраска индикаторов в соответствии с характером среды |
Сильные кислоты: HCl, Н2SО4, HNO3, HI, HClO4, HMnO4,HBr
Слабые кислоты: HF, H3PO4, H2SiO3, H2CO3, CH3COOH, H2S, HNO2, Н2SО3, органические кислоты
II. Органическая химия
1. Общие формулы органических соединений основных классов
|
Название класса соединений |
Общая формула |
|
Алканы |
СnH2n+2 |
|
Алкены, циклоалканы |
СnH2n |
|
Алкины, алкадиены, циклоалкены |
СnH2n-2 |
|
Одноатомные спирты, простые эфиры |
СnH2n+1OH |
|
Двухатомные спирты |
СnH2n(OH)2 |
|
Трехатомные спирты |
СnH2n-1(OH)3 |
|
Альдегиды (предельные), кетоны |
СnH2n+1CHO |
|
Одноосновные карбоновые кислоты, сложные эфиры |
СnH2n+1COOH |
|
Двухосновные карбоновые кислоты |
СnH2n(COOH)2 |
|
Амины |
СnH2n+1NH2 |
|
Нитросоединения |
СnH2n+1NO2 |
|
Аминокислоты |
СnH2nNH2COOH |
|
Ароматические углеводороды, гомологи бензола |
СnH2n-6 |
|
Ароматические одноатомные спирты |
СnH2n-7OH |
|
Ароматические двухатомные спирты |
СnH2n-8(OH)2 |
|
Ароматические альдегиды |
СnH2n-7CHO |
|
Ароматические одноосновные кислоты |
СnH2n-7COOH |
2. Алгоритм составления формул изомеров алканов
1. Определите число атомов углерода по корню названия углеводорода.
2. Изобразите схему нормальной углеродной цепи и пронумеруйте в ней атомы углерода.
3. Изобразите схему пронумерованной углеродной цепи изомеров, которых по сравнению с нормальной цепью на один атом углерода меньше, этот атом углерода присоедините во всевозможных положениях к атомам углерода пронумерованной главной цепи, кроме крайних.
4. Составьте схему пронумерованной углеродной цепи изомеров, в которых по сравнению с нормальной цепью на два атома углерода меньше; эти два атома углерода присоедините всевозможных положениях к атомам углерода пронумерованной главной цепи, кроме крайних.
5. Впишите атомы водорода с учетом недостающих единиц валентности у атомов углерода в схемах углеродной цепи (валентность углерода – IV).
6. Количество атомов углерода и водорода в углеродной цепи изомеров не должно меняться.
3. Алгоритм составления формул углеводородов по их названию
1. Определите число атомов углерода в молекуле по корню названия углеводорода.
2. Изобразите углеродную цепь в соответствии с числом атомов углерода в молекуле.
3. Пронумеруйте углеродную цепь.
4. Установите наличие соответствующей углеродной связи в молекуле по суффиксу названия углеводорода, изобразите эту связь в углеродной цепи.
5. Подставьте радикалы в соответствии с номерами атомов углерода в цепи.
6. Обозначьте черточками недостающие валентности у атомов углерода.
7. Впишите недостающие атомы водорода.
8. Представьте структурную формулу в сокращенной записи.
4. Названия некоторых органических веществ
|
Химическая формула |
Систематическое название вещества |
Тривиальное название вещества |
|
СH2Cl2 |
Дихлорметан |
Хлористый метилен |
|
CHCl3 |
Трихлорметан |
Хлороформ |
|
CCl4 |
Тетрахлорметан |
Четыреххлористый углерод |
|
C2H2 |
Этин |
Ацетилен |
|
C6H4(CH3)2 |
Диметилбензол |
Ксилол |
|
C6H5CH3 |
Метилбензол |
Толуол |
|
C6H5NH2 |
Аминобензол |
Анилин |
|
C6H5OH |
Гидроксибензол |
Фенол, карболовая кислота |
|
C6H2CH3(NO2)3 |
2,4,6-тринитротолуол |
Тол, тротил |
|
С6Н3(ОН)3 |
1,2,3 — тригидроксибензол |
Пирогаллол |
|
С6Н4(ОН)2 |
1,3 — дигидроксибензол |
Резорцин |
|
С6Н4(ОН)2 |
1,2- дигидроксибензол |
Пирокатехин |
|
С6Н4(ОН)2 |
1,4 — дигидроксибензол |
Гидрохинон |
|
C6H2OH(NO2)3 |
2,4,6- тринитрофенол |
Пикриновая кислота |
|
C3H5(OH)3 |
Пропантриол -1,2,3 |
Глицерин |
|
C2H4(OH)2 |
Этандиол – 1,2 |
Этиленгликоль |
|
C6H5CH2OH |
Фенилметанол |
Бензиловый спирт |
|
С6H8(OH)6 |
Гексангексаол-1,2,3,4,5,6 |
Сорбит |
|
C3H6O |
Прапанон |
Ацетон |
|
CH3OH |
Метанол (метиловый спирт) |
Древесный спирт |
|
СН2О |
Метаналь |
Формальдегид |
|
С2Н4О |
Этаналь |
Уксусный альдегид, ацетальальдегид |
|
С3Н6О |
Пропаналь |
Пропионовый альдегид |
|
С3Н4О |
Пропеналь |
Акролеин |
|
С6Н5СОН |
Бензальдегид |
Бензойный альдегид |
|
С4Н8О |
Бутаналь |
Масляный альдегид |
|
С5Н10О |
Пентаналь |
Валериановый альдегид |
|
НСООН |
Метановая кислота |
Муравьиная кислота(соль — формиат) |
|
СН3СООН |
Этановая кислота |
Уксусная кислота( соль – ацетат) |
|
С2Н5СООН |
Пропановая кислота |
Пропионовая кислота |
|
С3Н7СООН |
Бутановая кислота |
Масляная кислота |
|
С4Н9СООН |
Пентановая кислота |
Валериановая кислота |
|
С5Н11СООН |
Гексановая кислота |
Капроновая кислота |
|
С6Н13СООН |
Гептановая кислота |
Энантовая кислота |
|
С7Н15СООН |
Октановая кислота |
Каприловая кислота |
|
С8Н17СООН |
Нонановая кислота |
Пеларголовая кислота |
|
НООС — СООН |
Этандиовая кислота |
Щавелевая кислота(соль – оксалат) |
|
НООС –СН2 — СООН |
Пропандиовая кислота |
Малоновая кислота |
|
НООС –(СН2)2 — СООН |
Бутандиовая кислота |
Янтарная кислота |
|
С17Н33СООН(непред) |
Октадекеновая кислота |
Олеиновая кислота |
|
С15Н31СООН(пред) |
Гексадекановая кислота |
Пальмитиновая кислота |
|
С17Н35СООН(пред) |
Октадекановая кислота |
Стеариновая кислота(соль – стеарат) |
5. Качественные реакции органических веществ
1. Алкен обесцвечивает бромную воду
CH2=СH2 + Br2 → CH2Br -СH2Br
Обесцвечивает раствор KMnO4
CH2=СH2 + [O] + Н2О → CH2OH-СH2OH
2. Алкин обесцвечивает бромную воду
CH≡СH + 2Br2 → CH2Br2-СH2Br2
Обесцвечивает раствор KMnO4
CH≡СH + 4[O] + Н2О → HOOC-COOH
3. Реакция на многоатомные спирты
2CH2OH-СH2OH + Cu(OH)2 → 2Н2О +
Ярко-синий раствор
4. Фенол с бромной водой образует белый осадок
ОН
ОН + 3Br2 → Br Br + 3НBr
Br
5. Фенол с хлоридом железа (II) – грязно-фиолетовое окрашивание
6 С6Н5ОН + FeCl3 → [Fe(С6Н5О)6]3- + 3Cl— + 6H+
6. Реакция серебряного зеркала на альдегиды
R-COH + Ag2O → R-COOH + 2Ag
7. Альдегиды с Cu(OH)2
R-COH + Cu(OH)2 R-COOH + Cu2O + 2Н2О (красный осадок)
8. Биуретовая реакция с пептидами дает фиолетово-синее окрашивание
(белок с Cu(OH)2).
9. Ксантопротеиновая реакция (белок с азотной концентрированной кислотой дает желтый осадок).
10. Анилин с бромной водой
NH2
NH2 + 3Br2 → 3HBr + Br Br
Br
6. Именные реакции в органической химии
1. Реакция Вюрца
2СН3-Сl + 2Na СН3-СH3 + 2NaCl
2. Реакция Вюрца-Фиттига
С6Н5С1 + 2Na + СН3-Сl С6Н5СH3 + 2NaCl
3. Реакция Коновалова
СН3-СH3 + НО-NО2 СН3-СH2— NО2 + Н2О
4. Реакция Кучерова
СН≡СН + Н2О СН3-СOH
5. Реакция Фриделя-Крафтса
С6Н6 + С1-СH3 С6Н5СH3 + HCl
6. Реакция Зинина
С6Н5NО2 + 6[H] С6Н5NH2 + 2Н2О
7. Реакция Лебедева
2 СН3-СH2-ОН CH2=CH-CH=СH2 + 2Н2О + Н2
n CH2=CH-CH=СH2 (-CH2-CH-=CH-СH2-)n
8. Реакция Зелинского – Казанского
3CH≡СН С6Н6 (бензол)
9. Метод Фишера-Тропша
СО2 + 4Н2 СН4 + 2Н2О
CO + 3Н2 СН4 + Н2О
10. Реакция Кольбе (электролиз солей карбоновых кислот)
2R-COONa + 2Н2О 2NaOH + Н2 + R-R + СО2
11. Реакция Вагнера
CH2=СH2 + + Н2О → CH2OH-СH2OH
12. Реакция Гриньяра
СН3-I + Mg СН3— MgI
13. Реакция Канниццаро
С6Н5COH + HCOH С6Н5CH2OH + HCOONa
14. Метод Реймера и Тимана
OH OH OH
+
COH
Важнейшие свойства органических соединений.
|
Реакции |
Классы соединений |
||||||||
|
Углеводороды |
Производные алканов |
||||||||
|
Предельные (алканы) |
Непредельные |
Арены |
Спирты |
Альдегиды |
Карбоновые кислоты |
Амины |
Аминокислоты |
Эфиры |
|
|
Окисление |
+ |
+ |
+ |
+ |
+ |
+ |
|||
|
Горение |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
|
Восстановление |
+ |
+ |
+ |
+ |
|||||
|
Гидрирование (+ водород) |
+ |
+ |
+ |
+ |
|||||
|
Дегидрирование ( – водород) |
+ |
+ |
+ |
||||||
|
Галогенирование (+ галоген) |
+ |
+ |
+ |
+ |
+ |
||||
|
Гидрогалогенирование (+ галогеноводород) |
+ |
+ |
+ |
+ |
|||||
|
Гидратация (+ вода) |
+ |
+ |
+ |
+ |
|||||
|
Дегидратация (- вода) |
+ |
||||||||
|
Нитрование (+ нитрогруппа) |
+ |
+ |
|||||||
|
Этерификация (спирт + карб.кислота = сложный эфир) |
+ |
+ |
+ |
||||||
|
Гидролиз (разложение веществ водой) |
+ |
||||||||
|
Кислотные свойства |
+ |
+ |
+ |
||||||
|
Основные свойства |
+* |
+ |
+ |
||||||
|
Полимеризация (образование полимера) |
+ |
+ |
|||||||
|
Поликонденсация (образование полимера и др. веществ) |
+** |
+ |
*С галогенами
** Для многоатомных спиртов
Литература
1. Горбунцова С.В. Тесты и ЕГЭ по основным разделам школьного курса химии: 10-11 классы. М., ВАКО, 2006.
2. Гузей Л.С. Новый справочник по химии. М., Большая Медведица, 2002.
3. Косова О.Ю. ЕГЭ. Химия. Челябинск, Взгляд, 2004.
4. Насонова А.Е. Химия в таблицах. М., Дрофа, 2006.
5. Сорокин В.В. Сборник задач с решениями и ответами. М., Астрель, 2001.
6. Суровцева Р.П. Химия 10-11 классы. Методическое пособие. М., Дрофа, 2001.
7. Тесты. Химия. М., Центр тестирования МО РФ, 2004.
8. Хомченко Г.П. Сборник задач по химии для поступающих в вузы. М., Новая волна, 2003.
Запоминалки для школьников
Реакции двойного обмена идут до конца:, Если выделится газ — Это раз;И получится вода -Это два;А еще — нерастворимый Осаждается продукт…»Есть осадок» — говорим мы.Это третий важный пункт.Химик правила обменаНе забудет никогда:В результате — непременноБудет газ или вода, Выпадет осадок — Вот тогда — порядок! Давайте-ка изучим номенклатуру неорганических веществ
Вот анионы кислородных кислот хлора:ClO4— — перхлорат-анионClO3— — хлорат-анионClO2— — хлорит-анионClO— — гипохлорит-анион
В хлориде хлор совсем один. Зато себе он господин.И отрицательным зарядом Делиться с братьями не надо.Перхлорат с хлоратом-братомИ хлорит с гипохлоритомЗаявляют всем открыто:»Мы скромны и небогаты, Хлор у нас — центральный атом,Но слывем вояками И окислим всякого!»
А вот анионы кислот, содержащих серу:
S2— — сульфид-анионHS— — гидросульфид-анионSO32— — сульфит-анионHSO3— — гидросульфит-анионSO42— — сульфат-анионHSO4— — гидросульфат-анион
Сульфит не путайте с сульфидом, Чтоб места не было обидам:Сульфиды — сероводорода Родня. И нет в них кислорода!А вот сульфит. Скорей смотри:В нем кислорода сразу три!Добавим кислорода атом -И познакомимся с сульфатом!
СТИХИ:В красной соли кровяной
калий с тройкой за стеной.
Дальше феррум, шесть цианов
Все в порядке, без обманов.
…ПРО ГАЛОГЕНЫ
Хлор хвалился: «Нет мне равных!Галоген я самый главный.Зря болтать я не люблю:Всё на свете отбелю!»Иод красой своей гордился,Твердым был, но испарился. Фиолетовый, как ночь,Далеко умчался прочь.Бром разлился океаном,Хоть зловонным, но — румяным.Бил себя он грозно в грудь: «Я ведь бром! Не кто-нибудь!..»Фтор молчал и думал: «Эх!..Ведь приду — окислю всех…»ПРО ХАЛЬКОГЕНЫ — ЭЛЕМЕНТЫ VIA-группы
Халькогены часто вместе,И о ком из них ни спросим — Все живут в шестом подъезде «Менделеевского дома».С ними мы давно знакомы.»Я жилец квартиры восемь.Я могу зажечь на спорСпичку, печку и костер.Кто вам всем дышать дает — Атмосферный кислород!»Кто под номером шестнадцать?»Я готова вам признаться:Вижу я себя на троне В восьмиатомной короне.Не парю я в атмосфере,Тяжко мне живется, сере!»Красный или серый,Свет готов ловить селен.(Необычный элемент!)А теллур из тьмы возник,Это полупроводник.И у всех манеры -Точно как у серы.
ПРО ЭЛЕМЕНТЫ IVA-группы
Пятеро нас. Мы особого сорта.Мы — элементы группы четвертой.Наш коллектив удивительно дружен,Каждый из нас очень важен и нужен.У элемента номер шесть Достоинств очень много есть.»Людям я совсем как брат.Много тысяч лет назадЯ уже пылал в костре, Освещая интерьерПервобытных их пещер.И украсить был я рад Дам и рыцарей наряд,Что блистали при дворе…Если мягким быть решу, -То в тетради я пишу.Такова, друзья, природаЭлемента углерода!»Сосед углерода привык к работе, Замену ему нигде не найдете. Если бы этот пропал элемент, Где бы мы взяли кирпич и цемент, Чем бы стеклили окно, и кудаДелись бы кварц, и фарфор, и слюда?Пляжи песчаные, толщи подземные -Где бы все это было без кремния?
«Дайте выйти в первый ряд!Я ведь — номер пятьдесят.Я древний, но выгляжу молодо.Я — в бронзе, похожей на золото.Но я не спесив. Всем люблю помогать:И дырку в кастрюле могу запаять, Фольгой, даже банкой готов я предстать.И лишь от мороза теряю я голову.Ну как, догадались? Зовут меня олово».Поднял голову едваНомер восемьдесят два:»Знает каждый ученик:Я — металл. Пусть я старик, Но за все берусь с отвагой,Не сижу без дела я.Я рисую. Где бумага?Я стреляю из ружья.Труба канализации,Экран от радиации,Балласт подводного пловца -Моим заслугам нет конца;Таков уж мой природный стиль:Я ток даю в автомобиль…Ну, догадайтесь, наконец, Кто я? Меня зовут свинец».»А я здесь самый молодой, И не седою бородой,А тем, что полупроводник,Быть примечательным привык.Открыт я был в Германии, Зовут меня германием».
Запоминательные стихи по органической химии
Запомним, друг, и я, и ты,Чем отличаются спирты — В них углерод и гидроксид, И каждый спирт легко горит.R — это значит радикал,Он может быть велик и мал, Предельный или непредельный.Но это разговор отдельный.Приятно пахнут альдегиды,Но группа C(H)O их выдаст.Среди карбоновых кислотИзвестных «лиц» невпроворот.В кислотах — группы карбоксильные,Но все кислоты здесь — несильные.В кетонах группа есть CO,Но это тоже ничего…Горит прекрасно ацетон,И растворитель — тоже он.Мы говорим спокойно: жир.А между прочим, он — эфир,Он из кислот и глицерина.Такая вот у нас картина…
Если ты, придя с мороза,Наливаешь крепкий чай,Хорошенько сахарозув чашке ложкой размешай.Виноградную глюкозу И медовую фруктозуи молочную лактозулюбит взрослый и малыш.Но крахмалом и клетчаткой, Что совсем-совсем несладкиТоже нас не удивишь.
Так устроена природа — Это тоже углеводы.
Если Вы являетесь автором этой работы и хотите отредактировать, либо удалить ее с сайта — свяжитесь, пожалуйста, с нами.
Запоминалки для школьников
Реакции двойного обмена идут до конца:, Если выделится газ — Это раз;И получится вода -Это два;А еще — нерастворимый Осаждается продукт…»Есть осадок» — говорим мы.Это третий важный пункт.Химик правила обменаНе забудет никогда:В результате — непременноБудет газ или вода, Выпадет осадок — Вот тогда — порядок! Давайте-ка изучим номенклатуру неорганических веществ
Вот анионы кислородных кислот хлора:ClO4— — перхлорат-анионClO3— — хлорат-анионClO2— — хлорит-анионClO— — гипохлорит-анион
В хлориде хлор совсем один. Зато себе он господин.И отрицательным зарядом Делиться с братьями не надо.Перхлорат с хлоратом-братомИ хлорит с гипохлоритомЗаявляют всем открыто:»Мы скромны и небогаты, Хлор у нас — центральный атом,Но слывем вояками И окислим всякого!»
А вот анионы кислот, содержащих серу:
S2— — сульфид-анионHS— — гидросульфид-анионSO32— — сульфит-анионHSO3— — гидросульфит-анионSO42— — сульфат-анионHSO4— — гидросульфат-анион
Сульфит не путайте с сульфидом, Чтоб места не было обидам:Сульфиды — сероводорода Родня. И нет в них кислорода!А вот сульфит. Скорей смотри:В нем кислорода сразу три!Добавим кислорода атом -И познакомимся с сульфатом!
СТИХИ:В красной соли кровяной
калий с тройкой за стеной.
Дальше феррум, шесть цианов
Все в порядке, без обманов.
…ПРО ГАЛОГЕНЫ
Хлор хвалился: «Нет мне равных!Галоген я самый главный.Зря болтать я не люблю:Всё на свете отбелю!»Иод красой своей гордился,Твердым был, но испарился. Фиолетовый, как ночь,Далеко умчался прочь.Бром разлился океаном,Хоть зловонным, но — румяным.Бил себя он грозно в грудь: «Я ведь бром! Не кто-нибудь!..»Фтор молчал и думал: «Эх!..Ведь приду — окислю всех…»ПРО ХАЛЬКОГЕНЫ — ЭЛЕМЕНТЫ VIA-группы
Халькогены часто вместе,И о ком из них ни спросим — Все живут в шестом подъезде «Менделеевского дома».С ними мы давно знакомы.»Я жилец квартиры восемь.Я могу зажечь на спорСпичку, печку и костер.Кто вам всем дышать дает — Атмосферный кислород!»Кто под номером шестнадцать?»Я готова вам признаться:Вижу я себя на троне В восьмиатомной короне.Не парю я в атмосфере,Тяжко мне живется, сере!»Красный или серый,Свет готов ловить селен.(Необычный элемент!)А теллур из тьмы возник,Это полупроводник.И у всех манеры -Точно как у серы.
ПРО ЭЛЕМЕНТЫ IVA-группы
Пятеро нас. Мы особого сорта.Мы — элементы группы четвертой.Наш коллектив удивительно дружен,Каждый из нас очень важен и нужен.У элемента номер шесть Достоинств очень много есть.»Людям я совсем как брат.Много тысяч лет назадЯ уже пылал в костре, Освещая интерьерПервобытных их пещер.И украсить был я рад Дам и рыцарей наряд,Что блистали при дворе…Если мягким быть решу, -То в тетради я пишу.Такова, друзья, природаЭлемента углерода!»Сосед углерода привык к работе, Замену ему нигде не найдете. Если бы этот пропал элемент, Где бы мы взяли кирпич и цемент, Чем бы стеклили окно, и кудаДелись бы кварц, и фарфор, и слюда?Пляжи песчаные, толщи подземные -Где бы все это было без кремния?
«Дайте выйти в первый ряд!Я ведь — номер пятьдесят.Я древний, но выгляжу молодо.Я — в бронзе, похожей на золото.Но я не спесив. Всем люблю помогать:И дырку в кастрюле могу запаять, Фольгой, даже банкой готов я предстать.И лишь от мороза теряю я голову.Ну как, догадались? Зовут меня олово».Поднял голову едваНомер восемьдесят два:»Знает каждый ученик:Я — металл. Пусть я старик, Но за все берусь с отвагой,Не сижу без дела я.Я рисую. Где бумага?Я стреляю из ружья.Труба канализации,Экран от радиации,Балласт подводного пловца -Моим заслугам нет конца;Таков уж мой природный стиль:Я ток даю в автомобиль…Ну, догадайтесь, наконец, Кто я? Меня зовут свинец».»А я здесь самый молодой, И не седою бородой,А тем, что полупроводник,Быть примечательным привык.Открыт я был в Германии, Зовут меня германием».
Запоминательные стихи по органической химии
Запомним, друг, и я, и ты,Чем отличаются спирты — В них углерод и гидроксид, И каждый спирт легко горит.R — это значит радикал,Он может быть велик и мал, Предельный или непредельный.Но это разговор отдельный.Приятно пахнут альдегиды,Но группа C(H)O их выдаст.Среди карбоновых кислотИзвестных «лиц» невпроворот.В кислотах — группы карбоксильные,Но все кислоты здесь — несильные.В кетонах группа есть CO,Но это тоже ничего…Горит прекрасно ацетон,И растворитель — тоже он.Мы говорим спокойно: жир.А между прочим, он — эфир,Он из кислот и глицерина.Такая вот у нас картина…
Если ты, придя с мороза,Наливаешь крепкий чай,Хорошенько сахарозув чашке ложкой размешай.Виноградную глюкозу И медовую фруктозуи молочную лактозулюбит взрослый и малыш.Но крахмалом и клетчаткой, Что совсем-совсем несладкиТоже нас не удивишь.
Так устроена природа — Это тоже углеводы.

Подготовка к ЕГЭ по химии и другие
полезные материалы для учителя химии, которые вы можете выбрать и скачать бесплатно в этом разделе.
Показывать
Подготовка к ЕГЭ

Химия

Все классы

Все учебники



Урок по теме: «Бензол и его соединения»
Подготовка к ЕГЭ 
Бензо́л — органическое химическое соединение, бесцветная жидкость со специфическим сладковатым запахом. Простейший ароматический углеводород. Широко применяется в промышленности,…
12.01.2022, Андреева Елена Сергеевна





Задачи на тему «Взаимосвязь органических веществ»
Подготовка к ЕГЭ 
Данную подборку задач на тему » Взаимосвязь органических веществ» можно использовать при изучении химии в 10 классе, а также при подготовке к ЕГЭ по химии.
03.02.2021, Кокуева Елена Станиславовна

Задачи на тему «Условия смещение химического равновесия»
Подготовка к ЕГЭ 
В данной работе приведены задания на тему » Условия смещения химического равновесия» с ответами. Можно использовать как на уроке, так и для подготовки к ЕГЭ по химии.
03.02.2021, Кокуева Елена Станиславовна


Таблица Менделеева
Самый первый — водород.
Это знает весь народ.
Гелий, Литий и Бериллий,
Бор, а следом — Углерод,
Там Азот, а за Азотом
Двухвалентный Кислород.
Фтор с Неоном, Натрий, Магний,
Алюминий, Кремний тут.
Фосфор, Сера, Хлор с Аргоном,
Калий с Кальцием идут.
Скандий, вслед- Титан, Ванадий.
Хром и Марганец, а там
Уж железо вставить надо,
Ну и Кобальт по пятам.
Никель с Медью,
Цинк и Галлий,
И Германий близко так.
Ну а следом угадали-
Сам убийственный мышьяк.
Место здесь Селену с Бромом.
К ним пристроился Криптон.
Вслед Рубидий, незнакомый —
Стронций, Иттрий влезли в дом.
А цирконий и Ниобий
Обогнали Молибден.
А за ним — Технеций вроде,
И Рутению — » добро»
За Рутением и Родий
Там Палладий, Серебро.
Кадмий, Индий тут же рядом
Следом- Олово, Сурьма
Дальше Йод с Ксеноном надо
Разместить. Сойдешь с ума
Оттого, что Цезий, Барий
Вместе встали, а Лантан,
С Церием стоял бы в паре.
Но второго нету там.
Он стоит в отдельной строчке
Возглавляя новый ряд.
Празеодим и Неодим
И Прометий в нём стоят.
Там Самарий и Европий,
Гадолиний, Тербий тож,
И какой-то там Диспрозий
Врезался как острый нож.
Дальше- Гольмий, Эрбий, Тулий,
Вслед Иттербий влез подлец.
Их тринадцать влезли в улей
И Лютеций, наконец.
Но местечко ведь осталось
Где последним был Лантан.
Рядом с Гафнием, Танталом,
Разместился сам Вольфрам.
А за ними — Рений, Осмий
И Иридий тут как тут.
Дальше -Платина, а после
Золото и Ртуть идут.
А за Ртутью — Таллий. Рядом
разместился и Свинец.
Висмут мы увидеть рады.
И Полоний, наконец.
Вот Астат с Радоном гордым.
Франций с Радием вдвоем.
И Актиний. Резерфордом.
новый ряд опять начнем.
Между ними Торий вгоним,
Протактиний и Уран.
Там — Нептуний и Плутоний,
Ну а честь имен и стран.
Америций, Кюрий, Берклий,
Калифорний,наконец.
Вот Энштейний с высшей меркой.
Ну и Фермий, наконец.
Менделеевий родимый
С ним стоять Нобелий рад.
И концом неумолимым
Лоуренсий занял ряд.
К Резерфордию вернуться
Мы теперь опять должны.
Там уже в прихожей мнутся
Дубний (назван в честь Дубны!)
К Сиборговию примкнули
Борий, Хассий -новички.
Там Мейтнерий,Ун-ун-нули.
А теперь сними очки.
И реши себе признаться:
Что «сто десять» не конец.
Найден номер «сто шестнадцать»
Но нам кажется «творец»
Не закончил им таблицу
Широко открыта дверь.
Чтобы в этом убедиться
Этой формуле поверь:
Nn = Σ n [ 1+(-1)] exp ( n-1)
Эн( n) здесь просто номер ряда
ЭН (Nn) — все атомы в ряду.
Только здесь подумать надо,
Что ученым на беду.
Лишний ряд встает в начале
(Россий — Невий в нем живут).
Все его не замечали.
Что же нам поделать тут?
Не кричать же : Бога ради
Нужно в Солнце их искать.
Может быть еще «Коллайдер»
Подтвержденье сможет дать.
Спорить здесь я не намерен.
Время споры разрешит.
Но сейчас, по крайней мере,
Тему я поднял на щит.
Функциональные группы
Запомним, друг, и я, и ты,
Чем отличаются спирты —
В них углерод и гидроксид,
И каждый спирт легко горит.
R — это значит радикал,
Он может быть велик и мал,
Предельный или непредельный.
Но это разговор отдельный.
Приятно пахнут альдегиды,
Но группа C(H)O их выдаст.
Среди карбоновых кислот
Известных «лиц» невпроворот.
В кислотах — группы карбоксильные,
Но все кислоты здесь — несильные.
В кетонах группа есть CO,
Но это тоже ничего…
Горит прекрасно ацетон,
И растворитель — тоже он.
Мы говорим спокойно: жир.
А между прочим, он — эфир,
Он из кислот и глицерина.
Такая вот у нас картина…
Индикаторы
От щелочи я желт как в лихорадке,
И от кислот краснею, словно от стыда,
Но я бросаюсь в воду без оглядки,
И тут уж не заест меня среда
(метиловый оранжевый)
Попасть в кислоту — вот неудача,
Но он перетерпит без вздоха и плача,
Зато в щелочах у фенолфталеина
Начнется не жизнь, а сплошная малина!
Вещества
— Купорос мой медный!
Почему ты бледный?
— Потому я вредный —
Что нагрев мне вредный.
Воду поднеси мне,
Снова стану синим.
Если ты, придя с мороза,
Наливаешь крепкий чай,
Хорошенько сахарозу
в чашке ложкой размешай.
Виноградную глюкозу
И медовую фруктозу
и молочную лактозу
любит взрослый и малыш.
Но крахмалом и клетчаткой,
Что совсем-совсем несладки
Тоже нас не удивишь.
Так устроена природа —
Это тоже углеводы.
Правило Марковникова
Найдешb ли справедливость тут
Где действуют двойные связи:
Где много — там еще дадут,
Где мало — там отнимут сразу!
Правило Клечковского
Нас арифметикой банальною
не мучай
Над нами лишь Клечковский
господин,
А он сказал, что 3+2
получше
Чем, например, 4+1
Принцип Паули
Нас в атоме непросто счесть,
Жвиженьем живы мы, движеньем,
Но всеж отличен каждый здесь
Лица необщим выраженьем.
Правило Хунда
Ты приглядись, решив присесть
К местам трамвайного вагона:
Когда ряды пустые есть,
Подсаживаться нет резона.
Строение атома и периодический закон
Он бежит по проводам,
Он бывает тут и там.
Свет зажег, нагрел утюг
… — наш лучший друг.
Если в атом он попал —
То, считай, почти пропал:
Он с утра и до утра
Носится вокруг ядра.
Очень положительный,
С массою внушительной.
А таких, как он, отряд
Создает в ядре заряд.
Лучший друг его — нейтрон.
Догадались? Он — …!
Зарядом я похвастать не могу,
А потому сижу в ядре и ни гу-гу.
А то еще подумают: шпион.
А я нейтральный и зовусь …!
По-античному наивно,
Откровенно простовато
Совершенно «неделимым»
Называли греки атом.
Но теперь твердит наука:
Атом — непростая штука
И устроен он хитро.
В центре — плотное ядро,
А вокруг, как роем мошки,
Пляшут электроны-крошки…
В электронных облаках,
Как кораблик на волнах,
Плыть стремится каждый атом
По своим координатам
В Менделеевской таблице.
Дочитаем всю страницу…
Имена координат
Даст отгадка двух шарад.
I. Три буквы плода треугольного,
Две буквы от стола, от школьного,
«П» между этими фрагментами…
Все вместе — столбик с элементами!
II. Птичий мех, но не пух,
и без букв последних двух,
Плюс раствор для смазки ссадин,
что сажают дети за день;
Вместе — ряд горизонтальный
получаем моментально.
Индикаторы
Лакмус
Индикатор лакмус – красный,
Кислоту укажет ясно.
Индикатор лакмус – синий,
Щелочь здесь – не будь разиней.
Когда ж нейтральная среда,
Он фиолетовый всегда
Лакмус
Реактив-хамелеон:
В щелочах синеет он,
В кислоте опасной
Он окрашен в красный
Фенолфталеин
Попасть в кислоту для других неудача,
Но он перетерпит без вздохов, без плача,
Зато в щелочах у фенолфталеина
Не жизнь, а малина, сплошная малина!
Метиловый оранжевый
От щелочи я желт, как в лихорадке.
Краснею от кислот, как от стыда.
И я бросаюсь в воду без оглядки,
Чтоб не могла заесть меня среда.
Вещества
— Купорос мой медный!
Почему ты бледный?
— Потому я вредный —
Что нагрев мне вредный.
Воду поднеси мне,
Снова стану синим.
Если ты, придя с мороза,
Наливаешь крепкий чай,
Хорошенько сахарозу
в чашке ложкой размешай.
Виноградную глюкозу
И медовую фруктозу
и молочную лактозу
любит взрослый и малыш.
Но крахмалом и клетчаткой,
Что совсем-совсем несладки
Тоже нас не удивишь.
Так устроена природа —
Это тоже углеводы.
Функциональные группы
Запомним, друг, и я, и ты,
Чем отличаются спирты —
В них углерод и гидроксид,
И каждый спирт легко горит.
R — это значит радикал,
Он может быть велик и мал,
Предельный или непредельный.
Но это разговор отдельный.
Приятно пахнут альдегиды,
Но группа C(H)O их выдаст.
Среди карбоновых кислот
Известных «лиц» невпроворот.
В кислотах — группы карбоксильные,
Но все кислоты здесь — несильные.
В кетонах группа есть CO,
Но это тоже ничего…
Горит прекрасно ацетон,
И растворитель — тоже он.
Мы говорим спокойно: жир.
А между прочим, он — эфир,
Он из кислот и глицерина.
Такая вот у нас картина…
Названия химических элементов
Cu
Надо сильно попотеть
Вечером и утром,
Чтоб запомнить: слово «медь»
По-латыни – «купрум».
Fe
Новую эру
Миру дал «феррум».
Очень полезно
Людям железо!
Au
Ах, какая аура
Окружает аурум!
Символ власти – кольца
Золота и Солнца.
Химические формулы
По формуле, как ни смотри,
Они не разнятся никак:
Все тот же кальций-це-о-три
И мел, и известняк.
В соли красной кровяной
Калий с тройкой за стеной,
Дальше феррум, шесть цианов.
Все в порядке – без обмана.
Валентность химических элементов
Натрий, калий, серебро –
Одновалентное добро.
Углерод четырехвалентен всегда
В органических соединениях
Независимо от формулы вещества
И его строения.
Химические реакции
Говорят, если реакция свершается,
То при этом осадок получается,
Или газ выделяется,
Или цвет изменяется,
Или запах появляется,
Или вещество нагревается,
То есть органами чувств реакция определяется.
Сера, сера, сера – S.
Тридцать два атомный вес.
Сера в воздухе горит,
Выделяет ангидрид.
Ангидрид – пахучий газ,
Слезы капают из глаз.
Рождает воду водород,
Ну а теперь наоборот:
Вода рождает водород,
А заодно и кислород.
На аноде анионы окисляются,
На катоде катионы восстанавливаются.
Химическая связь
Ни один ученик никогда не забудет,
Что химическая связь прочнее будет
И энергии больше выделяется,
Коли облака лучше перекрываются.
Химическое строение
Не надо забывать, дружок,
Что атомы в молекуле
Располагаются цепочкой и в кружок.
Об этом, безусловно, знал и Кекуле.
Все атомы между собой взаимосвязаны,
Влияют друг на друга по-разному.
И последовательность их соединения
Называем мы химическим строением.
Правила Марковникова и Зайцева
Найдешь ли справедливость тут,
Где действуют двойные связи:
Где много – так еще дадут,
Где мало – так отнимут сразу!
Электролитическая диссоциация
Истина всегда проста:
Щелочь, соль и кислота
Пропускают ток всегда,
Если их раствор – вода.
Почему же кислород,
Спирт, глюкоза и азот,
Растворенные в воде,
Не пропустят ток нигде?
Потому что вещества –
Неживые существа,
И зависят свойства их,
Сложных и совсем простых,
От строения частиц,
Микромира без границ.
А раствор, где ток бурлит,
Назван был электролит.
Связь химическую тут
В честь ионов назовут,
Как положено, ионной.
Ток не любит жизни сонной.
Любит он, хитрец коварный,
Где силен союз полярный.
Например, хлор–водород.
Связь полярна, ковалентна,
Но приходит свой черед
Для удачного момента,
И разрушена вся связь.
Это водные ионы,
Презирая все законы,
Как бы в шутку и резвясь,
Разорвали все на части,
И пошел, пошел распад
На ионы разной масти,
Разных знаков, говорят.
* * *
Ни к чему овации
Для диссоциации.
Так процесс был назван тот,
Где распад произойдет.
Фосфор
Мечтая раздобыть свой философский камень,
Способный приоткрыть златые ворота,
Алхимик Бранд увидел синий пламень
И фосфором нарек его тогда.
Он «элементом мысли» будет назван,
Плодоношенье трав определит.
И даст начало удобреньям разным:
Природный фосфорит и апатит.
Двуликий фосфор: миф о нем развеян.
Он даст завесы дым — лишь только тронь.
Или в компании с стеклом и клеем
На спичке в коробке смирит огонь.
Есть фосфор белый, черный, красный –
Три аллотропных формы есть.
Вот белый: это яд опасный.
Слегка нагреешь – вспыхнет весь.
Элемент был назван «светоносным»
За то, что в полной темноте
Свет испускает белый фосфор,
В воздушной находясь среде.
Известен людям фосфор красный,
Ведь спички зажигают все.
В составе смеси безопасной
Он есть на каждом коробке.
Запомним: в спичечной головке
Смесь серы с солью Бертолле.
Мы чиркнем спичкой о коробку,
И вмиг окажемся в тепле:
6P + 5KCLO3 = 3P2O5 + 5KCl.
В природе мы в свободном виде,
Конечно, фосфор не найдем.
Можно извлечь из фосфорита (Ca3(PO4)2)
Его химическим путем.
Фосфат и уголь измельчают,
Добавив кварцевый песок.
В печах смесь сильно нагревают,
Используя электроток:
Ca3(PO4)2 + 5С + 3SiO2 = 3CaSiO3 + 2P + 5CO2
Правило прохождения реакции двойного обмена
Если выделится газ — это РАЗ
И получится вода — это ДВА
А еще — нерастворимый осаждается продукт…
«Есть осадок» — говорим мы.
Это третий важный пункт.
Химик правила обмена
Не забудет никогда:
В результате — непременно
Будет газ или вода,
Выпадет осадок —
Вот тогда — порядок!
Элементы четвертой (IV) группы таблицы Менделеева
Пятеро нас. Мы особого сорта.
Мы — элементы группы четвертой.
Наш коллектив удивительно дружен,
Каждый из нас очень важен и нужен.
У элемента номер шесть
Достоинств очень много есть.
«Людям я совсем как брат.
Много тысяч лет назад
Я уже пылал в костре,
Освещая интерьер
Первобытных их пещер.
И украсить был я рад
Дам и рыцарей наряд,
Что блистали при дворе…
Если мягким быть решу, —
То в тетради я пишу.
Такова, друзья, природа
Элемента углерода!
Cосед углерода привык к работе,
Замену ему нигде не найдете.
Если бы этот пропал элемент,
Где бы мы взяли кирпич и цемент,
Чем бы стеклили окно, и куда
Делись бы кварц, и фарфор, и слюда?
Пляжи песчаные, толщи подземные —
Где бы все это было без кремния?
«Дайте выйти в первый ряд!
Я ведь — номер пятьдесят.
Я древний, но выгляжу молодо.
Я — в бронзе, похожей на золото.
Но я не спесив. Всем люблю помогать:
И дырку в кастрюле могу запаять,
Фольгой, даже банкой готов я предстать.
И лишь от мороза теряю я голову.
Ну как, догадались? Зовут меня олово».
Поднял голову едва
Номер восемьдесят два:
«Знает каждый ученик:
Я — металл. Пусть я старик,
Но за все берусь с отвагой,
Не сижу без дела я.
Я рисую. Где бумага?
Я стреляю из ружья.
Труба канализации,
Экран от радиации,
Балласт подводного пловца —
Моим заслугам нет конца;
Таков уж мой природный стиль:
Я ток даю в автомобиль…
Ну, догадайтесь, наконец,
Кто я? Меня зовут свинец».
«А я здесь самый молодой,
И не седою бородой,
А тем, что полупроводник,
Быть примечательным привык.
Открыт я был в Германии,
Зовут меня германием».
Формула ангидрида
Загорелся, всем на диво
Фосфор в колбочке красиво —
Получился, надо знать,
Ангидрид Р2О5!
Как запомнить приставки алканов
Раз, два, три, четыре, пять
Станем атомы считать
Учим новые слова:
Мета — раз, а эта — два.
Три — пропан, бутан — четыре,
Все соседи по квартире.
Вьется атомная лента,
Номер пятый будет пента
Шесть — гексан, а семь -гептан.
Углероды, по местам!
А в октане, как в октаве,
Восемь атомов в составе.
Соответственно Закону
Атом девять значит нона.
Наконец, как истукан,
Возвышается декан!
Химические термины можно учить не только методом зубрёжки, но и с помощью специальных фраз. Надеемся, что эти запоминалки помогут вам в подготовке к ЕГЭ.
- Восстановитель — это тот, кто электроны отдает. Сам отдает грабителю, злодею-окислителю.
- Среди карбоновых кислотИзвестных «лиц» невпроворот.
В кислотах — группы карбоксильные,
Но все кислоты здесь — несильные.
- Загорелся, всем на дивоФосфор в колбочке красиво —
Получился, надо знать,
Ангидрид Р₂О₅!
- Для запоминания названий алканов:Милый -метан
Этичный — этан
ПРактичный — ПРопан
Барашек -бутан
Пасется — пентан
в Горах — ГЕКсан
Гималаях — ГЕПтан
- Углерод четырехвалентен всегда-В органических соединениях,
Независимо от формулы вещества
И его строения.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter. Мы обязательно поправим!
Химические запоминалки 1
Общеизвестный факт, что запоминать проще если новый материал связан со старым. Например, в детстве для запоминания очередности цветов спектра мы учили фразу: «Каждый охотник желает знать, где сидит фазан», по начальным буквам которой определялось: каждый — красный, охотник — оранжевый, желает — желтый, и.т.д. Существует и более современные вариант: “Каждый оформитель желает знать, где скачать Фотошоп”. На Британских островах последовательность спектра кодируют фразой связанной с историей Англии, когда Ричард Плантагенет (герцог Йоркский) потерпел сокрушительное поражение и погиб в войне Алой и Белой Розы. И сама фраза на английском: “Richard Of York Gave Battle In Vain” («Ричард Йоркский дал сражение напрасно»). И соответственно Richard – red, Of – orange, York – yellow, Gave – green, Battle – blue, In – indigo, Vain – violet.
Техника безопасности
Подобно этому существуют некоторые запоминалки и для химии: «ЛИЛА ВОДУ В КИСЛОТУ — ПОТЕРЯЛА КРАСОТУ». Которая гласит нам, что по правилам безопасности при работе с кислотой, кислота всегда добавляется в воду, а не наоборот.
Кстати, по-английски на эту тему есть правило трех «А»: Always (всегда), Add (добавляй), Acid (кислоту). Сначала вода, потом кислота, а не то случится беда.
И ещё по технике безопасности:
Помни, каждый ученик,
Знай, любая кроха:
Безопасность – хорошо,
А халатность – плохо
Чай и вкусный бутерброд
Очень просятся в твой рот.
Не обманывай себя —
Есть и пить у нас нельзя!
Это, друг, химкабинет,
Для еды условий нет.
Пусть в пробирке пахнет воблой,
В колбе — будто мармелад,
Вещества на вкус не пробуй!
Сладко пахнет даже яд.
Как же нюхать вещества?
В колбу нос совать нельзя!
Что может случиться?
Ты можешь отравиться!
Прежде чем начать работать,
Парту надо расчищать,
А не то учебник будет
Под рукой тебе мешать!
Хочешь весел быть и рад –
Надевай всегда халат!
Это должен каждый знать:
Спирт в спиртовке поджигать
Спичкой только можно
И очень осторожно.
Чтобы пламя погасить
Спиртовку следует закрыть.
И для этого, дружок,
У неё есть колпачок.
Рукой не трогай реактивы –
Начнутся страшные нарывы.
А коль коснешься кислоты,
О, скоро пожалеешь ты!
Остатки слив без разрешенья,
Ты не получишь утешенья.
Реакция начаться может,
Тогда никто уж не поможет.
Мы работаем по парам,
Чтобы не обдало жаром,
Ты пробирку отверни
От соседа впереди.
Всю сначала прогревай,
Уголочком наклоняй,
А потом – сильнее там,
Где есть место веществам!
Мы растворчик подогрели,
Вещества у нас вскипели.
Надо пламя укротить
И спиртовочку закрыть!
Если на руку попала
Капля жидкости какой,
Поспеши промыть то место
Ты холодною водой!
Правило прохождения реакции двойного обмена:
Химик правила обмена
Не забудет никогда:
В результате — непременно
Будет газ или вода,
Выпадет осадок —
Вот тогда — порядок!
Про органическую химию
Запомним, друг, и я, и ты,
Чем отличаются спирты —
В них углерод и гидроксид,
И каждый спирт легко горит.
R — это значит радикал,
Он может быть велик и мал,
Предельный или непредельный.
Но это разговор отдельный.
Среди карбоновых кислот
Известных «лиц» невпроворот.
В кислотах — группы карбоксильные,
Но все кислоты здесь — несильные.
В кетонах группа есть CO,
Но это тоже ничего…
Горит прекрасно ацетон,
И растворитель — тоже он.
Если ты, придя с мороза,
Наливаешь крепкий чай,
Хорошенько сахарозу
в чашке ложкой размешай.
Виноградную глюкозу
И медовую фруктозу
и молочную лактозу
любит взрослый и малыш.
Но крахмалом и клетчаткой,
Что совсем-совсем несладки
Тоже нас не удивишь.
Так устроена природа —
Это тоже углеводы.
Мы говорим спокойно: жир. А между прочим, он — эфир, Он из кислот и глицерина. Такая вот у нас картина…
Окраска индикаторов
Индикатор лакмус — красный,
Кислоту укажет ясно.
Индикатор лакмус — синий,
Щелочь здесь! Не будь разиней!
Фенолфталеиновый в щелочах малиновый.
Сульфит и сульфид
Сульфит не путайте с сульфидом,
Чтоб места не было обидам:
Сульфиды — сероводорода
Родня. И нет в них кислорода!
А вот сульфит. Скорей смотри:
В нем кислорода сразу три!
Добавим кислорода атом —
И познакомимся с сульфатом!
А вот ещё про серу:
Тем, кто с Серой незнаком,
Я сейчас представлюсь лично:
Я бываю порошком,
А бываю и пластичной.
Поджигаю веток ворох –
Спичкам я даю огня.
Знай, алхимики и порох
Получили из меня!
Сера, сера буква S.
32 — атомный вес.
Сера в воздухе горит —
Получаем ангидрид.
Ангидрид да плюс вода —
Это будет кислота.
Сразу 4 факта зашифрованы в стишке:
- Сера обозначается буквой S.
- Её атомная ма́сса, относительная атомная масса (устаревшее название — атомный вес) — значение массы атома, выраженное в атомных единицах массы — 32.
- При горении получается сернистый ангидрит.
- Ангидрит при растворении в воде даёт сернистую кислоту (H2SO4).
Кислоты
Для запоминания основных карбоновых кислот: щавелевая, малоновая, янтарная, глутаровая, адипиновая. Используют слово Щмяга. Слово не имеет перевода, но звучит забавно и хорошо запоминается.
Среди карбоновых кислот Известных “лиц” невпроворот. В кислотах — группы карбоксильные, Но все кислоты здесь — несильные.
Кислота тепла боится, быстро в воду превратится.
(Речь идет об угольной и сернистой кислотах)
Лакмус будет в них краснеть,
Растворяться — цинк и медь.
А мелок в них, посмотри,
Вмиг пускает пузыри!
И опасны для работы
Эти жгучие кислоты.
Самой сильной из кислот имя галоген дает.
(Хлорная кислота)
Водород
Не шутите с Водородом!
Он горит, рождая воду,
В смеси с Кислородом-братом
Он взрывается, ребята!
Вам скажу на всякий случай –
Эту смесь зовут гремучей.
Формулы
Загорелся, всем на диво
Фосфор в колбочке красиво —
Получился, надо знать,
Ангидрид Р2О5!
Алюминий, феррум, хром – их валентность равна трем.
Натрий, калий, серебро – одновалентное добро.
Магний, кальций, цинк и барий — их валентность равна паре.
Массу мы легко найдем,
умножив плотность на объём.
Получен газ, осадок иль вода – Процесс необратимый навсегда!
Стихи загадки
Если крупинки в жидкости найдет,
Как такую муть химик назовет?
(Суспензия)
В чем горят дрова и газ,
Фосфор, водород, алмаз?
Дышит чем любой из нас
Каждый миг и каждый час?
Без чего мертва природа?
Правильно, без …
(Кислорода)
В воздухе он главный газ,
Окружает всюду нас.
Угасает жизнь растений
Без него, без удобрений.
В наших клеточках живет
Важный элемент …
(Азот)
Я растворчик изучал.
Лакмус в нем синее стал.
Поглощал раствор тотчас
Кислый углекислый газ!
Про такой раствор я знаю,
Что среда в нем …
(Щелочная)
И напоследок могу сказать, что наша учительница химии в школе поставила спектакль. Он тоже был в стихах, у каждого элемента была роль в соответствии с его активностью. Например, золото было королем и ни с кем не реагировало. А интриги против короля плели придворные азотная и соляной кислоты. Прошло почти 30 лет после спектакля, а я все помню. Спасибо учителю!
Подборка онлайн-ресурсов для «прокачки» химии
Наглядные онлайн-учебники, сайты с инфографикой, youtube и виртуальные лаборатории
Химия — не только один из предметов, по которому школьники сдают ЕГЭ. Это логичная и захватывающая наука о том, как устроен мир вокруг нас. Вместе с преподавателем химии в «Фоксфорде» Еленой Валишиной мы собрали полезные ресурсы, которые помогут изучать этот предмет с интересом и удовольствием.
Онлайн-учебники
Собственная википедия «Фоксфорда». Мы собрали всю школьную программу и немного больше в лаконичную структуру из отдельных статей. В учебнике есть понятные иллюстрации, видео-тьюториалы, возможность сохранять избранные статьи и много другое. И так по всем предметам — не только по химии.
Справочник, который в 2006 году выпустил Томский государственный университет. «Неорганическая химия» — базовый раздел, с которого начинается изучение химии в восьмом классе, поэтому ресурс пригодится для подготовки к ОГЭ, ЕГЭ и олимпиадам.
Больше нужен олимпиадникам и старшеклассникам, которые готовятся к ЕГЭ: органическая химия начинается только в конце девятого класса. Однако в ОГЭ есть один вопрос из органики, поэтому девятиклассникам учебник тоже пригодится.
Сборник авторских лекций, которые подготовил профессор Южного федерального университета Сергей Иванович Левченков. Отличный ресурс для того, чтобы понять логику науки: в какой последовательности происходили самые важные открытия в химии и как они связаны между собой.
Химическая википедия. Этому ресурсу можно доверять, потому что разработчики перевели в электронный вид хорошие справочники по химии. Также они сделали удобный поиск по сайту.
Ещё одно преимущество «Химика» — сервисы, которые помогают школьникам разобраться в сложных темах с помощью наглядных схем. Вот два самых важных из них:
Приложение для проверки своих знаний по строению атома: вводите символ элемента и приложение сразу выдаёт все возможные записи электронной конфигурации его атома.
Сервис помогает разобраться, какие вещества реагируют друг с другом, при каких условиях и что образуется в результате. Например, если ввести в строку поиска уравнение Cl2 + NaOH, можно получить все возможные реакции этих соединений с коэффициентами.
Виртуальные лаборатории
Российский портал, на котором эксперименты из школьной программы можно смоделировать онлайн.
Международный ресурс, которые разрабатывают учёные со всего мира. Позволяет ставить более серьёзные опыты.
Проект по доставке на дом наборов для экспериментов. Также на сайте есть подробные и корректные инструкции по выполнению опытов. Многие ингредиенты для этих опытов можно самостоятельно купить в аптеке или продовольственном магазине. В дополнение к опытам на Mel Science полезно смотреть видео, которые объясняют суть химических явлений.
На портале есть множество полезных статей, подробные разборы опытов, инструкции, как проводить их в домашних условиях и где брать для них реактивы.
7 важных советов, как готовиться к ЕГЭ по химии. Все нужные таблицы, формулы и пособия
До ЕГЭ по химии осталось совсем немного — меньше полугода (вот тут календарь ЕГЭ-2018). Но наверстать упущенное и разобраться наконец в таблице растворимости и формулах — не поздно. И не только в них, если составить чёткий план и выбрать правильные материалы. О подготовке к ЕГЭ по химии — преподаватель химии и автор телеграм-канала «ФарСмацевтика» Анна Тихонова.
В этом году форма экзамена почти не изменилась: вместо 34 заданий их будет 35. Но из-за этого немного изменится система пересчёта первичных баллов в тестовые. Экзамен состоит из двух частей: первая предполагает выбор цифр или последовательности цифр (29 заданий), вторая — ответы с развёрнутым ответом (6 заданий). Максимальное количество первичных баллов, которое можно набрать за первую часть, — 40, за вторую — 20. Обычно мои ученики начинают паниковать уже на этой стадии — когда узнают о заданиях. Но на самом деле всё не так страшно, как кажется.
1. Найдите человека, которому вы сможете задавать вопросы
Необязательно нанимать репетитора. Этим человеком может быть учитель в школе или знакомый студент, который учится на химфаке. Главное — не стесняться задавать даже самые глупые, на ваш взгляд, вопросы и стараться закрывать пробелы, которые возникают во время подготовки. Поверьте, то, что у вас появляются хоть какие-то мысли насчёт химии, уже говорит о том, что процесс запущен. Смело поднимайте руку прямо во время урока, расспрашивайте репетитора, участвуйте в обсуждениях в тематических сообществах и не бойтесь выглядеть глупо в глазах других.
2. На экзамене у вас будет три официальные шпаргалки. И в них нужно разбираться
Это таблица Менделеева, таблица растворимости и ряд напряжения металлов. В них содержится около 70% информации, которая поможет вам успешно сдать экзамен. На остальные 30% от вашего успеха приходится ваше умение пользоваться ими.
Чтобы разобраться с таблицей Менделеева, нужно сначала изучить периодические свойства элементов: строение атомов элементов, электроотрицательность, металлические, неметаллические, окислительные и восстановительные свойства, валентности, степени окисления. Если запомните их — не придётся запоминать свойства каждого отдельного элемента или каждого отдельного вещества в природе. Достаточно взглянуть в таблицу и вспомнить о периодическом законе.
Подсказка для тех, кто вечно всё забывает: F (Фтор) самый сильный неметалл и самый электроотрицательный элемент, а Fr (Франций) — наоборот (самый сильный металл и наименее электроотрицательный элемент). Это поможет с чего-то начать.
3. Повторяйте математику. Химию без неё не сдать
Конечно, никто не просит вас интегрировать или дифференцировать и вообще на экзамене можно пользоваться непрограммируемым калькулятором. Но повторить темы процентов и пропорций — обязательно. Формул, которые необходимы для решения задач, не так уж и много. Запомнить нужно только основные: формула для расчёта массовой доли, массы вещества, объёма, количества вещества, плотности и выхода продукта. Зная их, вы сможете без проблем выводить другие.
Попробуйте вывести из формулы массовой доли массу раствора или, зная массу и молярную массу вещества, определить его количество. Через несколько недель тренировок вы заметите, что все эти формулы связаны между собой и, если вы что-то забыли, всегда можно вывести нужную вам формулу из другой.
4. Таблица химических реакций — ваш помощник
Веществ в химии действительно очень много, их можно систематизировать и выявить закономерности. Вам поможет таблица взаимодействия веществ между собой. Распечатайте её и держите перед глазами, когда только начнёте решать цепочки или реакции.
Как ей пользоваться?
- Научитесь определять класс веществ (оксиды, кислоты, соли, основания, металлы и неметаллы) и разберитесь в типах реакций, чем они друг от друга отличаются.
- В реакцию вступает минимум два вещества. Определяете, к какому классу относится первое вещество. Находите соответствующий пункт в таблице справа (или вверху).
- Проделайте то же самое со вторым веществом, ищите пункт сверху таблицы (или справа).
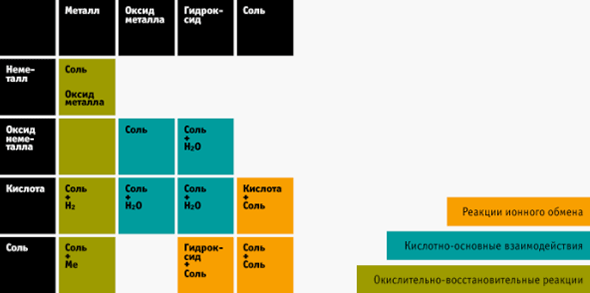
- Смотрите на пересечение этих двух пунктов в таблице — это ответ, который получается в реакции.
На экзамене такой шпаргалкой пользоваться нельзя. Но во время подготовки вы легко запомните, что получается, если, например, реагируют кислота и щелочь, и другие вещества. А это около 80% заданий на ЕГЭ.
5. Берите книжки ФИПИ и идите от простого к сложному
На самом деле не важно, какой учебник вы выберете для подготовки к ЕГЭ. Берите тот, где вам будет понятен материал и в котором есть все темы, которые встретятся на экзамене. Что касается тестов, здесь тоже не нужно изобретать велосипед: я рекомендую пользоваться книжками ФИПИ. Тот материал, который они дают, максимально приближен к тому, что будет на экзамене. И можно решать тексты по изученным темам прямо на их сайте.
Начать стоит с блоков, которые встречаются чаще всего:
- строение атома, периодические свойства элементов
- типы химической связи
- классы неорганических веществ
- гидролиз
- электролиз
- взаимодействие веществ между собой и классификация химических реакций
- задачи на тему «растворы»
- химическое равновесие
- органическая химия (классы соединений, их способы получения и химические свойства)
Остальные блоки сложнее. После того, как прорешаете задания по основным блокам, вы поймёте, в каких темах у вас пробелы, а какие вы знаете хорошо. Закрепите темы, которые вы знаете лучше остальных, и вернитесь к изучению теоретической базы тех тем, которые даются хуже. Учите тему и выполняйте по 20 упражнений в день. Если времени для подготовки мало, сосредоточьтесь на заданиях, темы которых вам ясны. Лучше целиком решить задание с ОВР (окислительно-восстановительными реакциями), чем не сделать ничего.
6. Теория хорошо, но без тестов всё равно никуда
Если кажется, что вы всё знаете из теории и вам не нужно тратить время на решение тестов — это не так. Большинство ошибок на экзамене случается из-за того, что ученик неправильно прочитал задание или не понял, что от него хотят. Чем чаще вы будете решать тесты, тем быстрее поймёте структуру экзамена и сложные и загадочные формулировки задания.
Например, в задании № 30 сказано: «Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена. В ответе запишите молекулярное, полное и сокращённое ионное уравнения только одной из возможных реакций». Очень часто ученики пропускают стадию написания полного ионного уравнения и пишут сразу сокращённое, потому что так быстрее. Это не ошибка, но за это могу снять один первичный балл.
7. А вот читать лишние статьи и литературу точно не нужно
Иногда во время подготовки к экзамену ученик настолько увлекается, что начинает читать узкоспециализированную литературу. И при ответе на простой вопрос путает самого себя: вроде бы гидроксид цинка проявляет амфотерные свойства и реагирует и с кислотами, и с основаниями, а вот в такой-то статье говорилось, что новые исследования говорят абсолютно о другом. И это ставит под сомнения все фундаментальные знания о химии! Я, конечно, утрирую, но смысл в том, что цель экзамена — проверить ваши знания школьной программы. И стратегия «чем проще, тем вернее» работает в тестах как нельзя лучше.
источники:
http://media.foxford.ru/chemistry_online/
http://mel.fm/ucheba/yege/9276814-ege_chemistry_2018
Краевое государственное специальное (коррекционное)
образовательное учреждение для обучающихся, воспитанников
с ограниченными возможностями здоровья
«Барнаульская краевая специальная (коррекционная)
общеобразовательная школа-интернат VI вида»
Мнемонические правила по химии.
Выполнила: Ковшова Екатерина,8 класс,
КГБСКОУ «Барнаульская специальная
школа – интернат VI вида»
Научный руководитель:Колесова Татьяна Юрьевна, учитель химии ,
«Барнаульская специальная
школа – интернат VI вида», Солнечная
поляна, 53
г. Барнаул 2013
Содержание стр.
Введение … … … … … … … … … … … … … … … … … … … … … … … .3
1. Мнемоника- искусство запоминания … ..6
2. Мнемоника в повседневной жизни… … … … … … … … … … … … … 7
3. Основные приёмы запоминания… … … … … … … … … … … … … … 12
Заключение … … … … … … … … … … … … … … … … … … … … … …13
Список используемых источников и литературы … … … … … … … … … .14
Приложение … … … … … … … … … … … … … … … … … … … … … ..15
Введение
Актуальность темы:
Многие дети не любят химию, так как им сложно дается запоминание формул, терминов и правил. Химия действительно достаточно сложная наука для запоминания. Новые термины ,значение которых нам ранее были неизвестны, запомнить очень сложно. Конечно можно «зазубрить» новый термин, но через несколько дней он исчезнет из памяти. Много ранее изученной информации необходимо держать постоянно в памяти, т.к. она необходима для дальнейшего успешного изучения учебного материала. И я задумалась, как можно облегчить изучение такого сложного предмета? Для прочного и одновременно лёгкого запоминания следует наполнить слово содержанием или чем-то, что связано с конкретными ярким и зрительными, звуковыми образами сильными ощущениями. Мнемоника (греч.) — искусство запоминания, мнемотехника — совокупность специальных приёмов и способов, облегчающих связывание объектов с уже имеющейся информацией в памяти различных типов для упрощения запоминания.
Мнемонические правила повышают интерес к предмету у школьников. Однако мнемонические правила не всегда пользуются популярностью у учителей, потому что они справедливо считают, что запоминание материала должно базироваться, прежде всего, на его понимании.
Все мнемонические упражнения основаны на внесении какой-либо ясности в бессмысленный материал. Слова с неизвестным, абстрактным значением запомнить большинству людей сложно. Мнемоника позволяет запоминать информацию с однократного восприятия каждого элемента.
Степень изученности:
Искусство запоминания было особенно важным в дописьменные периоды человеческой истории. Так жрецы, шаманы, сказители должны были запоминать огромные объёмы информации. Даже после появления письменности искусство запоминания не утратило своей актуальности. Очень малое количество книг, дороговизна материалов для письма, большие масса и объём написанной книги — всё это побуждало запоминать текст.
Первые известные тексты по мнемонике создавали древние греки. Искусство запоминания также развивалось средневековыми монахами, которым нужно было помнить огромное количество богослужебных текстов. В эпоху Возрождения, когда знания стали считаться силой, способность держать знания в голове также ценилась очень и очень высоко. Например, книги по мнемонике писал Джордано Бруно. В своих показаниях трибуналу инквизиции он сообщает, что напечатал во Франции книгу о памяти под названием «О тенях идей». Учитывая то, что Бруно приглашал к себе король Генрих III (король Франции), желая выяснить — откуда у него столько знаний, следует предположить, что Бруно хорошо владел искусством запоминания.
Самое основное правило – «лучше один раз увидеть, чем 100 раз услышать», ведь такое запоминание основано на свойстве памяти очень быстро запоминать связь между одновременно воспринимаемыми образами. Поэтому-то в детских книгах так много иллюстраций – ребёнок сам того не осознавая прослеживает связь между прочитанным и увиденным.
Мнемоническое запоминание похоже на образное конспектирование: запоминается самое важное и в виде зрительных образов. Так что мнемоника вполне может заменить традиционные бумажные шпаргалки. Но в отличие от них, мнемонические «шпаргалки» — невидимые, и могут сохраняться в памяти пожизненно.
Мнемоника появилась задолго до возникновения психологии, как самостоятельной науки. Сам термин был введен еще в VI веке до н. э. великим древнегреческим философом, математиком и политическим деятелем Пифагором Самосским.
Первым, кто начал применять мнемотехнику на практике, был древнегреческий поэт Симонид Кеосский. Он был способен часами читать по памяти свои и чужие стихи. С его именем также связан случай На пиру, устроенном фессалийским аристократом по имени Скопас, поэт Симонид Кеосский исполнил лирическую поэму в честь хозяина, включавшую также фрагмент, в котором восхвалялись также Кастор и Поллукс. Скопас, по скаредности своей, объявил поэту, что выплатит ему за панегирик только половину условленной суммы, а недостающее ему надлежит получить у тех божественных близнецов, которым он посвятил половину поэмы. Спустя некоторое время Симонида известили о том, что двое юношей, желающих его видеть, ожидают у дверей дома. Он оставил пирующих, но, выйдя за дверь, никого не обнаружил. Во время его недолгого отсутствия в пиршественном зале обвалилась кровля, и Скопас со всеми своими гостями погиб под обломками; трупы были изуродованы настолько, что родственники, явившиеся, чтобы извлечь их для погребения, не могли опознать своих близких. Симонид же запомнил место каждого за столом и поэтому смог указать ищущим, кто из погибших был их родственником.
Цицерону и Квинтилиану принадлежат первые систематизированные труды по мнемонике, частично дошедшие до наших дней.
«De oratore» Цицерона 1
Удивительную историю о том, как Симонид изобрел искусство памяти, рассказывает Цицерон в сочинении «Об ораторе», когда ведет речь о памяти как об одной из частей риторики. Этот рассказ содержит краткое описание мнемонических мест и образов (loci и images).
Раздел, посвященный памяти, заканчивается напоминанием о необходимости напряженного труда. «Во всякой дисциплине теория мало чем полезна без непрерывного упражнения, особенно же в мнемотехнике теория почти ничего не значит, пока ей не сопутствует прилежание, ревностное служение, напряженный труд и забота. Вы можете быть уверены в том, что располагаете по возможности наибольшим числом мест и что они -полностью соответствуют правилам, но в размещении этих образов вы должны упражняться ежедневно».В современной психологии описан метод, который так и называется- метод Цицерона.
«Institutio oratoria» Квинтилиан2
В своих трудах он описал архитектурный тип. Для того чтобы сформировать в памяти ряд мест, говорит он, нужно вспомнить какое-нибудь здание, по возможности более просторное и состоящее из самых разнообразных помещений – передней, гостиной, спален и кабинетов, – не проходя также мимо статуй и других деталей, которыми они украшены. Образы, которые будут помогать нам вспоминать речь, – в качестве примера таких образов, говорит Квинтилиан, можно привести якорь или меч, – располагаются затем в воображении по местам здания, которые были запечатлены в памяти. Теперь, как только потребуется оживить память о фактах, следует посетить по очереди все эти места и востребовать у их хранителей то, что было в них помещено.
Среди психологов конца XIX — начала XX века наиболее крупный вклад в психологическое осмысление мнемонических методов внесли немецкий психолог Г. Эббингауз , в своей книге « О памяти», основой этой работы стали эксперименты, проведенные им на себе. Пытаясь вывести определенные законы запоминания материала и его последующего воспроизведения, ученый составил 2300 трехбуквенных слов, состоящих из двух согласных и гласной между ними. Эти слова не несли никакого смысла и, кроме того, не вызывали никаких смысловых ассоциаций. Во время опытов он испробовал и просчитал время и объем их заучивания, нашел закономерности забывания. «Кривая забывания», выведенная им на основе этих опытов, является одним из основополагающих элементов психологии памяти. Она показывает, что около половины запоминаемого материала забывается в первые полчаса после заучивания, а в течение первого часа — уже около 60 % полученной информации. Постепенно скорость процесса забывания уменьшается, и через неделю в памяти находится 20 % и отечественный психолог Г. И. Челпанов «О памяти и мнемонике»3, который дал очень точное определение сущности мнемотехники: «Мнемоника или мнемотехника — это искусство запоминания».
К началу XX века в России появляется значительное количество учебников, пособий и руководств как по общей мнемонике, так и по изучению при помощи мнемотехники различных предметов (истории, географии, математики и т. д.).
Цель и задачи: Исходя из вышеизложенного целью данной работы является сбор и систематизация мнемонических правил по химии, издание сборника правил, которые помогут в изучении химии. Для реализации поставленной цели способствовало решение следующих задач:
- изучить историю появления мнемоники;
- выявить где используется мнемоника в повседневной жизни людей;
- описать мнемонические правила по химии;
- описать основные приёмы запоминания.
Мы напомним известные и познакомим с интересными, но редко встречающимися мнемоническими правилами.
Объектом исследования является мнемоника, предметом- мнемонические правила по химии.
Методы исследования: В качестве основных методов в данном исследовании применяются анализ и синтез. Анализу подверглись мнемонические правила по всем школьным предметам, в результате выделены только правила по химии и распределены по темам, которые изучаются в школьном курсе химии. Процедурой, обратной анализу, является синтез. Синтез- это соединение выделенных в ходе анализа сторон предмета в единое целое. Таким образом, все мнемонические правила по химии, собраны в единую печатную брошюру.
Структура работы. Работа построена по проблемному принципу и состоит из введения, трёх параграфов, заключения, списка литературы и источников, приложения.
1Цицерон М.Т. Три трактата об ораторском искусстве/Пер. с лат. Ф.А. Петовкого, И.П. Стрельниковой, М.Л. Гаспарова/Под ред. М.Л. Гаспарова. – М: Научно издательский центр «Ладомир», 1994
2Марк Фабий Квинтилиан. Двенадцать книг риторических наставлений. / Пер. с лат.[неполный] А.Никольского. Санкт-Петербург, типография Императорской Российской Академии, 1834, частьI 3Профессор Г.Челпанов О памяти и мнемонике Второе издание С.-Петербург Типография И.Н.Скороходова (Надеждинская, 43) 1903 год
Мнемоника-искусство запоминания
Мнемотехника (или мнемоника) – от греч. mnemonikon – искусство запоминания, означает совокупность приемов и способов, облегчающих запоминание и увеличивающих объем памяти путем образования искусственных ассоциаций. Само слово «мнем» греческое и означает «память». Греческая мифология знала Мнемозину, мать девяти муз, и почитала ее как богиню памяти, воспоминаний. По легенде, люди, получившие на свой вопрос через оракула ответ от богов, пили воду из источника Мнемозины, чтобы никогда не забыть божественный ответ. Рядом с источником стоял трон Мнемозины, которая, как верили молящиеся, помогала удерживать в памяти виденное и слышанное. Мнемозина, в греческой мифологии богиня памяти, дочь Урана и Геи. Греки полагали, что слияние энергии (Зевс) и Памяти (Мнемозина), даёт начало Творчеству и Знаниям.
Техника мнемоника облегчает запоминание, но лишь в отдельных случаях. Однако в некоторых случаях неверное применение мнемоники может оказать и прямой вред, при подмене осмысленного запоминания механическим заучиванием.
Мнемоническое запоминание состоит из четырёх этапов: кодирование в образы, запоминание, запоминание последовательности, закрепление в памяти.
Мнемотехника применяется для запоминания незапоминаемой информации. Например, когда нужно запомнить последовательность двухсот цифр, список из 50-100 телефонных номеров и т. п. Мнемоника позволяет запоминать информацию с однократного восприятия каждого элемента. Например, 100 случайных слов (чисел) можно запомнить последовательно с интервалом в среднем в 6 секунд.
При заучивании учебных дисциплин (физика, биология, химия и т. п.) мнемотехника обеспечивает очень глубокое понимание материала, поскольку методы запоминания предписывают создавать в воображении яркие образные иллюстрации для понятий и определений.
В современной трактовке мнемоника обозначает всю совокупность приемов и методов запоминания информации, применяемых в той или иной системе, а термин мнемотехника трактуется как практическое применение методов определенных в данной конкретной мнемонике.
Классическая мнемотехника — это первое направление мнемотехники в истории. Говорят, что мнемотехникой пользовались еще в древнем Египте и племена Майя обучали своих детей мнемотехнике — системе внутреннего письма. Однако письменных документов, подтверждающих это у нас нет. Первые сохранившиеся работы по мнемотехнике датируются 86 годом до рождества Христова. Именно эта дата считается в истории мнемотехники датой возникновения классической мнемоники.
Классическая мнемотехника возникла как составная часть ораторского искусства и использовалась в качестве вспомогательного средства для запоминания последовательности изложения длинных речей. Набор приемов классической мнемотехники ограничен. Механизмы памяти интуитивно понимались правильно, однако объяснить принципы работы памяти в то время не было возможности — слишком низок был уровень знаний об окружающем мире.
Ярким примером классической мнемотехники является метод Цицерона — выделение объектов в хорошо знакомом помещении или на улице, и использование их в качестве «вешалок» для запоминаемых сведений. До сих пор остаются актуальными и некоторые другие положения, сформулированные Цицероном. Так, классическая мнемоника рекомендовала запоминать информацию, предварительно преобразовав ее в зрительные образы. Сами же образы делились на две большие группы: вспомогательные образы для фиксации последовательности и образы, в которых кодировалась сама запоминаемая информация. Классическая мнемотехника обратила внимание на тот факт, что образы можно не только запоминать, но их можно и стирать.
Классическая мнемотехника в свое время также разделилась на два направления. Одни (Цицерон) в совершенстве владели техникой запоминания с помощью образных кодов. Другие представители мнемотехники (Квинтилиан) не рекомендовали использовать образные коды для запоминания. Как отмечают историки мнемотехники, люди, которые отказывались от методов классической мнемотехники, как правило, имели какие-то проблемы с визуальным мышлением. Они не могли ярко представлять зрительные образы и манипулировать ими в своем воображении. В связи с физиологическим ограничениями методы классической мнемотехники были недоступны таким людям, и они были вынуждены разрабатывать свои альтернативные системы запоминания, которые меньше зависели от визуального мышления. Уже в работах Квинтилиана мы можем увидеть первые ростки педагогической мнемотехники, мнемотехники для людей не способных к эффективному визуальному мышлению.
Мнемоника в повседневной жизни
Может быть, мнемотехникой увлекались только в далеком прошлом, а в наше время интерес к ней пропал?
В литературе описаны случаи проявления феноменальной памяти. 26-летняя китайская телефонистка из Харбина помнила 15 000 телефонных номеров 10 городов Китая. Доминик о’Брайн из Великобритании запомнил последовательность карт в 40 различных колодах лишь с одной ошибкой. Причем каждая карта была показана ему только одни раз. Рекорд установлен им 26 ноября 1993 года в студии “Би-би-си” в Элстри (Великобритания). 25 марта 1994 года на презентации мировых рекордов Гиннеса Доминик запомнил последовательность карт в одной колоде за 43.59 секунды (продемонстрировав скорость запоминания 0.84 секунды на одну карту).
Двадцатитрехлетний индиец С.Махедеван, студент-психолог из города Мангалур, установил мировой рекорд памяти в запоминании цифровой информации. За три часа и тридцать девять минут он запомнил и повторил наизусть 31811 цифр, т.е. он тратил всего 0,41 секунды на запоминание одной цифры! Прежний рекорд составлял 28013 цифр за 9 часов 14 минут, т.е. примерно 1,2 секунды на цифру.
В этих рекордах поражает высокая скорость запоминания, т.е. среднее время, затраченное на запоминание одной единицы информации.
С 1991 года проводятся чемпионаты мира по запоминанию. В настоящее время соревнования проводятся в 30 странах мира по следующим дисциплинам: абстрактные изображения, слова, имена и лица, карты на скорость, последовательность карт за час, цифры на скорость, числа за час, двоичные числа на скорость, исторические даты, числа на слух.
Как видите, интерес к мнемотехнике в настоящее время не угас. Более того, виды мнемонической техники запоминания постоянно совершенствуются на основе новых представлений о механизмах памяти человека. Сейчас феноменальная память из разряда чудес переходит в разряд обыкновенных, доступных каждому навыков запоминания, которые можно сформировать, как и любые другие навыки.
А вот самые известные «запоминалки», которыми мы очень часто пользуемся на уроках и в жизни:
Русский язык:
Исключения второго спряжения :
Гнать, держать, дышать, зависеть, видеть, слышать и обидеть, а ещё вертеть, смотреть, ненавидеть и терпеть.
Падежи: (именительный, родительный, дательный, винительный, творительный, предложный)
«Иван (Ирина) Родил Девчонку, Велел Тащить Пелёнку».
Математика:
Биссектриса — это крыса (бегает по углам и делит их пополам/шныряет по углам, разгрызает пополам)
Число Пи — длины слов кодируют первые цифры числа:— Что я знаю о кругах? (≈3,1416)
Физика:
Закон Архимеда:
Тело, всунутое в воду,
выпирает на свободу
с силой выпертой воды
телом, всунутым туды.
Цвета радуги: Красный, Оранжевый, Жёлтый, Зелёный, Голубой, Синий, Фиолетовый
Каждый охотник желает знать, где сидит фазан.
Биология :
Для запоминания специфики работы фоторецепторов сетчатки глаза: днём работают с колбочками, ночью ходят с палочками !
Календарь:
Количество дней в месяцах года: по костяшкам пальцев. Надо сжать руки в кулаки и сложить два кулака вместе, боком друг к другу, как будто двумя руками держишь карандаш. Счёт месяцев идёт по выступающим костяшкам пальцев и по впадинкам между костяшками. Если месяц приходится на костяшку, значит он длинный, в нём 31 день; если на впадинку — значит короткий, в нём 30 дней, или 28/29, если это февраль. Январь — костяшка мизинца, февраль — впадинка между мизинцем и безымянным пальцем, март — костяшка безымянного, и т. д. Месяца июль и август приходятся на костяшки указательных пальцев, между ними ложбинки не
Химия:
Правила по технике безопасности:
Не надо плевать в кислоту, а то она ответит!
Химик, запомни как оду — льют кислоту в воду!
Лила воду в кислоту — потеряла красоту!
Коль не хочешь стать уродом — кислоту вливаем в воду!
Лей кислоту поверх воды, а то недолго до беды!
Сначала вода, потом кислота, иначе случится большая
беда!
Чай с лимоном (здесь нужно представить, как в чай Вы кладете дольку лимона).
Процессы окисления-восстановления, свойства окислителей и восстановителей:
Отдать — Окислиться, Взять — Восстановиться
(слова начинаются с одинаковых букв; при отдавании кем-либо чего-либо полезного — кислое, опущенное выражение лица, при получении — воспрявшее, восстановленное).
Окислитель — грабитель (в процессе окислительно-восстановительной реакции окислитель присоединяет электроны).
Восстановитель — это тот, кто электроны отдает. Сам отдает грабителю, злодею-окислителю.
Химические формулы:
Сапоги мои того…
Пропускают H2O!
А как лучше запомнить названия кислот серной и сернистой: H2SO3, H2SO4?
H2SO3 – короткая(3), а название длинное «сернистая».
H2SO4 – длинная(4), а название короткое «серная».
Убежал козленок в лес — выпускал там Н2S!
По формуле, как ни смотри,
Они не разнятся никак:
Все тот же кальций-це-о-три
И мел, и известняк.
В соли красной кровяной
Калий с тройкой за стеной,
Дальше феррум, шесть цианов.
Все в порядке – без обмана.
Загорелся, всем на диво
Фосфор в колбочке красиво —
Получился, надо знать,
Ангидрид Р2О5!
Валентность химических элементов:
Калий, натрий, серебро с водородом заодно. (валентность 1).
Натрий, калий, серебро – одновалентное добро.
Одновалентные элементы: хлор, бром, фтор, йод, калий, натрий, водород.
Кальций, магний, медь и цинк — двухвалентны, как не кинь.
Алюминий, да и висмут на трех ниточках повиснут (т.е. трехвалентные).
Химические реакции:
Говорят, если реакция свершается,
То при этом осадок получается,
Или газ выделяется,
Или цвет изменяется,
Или запах появляется,
Или вещество нагревается,
То есть органами чувств реакция определяется.
Сера, сера, сера – S.
Тридцать два атомный вес.
Сера в воздухе горит,
Выделяет ангидрид.
Ангидрид – пахучий газ,
Слезы капают из глаз.
Рождает воду водород,
Ну а теперь наоборот:
Вода рождает водород,
А заодно и кислород.
– Купорос мой медный,
Почему ты бледный?
– Потому я бледный,
Что нагрев мне вредный.
Воду поднеси мне –
Снова стану синим.
Не помирятся с рожденья
основанье с кислотой.
в результате их сраженья
получилась соль с водой.
Индикаторы:
Лакмусовой бумажкой можно определить кислота в сосуде или щелочь. Бумажка окрасится в красный (розовый) или фиолетовый. Только вот что окрашивает в какой? Для этого можно провести аналогию –Красный и Кислота начинаются с буквы К. Ну, а фиолетовый по принципу исключения определим как щелочь.
Индикатор лакмус – красный,
Кислоту укажет ясно.
Индикатор лакмус – синий,
Щелочь здесь – не будь разиней.
Когда ж нейтральная среда,
Он фиолетовый всегда.
Попасть в кислоту — вот неудача,
Но он перетерпит без вздоха и плача,
Зато в щелочах у фенолфталеина
Начнется не жизнь, а сплошная малина!
Органическая химия:
Раз, два, три, четыре, пять- станем атомы считать
Учим новые слова: мета — раз, а эта — два.
Три — пропан, бутан — четыре, все соседи по квартире.
Вьется атомная лента, номер пятый будет пента,
Шесть — гексан, а семь -гептан. Углероды, по местам!
А в октане, как в октаве, восемь атомов в составе.
Соответственно Закону, атом девять значит нона.
Наконец, как истукан, возвышается декан!
Запомним, друг, и я ,и ты,
Чем отличаются спирты —
В них углерод и гидроксид,
И каждый спирт легко горит.
Мы говорим спокойно: жир.
А между прочим, он — эфир,
Он из кислот и глицерина.
Такая вот у нас картина…
Для запоминания названий алканов:
Милый -метан
Этичный — этан
ПРактичный — ПРопан
Барашек -бутан
Пасется — пентан
в Горах — ГЕКсан
Гималаях — ГЕПтан (оба на «г» в алфавитном порядке).
Углерод четырехвалентен всегда-
В органических соединениях,
Независимо от формулы вещества
И его строения.
Молярность- Нормальность:
Зачастую у школьников вызывают путаницу понятия молярная и нормальная концентрация растворённого вещества в растворе. При этом очевидно, что они кратны друг другу и отличаются в число эквивалентов. Так, например для соляной кислоты они совпадают, так как она содержит один эквивалент протонов. Серная же кислота содержит два протона, а ортофосфорная — три, следовательно для них молярность и нормальность отличаются в три раза. Для окислительно-восстановительных реакции отличаются в число передающихся электронов. Таким образом, важно запомнить, какая из двух концентраций больше. Для этого можно просто сравнить положения букв М(Молярность) и Н(Нормальность) в русском алфавите — Н позже М, и нормальность всегда больше или равна молярности.
Основные приёмы запоминания:
1)Образование смысловых фраз из начальных букв запоминаемой информации.
Примером может служить правило для запоминания процессов окисления и восстановления: Отдать — Окислиться, Взять — Восстановиться
(слова начинаются с одинаковых букв; при отдавании кем-либо чего-либо полезного — кислое, опущенное выражение лица, при получении — воспрявшее, восстановленное).
2)Рифмизация. Рифмизация – перевод информации в стихи, песенки, в строки, связанные определенным ритмом или рифмой. Зарифмованный учебный материал лучше запоминается.
Правила для запоминания химических формул, например: сапоги мои того- пропускают Н2О !
3)Запоминание длинных терминов или иностранных слов с помощью созвучных.
Для запоминания названий алканов используется правило:
Милый -метан
Этичный — этан
ПРактичный — ПРопан
Барашек -бутан
Пасется — пентан
в Горах — ГЕКсан
Гималаях — ГЕПтан (оба на «г» в алфавитном порядке).
4)Нахождение ярких необычных ассоциаций (картинки, фразы), которые соединяются с запоминаемой информацией. Например, чтобы запомнить как правильно разбавить кислоту водой, что льют кислоту в воду или наоборот , нужно представить как Вы в чай ( в воду) кладёте дольку лимона (кислоту).
5)Метод Цицерона на пространственное воображение . Большинство обладателей сверхпамяти признались, что целенаправленно развивали свои способности, используя метод, известный еще в Древней Греции и Риме. Его обычно называют « методом Цицерона», «методом Римской комнаты», или методом мест. Суть его состоит в том, что «единицы информации», которые необходимо запомнить, мысленно расставляются в хорошо знакомой комнате в строго определенном порядке. Затем достаточно вспомнить эту комнату, чтобы воспроизвести необходимую информацию. Например, можно выполнить упражнение «Соленый класс». Мысленно расположите предложенные соли в классе в определенном порядке. Затем достаточно вспомнить класс, чтобы воспроизвести данную информацию.
6)Метод Айвазовского основан на тренировке зрительной памяти. Мы всегда на уроках химии пользуемся Периодической системой химических элементов и непроизвольно запоминаем написание химических символов.
Заключение
В результате этой работы можно сделать следующие выводы:
1)Мнемоника является не только наукой, которая зародилась в Древней Греции и продолжает развиваться в современном мире, но и искусством укреплять память.
2)При помощи использования мнемотехники, изучать некоторые сложные темы по большинству учебных предметов, в том числе и по химии, станет гораздо легче.
3)Изучив основные приёмы запоминания, можно развивать и тренировать память, при помощи упражнений; создавать ассоциации, находить яркие, необычные образы, картинки, которые «методом связки» нужно соединить с информацией, которую надо запомнить; можно переводить информацию в стихи, в строки, связанные определенным ритмом или рифмой. Тренировки по мнемотехнике также имеют и побочные положительные эффекты: улучшаются воображение, внимание.
4)Выпущена печатная брошюра «Мнемонические правила по химии», один экземпляр подарен школьной библиотеке, для пользования обучающимися.
Список используемых источников и литературы
Литература
1.Бархаев Б.П. Педагогическая психология. Москва: Высшая школа.-2007.
2. Гоноболин Ф.Н. Психология. — М.: Просвещение, 1973 [Электронный ресурс]. — Режим доступа: #»#»>#»#»>http://www.toptrening.ru/articles/1052/ — Дата доступа: 30.02.2013
3.Йейтс Ф. А. Искусство памяти. — СПб., 1997.
4.Кузьмин В.С. Психология. Москва: Высшая школа.-1982.
5.Хрестоматия по общей психологии. Психология памяти / Под ред. Ю. Б.
Гиппенрейтер, В. Я. Романова. М.: Изд-во МГУ, 1980
6.Цицерон М.Т. Три трактата об ораторском искусстве/Пер. с лат. Ф.А. Петовкого, И.П. Стрельниковой, М.Л. Гаспарова/Под ред. М.Л. Гаспарова. – М: Научно издательский центр «Ладомир», 1994
Интернет-ресурсы
http://him.1september.ru/article.php?ID=200800708
http://paramitacenter.ru/node/667
http://pomnupi.ru/index/0-7
http://ru.wikipedia.org/wiki/%D0%9C%D0%BD%D0%B5%D0%BC%D0%BE%D0%BD%D0%B8%D0%BA%D0%B0
http://dxdy.ru/topic7454-45.html
http://pedsovet.org/forum/index.php?autocom=blog&blogid=453&&req=printentry&eid=3181
Приложения
Мнемоника – искусство запоминания – помогает нам выучить громоздкие формулы или правила, переводя их на язык смешных ассоциаций, созвучных фраз или стихов. Предлагаем вашему вниманию различные мнемонические правила по химии, помогающие легко запомнить химические формулы, названия элементов, химические реакции и принципы. Запомните: ВЕЩЕСТВА (то, из чего ВЕЩИ состоят) !
Авторы:
Ковшова Екатерина, ученица КГБ СКОУ
« Барнаульская школа-интернат VI вида»
Колесова Т.Ю., учитель химии КГБ СКОУ
« Барнаульская школа-интернат VI вида»
П
рекраснее нет в школе
редмета,
Узнать, что из атомов наша планета…
Правила по технике безопасности:
Не надо плевать в кислоту, а то она ответит!
Химик, запомни как оду — льют кислоту в воду!
Лила воду в кислоту — потеряла красоту!
Коль не хочешь стать уродом — кислоту вливаем в воду!
Лей кислоту поверх воды, а то недолго до беды!
Сначала вода, потом кислота, иначе случится большая
беда!
Чай с лимоном (здесь нужно представить, как в чай Вы кладете дольку лимона).
Процессы окисления-восстановления, свойства окислителей и восстановителей:
- Отдать — Окислиться, Взять — Восстановиться
(слова начинаются с одинаковых букв; при отдавании кем-либо чего-либо полезного — кислое, опущенное выражение лица, при получении — воспрявшее, восстановленное).
- Окислитель — грабитель (в процессе окислительно-восстановительной реакции окислитель присоединяет электроны).
- Восстановитель — это тот, кто электроны отдает. Сам отдает грабителю, злодею-окислителю.
Названия химических элементов:
Надо сильно попотеть
Вечером и утром,
Чтоб запомнить: слово «медь»
По-латыни – «купрум».
Самый первый — водород.
Это знает весь народ.
Хлор хвалился: «Нет мне равных!
Галоген я самый главный.
Зря болтать я не люблю:
Всё на свете отбелю!»
Химические формулы:
Сапоги мои того…
Пропускают H2O!
H2O
А как лучше запомнить названия кислот серной и сернистой: H2SO3, H2SO4?
H2SO3 – короткая(3), а название длинное «сернистая».
H2SO4 – длинная(4), а название короткое «серная».
Убежал козленок в лес — выпускал там Н2S!
По формуле, как ни смотри,
Они не разнятся никак:
Все тот же кальций-це-о-три
И мел, и известняк.
В соли красной кровяной
Калий с тройкой за стеной,
Дальше феррум, шесть цианов.
Все в порядке – без обмана.
Загорелся, всем на диво
Фосфор в колбочке красиво —
Получился, надо знать,
Ангидрид Р2О5!
Валентность химических элементов:
Калий, натрий, серебро с водородом заодно. (валентность 1).
Натрий, калий, серебро – одновалентное добро.
Одновалентные элементы: хлор, бром, фтор, йод, калий, натрий, водород.
Кальций, магний, медь и цинк — двухвалентны, как не кинь.
Алюминий, да и висмут на трех ниточках повиснут (т.е. трехвалентные).
Химические реакции:
Говорят, если реакция свершается,
То при этом осадок получается,
Или газ выделяется,
Или цвет изменяется,
Или запах появляется,
Или вещество нагревается,
То есть органами чувств реакция определяется.
Сера, сера, сера – S.
Тридцать два атомный вес.
Сера в воздухе горит,
Выделяет ангидрид.
Ангидрид – пахучий газ,
Слезы капают из глаз.
Рождает воду водород,
Ну а теперь наоборот:
Вода рождает водород,
А заодно и кислород.
– Купорос мой медный,
Почему ты бледный?
– Потому я бледный,
Что нагрев мне вредный.
Воду поднеси мне –
Снова стану синим.
Не помирятся с рожденья
основанье с кислотой.
в результате их сраженья
получилась соль с водой.
Индикаторы:
Лакмусовой бумажкой можно определить кислота в сосуде или щелочь. Бумажка окрасится в красный (розовый) или фиолетовый. Только вот что окрашивает в какой? Для этого можно провести аналогию –Красный и Кислота начинаются с буквы К. Ну, а фиолетовый по принципу исключения определим как щелочь.
Индикатор лакмус – красный,
Кислоту укажет ясно.
Индикатор лакмус – синий,
Щелочь здесь – не будь разиней.
Когда ж нейтральная среда,
Он фиолетовый всегда.
Попасть в кислоту — вот неудача,
Но он перетерпит без вздоха и плача,
Зато в щелочах у фенолфталеина
Начнется не жизнь, а сплошная малина!
Органическая химия:
Раз, два, три, четыре, пять- станем атомы считать
Учим новые слова: мета — раз, а эта — два.
Три — пропан, бутан — четыре, все соседи по квартире.
Вьется атомная лента, номер пятый будет пента,
Шесть — гексан, а семь -гептан. Углероды, по местам!
А в октане, как в октаве, восемь атомов в составе.
Соответственно Закону, атом девять значит нона.
Наконец, как истукан, возвышается декан!
Запомним, друг, и я ,и ты,
Чем отличаются спирты —
В них углерод и гидроксид,
И каждый спирт легко горит.
Мы говорим спокойно: жир.
А между прочим, он — эфир,
Он из кислот и глицерина.
Такая вот у нас картина…
Для запоминания названий алканов:
Милый -метан
Этичный — этан
ПРактичный — ПРопан
Барашек -бутан
Пасется — пентан
в Горах — ГЕКсан
Гималаях — ГЕПтан (оба на «г» в алфавитном порядке).
Углерод четырехвалентен всегда-
В органических соединениях,
Независимо от формулы вещества
И его строения.
Молярность- Нормальность:
Зачастую у школьников вызывают путаницу понятия молярная и нормальная концентрация растворённого вещества в растворе. При этом очевидно, что они кратны друг другу и отличаются в число эквивалентов. Так,например для соляной кислоты они совпадают, так как она содержит один эквивалент протонов. Серная же кислота содержит два протона, а ортофосфорная — три, следовательно для них молярность и нормальность отличаются в три раза. Для окислительно-восстановительных реакции отличаются в число передающихся электронов. Таким образом, важно запомнить, какая из двух концентраций больше. Для этого можно просто сравнить положения букв М(Молярность) и Н(Нормальность) в русском алфавите — Н позже М, и нормальность всегда больше или равна молярности.

- Серебра нитрат –
Прозрачен, говорят,
Натрия хлорид –
Бесцветен на вид,
Но из них легко получу «молоко».
(нерастворимый осадок хлорид серебра)
2. Жил да был один шпион
Звался он сульфат ион.
Незаметный и невзрачный
И на вид совсем прозрачный.
Но нашёлся спецагент
Уникальный реагент.
Постарался славно он –
В осадок выпал вдруг шпион. (хлорид бария)
3. Удивительный металл –
Кем же только он не стал,
Вместе с группою (-ОН)
Побелили весь этаж.
А из него и карбонат иона
Скульптор сделал Аполлона. (кальций)
4. Кислород себя хвалил,
Своей силой всех дивил.
Я любого, говорит,
Захвачу себе в оксид.
Похвалялся, похвалялся,
Сам на удочку попался
К элементу силачу.
Имя знать его хочу. (фтор)
5. С водорода всегда начинаюсь,
С основанием в соль превращаюсь,
Крашу лакмус в красный цвет,
А металла во мне нет. (кислота)
6. Из меня не сваришь супа,
Содержу гидроксогруппу,
И активного металла
В моей формуле немало.
Крашу лакмус в синий цвет,
Я опасна, спору нет. (щелочь)
7. С кислотой и щелочами
Прореагирую в момент я,
Я оксид необычайный,
Переходных элементов
Узнали вы меня наверно,
Так какой я? …(амфотерный)
8. Соль водою растворили,
Постоянный ток включили,
Только соли уж не стало,
Получили газ с металлом.
Что за ситуация?
Процесс…(диссоциация),
9. Брат один сердитый,
Другой брат ядовитый.
Первый брат в воде горел,
Брат другой позеленел.
Первый брат – металл у нас,
Брат другой – конечно газ.
Если их объединить,
Можно чудо совершить.
Попадутся братцы эти,
Вам в супу или в котлете! (натрий, хлор)
10. С водорода начинается – кислотою называется.
Если есть ОН в названии –
Это точно основание.
Если только буква О –
То оксид скорей всего.
металл с остатком, между нами называется солями.
11. Получен газ, осадок иль вода –
Процесс необратимый навсегда!
12. Как-то раз металл в кислоту попал.
Закипело, зашипело и со свистом улетело!
Удивляется народ:
— Что такое? (Водород!)
13. Кислоте и щёлочи каждый день,
Спорить кто из них сильней никогда не лень.
Как-то раз, на горе людям,
Встретились в одной посуде.
Обе в гневе закипели.
Даже брызги полетели.
И исчезли без следа!
Соль осталась и вода.
Такая ситуация –( нейтрализация.)
14. Если в соль добавить щёлочь,
На пробирку посмотреть –
Синий выпадет осадок –
Значит соль содержит ( медь.)

Индикаторы
Индикатор
лакмус – красный,
Кислоту укажет ясно.
Индикатор лакмус – синий,
Щелочь здесь – не будь разиней.
Когда ж нейтральная среда,
Он фиолетовый всегда.
Реактив-хамелеон:
В щелочах синеет он,
В кислоте опасной
Он окрашен в красный!
Попасть в
кислоту для других неудача,
Но он перетерпит без вздохов, без плача,
Зато в щелочах у фенолфталеина
Не жизнь, а малина, сплошная малина!
От щелочи я желт, как в лихорадке.
Краснею от кислот, как от стыда.
И я бросаюсь в воду без оглядки,
Чтоб не могла заесть меня среда.
Правило
Марковникова — Зайцева
Найдешь ли справедливость тут
Где действуют двойные связи:
Где много — там еще дадут,
Где мало — там отнимут сразу!
Признаки
химических реакций
Говорят, если реакция свершается,
То при этом осадок получается,
Или газ выделяется,
Или цвет изменяется,
Или запах появляется,
Или вещество нагревается,
То есть органами чувств реакция определяется.
Правило
Хунда
Ты приглядись, решив присесть,
К местам трамвайного вагона:
Когда ряды пустые есть,
Подсаживаться нет резона.
Правило Клечковского
Нас арифметикой банальною не мучай
Над нами лишь Клечковский господин,
А он сказал, что 3+2 получше
Чем, например, 4+1
Принцип Паули
Нас в атоме непросто счесть,
Движеньем живы мы, движеньем,
Но все ж отличен каждый здесь
Лица не общим выражением.
Протон
Очень положительный,
С массою внушительной.
А таких, как он, отряд
Создает в ядре заряд.
Лучший друг его — нейтрон.
Ну конечно он — протон.
Нейтрон
Зарядом я похвастать не могу,
А потому сижу в ядре и ни гу-гу.
А то еще подумают: шпион.
А я нейтральный и зовусь нейтрон.
Число Пи : Это я знаю и помню прекрасно Пи многие знаки мне лишни, напрасны.
3,14158265358 (Каждая цифра соответствует количеству букв в слове.)
Квадратный
корень из двух запомнить можно следующим образом: 1,4142135624 = Я Таня, я дура, но я вот нашла корень из двух. (Каждая цифра соответствует количеству букв в слове.)
Можно
Вылететь За Марс, Ювелирно Свернув У Нашей Планеты — запоминаем планеты солнечной системы, начиная от солнца.(первая буква в слове, она же первая буква в названии планеты)