Железо Fe: химические свойства, способы получения железа, взаимодействие с простыми веществами (кислород, сера) и со сложными веществами (кислоты, вода, сильные окислители). Оксид железа (II) FeO, оксид железа (III) Fe2O3, железная окалина (Fe3O4) — способы получения и химические свойства. Гидроксид железа (II) Fe(OH)2, гидроксид железа (III) Fe(OH)3 — способы получения и химические свойства.
Положение железа в периодической системе химических элементов
Электронное строение железа
Физические свойства
Нахождение в природе
Способы получения
Качественные реакции
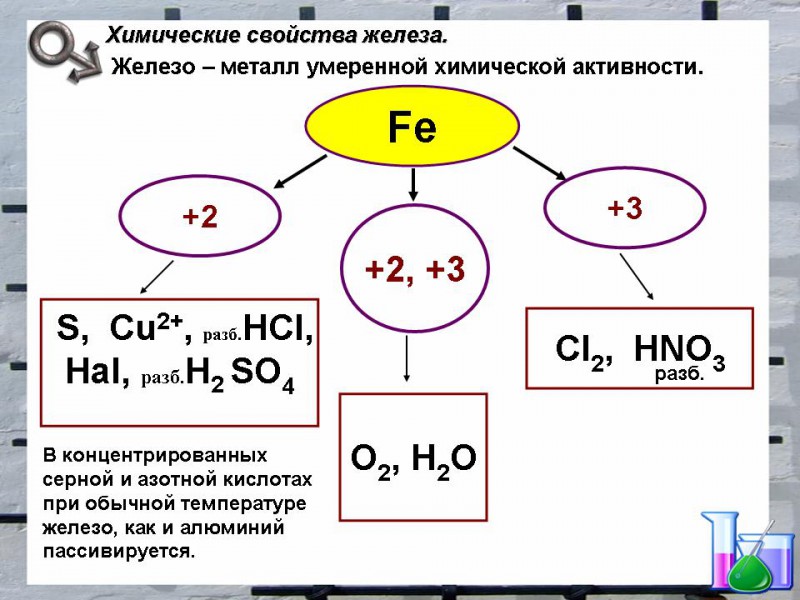
Химические свойства
1. Взаимодействие с простыми веществами
1.1. Взаимодействие с галогенами
1.2. Взаимодействие с серой
1.3. Взаимодействие с фосфором
1.4. Взаимодействие с азотом
1.5. Взаимодействие с углеродом
1.6. Горение
2. Взаимодействие со сложными веществами
2.1. Взаимодействие с водой
2.2. Взаимодействие с минеральными кислотами
2.3. Взаимодействие с серной кислотой
2.4. Взаимодействие с азотной кислотой
2.5. Взаимодействие с сильными окислителями
2.6. Взаимодействие с оксидами и солями
Оксид железа (II)
Способы получения
Химические свойства
1. Взаимодействие с кислотными оксидами
2. Взаимодействие с кислотами
3. Взаимодействие с водой
4. Взаимодействие с окислителями
5. Взаимодействие с кислотами
6. Взаимодействие с восстановителями
Оксид железа (III)
Способы получения
Химические свойства
1. Взаимодействие с кислотными оксидами и кислотами
2. Взаимодействие с щелочами и основными оксидами
3. Взаимодействие с водой
4. Взаимодействие с окислителями
5. Окислительные свойства оксида железа (III)
6. Взаимодействие с солями более летучих кислот
Оксид железа (II, III)
Способы получения
Химические свойства
1. Взаимодействие с кислотными оксидами и кислотами
2. Взаимодействие с сильными кислотами-окислителями
3. Взаимодействие с водой
4. Взаимодействие с окислителями
5. Окислительные свойства оксида железа (II, III)
Гидроксид железа (II)
Способы получения
Химические свойства
1. Взаимодействие с кислотами
2. Взаимодействие с кислотными оксидами
3. Восстановительные свойства
4. Разложение при нагревании
Гидроксид железа (III)
Способы получения
Химические свойства
1. Взаимодействие с кислотами
2. Взаимодействие с кислотными оксидами
3. Взаимодействие с щелочами
4. Разложение при нагревании
Соли железа
Железо
Положение в периодической системе химических элементов
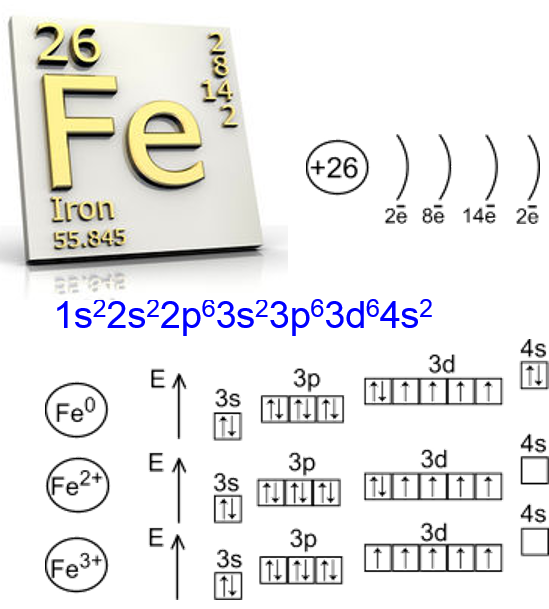
Элемент железо расположен в побочной подгруппе VIII группы (или в 8 группе в современной форме ПСХЭ) и в четвертом периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение атома железа
Электронная конфигурация железа в основном состоянии:
+26Fe 1s22s22p63s23p64s23d6
Железо проявляет ярко выраженные магнитные свойства.
Физические свойства
Железо – металл серебристо-белого цвета, с высокой химической активностью и высокой ковкостью. Обладает высокой тепло- и электропроводностью.

Температура плавления 1538оС, температура кипения 2861оС.
Нахождение в природе
Железо довольно распространено в земной коре (порядка 4% массы земной коры). По распространенности на Земле железо занимает 4-ое место среди всех элементов и 2-ое место среди металлов. Содержание в земной коре — около 8%.
В природе железо в основном встречается в виде соединений:
Красный железняк Fe2O3 (гематит).

Магнитный железняк Fe3O4 или FeO·Fe2O3 (магнетит).
(изображение с портала emchi-med.ru)
В природе также широко распространены сульфиды железа, например, пирит FeS2.

Встречаются и другие минералы, содержащие железо.
Способы получения
Железо в промышленности получают из железной руды, гематита Fe2O3 или магнетита (Fe3O4или FeO·Fe2O3).
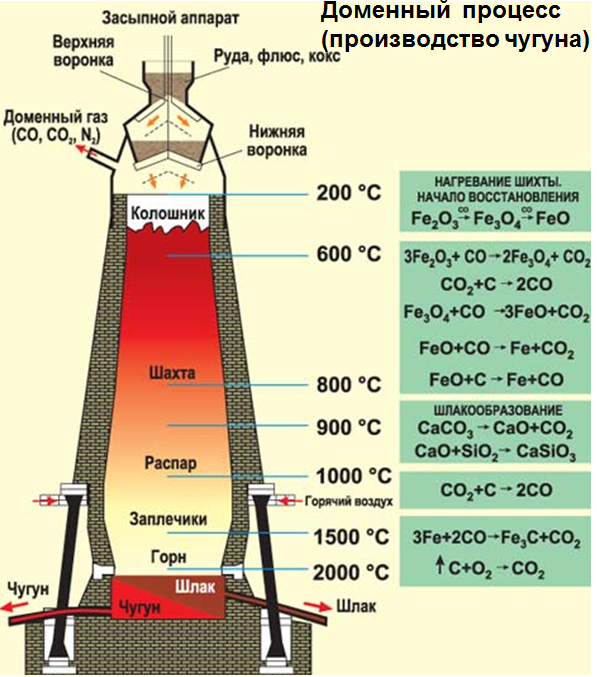
1. Один из основных способов производства железа – доменный процесс. Доменный процесс основан на восстановлении железа из оксида углеродом в доменной печи.
В печь загружают руду, кокс и флюсы.
Шихта – смесь исходных материалов, а в некоторых случаях и топлива в определённой пропорции, которую обрабатывают в печи.
Каменноугольный кокс – это твёрдый пористый продукт серого цвета, получаемый путем коксования каменного угля при температурах 950—1100 °С без доступа воздуха. Содержит 96—98 % углерода.
Флюсы – это неорганические вещества, которые добавляют к руде при выплавке металлов, чтобы снизить температуру плавления и легче отделить металл от пустой породы.
Шлак – расплав (а после затвердевания – стекловидная масса), покрывающий поверхность жидкого металла. Шлак состоит из всплывших продуктов пустой породы с флюсами и предохраняет металл от вредного воздействия газовой среды печи, удаляет примеси.
В печи кокс окисляется до оксида углерода (II):
2C + O2 → 2CO
Затем нагретый угарный газ восстанавливает оксид железа (III):
3CO + Fe2O3 → 3CO2 + 2Fe
Процесс получения железа – многоэтапный и зависит от температуры.
Наверху, где температура обычно находится в диапазоне между 200 °C и 700 °C, протекает следующая реакция:
3Fe2O3 + CO → 2Fe3O4 + CO2
Ниже в печи, при температурах приблизительно 850 °C, протекает восстановление смешанного оксида железа (II, III) до оксида железа (II):
Fe3O4 + CO → 3FeO + CO2
Встречные потоки газов разогревают шихту, и происходит разложение известняка:
CaCO3 → CaO + CO2
Оксид железа (II) опускается в область с более высоких температур (до 1200oC), где протекает следующая реакция:
FeO + CO → Fe + CO2
Углекислый газ поднимается вверх и реагирует с коксом, образуя угарный газ:
CO2 + C → 2CO

2. Также железо получают прямым восстановлением из оксида водородом:
Fe2O3 + 3H2 → 2Fe + 3H2O
При этом получается более чистое железо, т.к. получаемое железо не загрязнено серой и фосфором, которые являются примесями в каменном угле.
3. Еще один способ получения железа в промышленности – электролиз растворов солей железа.
Качественные реакции
Качественные реакции на ионы железа +2.
– взаимодействие солей железа (II) с щелочами. При этом образуется серо-зеленый студенистый осадок гидроксида железа (II).
Например, хлорид железа (II) реагирует с гидроксидом натрия:
2NaOH + FeCl2 → Fe(OH)2 + 2NaCl
Видеоопыт взаимодействия раствора сульфата железа (II) с раствором гидроксида натрия (качественная реакция на ионы железа (II)) можно посмотреть здесь.
Гидроксид железа (II) на воздухе буреет, так как окисляется до гидроксида железа (III):
4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3
– ионы железа +2 окрашивают раствор в светлый желто-зеленый цвет.
– взаимодействие с красной кровяной солью K3[Fe(CN)6] – также качественная реакция на ионы железа +2. При этом образуется синий осадок «турнбулева синь».
Видеоопыт взаимодействия раствора хлорида железа (II) с раствором гексацианоферрата (III) калия (качественная реакция на ионы железа (II)) можно посмотреть здесь.
Качественные реакции на ионы железа +3
– взаимодействие солей железа (III) с щелочами. При этом образуется бурый осадок гидроксида железа (III).

Например, хлорид железа (III) реагирует с гидроксидом натрия:
3NaOH + FeCl3 → Fe(OH)3 + 3NaCl
Видеоопыт взаимодействия раствора хлорида железа (III) с раствором гидроксида натрия (качественная реакция на ионы железа (III)) можно посмотреть здесь.
– ионы железа +3 окрашивают раствор в светлый желто-оранжевый цвет.
– взаимодействие с желтой кровяной солью K4[Fe(CN)6] ионы железа +3. При этом образуется синий осадок «берлинская лазурь».
Видеоопыт взаимодействия раствора хлорида железа (III) с раствором гексацианоферрата (II) калия (качественная реакция на ионы железа (III)) можно посмотреть здесь.
В последнее время получены данные, которые свидетельствуют, что молекулы берлинской лазури идентичны по строению молекулам турнбулевой сини. Состав молекул обоих этих веществ можно выразить формулой Fe4[Fe2(CN)6]3.
– при взаимодействии солей железа (III) с роданидами раствор окрашивается в кроваво-красный цвет.
Например, хлорид железа (III) взаимодействует с роданидом натрия:
FeCl3 + 3NaCNS → Fe(CNS)3 + 3NaCl
Видеоопыт взаимодействия раствора хлорида железа (III) с раствором роданида калия (качественная реакция на ионы железа (III)) можно посмотреть здесь.
Химические свойства
1. При обычных условиях железо малоактивно, но при нагревании, в особенности в мелкораздробленном состоянии, оно становится активным и реагирует почти со всеми неметаллами.
1.1. Железо реагирует с галогенами с образованием галогенидов. При этом активные неметаллы (фтор, хлор и бром) окисляют железо до степени окисления +3:
2Fe + 3Cl2 → 2FeCl3
Менее активный йод окисляет железо до степени окисления +2:
Fe + I2 → FeI2
1.2. Железо реагирует с серой с образованием сульфида железа (II):
Fe + S → FeS
1.3. Железо реагирует с фосфором. При этом образуется бинарное соединения – фосфид железа:
Fe + P → FeP
1.4. С азотом железо реагирует в специфических условиях.
1.5. Железо реагирует с углеродом и кремнием с образованием карбида и силицида.
1.6. При взаимодействии с кислородом железо образует окалину – двойной оксид железа (II, III):
3Fe + 2O2 → Fe3O4
При пропускании кислорода через расплавленное железо возможно образование оксида железа (II):
2Fe + O2 → 2FeO
2. Железо взаимодействует со сложными веществами.
2.1. При обычных условиях железо с водой практически не реагирует. Раскаленное железо может вступать в реакцию при температуре 700-900оС с водяным паром:
3Fe0 + 4H2+O → Fe+33O4 + 4H20
В воде в присутствии кислорода или во влажном воздухе железо медленно окисляется (корродирует):
4Fe + 3O2 + 6H2O → 4Fe(OH)3
2.2. Железо взаимодействуют с минеральными кислотами (с соляной, фосфорной и разбавленной серной кислотой). При этом образуются соль железа со степенью окисления +2 и водород.
Например, железо бурно реагирует с соляной кислотой:
Fe + 2HCl → FeCl2 + H2↑
2.3. При обычных условиях железо не реагирует с концентрированной серной кислотой из-за пассивации – образования плотной оксидной пленки. При нагревании реакция идет, образуются оксид серы (IV), сульфат железа (III) и вода:
2Fe + 6H2SO4(конц.) → Fe2(SO4)3 + 3SO2 + 6H2O
2.4. Железо не реагирует при обычных условиях с концентрированной азотной кислотой также из-за пассивации. При нагревании реакция идет с образованием нитрата железа (III), оксида азота (IV) и воды:
Fe + 6HNO3(конц.) → Fe(NO3)3 + 3NO2↑ + 3H2O
С разбавленной азотной кислотой железо реагирует с образованием оксида азота (II):
Fe + 4HNO3(разб.гор.) → Fe(NO3)3 + NO + 2H2O
При взаимодействии железа с очень разбавленной азотной кислотой образуется нитрат аммония:
8Fe + 30HNO3(оч. разб.) → 8Fe(NO3)3 + 3NH4NO3 + 9H2O
2.5. Железо может реагировать с щелочными растворами или расплавами сильных окислителей. При этом железо окисляет до степени окисления +6, образуя соль (феррат).
Например, при взаимодействии железа с расплавом нитрата калия в присутствии гидроксида калия железо окисляется до феррата калия, а азот восстанавливается либо до нитрита калия, либо до аммиака:
Fe + 2KOH + 3KNO3 → 3KNO2 + K2FeO4 + H2O
2.6. Железо восстанавливает менее активные металлы из оксидов и солей.
Например, железо вытесняет медь из сульфата меди (II). Реакция экзотермическая:
Fe + CuSO4 → FeSO4 + Cu
Еще пример: простое вещество железо восстанавливает железо до степени окисления +2 при взаимодействии с соединениями железа +3:
2Fe(NO3)3 + Fe → 3Fe(NO3)2
2FeCl3 + Fe → 3FeCl2
Fe2(SO4)3 + Fe → 3FeSO4
Оксид железа (II)
Оксид железа (II) – это твердое, нерастворимое в воде вещество черного цвета.
Способы получения
Оксид железа (II) можно получить различными методами:
1. Частичным восстановлением оксида железа (III).
Например, частичным восстановлением оксида железа (III) водородом:
Fe2O3 + H2 → 2FeO + H2O
Или частичным восстановлением оксида железа (III) угарным газом:
Fe2O3 + CO → 2FeO + CO2
Еще один пример: восстановление оксида железа (III) железом:
Fe2O3 + Fe → 3FeO
2. Разложение гидроксида железа (II) при нагревании:
Fe(OH)2 → FeO + H2O
Химические свойства
Оксид железа (II) — типичный основный оксид.
1. При взаимодействии оксида железа (II) с кислотными оксидами образуются соли.
Например, оксид железа (II) взаимодействует с оксидом серы (VI):
FeO + SO3 → FeSO4
2. Оксид железа (II) взаимодействует с растворимыми кислотами. При этом также образуются соответствующие соли.
Например, оксид железа (II) взаимодействует с соляной кислотой:
FeO + 2HCl → FeCl2 + H2O
3. Оксид железа (II) не взаимодействует с водой.
4. Оксид железа (II) малоустойчив, и легко окисляется до соединений железа (III).
Например, при взаимодействии с концентрированной азотной кислотой образуются нитрат железа (III), оксид азота (IV) и вода:
FeO + 4HNO3(конц.) → NO2 + Fe(NO3)3 + 2H2O
При взаимодействии с разбавленной азотной кислотой образуется оксид азота (II). Реакция идет при нагревании:
3FeO + 10HNO3(разб.) → 3Fe(NO3)3 + NO + 5H2O
5. Оксид железа (II) проявляет слабые окислительные свойства.
Например, оксид железа (II) реагирует с угарным газом при нагревании:
FeO + CO → Fe + CO2
Оксид железа (III)
Оксид железа (III) – это твердое, нерастворимое в воде вещество красно-коричневого цвета.
Способы получения
Оксид железа (III) можно получить различными методами:
1. Окисление оксида железа (II) кислородом.
4FeO + O2 → 2Fe2O3
2. Разложение гидроксида железа (III) при нагревании:
2Fe(OH)3 → Fe2O3 + 3H2O
Химические свойства
Оксид железа (III) – амфотерный.
1. При взаимодействии оксида железа (III) с кислотными оксидами и кислотами образуются соли.
Например, оксид железа (III) взаимодействует с азотной кислотой:
Fe2O3 + 6HNO3 → 2Fe(NO3)3 + 3H2O
2. Оксид железа (III) взаимодействует с щелочами и основными оксидами. Реакция протекает в расплаве, при этом образуется соответствующая соль (феррит).
Например, оксид железа (III) взаимодействует с гидроксидом натрия:
Fe2O3 + 2NaOH → 2NaFeO2 + H2O
3. Оксид железа (III) не взаимодействует с водой.
4. Оксид железа (III) окисляется сильными окислителями до соединений железа (VI).
Например, хлорат калия в щелочной среде окисляет оксид железа (III) до феррата:
Fe2O3 + KClO3 + 4KOH → 2K2FeO4 + KCl + 2H2O
Нитраты и нитриты в щелочной среде также окисляют оксид железа (III):
Fe2O3 + 3KNO3 + 4KOH → 2K2FeO4 + 3KNO2 + 2H2O
5. Оксид железа (III) проявляет окислительные свойства.
Например, оксид железа (III) реагирует с угарным газом при нагревании. При этом возможно восстановление как до чистого железа, так и до оксида железа (II) или железной окалины:
Fe2O3 + 3СO → 2Fe + 3CO2
Также оксид железа (III) восстанавливается водородом:
Fe2O3 + 3Н2 → 2Fe + 3H2O
Железом можно восстановить оксид железа только до оксида железа (II):
Fe2O3 + Fe → 3FeO
Оксид железа (III) реагирует с более активными металлами.
Например, с алюминием (алюмотермия):
Fe2O3 + 2Al → 2Fe + Al2O3
Оксид железа (III) реагирует также с некоторыми другими сильными восстановителями.
Например, с гидридом натрия:
Fe2O3 + 3NaH → 3NaOH + 2Fe
6. Оксид железа (III) – твердый, нелетучий и амфотерный. А следовательно, он вытесняет более летучие оксиды (как правило, углекислый газ) из солей при сплавлении.
Например, из карбоната натрия:
Fe2O3 + Na2CO3 → 2NaFeO2 + CO2
Оксид железа (II, III)
Оксид железа (II, III) (железная окалина, магнетит) – это твердое, нерастворимое в воде вещество черного цвета.
Фото с сайта wikipedia.ru
Способы получения
Оксид железа (II, III) можно получить различными методами:
1. Горение железа на воздухе:
3Fe + 2O2 → Fe3O4
2. Частичное восстановление оксида железа (III) водородом или угарным газом:
3Fe2O3 + Н2 → 2Fe3O4 + H2O
3. При высокой температуре раскаленное железо реагирует с водой, образуя двойной оксид железа (II, III):
3Fe + 4H2O(пар) → Fe3O4 + 4H2
Химические свойства
Свойства оксида железа (II, III) определяются свойствами двух оксидов, из которых он состоит: основного оксида железа (II) и амфотерного оксида железа (III).
1. При взаимодействии оксида железа (II, III) с кислотными оксидами и кислотами образуются соли железа (II) и железа (III).
Например, оксид железа (II, III) взаимодействует с соляной кислотой. При это образуются две соли – хлорид железа (II) и хлорид железа (III):
Fe3O4 + 8HCl → FeCl2 + 2FeCl3 + 4H2O
Еще пример: оксид железа (II, III) взаимодействует с разбавленной серной кислотой.
Fe3O4 + 4H2SO4(разб.) → Fe2(SO4)3 + FeSO4 + 4Н2О
2. Оксид железа (II, III) взаимодействует с сильными кислотами-окислителями (серной-концентрированной и азотной).
Например, железная окалина окисляется концентрированной азотной кислотой:
Fe3O4 + 10HNO3(конц.) → NO2↑ + 3Fe(NO3)3 + 5H2O
Разбавленной азотной кислотой окалина окисляется при нагревании:
3Fe3O4 + 28HNO3(разб.) → 9Fe(NO3)3 + NO + 14H2O
Также оксид железа (II, III) окисляется концентрированной серной кислотой:
2Fe3O4 + 10H2SO4(конц.) → 3Fe2(SO4)3 + SO2 + 10H2O
Также окалина окисляется кислородом воздуха:
4Fe3O4 + O2(воздух) → 6Fe2O3
3. Оксид железа (II, III) не взаимодействует с водой.
4. Оксид железа (II, III) окисляется сильными окислителями до соединений железа (VI), как и прочие оксиды железа (см. выше).
5. Железная окалина проявляет окислительные свойства.
Например, оксид железа (II, III) реагирует с угарным газом при нагревании. При этом возможно восстановление как до чистого железа, так и до оксида железа (II):
Fe3O4 + 4CO → 3Fe + 4CO2
Также железная окалина восстанавливается водородом:
Fe3O4 + 4H2 → 3Fe + 4H2O
Оксид железа (II, III) реагирует с более активными металлами.
Например, с алюминием (алюмотермия):
3Fe3O4 + 8Al → 9Fe + 4Al2O3
Оксид железа (II, III) реагирует также с некоторыми другими сильными восстановителями (йодидами и сульфидами).
Например, с йодоводородом:
Fe3O4 + 8HI → 3FeI2 + I2 + 4H2O
Гидроксид железа (II)
Способы получения
1. Гидроксид железа (II) можно получить действием раствора аммиака на соли железа (II).
Например, хлорид железа (II) реагирует с водным раствором аммиака с образованием гидроксида железа (II) и хлорида аммония:
FeCl2 + 2NH3 + 2H2O → Fe(OH)2 + 2NH4Cl
2. Гидроксид железа (II) можно получить действием щелочи на соли железа (II).
Например, хлорид железа (II) реагирует с гидроксидом калия с образованием гидроксида железа (II) и хлорида калия:
FeCl2 + 2KOH → Fe(OH)2↓ + 2KCl
Химические свойства
1. Гидроксид железа (II) проявляется основные свойства, а именно реагирует с кислотами. При этом образуются соответствующие соли.
Например, гидроксид железа (II) взаимодействует с соляной кислотой с образованием хлорида железа (II):
Fe(OH)2 + 2HCl → FeCl2 + 2H2O
Fe(OH)2 + H2SO4 → FeSO4 + 2H2O
Fe(OH)2 + 2HBr → FeBr2 + 2H2O
2. Гидроксид железа (II) взаимодействует с кислотными оксидами сильных кислот.
Например, гидроксид железа (II) взаимодействует с оксидом серы (VI) с образованием сульфата железа (II):
Fe(OH)2 + SO3 → FeSO4 + 2H2O
3. Гидроксид железа (II) проявляет сильные восстановительные свойства, и реагирует с окислителями. При этом образуются соединения железа (III).
Например, гидроксид железа (II) взаимодействует с кислородом в присутствии воды:
4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3↓
Гидроксид железа (II) взаимодействует с пероксидом водорода:
2Fe(OH)2 + H2O2 → 2Fe(OH)3
При растворении Fe(OH)2 в азотной или концентрированной серной кислотах образуются соли железа (III):
2Fe(OH)2 + 4H2SO4(конц.) → Fe2(SO4)3 + SO2 + 6H2O
4. Гидроксид железа (II) разлагается при нагревании:
Fe(OH)2 → FeO + H2O
Гидроксид железа (III)
Способы получения
1. Гидроксид железа (III) можно получить действием раствора аммиака на соли железа (III).
Например, хлорид железа (III) реагирует с водным раствором аммиака с образованием гидроксида железа (III) и хлорида аммония:
FeCl3 + 3NH3 + 3H2O = Fe(OH)3 + 3NH4Cl
2. Окислением гидроксида железа (II) кислородом или пероксидом водорода:
4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3↓
2Fe(OH)2 + H2O2 → 2Fe(OH)3
3. Гидроксид железа (III) можно получить действием щелочи на раствор соли железа (III).
Например, хлорид железа (III) реагирует с раствором гидроксида калия с образованием гидроксида железа (III) и хлорида калия:
FeCl3 + 3KOH → Fe(OH)3↓ + 3KCl
Видеоопыт получения гидроксида железа (III) взаимодействием хлорида железа (III) и гидроксида калия можно посмотреть здесь.
4. Также гидроксид железа (III) образуется при взаимодействии растворимых солей железа (III) с растворами карбонатов и сульфитов. Карбонаты и сульфиты железа (III) необратимо гидролизуются в водном растворе.
Например: бромид железа (III) реагирует с карбонатом натрия. При этом выпадает осадок гидроксида железа (III), выделяется углекислый газ и образуется бромид натрия:
2FeBr3 + 3Na2CO3 + 3H2O = 2Fe(OH)3↓ + CO2↑ + 6NaBr
Но есть исключение! Взаимодействие солей железа (III) с сульфитами в ЕГЭ по химии — окислительно-восстановительная реакция. Соединения железа (III) окисляют сульфиты, а также сульфиды и иодиды.
Взаимодействие хлорида железа (III) с сульфитом, например, калия — очень интересная реакция. Во-первых, в некоторых источниках указывается, что в ней таки может протекать необратимый гидролиз. Но для ЕГЭ лучше считать, что при этом протекает ОВР. Во-вторых, ОВР можно записать в разных видах:
2FeCl3 + Na2SO3 + H2O = 2FeCl2 + Na2SO4 + 2HCl
Также допустима такая запись:
2FeCl3 + Na2SO3 + H2O = FeSO4 + 2NaCl + FeCl2 + 2HCl
Химические свойства
1. Гидроксид железа (III) проявляет слабовыраженные амфотерные свойства, с преобладанием основных. Как основание, гидроксид железа (III) реагирует с растворимыми кислотами.
Например, гидроксид железа (III) взаимодействует с азотной кислотой с образованием нитрата железа (III):
Fe(OH)3 + 3HNO3 → Fe(NO3)3 + 3H2O
Fe(OH)3 + 3HCl → FeCl3 + 3H2O
2Fe(OH)3 + 3H2SO4 → Fe2(SO4)3 + 6H2O
Fe(OH)3 + 3HBr → FeBr3 + 3H2O
2. Гидроксид железа (III) взаимодействует с кислотными оксидами сильных кислот.
Например, гидроксид железа (III) взаимодействует с оксидом серы (VI) с образованием сульфата железа (III):
2Fe(OH)3 + 3SO3 → Fe2(SO4)3 + 3H2O
3. Гидроксид железа (III) взаимодействует с растворимыми основаниями (щелочами). При этом в расплаве образуются соли—ферриты, а в растворе реакция практически не идет. При этом гидроксид железа (III) проявляет кислотные свойства.
Например, гидроксид железа (III) взаимодействует с гидроксидом калия в расплаве с образованием феррита калия и воды:
KOH + Fe(OH)3 → KFeO2 + 2H2O
4. Гидроксид железа (III) разлагается при нагревании:
2Fe(OH)3 → Fe2O3 + 3H2O
Видеоопыт взаимодействия гидроксида железа (III) с соляной кислотой можно посмотреть здесь.
Соли железа
Нитраты железа
Нитрат железа (II) при нагревании разлагается на оксид железа (III), оксид азота (IV) и кислород:
4Fe(NO3)2 → 2Fe2O3 + 8NO2 + O2
Нитрат железа (III) при нагревании разлагается также на оксид железа (III), оксид азота (IV) и кислород:
4Fe(NO3)3 → 2Fe2O3 + 12NO2 + 3O2
Гидролиз солей железа
Растворимые соли железа, образованные кислотными остатками сильных кислот гидролизуются по катиону. Гидролиз протекает ступенчато и обратимо, т.е. частично:
I ступень: Fe3+ + H2O ↔ FeOH2+ + H+
II ступень: FeOH2+ + H2O ↔ Fe(OH)2+ + H+
III ступень: Fe(OH)2+ + H2O ↔ Fe(OH)3 + H+
Однако сульфиты и карбонаты железа (III) и их кислые соли гидролизуются необратимо, полностью, т.е. в водном растворе не существуют, а разлагаются водой:
Fe2(SO4)3 + 6NaHSO3 → 2Fe(OH)3 + 6SO2 + 3Na2SO4
2FeBr3 + 3Na2CO3 + 3H2O → 2Fe(OH)3↓ + CO2↑ + 6NaBr
2Fe(NO3)3 + 3Na2CO3 + 3H2O → 2Fe(OH)3↓ + 6NaNO3 + 3CO2↑
2FeCl3 + 3Na2CO3 + 3H2O → 2Fe(OH)3↓ + 6NaCl + 3CO2↑
Fe2(SO4)3 + 3K2CO3 + 3H2O → 2Fe(OH)3↓ + 3CO2↑ + 3K2SO4
При взаимодействии соединений железа (III) с сульфидами протекает ОВР:
2FeCl3 + 3Na2S → 2FeS + S + 6NaCl
Более подробно про гидролиз можно прочитать в соответствующей статье.
Окислительные свойства железа (III)
Соли железа (III) под проявляют довольно сильные окислительные свойств. Так, при взаимодействии соединений железа (III) с сульфидами протекает окислительно-восстановительная реакция.
Например: хлорид железа (III) взаимодействует с сульфидом натрия. При этом образуется сера, хлорид натрия и либо черный осадок сульфида железа (II) (в избытке сульфида натрия), либо хлорид железа (II) (в избытке хлорида железа (III)):
2FeCl3 + 3Na2S → 2FeS + S + 6NaCl
2FeCl3 + Na2S → 2FeCl2 + S + 2NaCl
По такому же принципу соли железа (III) реагируют с сероводородом:
2FeCl3 + H2S → 2FeCl2 + S + 2HCl
Соли железа (III) также вступают в окислительно-восстановительные реакции с йодидами.
Например, хлорид железа (III) взаимодействует с йодидом калия. При этом образуются хлорид железа (II), молекулярный йод и хлорид калия:
2FeCl3 + 2KI → 2FeCl2 + I2 + 2KCl
Интерес представляют также реакции солей железа (III) с металлами. Мы знаем, что более активные металлы вытесняют из солей менее активные металлы. Иначе говоря, металлы, которые стоят в электрохимическом ряду левее, могут взаимодействовать с солями металлов, которые расположены в этом ряду правее. Исходя из этого правила, соли железа могут взаимодействовать только с металлами, которые расположены до железа. И они взаимодействуют.
Однако, соли железа со степенью окисления +3 в этом ряду являются небольшим исключением. Ведь для железа характерны две степени окисления: +2 и +3. И железо со степенью окисления +3 является более сильным окислителем. Таким образом, условно говоря, железо со степенью окисления +3 расположено в ряду активности после меди. И соли железа (III) могут реагировать еще и с металлами, которые расположены правее железа! Но до меди, включительно. Вот такой парадокс.
И еще один момент. Соединения железа (III) с этими металлами реагировать будут, а вот соединения железа (II) с ними реагировать не будут. Таким образом, металлы, расположенные в ряду активности между железом и медью (включая медь) при взаимодействии с солями железа (III) восстанавливают железо до степени окисления +2. А вот металлы, расположенные до железа в ряду активности, могут восстановить железо и до простого вещества.
Например, хлорид железа (III) взаимодействует с медью. При этом образуются хлорид железа (II) и хлорид меди (II):
2FeCl3 + Cu → 2FeCl2 + CuCl2
А вот реакция нитрата железа (III) с цинком протекает уже по привычному механизму. И железо восстанавливается до простого вещества:
2Fe(NO3)3 + 3Zn → 2Fe + 3Zn(NO3)2
Железо ($Fe$) — элемент побочной подгруппы VIII группы и 4-го периода Периодической системы. Как и положено металлу $4$-го периода, атомы железа имеют четыре энергетических уровня, но заполняется у них не последний, а предпоследний, третий от ядра, уровень. Распределение электронов таково: $2e↖{-};8e↖{-};14e↖{-};2e↖{-}$. Подобно всем металлам, атомы железа проявляют восстановительные свойства, отдавая при химических взаимодействиях не только два электрона с последнего уровня и приобретая степень окисления $+2$, но и электрон с предпоследнего уровня, при этом степень окисления повышается до $+3$.
Железо — металл со всеми характерными свойствами металлов: высокими тепло- и электропроводностью, ковкостью, металлическим блеском, высокой $t°{пл}=1540°С$ и плотностью $ρ=7,85 г/{см^3}$. Железо образует сплавы с неметаллами (углеродом) и другими металлами. Железо может намагничиваться, оно обладает ферромагнетизмом. Для железа характерны два ряда соединений: соединения железа (II) и железа (III). Химические свойства железа и его соединений приведены в таблице. Железо входит в состав крови человека (гемоглобин), содержится оно и в некоторых растениях: шпинате, салате, капусте.
Роль железа в жизни человека общеизвестна, об этом можно не говорить. Железо — это основа всей современной цивилизации.
Железо и его соединения.
| Железо | Оксиды железа (II) и (III) | Гидроксиды железа (II) и (III) |
| 1. Серебристо-белый металл. 2. Взаимодействует с простыми веществами: а) горит в кислороде: $3Fe+2O_2=Fe_3O_4$ б) реагирует с хлором: $2Fe+3Cl_2=2FeCl_3$ в) взаимодействует с серой: $Fe+S=FeS$ 3. Реагирует с растворами кислот: $Fe+2H^{+}=Fe^{2+}+H_2↑$ 4. Вытесняет водород из воды при сильном нагревании: $Fe+H_2O=FeO+H_2↑$ 5. Окисляется в присутствии воды и кислорода воздуха (с образованием ржавчины): $4Fe+6H_2O+3O_2=4Fe(OH)3$ 6. Замещает менее активный металл в растворе его соли: $Fe+Cu^{2+}=Fe^{2+}+Cu$ Получение Восстановление оксидов железа оксидом углерода (II), водородом или алюминием: $Fe_3O_4+4CO=3Fe+4CO_2$ $FeO+H_2=Fe+H_2O$ $Fe_2O_3+2Al=2Fe+Al_2O_3$ |
1. Проявляют основные свойства, взаимодействуя с кислотами: $FeO+2H^{+}=Fe^{2+}+H_2O$ $Fe_2O_3+6H^{+}=2Fe^{3+}+3H_2O$ 2. Оксид железа (III) проявляет слабые амфотерные свойства, взаимодействуя при нагревании с основными оксидами с образованием ферритов: $MnO+Fe_2O_3=Mn(FeO_2)2$ |
1. Проявляют свойства нерастворимых в воде оснований: а) взаимодействуют с кислотами: $Fe(OH)2+2H^{+}=Fe^{2+}+2H_2O$ $Fe(OH)3+3H^{+}=Fe^{3+}+3H_2O$ б) разлагаются при нагревании: $Fe(OH)2=FeO+H_2O$ $2Fe(OH)3=Fe_2O_3+3H_2O$ 2. Гидроксид железа (III) проявляет слабые амфотерные свойства, реагируя с горячими концентрированными растворами щелочей: $Fe(OH)3+NaOH=NaFeO_2+2H_2O$ 3. Гидроксид железа (II) на воздухе окисляется в гидроксид железа (III): $4Fe(OH)2+O_2+2H_2O=4Fe(OH)3$ 4. Соли железа (II) и (III) гидролизуются: $Fe^{2+}+H_2O⇄FeOH^{+}+H^{+}$; $Fe^{3+}+H_2O⇄FeOH^{2+}+H^{+}$ |
Хром
Твердый металл голубовато-белого цвета. Этимология слова «хром» берет начало от греч. χρῶμα — цвет, что связано с большим
разнообразием цветов соединений хрома. Массовая доля этого элемента в земной коре составляет 0.02% по массе.

Для хрома характерны степени окисления +2, +3 и +6. У соединений, где хром принимает степень окисления +2, свойства основные, +3 — амфотерные,
+6 — кислотные.

В природе хром встречается в виде следующих соединений.
- Fe(CrO2)2 — хромистый железняк, хромит
- (Mg, Fe)Cr2O4 — магнохромит
- (Fe, Mg)(Cr, Al)2O4 — алюмохромит

Получение
В промышленности хром получают прокаливанием хромистого железняка с углеродом. Также применяют алюминотермию для вытеснения хрома из
его оксида.
Fe(CrO2)2 + C = Fe + Cr + CO
Cr2O3 + Al = Al2O3 + Cr
Химические свойства
- Реакции с неметаллами
- Реакция с водой
- Реакции с кислотами
- Реакции с солями менее активных металлов
Уже на воздухе вступает в реакцию с кислородом: на поверхности металла образуется пленка из оксида хрома (III) — Cr2O3 —
происходит пассивирование. Реагирует с неметаллами при нагревании.
Cr + O2 = (t) Cr2O3
Cr + S = (t) Cr2S3
Cr + N2 = (t) CrN
Cr + C = Cr2C3

Протекает в раскаленном состоянии.
Cr + H2O = (t) Cr(OH)3 + H2↑
Cr + HCl = CrCl2 + H2↑

Cr + H2SO4(разб.) = CrSO4 + H2↑
С холодными концентрированными серной и азотной кислотой реакция не идет. Она начинается только при нагревании.
Cr + H2SO4 = (t) Cr2(SO4)3 + SO2↑ + H2O
Хром способен вытеснить из солей металлы, стоящие в ряду напряжений правее него.
Cr + CuSO4 = CrSO4 + Cu
Соединения хрома (II)
Соединение хрома (II) носят основный характер. Оксид хрома (II) окисляется кислородом воздуха до более устойчивой формы — оксида хрома (III),
реагирует с кислотами, кислотными оксидами.

CrO + O2 = Cr2O3
CrO + H2SO4 = CrSO4 + H2O
CrO + SO3 = CrSO4
Гидроксид хрома (II), как нерастворимый гидроксид, легко разлагается при нагревании на соответствующий оксид и воду, реагирует с кислотами,
кислотными оксидами.

Cr(OH)2 = (t) CrO + H2O
Cr(OH)2 + HCl = CrCl2 + H2O
Cr(OH)2 + SO3 = CrSO4 + H2O
Соединения хрома (III)
Это наиболее устойчивые соединения, которые носят амфотерный характер. К ним относятся оксид хрома (III) гидроксид хрома (III).

Оксид хрома (III) реагирует как с щелочами, так и с кислотами. В реакциях с щелочами при нормальной температуре (в растворе) образуются комплексные соли, при прокаливании — смешанные оксиды. С кислотами оксид хрома (III) образует различные соли.
H2O + NaOH + Cr2O3 → Na3[Cr(OH)6] (в растворе, гексагидроксохромат натрия)
Cr2O3 + Ba(OH)2 → (t°) Ba(CrO2)2 + H2O (прокаливание, хромит бария)
Cr2O3 + 2NaOH → (t°) 2NaCrO2 + H2O (прокаливание, хромит натрия)
Cr2O3 + HCl = CrCl3 + H2O (сохраняем степень окисления Cr+3)

Оксид хрома (III) реагирует с более активными металлами (например, при алюминотермии).
Cr2O3 + Al = Al2O3 + Cr
При окислении соединение хрома (III) получают соединения хрома (VI) (в щелочной среде).
K3[Cr(OH)6] + H2O2 = K2CrO4 + KOH + H2O
Cr2O3 + 8NaOH + O2 = (t) Na2CrO4 + H2O
Соединения хрома (VI)
В этой степени окисления хром проявляет кислотные свойства. К ним относится оксид хрома (VI) — CrO3, и две кислоты, находящиеся в
растворе в состоянии равновесия: хромовая — H2CrO4 и дихромовая кислоты — H2Cr2O7.
Принципиально важно помнить окраску хроматов и дихроматов (часто она бывает дана в заданиях в качестве подсказки). Хроматы окрашивают
раствор в желтый цвет, а дихроматы — в оранжевый цвет.

Хроматы переходят в дихроматы с увеличением кислотности среды (часто в реакциях с кислотами). Цвет раствора меняется с желтого на оранжевый.
Na2CrO4 + H2SO4 = Na2Cr2O7 + Na2SO4 + H2O
Если же оранжевому раствору дихромата прилить щелочь, то он сменит свой цвет на желтый — образуется хромат.
Na2Cr2O7 + NaOH = Na2CrO4 + H2O
Разложение дихромата аммония выглядит очень эффектно и носит название «вулканчик» 
(NH4)2Cr2O7 = (t) Cr2O3 + N2↑ + H2O

В степени окисления +6 соединения хрома проявляют выраженные окислительные свойства.
K2Cr2O7 + HCl = CrCl3 + KCl + Cl2↑ + H2O
Железо
Является одним из самых распространенных элементов в земной коре (после алюминия), составляет 4,65% ее массы.

Для железа характерны две основные степени окисления +2, +3, +6.

В природе железо встречается в виде следующих соединений:
- Fe2O3 — красный железняк, гематит
- Fe3O4 — магнитный железняк, магнетит
- Fe2O3*H2O — бурый железняк, лимонит
- FeS2 — пирит, серый или железный колчедан
- FeCO3 — сидерит

Получение
Получают железо восстановлением из его оксида — руды. Восстанавливают с помощью угарного газа, водорода.
CO + Fe2O3 = Fe + CO2↑
H2 + Fe2O3 = Fe + H2O
Основными сплавами железа являются чугун и сталь. В стали содержание углерода менее 2%, меньше содержится P, Mn, Si, S. Чугун отличается
бо́льшим содержанием углерода (2-6%), содержит больше P, Mn, Si, S.

Химические свойства
- Реакции с неметаллами
- Реакции с кислотами
- Реакции с солями
- Восстановительные свойства
Fe + S = FeS (t > 700°C)
Fe + S = FeS2 (t < 700°C)
Fe + O2 = Fe3O4 (при горении железа образуется железная окалина — Fe3O4 — смесь двух оксидов
FeO*Fe2O3)
При нагревании железо взаимодействует с галогенами, азотом, фосфором, углеродом, кремнием и другими.
Fe + Cl2 = (t) FeCl3
Fe + P = (t) FeP
Fe + C = (t) Fe3C
Fe + Si = (t) FeSi

Железо активнее водорода, способно вытеснить его из кислот.
Fe + HCl = FeCl2 + H2↑
На воздухе железо покрывается пленкой оксида, из-за чего пассивируется во многих реакциях, в том числе с концентрированными холодными
серной и азотной кислотами.
Fe + H2SO4(разб.) = FeSO4 + H2↑
Реакция с концентрированными кислотами идет только при нагревании. В холодных серной и азотной кислотах железо пассивируется.

Fe + H2SO4(конц.) = Fe2(SO4)3 + SO2↑ + H2O
Железо способно вытеснить из солей металлы, стоящие в ряду напряжений правее железа.
CuCl2 + Fe = FeCl2 + Cu
Железо способно восстанавливать соединения железа +3 до +2.
Fe + Fe2O3 = (t) FeO
Fe + FeCl3 = (t) FeCl2
Соединения железа (II) проявляют основные свойства. Реагируют c кислотами. При разложении гидроксид железа (II)
распадается на соответствующий оксид и воду.
FeO + H2SO4 = FeSO4 + H2O
Fe(OH)2 + HCl = FeCl2 + H2O
Fe(OH)2 = (t) FeO + H2O

При хранении на открытом воздухе соли железа (II) приобретают коричневый цвет из-за окисления до железа +3.
FeCl2 + H2O + O2 = Fe(OH)Cl2
Качественной реакцией на ионы Fe2+ в растворе является реакция с красной кровяной солью — K3[Fe(CN)6] —
гексацианоферратом (III) калия. В результате реакции образуется берлинская лазурь (прусский синий).
FeCl2 + K3[Fe(CN)6] = KFe[Fe(CN)6] + KCl
Качественной реакцией на ионы Fe2+ также является взаимодействие с щелочью (гидроксидом натрия). В результате
выпадает осадок зеленого цвета.
FeCl2 + NaOH = Fe(OH)2 + NaCl
Соединения железа (III) проявляют амфотерные свойства. Оксид и гидроксид железа (III) реагирует и с кислотами, и с щелочами.
Fe(OH)3 + H2SO4 = Fe2(SO4)3 + H2O
Fe(OH)3 + KOH = K3[Fe(OH)6] (гексагидроксоферрат калия)
При сплавлении комплексные соли не образуются из-за испарения воды.
Fe(OH)3 + KOH = (t) KFeO2 + H2O
Гидроксид железа (III) — ржавчина, образуется на воздухе в результате взаимодействия железа с водой в присутствии кислорода. При нагревании
легко распадается на воду и соответствующий оксид.

Fe + H2O + O2 = Fe(OH)3
Fe(OH)3 = (t) Fe2O3 + H2O
Качественной реакцией на ионы Fe3+ является взаимодействие с желтой кровяной солью K4[Fe(CN)6].
В результате реакции образуется берлинская лазурь (прусский синий).
FeCl3 + K4[Fe(CN)6] = KFe[Fe(CN)6] + KCl
Реакция хлорида железа (III) с роданидом калия также является качественной, в результате нее образуется характерный раствор ярко
красного цвета.
FeCl3 + KCNS = Fe(CNS)3 + KCl

И еще одна качественная реакция на ионы Fe3+ — взаимодействие с щелочью (гидроксидом натрия). В результате
выпадает осадок бурого цвета.
FeCl3 + NaOH = Fe(OH)3 + NaCl
Соединения железа (VI) — ферраты — соли несуществующей в свободном виде железной кислоты. Обладают выраженными
окислительными свойствами.
Ферраты можно получить в ходе электролизом щелочи на железном аноде, а также действием хлора на взвесь Fe(OH)3
в щелочи.
Fe + KOH + H2O = (электролиз) K2FeO4 + H2↑
Fe(OH)3 + Cl2 + KOH = K2FeO4 + KCl + H2O

Медь
Один из первых металлов, освоенных человеком вследствие низкой температуры плавления и доступности получения руды.

Основные степени окисления меди +1, +2.

Медь встречается в самородном виде и в виде соединений, наиболее известные из которых:
- CuFeS2 — медный колчедан, халькопирит
- Cu2S — халькозин
- Cu2CO3(OH)2 — малахит

Получение
Пирометаллургический метод получения основан на получении меди путем обжига халькопирита, который идет в несколько этапов.
CuFeS2 + O2 = Cu2S + FeS + SO2↑
Cu2S + O2 = Cu2O + SO2
Cu2O + Cu2S = Cu + SO2
Гидрометаллургический метод заключается в растворении минералов меди в разбавленной серной кислоте и дальнейшем вытеснении меди
более активными металлами, например — железом.
CuSO4 + Fe = Cu + FeSO4

Медь, как малоактивный металл, выделяется при электролизе солей в водном растворе на катоде.
CuSO4 + H2O = Cu + O2 + H2SO4 (медь — на катоде, кислород — на аноде)
Химические свойства
- Реакции с неметаллами
- Реакции с кислотами
- С оксидами неметаллов
Во влажном воздухе окисляется с образованием основного карбоната меди.
Cu + CO2 + H2O + O2 = (CuOH)2CO3
При нагревании реагирует с кислородом, селеном, серой, при комнатной температуре с: хлором, бромом и йодом.
4Cu + O2 = (t) 2Cu2O (при недостатке кислорода)
2Cu + O2 = (t) 2CuO (в избытке кислорода)

Cu + Se = (t) Cu2Se
Cu + S = (t) Cu2S
Медь способна реагировать с концентрированными серной и азотной кислотами. С разбавленной серной не реагирует, с разбавленной азотной
— реакция идет.
Cu + H2SO4(конц.) = (t) CuSO4 + SO2↑ + H2O
Cu + HNO3(конц.) = Cu(NO3)2 + NO2↑ + H2O
Cu + HNO3(разб.) = Cu(NO3)2 + NO↑ + H2O

Реагирует с царской водкой — смесью соляной и азотной кислот в соотношении 1 объем HNO3 к 3 объемам HCl.
Cu + HCl + HNO3 = CuCl2 + NO + H2O
Медь способна восстанавливать неметаллы из их оксидов.
Cu + SO2 = (t) CuO + S
Cu + NO2 = (t) CuO + N2↑
Cu + NO = (t) CuO + N2↑
Соединения меди I
В степени окисления +1 медь проявляет основные свойства. Соединения меди (I) можно получить путем восстановления соединений меди (II).
CuCl2 + Cu = CuCl
CuO + Cu = Cu2O
Оксид меди (I) можно восстановить до меди различными восстановителями: угарным газом, алюминием (алюминотермией), водородом.
Cu2O + CO = (t) Cu + CO2
Cu2O + Al = (t) Cu + Al2O3
Cu2O + H2 = (t) Cu + H2O
Оксид меди (I) окисляется кислородом до оксида меди (II).
Cu2O + O2 = (t) CuO
Оксид меди (I) вступает в реакции с кислотами.
Cu2O + HCl = CuCl + H2O
Гидроксид меди CuOH неустойчив и быстро разлагается на соответствующий оксид и воду.
CuOH → Cu2O + H2O
Соединения меди (II)
Степень окисления +2 является наиболее стабильной для меди. В этой степени окисления у меди есть оксид CuO и гидроксид Cu(OH)2.
Данные соединения проявляют преимущественно основные свойства.
Оксид меди (II) получают в реакциях термического разложения гидроксида меди (II), реакцией избытка кислорода с медью при нагревании.
Cu(OH)2 = (t) CuO + H2O
Cu + O2 = (t) CuO
Химические свойства
- Реакции с кислотами
- Разложение
- Восстановление
CuO + H2SO4 = CuSO4 + H2O
CuO + HCl = CuCl2 + H2O
CuO = (t) Cu2O + O2
CuO + CO = Cu + CO2
CuO + C = Cu + CO
CuO + H2 = Cu + H2O
Гидроксид меди (II) — Cu(OH)2 — получают в реакциях обмена между растворимыми солями меди и щелочью.

CuSO4 + KOH = K2SO4 + Cu(OH)2↓
- Разложение
- Реакции с кислотами
- Реакции с щелочами
- Реакции с кислотными оксидами
При нагревании гидроксид меди (II), как нерастворимое основание, легко разлагается на соответствующий оксид и воду.
Cu(OH)2 = (t) CuO + H2O
Cu(OH)2 + HNO3 = Cu(NO3)2 + H2O
Cu(OH)2 + HCl = CuCl2 + H2O
Как сказано выше, гидроксид меди (II) носит преимущественно основный характер, однако способен проявлять и амфотерные свойства.
В растворе концентрированной щелочи он растворяется, образуя гидроксокомлпекс.
Cu(OH)2 + LiOH = Li2[Cu(OH)4]
Cu(OH)2 + CO2 = (CuOH)2CO3 + H2O (дигидроксокарбонат меди (II) — (CuOH)2CO3)
Обратите особое внимание на реакцию взаимодействия соли меди (II) — сульфата меди (II), карбоната натрия и воды.
CuSO4 + Na2CO3 + H2O = (CuOH)2CO3 + Na2SO4 + CO2
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Чтобы поделиться, нажимайте
Элемент железо входит в побочную подгруппу VIII группы периодической системы и относится к d-элементам.
Железо известно очень давно. Это самый распространенный в земной коре металл (около 4 % по массе) и самый распространенный в природе переходный металл. В природе железо существует только в виде соединений. Чистое железо имеет преимущественно внеземное происхождение.
Железо используются в виде сплавов: чугуна, стали и ковкого железа. Эти сплавы различаются различным содержанием углерода, в чугуне более 1,7 %, в стали – от 0,3 % до 1,7 %, а в ковком железе – менее 0,3 %. В состав так называемых легированных сталей входят хром, вольфрам, молибден, никель, ванадий, титан, кобальт и другие металлы, что дает возможность получать стали с разными полезными свойствами.
Чистое железо – блестящий серебристо-белый металл. В ряду активности стоит до водорода и растворяется в соляной и разбавленной серной кислотах, выделяя водород. При действии концентрированной серной и азотной кислот железо пассивируется – покрывается тонкой защитной пленкой оксида, поэтому эти кислоты перевозят в железных цистернах.
В соединениях железо проявляет различные степени окисления, в основном +2 и +3, известны также высшие степени окисления железа +4, +5 и +6. Железо является металлом средней активности. При нагревании выше 200 °С в отсутствие паров воды железо покрывается плотной пленкой оксида. Этот процесс называется воронением.
Железо взаимодействует с парами воды при нагревании:
3Fe + 4H2O = Fe3O4 + 4H2
С галогенами железо образует соответствующие соли железа (II и III), а при избытке галогена образуется галогенид железа (III):
2Fe + 3Cl2 = 2FeCl3
Железо растворяется в разбавленных соляной и серной кислотах с образованием солей железа (II):
Fe + 2HCl = FeCl2 + H2
Разбавленная азотная кислота растворяет железо с выделением оксидов азота и нитрата железа (III).
Во влажном воздухе и воде железо разрушается – коррозирует, образуя ржавчину. Коррозия – это окислительно-восстановительный процесс, при котором металл окисляется. Наиболее интенсивно он идет при одновременном присутствии воды и кислорода. В сухом воздухе или в воде, не содержащей кислорода, железо не ржавеет. Суммарное уравнение реакции ржавления железа можно записать так:
4Fe + 6H2O + 3O2 = 4Fe(OH)3
В настоящее с коррозией борются нанесением защитных покрытий, легированием, применением ингибиторов.
Получение:
Доменный процесс (производство чугуна):
C + O2 = CO2, CO2 + C ↔ 2CO
3Fe2O3 + CO = 2(Fe2Fe32)O4+ CO2
(Fe2Fe32)O4+ CO= 3FeO + CO2
FeO + CO= Fe + CO2
(чугун содержит до 6,67% углерода в виде зерен графита и цементита Fe3C);
Выплавка стали (0,2-2,06% углерода) проводится в специальных печах (конвертерных, мартеновских, электрических), отличающихся способом обогрева. Продувание воздуха, обогащенного кислородом, приводит к выгоранию из чугуна избыточного углерода, а также серы, фосфора и кремния в виде оксидов. При этом оксиды либо улавливаются в виде отходящих газов (CO2, SO2), либо связываются в легко отделяемый шлак – смесь Ca3(PO4)2 и CaSiO3. Для получения специальных сталей в печь вводят легирующие добавки других металлов.
Оксид железа(II) FеО. Основный оксид. Черный, имеет ионное строение Fе2+ O2-. При нагревании вначале разлагается, затем образуется вновь. Не образуется при сгорании железа на воздухе. Не реагирует с водой. Разлагается кислотами, сплавляется со щелочами. Медленно окисляется во влажном воздухе. Восстанавливается водородом, коксом. Участвует в доменном процессе выплавки чугуна. Применяется как компонент керамики и минеральных красок. Уравнения важнейших реакций:
FеО + 2НС1 (разб.) = FеС12 + Н2O
FеО + 4НNO3 (конц.) = Fе(NO3)3 +NO2↑ + 2Н2O
FеО + Н2 =Н2O + Fе (особо чистое) (350°С)
FеО + С(кокс) = Fе + СО (выше 1000 °С)
FеО + СО = Fе + СO2 (900°С)
4FеО + 2Н2O(влага) + O2 (воздух) →4FеО(ОН) (t)
6FеО + O2 = 2Fe3O4 (300—500°С)
Получение в лаборатории: термическое разложение соединений железа (II) без доступа воздуха:
Fе(ОН)2 = FеО + Н2O (150-200 °С)
FеСОз = FеО + СO2 (490-550 °С)
Оксид железа (III) – Fe3 O4 . Двойной оксид. Черный, имеет ионное строение Fe2+(Fе3+)2(O2-)4. Термически устойчив до высоких температур. Не реагирует с водой. Разлагается кислотами. Восстанавливается водородом, раскаленным железом. Участвует в доменном процессе производства чугуна. Применяется как компонент минеральных красок (железный сурик), керамики, цветного цемента. Продукт специального окисления поверхности стальных изделий (чернение, воронение). По составу отвечает коричневой ржавчине и темной окалине на железе. Применение брутто-формулы Fe3O4 не рекомендуется. Уравнения важнейших реакций:
2Fe3O4 = 6FеО + O2 (выше 1538 °С)
Fe3O4 + 8НС1 (разб.) = FеС12 + 2FеС13 + 4Н2O
Fe3O4 +10НNO3 (конц.) =3Fе(NO3)3 + NO2↑+ 5Н2O
Fe3O4 + O2 (воздух) = 6Fе2O3 (450-600°С)
Fe3O4 + 4Н2 = 4Н2O + 3Fе (особо чистое, 1000 °С)
Fe3O4 + СО =ЗFеО + СO2 (500—800°C)
Fe3O4 + Fе ⇌4FеО (900—1000 °С , 560—700 °С)
Получение: 3Fe + 2O2 (воздух) = Fe3O4
В природе – оксидная руда железа магнетит.
Оксид железа(III) Fе2О3. Амфотерный оксид с преобладанием основных свойств. Красно-коричневый, имеет ионное строение (Fе 3+)2(O2-)3. Термически устойчив до высоких температур. Не образуется при сгорании железа на воздухе. Не реагирует с водой, из раствора выпадает бурый аморфный гидрат Fе2O3 nН2О. Медленно реагирует с кислотами и щелочами. Восстанавливается монооксидом углерода, расплавленным железом. Сплавляется с оксидами других металлов и образует двойные оксиды – шпинели (технические продукты называются ферритами). Применяется как сырье при выплавке чугуна в доменном процессе, катализатор в производстве аммиака, компонент керамики, цветных цементов и минеральных красок, при термитной сварке стальных конструкций, как носитель звука и изображения на магнитных лентах, как полирующее средство для стали и стекла.
Уравнения важнейших реакций:
6Fе2O3 = Fe3O4 +O2 (1200—1300 °С)
Fе2O3 + 6НС1 (разб.) →2FеС13 + ЗН2O (t) (600°С,р)
Fе2O3 + 2NaОН (конц.) →Н2O+ 2NаFеO2 (красн.) диоксоферрат(III)
Fе2О3 + МО= Fe3O4 (М=Сu, Мn, Fе, Ni, Zn)
Fе2O3 + ЗН2 =ЗН2O+ 2Fе (особо чистое, 1050—1100 °С)
Fе2O3 + Fе = ЗFеО (900 °С)
3Fе2O3 + СО = 2Fe3O4 + СO2 (400—600 °С)
Получение в лаборатории – термическое разложение солей железа (III) на воздухе:
Fе2(SO4)3 = Fе2O3 + 3SO3 (500-700 °С)
4{Fе(NO3)3 9 Н2O} = 2Fе2O3 + 12NO2+ 3O2 + 36Н2O (600-700 °С)
В природе – оксидные руды железа гематит Fе2O3 и лимонит Fе2O3 nН2O
Гидроксид железа (II) Fе(ОН)2. Основный гидроксид. Белый (иногда с зеленоватым оттенком), связи Fе – ОН преимущественно ковалентные. Термически неустойчив. Легко окисляется на воздухе, особенно во влажном состоянии (темнеет). Нерастворим в воде. Реагирует с разбавленными кислотами, концентрированными щелочами. Типичный восстановитель. Промежуточный продукт при ржавлении железа. Применяется в изготовлении активной массы железоникелевых аккумуляторов.
Уравнения важнейших реакций:
Fе(OН)2 = FеО + Н2O (150-200 °С, в атм.N2)
Fе(ОН)2 + 2НС1 (разб.) =FеС12 + 2Н2O
Fе(ОН)2 + 2NаОН (> 50%) = Nа2[Fе(ОН)4] ↓(сине-зеленый) (кипячение)
4Fе(ОН)2 (суспензия) + O2 (воздух) →4FеО(ОН)↓ + 2Н2O (t)
2Fе(ОН)2 (суспензия) +Н2O2 (разб.) = 2FеО(ОН)↓ + 2Н2O
Fе(ОН)2 + КNO3 (конц.) = FеО(ОН)↓ + NO↑+ КОН (60 °С)
Получение: осаждение из раствора щелочами или гидратом аммиака в инертной атмосфере:
Fе2+ + 2OH (разб.) = Fе(ОН)2↓
Fе2+ + 2(NH3Н2O) = Fе(ОН)2↓+ 2NH4
2.2.4. Химические свойства переходных металлов (меди, цинка, хрома, железа).
Химические свойства меди
Медь (Cu) относится к d-элементам и расположена в IB группе периодической таблицы Д.И.Менделеева. Электронная конфигурация атома меди в основном состоянии записывается виде 1s22s22p63s23p63d104s1 вместо предполагаемой формулы 1s22s22p63s23p63d94s2. Другими словами, в случае атома меди наблюдается так называемый «проскок электрона» с 4s-подуровня на 3d-подуровень. Для меди, кроме нуля, возможны степени окисления +1 и +2. Степень окисления +1 склонна к диспропорционированию и стабильна лишь в нерастворимых соединениях типа CuI, CuCl, Cu2O и т. д., а также в комплексных соединениях, например, [Cu(NH3)2]Cl и [Cu(NH3)2]OH. Соединения меди в степени окисления +1 не имеют конкретной окраски. Так, оксид меди (I) в зависимости от размеров кристаллов может быть темно-красный (крупные кристаллы) и желтый (мелкие кристаллы), CuCl и CuI — белыe, а Cu2S — черно-синий. Более химически устойчивой является степень окисления меди, равная +2. Соли, содержащие медь в данной степени окисления, имеют синюю и сине-зеленую окраску.
Медь является очень мягким, ковким и пластичным металлом с высокой электро- и теплопроводностью. Окраска металлической меди красно-розовая. Медь находится в ряду активности металлов правее водорода, т.е. относится к малоактивным металлам.
Взаимодействие с простыми веществами
с кислородом
В обычных условиях медь с кислородом не взаимодействует. Для протекания реакции между ними требуется нагрев. В зависимости от избытка или недостатка кислорода и температурных условий может образовать оксид меди (II) и оксид меди (I):
с серой
Реакция серы с медью в зависимости от условий проведения может приводить к образованию как сульфида меди (I), так и сульфида меди (II). При нагревании смеси порошкообразных Cu и S до температуры 300-400оС образуется сульфид меди (I):
При избытке серы и проведении реакции при температуре более 400оС образуется сульфид меди (II). Однако, более простым способом получения сульфида меди (II) из простых веществ является взаимодействие меди с серой, растворенной в сероуглероде:
Данная реакция протекает при комнатной температуре.
с галогенами
С фтором, хлором и бромом медь реагирует, образуя галогениды с общей формулой CuHal2, где Hal – F, Cl или Br:
Cu + Br2 = CuBr2
В случае с йодом — самым слабым окислителем среди галогенов — образуется иодид меди (I):
С водородом, азотом, углеродом и кремнием медь не взаимодействует.
Взаимодействие со сложными веществами
с кислотами-неокислителями
Кислотами-неокислителями являются практически все кислоты, кроме концентрированной серной кислоты и азотной кислоты любой концентрации. Поскольку кислоты-неокислители в состоянии окислить только металлы, находящиеся в ряду активности до водорода; это означает, что медь с такими кислотами не реагирует.
с кислотами-окислителями
— концентрированной серной кислотой
С концентрированной серной кислотой медь реагирует как при нагревании, так и при комнатной температуре. При нагревании реакция протекает в соответствии с уравнением:
Поскольку медь не является сильным восстановителем, сера восстанавливается в данной реакции только до степени окисления +4 (в SO2).
— с разбавленной азотной кислотой
Реакция меди с разбавленной HNO3 приводит к образованию нитрата меди (II) и монооксида азота:
3Cu + 8HNO3(разб.) = 3Cu(NO3)2 + 2NO↑ + 4H2O
— с концентрированной азотной кислотой
Концентрированная HNO3 легко реагирует с медью при обычных условиях. Отличие реакции меди с концентрированной азотной кислотой от взаимодействия с разбавленной азотной кислотой заключается в продукте восстановления азота. В случае концентрированной HNO3 азот восстанавливается в меньшей степени: вместо оксида азота (II) образуется оксид азота (IV), что связано с большей конкуренцией между молекулами азотной кислоты в концентрированной кислоте за электроны восстановителя (Cu):
Cu + 4HNO3 = Cu(NO3)2 + 2NO2 + 2H2O
с оксидами неметаллов
Медь реагирует с некоторыми оксидами неметаллов. Например, с такими оксидами, как NO2, NO, N2O медь окисляется до оксида меди (II), а азот восстанавливается до степени окисления 0, т.е. образуется простое вещество N2:
В случае диоксида серы, вместо простого вещества (серы) образуется сульфид меди(I). Связано это с тем, что медь с серой, в отличие от азота, реагирует:
с оксидами металлов
При спекании металлической меди с оксидом меди (II) при температуре 1000-2000 оС может быть получен оксид меди (I):
Также металлическая медь может восстановить при прокаливании оксид железа (III) до оксида железа (II):
с солями металлов
Медь вытесняет менее активные металлы (правее нее в ряду активности) из растворов их солей:
Cu + 2AgNO3 = Cu(NO3)2 + 2Ag↓
Также имеет место интересная реакция, в которой медь растворяется в соли более активного металла – железа в степени окисления +3. Однако противоречий нет, т.к. медь не вытесняет железо из его соли, а лишь восстанавливает его со степени окисления +3 до степени окисления +2:
Fe2(SO4)3 + Cu = CuSO4 + 2FeSO4
Cu + 2FeCl3 = CuCl2 + 2FeCl2
Последняя реакция используется при производстве микросхем на стадии травления медных плат.
Коррозия меди
Медь со временем подвергается коррозии при контакте с влагой, углекислым газом и кислородом воздуха:
2Cu + H2O + СО2 + О2 = (CuOН)2СO3
В результате протекания данной реакции медные изделия покрываются рыхлым сине-зеленым налетом гидроксокарбоната меди (II).
Химические свойства цинка
Цинк Zn находится в IIБ группе IV-го периода. Электронная конфигурация валентных орбиталей атомов химического элемента в основном состоянии 3d104s2. Для цинка возможна только одна единственная степень окисления, равная +2. Оксид цинка ZnO и гидроксид цинка Zn(ОН)2 обладают ярко выраженными амфотерными свойствами.
Цинк при хранении на воздухе тускнеет, покрываясь тонким слоем оксида ZnO. Особенно легко окисление протекает при высокой влажности и в присутствии углекислого газа вследствие протекания реакции:
2Zn + H2O + O2 + CO2 → Zn2(OH)2CO3
Пар цинка горит на воздухе, а тонкая полоска цинка после накаливания в пламени горелки сгорает в нем зеленоватым пламенем:
При нагревании металлический цинк также взаимодействует с галогенами, серой, фосфором:
С водородом, азотом, углеродом, кремнием и бором цинк непосредственно не реагирует.
Цинк реагирует с кислотами-неокислителями с выделением водорода:
Zn + H2SO4 (20%) → ZnSO4 + H2↑
Zn + 2HCl → ZnCl2 + H2↑
Особенно легко растворяется в кислотах технический цинк, поскольку содержит в себе примеси других менее активных металлов, в частности, кадмия и меди. Высокочистый цинк по определенным причинам устойчив к воздействию кислот. Для того чтобы ускорить реакцию, образец цинка высокой степени чистоты приводят в соприкосновение с медью или добавляют в раствор кислоты немного соли меди.
При температуре 800-900oC (красное каление) металлический цинк, находясь в расплавленном состоянии, взаимодействует с перегретым водяным паром, выделяя из него водород:
Zn + H2O = ZnO + H2↑
Цинк реагирует также и с кислотами-окислителями: серной концентрированной и азотной.
Цинк как активный металл может образовывать с концентрированной серной кислотой сернистый газ, элементарную серу и даже сероводород.
Zn + 2H2SO4 = ZnSO4 + SO2↑ + 2H2O
Состав продуктов восстановления азотной кислоты определяется концентрацией раствора:
Zn + 4HNO3(конц.) = Zn(NO3)2 + 2NO2↑ + 2H2O
3Zn + 8HNO3(40%) = 3Zn(NO3)2 + 2NO↑ + 4H2O
4Zn +10HNO3(20%) = 4Zn(NO3)2 + N2O↑ + 5H2O
5Zn + 12HNO3(6%) = 5Zn(NO3)2 + N2↑ + 6H2O
4Zn + 10HNO3(0,5%) = 4Zn(NO3)2 + NH4NO3 + 3H2O
На направление протекания процесса влияют также температура, количество кислоты, чистота металла, время проведения реакции.
Цинк реагирует с растворами щелочей, при этом образуются тетрагидроксоцинкаты и водород:
Zn + 2NaOH + 2H2O = Na2[Zn(OH)4] + H2↑
Zn + Ba(OH)2 + 2H2O = Ba[Zn(OH)4] + H2↑
С безводными щелочами цинк при сплавлении образует цинкаты и водород:
В сильнощелочной среде цинк является крайне сильным восстановителем, способным восстанавливать азот в нитратах и нитритах до аммиака:
4Zn + NaNO3 + 7NaOH + 6H2O → 4Na2[Zn(OH)4] + NH3↑
Благодаря комплексообразованию цинк медленно растворяется в растворе аммиака, восстанавливая водород:
Zn + 4NH3·H2O → [Zn(NH3)4](OH)2 + H2↑ + 2H2O
Также цинк восстанавливает менее активные металлы (правее него в ряду активности) из водных растворов их солей:
Zn + CuCl2 = Cu + ZnCl2
Zn + FeSO4 = Fe + ZnSO4
Химические свойства хрома
Хром — элемент VIB группы таблицы Менделеева. Электронная конфигурация атома хрома записывается как 1s 22s 22p 63s 23p63d54s1, т.е. в случае хрома, также как и в случае атома меди, наблюдается так называемый «проскок электрона»
Наиболее часто проявляемыми степенями окисления хрома являются значения +2, +3 и +6. Их следует запомнить, и в рамках программы ЕГЭ по химии можно считать, что других степеней окисления хром не имеет.
При обычных условиях хром устойчив к коррозии как на воздухе, так и в воде.
Взаимодействие с неметаллами
с кислородом
Раскаленный до температуры более 600 oС порошкообразный металлический хром сгорает в чистом кислороде образуя окcид хрома (III):
4Cr + 3O2 = ot=> 2Cr2O3
с галогенами
С хлором и фтором хром реагирует при более низких температурах, чем с кислородом (250 и 300 oC соответственно):
2Cr + 3F2 = ot=> 2CrF3
2Cr + 3Cl2 = ot=> 2CrCl3
С бромом же хром реагирует при температуре красного каления (850-900 oC):
2Cr + 3Br2 = ot=> 2CrBr3
с азотом
С азотом металлический хром взаимодействует при температурах более 1000 oС:
2Cr + N2 =ot=> 2CrN
с серой
С серой хром может образовывать как сульфид хрома (II) так и сульфид хрома (III), что зависит от пропорций серы и хрома:
Cr + S =ot=> CrS
2Cr + 3S =ot=> Cr2S3
С водородом хром не реагирует.
Взаимодействие со сложными веществами
Взаимодействие с водой
Хром относится к металлам средней активности (расположен в ряду активности металлов между алюминием и водородом). Это означает, что реакция протекает между раскаленным до красного каления хромом и перегретым водяным паром:
2Cr + 3H2O =ot=> Cr2O3 + 3H2↑
Взаимодействие с кислотами
Хром при обычных условиях пассивируется концентрированными серной и азотной кислотами, однако, растворяется в них при кипячении, при этом окисляясь до степени окисления +3:
Cr + 6HNO3(конц.) =to=> Cr(NO3)3 + 3NO2↑ + 3H2O
2Cr + 6H2SO4(конц) =to=> Cr2(SO4)3 + 3SO2↑ + 6H2O
В случае разбавленной азотной кислоты основным продуктом восстановления азота является простое вещество N2:
10Cr + 36HNO3(разб) = 10Cr(NO3)3 + 3N2↑ + 18H2O
Хром расположен в ряду активности левее водорода, а это значит, что он способен выделять H2 из растворов кислот-неокислителей. В ходе таких реакций в отсутствие доступа кислорода воздуха образуются соли хрома (II):
Cr + 2HCl = CrCl2 + H2↑
Cr + H2SO4(разб.) = CrSO4 + H2↑
При проведении же реакции на открытом воздухе, двухвалентный хром мгновенно окисляется содержащимся в воздухе кислородом до степени окисления +3. При этом, например, уравнение с соляной кислотой примет вид:
4Cr + 12HCl + 3O2 = 4CrCl3 + 6H2O
При сплавлении металлического хрома с сильными окислителями в присутствии щелочей хром окисляется до степени окисления +6, образуя хроматы:
Химические свойства железа
Железо Fe, химический элемент, находящийся в VIIIB группе и имеющий порядковый номер 26 в таблице Менделеева. Распределение электронов в атоме железа следующее 26Fe1s22s22p63s23p63d64s2, то есть железо относится к d-элементам, поскольку заполняемым в его случае является d-подуровень. Для него наиболее характерны две степени окисления +2 и +3. У оксида FeO и гидроксида Fe(OH)2 преобладают основные свойства, у оксида Fe2O3 и гидроксида Fe(OH)3 заметно выражены амфотерные. Так оксид и гидроксид железа (lll) в некоторой степени растворяются при кипячении в концентрированных растворах щелочей, а также реагируют с безводными щелочами при сплавлении. Следует отметить что степень окисления железа +2 весьма неустойчива, и легко переходит в степень окисления +3. Также известны соединения железа в редкой степени окисления +6 – ферраты, соли не существующей «железной кислоты» H2FeO4. Указанные соединения относительно устойчивы лишь в твердом состоянии, либо в сильнощелочных растворах. При недостаточной щелочности среды ферраты довольно быстро окисляют даже воду, выделяя из нее кислород.
Взаимодействие с простыми веществами
С кислородом
При сгорании в чистом кислороде железо образует, так называемую, железную окалину, имеющую формулу Fe3O4 и фактически представляющую собой смешанный оксид, состав которого условно можно представить формулой FeO∙Fe2O3. Реакция горения железа имеет вид:
3Fe + 2O2 =to=> Fe3O4
С серой
При нагревании железо реагирует с серой, образуя сульфид двухвалентого железа:
Fe + S =to=> FeS
Либо же при избытке серы дисульфид железа:
Fe + 2S =to=> FeS2
С галогенами
Всеми галогенами кроме йода металлическое железо окисляется до степени окисления +3, образуя галогениды железа (lll):
2Fe + 3F2 =to=> 2FeF3 – фторид железа (lll)
2Fe + 3Cl2 =to=> 2FeCl3 – хлорид железа (lll)
2Fe + 3Br2 =to=> 2FeBr3 – бромид железа (lll)
Йод же, как наиболее слабый окислитель среди галогенов, окисляет железо лишь до степени окисления +2:
Fe + I2 =to=> FeI2 – йодид железа (ll)
Следует отметить, что соединения трехвалентного железа легко окисляют иодид-ионы в водном растворе до свободного йода I2 при этом восстанавливаясь до степени окисления +2. Примеры, подобных реакций из банка ФИПИ:
2FeCl3 + 2KI = 2FeCl2 + I2 + 2KCl
2Fe(OH)3 + 6HI = 2FeI2 + I2 + 6H2O
Fe2O3 + 6HI = 2FeI2 + I2 + 3H2O
С водородом
Железо с водородом не реагирует (с водородом из металлов реагируют только щелочные металлы и щелочноземельные):
Взаимодействие со сложными веществами
Взаимодействие с кислотами
С кислотами-неокислителями
Так как железо расположено в ряду активности левее водорода, это значит, что оно способно вытеснять водород из кислот-неокислителей (почти все кислоты кроме H2SO4 (конц.) и HNO3 любой концентрации):
Fe + H2SO4 (разб.) = FeSO4 + H2↑
Fe + 2HCl = FeCl2 + H2↑
Нужно обратить внимание на такую уловку в заданиях ЕГЭ, как вопрос на тему того до какой степени окисления окислится железо при действии на него разбавленной и концентрированной соляной кислоты. Правильный ответ – до +2 в обоих случаях.
Ловушка здесь заключается в интуитивном ожидании более глубокого окисления железа (до с.о. +3) в случае его взаимодействия с концентрированной соляной кислотой.
Взаимодействие с кислотами-окислителями
С концентрированными серной и азотной кислотами в обычных условиях железо не реагирует по причине пассивации. Однако, реагирует с ними при кипячении:
2Fe + 6H2SO4 = ot=> Fe2(SO4)3 + 3SO2 + 6H2O
Fe + 6HNO3 =ot=> Fe(NO3)3 + 3NO2 + 3H2O
Обратите внимание на то, что разбавленная серная кислота окисляет железо до степени окисления +2, а концентрированная до +3.
Коррозия (ржавление) железа
На влажном воздухе железо весьма быстро подвергается ржавлению:
4Fe + 6H2O + 3O2 = 4Fe(OH)3
С водой в отсутствие кислорода железо не реагирует ни в обычных условиях, ни при кипячении. Реакция с водой протекает лишь при температуре выше температуры красного каления (>800 оС). т.е.:
Железо
Физические свойства
Железо –
металл серебристо-белого цвета, с высокой химической активностью и высокой
ковкостью. Обладает высокой тепло- и электропроводностью.
Нахождение в природе
Железо довольно
распространено в земной коре (порядка 4% массы земной коры). По
распространенности на Земле железо занимает 4-ое место среди всех элементов и
2-ое место среди металлов. Содержание в земной коре — около 8%.
В
природе железо в основном встречается в виде соединений:
Красный железняк Fe2O3 (гематит).
Магнитный железняк Fe3O4 или
FeO·Fe2O3 (магнетит).
В природе также широко распространены
сульфиды железа, например, пирит FeS2.
Способы получения
Железо в
промышленности получают из железной руды, гематита Fe2O3 или
магнетита (Fe3O4или FeO·Fe2O3).
1. Один из
основных способов производства железа – доменный
процесс. Доменный процесс основан на восстановлении железа из оксида
углеродом в доменной печи.
В
печь загружают руду, кокс и флюсы.
Шихта – смесь
исходных материалов, а в некоторых случаях и топлива в определённой пропорции,
которую обрабатывают в печи.
Каменноугольный
кокс – это
твёрдый пористый продукт серого цвета, получаемый путем коксования каменного
угля при температурах 950—1100 °С без доступа воздуха. Содержит 96—98 %
углерода.
Флюсы – это
неорганические вещества, которые добавляют к руде при выплавке металлов, чтобы
снизить температуру плавления и легче отделить металл от пустой породы.
Шлак – расплав
(а после затвердевания – стекловидная
масса), покрывающий поверхность жидкого металла. Шлак состоит из всплывших
продуктов пустой породы с флюсами и предохраняет металл от вредного воздействия
газовой среды печи, удаляет примеси.
В
печи кокс окисляется до оксида углерода (II):
2C + O2
→ 2CO
Затем
нагретый угарный газ восстанавливает оксид железа (III):
3CO + Fe2O3
→ 2CO2 +
2Fe
Процесс
получения железа – многоэтапный и зависит от температуры.
Наверху,
где температура обычно находится в диапазоне между 200 °C и 700 °C, протекает следующая
реакция:
3Fe2O3
+ CO → 2Fe3O4
+ CO2
Ниже в печи, при температурах
приблизительно 850 °C, протекает восстановление смешанного оксида железа (II,
III) до оксида железа (II):
Fe3O4
+ CO → 3FeO
+ CO2
Встречные потоки газов разогревают
шихту, и происходит разложение известняка:
CaCO3
→ CaO +
CO2
Оксид железа (II) опускается в область с
более высоких температур (до 1200oC), где протекает следующая реакция:
FeO
+ CO → Fe + CO2
Углекислый
газ поднимается вверх и реагирует с коксом, образуя угарный газ:
CO2
+ C →
2CO
2. Также
железо получают прямым восстановлением из оксида водородом:
Fe2O3
+ 3H2
→ 2Fe +
3H2O
При этом получается более чистое железо,
т.к. получаемое железо не загрязнено серой и фосфором, которые являются
примесями в каменном угле.
3. Еще
один способ получения железа в промышленности – электролиз растворов солей
железа.
Качественные реакции
Качественные реакции на ионы
железа +2.
– взаимодействие солей
железа (II) с щелочами. При этом образуется серо-зеленый
студенистый осадок гидроксида железа (II).
Например,
хлорид железа (II) реагирует с гидроксидом натрия:
3NaOH +
FeCl2
→ Fe(OH)2
+ 3NaCl
Гидроксид
железа (II) на воздухе буреет, так как окисляется до гидроксида железа (III):
4Fe(OH)2
+ O2 +
2H2O → 4Fe(OH)3
–
ионы железа +2 окрашивают раствор в светлый
желто-зеленый цвет.
– взаимодействие с красной
кровяной солью K3[Fe(CN)6] –
также качественная реакция на ионы железа +2. При этом образуется синий
осадок «турнбулева синь».
Качественные реакции на ионы
железа +3
– взаимодействие солей
железа (III) с щелочами. При этом образуется бурый
осадок гидроксида железа (III).
Например,
хлорид железа (III) реагирует с гидроксидом натрия:
3NaOH +
FeCl3
→ Fe(OH)3
+ 3NaCl
–
ионы железа +3 окрашивают раствор в светлый
желто-оранжевый цвет.
–
взаимодействие с желтой кровяной солью K4[Fe(CN)6] ионы
железа +3. При этом образуется синий осадок «берлинская
лазурь».
Видеоопыт взаимодействия
раствора хлорида железа (III) с раствором гексацианоферрата (II) калия
(качественная реакция на ионы железа (III)) можно посмотреть здесь.
В последнее время получены
данные, которые свидетельствуют, что молекулы берлинской лазури идентичны по
строению молекулам турнбулевой сини. Состав молекул обоих этих веществ можно
выразить формулой Fe4[Fe2(CN)6]3.
–
при взаимодействии солей железа (III) с роданидами раствор
окрашивается в кроваво-красный цвет.
Например,
хлорид железа (III) взаимодействует с роданидом натрия:
FeCl3
+ 3NaCN → Fe(CN)3
+ 3NaCl
Химические свойства
1. При обычных
условиях железо малоактивно,
но при нагревании, в особенности в мелкораздробленном состоянии, оно становится
активным и реагирует почти со всеми неметаллами.
1.1. Железо
реагирует с галогенами с
образованием галогенидов. При этом активные неметаллы
(фтор, хлор и бром) окисляют железо до степени окисления +3:
2Fe + 3Cl2
→ 2FeCl3
Менее
активный йод окисляет железо до степени окисления +2:
Fe + I2
→ FeI2
1.2. Железо
реагирует с серой с
образованием сульфида железа (II):
Fe + S
→ FeS
1.3. Железо реагирует с фосфором.
При этом образуется бинарное соединения – фосфид железа:
Fe + P
→ FeP
2Fe + P
→ Fe2P
3Fe + P
→ Fe3P
1.4. С
азотом железо реагирует при нагревании с
образованием нитрида:
6Fe + N2 →
2Fe3N
1.5. Железо
реагирует с углеродом и кремнием с
образованием карбида и силицида:
3Fe + C
→ Fe3C
1.6. При
взаимодействии с кислородом железо
образует окалину – двойной оксид железа (II, III):
6Fe + 4O2
→ 2Fe3O4
При
пропускании кислорода через расплавленное железо возможно образование оксида
железа (II):
2Fe + O2
→ 2FeO
2. Железо
взаимодействует со сложными веществами.
2.1. При
обычных условиях железо с водой практически
не реагирует. Раскаленное железо может вступать в реакцию при температуре
700-900оС
с водяным паром:
3Fe0 +
4H2+O
→ Fe+33O4 +
4H20
В
воде в присутствии кислорода или во влажном воздухе железо медленно окисляется
(корродирует):
4Fe + 3O2
+ 6H2O
→ 4Fe(OH)3
2.2. Железо
взаимодействуют с минеральными кислотами (с
соляной, фосфорной и разбавленной серной кислотой). При этом образуются соль
железа со степенью окисления +2 и водород.
Например,
железо бурно реагирует с соляной кислотой:
Fe + 2HCl
→ FeCl2
+ H2↑
2.3. При
обычных условиях железо не реагирует с концентрированной
серной кислотой из-за пассивации –
образования плотной оксидной пленки. При нагревании реакция идет,
образуются оксид серы (IV), сульфат железа (III) и вода:
2Fe + 6H2SO4(конц.)
→ Fe2(SO4)3 +
3SO2 + 6H2O
2.4. Железо
не реагирует при обычных условиях с концентрированной
азотной кислотой также из-за пассивации. При
нагревании реакция идет с образованием нитрата железа (III), оксида азота (IV)
и воды:
Fe + 6HNO3(конц.)
→ Fe(NO3)3
+ 3NO2↑ + 3H2O
С разбавленной
азотной кислотой железо реагирует с образованием
оксида азота (II):
Fe + 4HNO3(разб.гор.)
→ Fe(NO3)3 + NO + 2H2O
При
взаимодействии железа с очень разбавленной азотной
кислотой образуется нитрат аммония:
8Fe + 30HNO3(оч. разб.)
→ 8Fe(NO3)3 + 3NH4NO3
+ 9H2O
2.5. Железо
может реагировать с щелочными растворами или
расплавами сильных окислителей. При этом железо окисляет
до степени окисления +6, образуя соль (феррат).
Например,
при взаимодействии железа с расплавом нитрата калия в присутствии гидроксида
калия железо окисляется до феррата калия, а азот восстанавливается либо до
нитрита калия, либо до аммиака:
Fe + 2KOH
+ 3KNO3 → 3KNO2
+ K2FeO4 + H2O
2.6. Железо
восстанавливает менее активные металлы из оксидов
и солей.
Например,
железо вытесняет медь из сульфата меди (II). Реакция
экзотермическая:
Fe + CuSO4
→ FeSO4
+ Cu
Еще пример:
простое вещество железо восстанавливает железо до степени окисления
+2 при взаимодействии с соединениями железа +3:
2Fe(NO3)3
+ Fe → 3Fe(NO3)2
2FeCl3
+ Fe → 3FeCl2
Fe2(SO4)3
+ Fe → 3FeSO4
Оксид железа (II)
Оксид
железа (II) – это твердое, нерастворимое в воде вещество черного цвета.
Способы получения
Оксид железа (II) можно
получить различными методами:
1. Частичным
восстановлением оксида железа (III).
Например, частичным
восстановлением оксида железа (III) водородом:
Fe2O3
+ 3H2
→ 2FeO + 3H2O
Или
частичным восстановлением оксида железа (III) угарным газом:
Fe2O3
+ CO → 2FeO + CO2
Еще
один пример: восстановление оксида железа (III)
железом:
Fe2O3
+ Fe → 3FeO
2. Разложение гидроксида
железа (II) при нагревании:
Fe(OH)2
→ FeO + H2O
Химические свойства
Оксид железа (II) — типичный основный
оксид.
1. При
взаимодействии оксида железа (II) с кислотными
оксидами образуются соли.
Например,
оксид железа (II) взаимодействует с оксидом серы (VI):
FeO + SO3
→ FeSO4
2. Оксид железа
(II) взаимодействует с растворимыми
кислотами. При этом также образуются соответствующие
соли.
Например, оксид
железа (II) взаимодействует с соляной кислотой:
FeO + 2HCl
→ FeCl2 + H2O
3. Оксид
железа (II) не взаимодействует с водой.
4. Оксид железа
(II) малоустойчив, и легко окисляется до соединений железа (III).
Например,
при взаимодействии с концентрированной азотной кислотой образуются
нитрат железа (III), оксид азота (IV) и вода:
FeO + 4HNO3(конц.) →
NO2 + Fe(NO3)3
+ 2H2O
При взаимодействии с разбавленной
азотной кислотой образуется оксид азота (II). Реакция идет при нагревании:
3FeO + 10HNO3(разб.)
→ 3Fe(NO3)3
+ NO + 5H2O
5. Оксид железа
(II) проявляет слабые окислительные свойства.
Например,
оксид железа (II) реагирует с угарным газом при нагревании:
FeO
+ CO → Fe + CO2
Оксид
железа (III)
Оксид
железа (III) – это твердое, нерастворимое в воде вещество
красно-коричневого цвет
Способы получения
Оксид железа (III) можно
получить различными методами:
1. Окисление оксида
железа (II) кислородом.
4FeO
+ 3O2
→ 2Fe2O3
2. Разложение гидроксида
железа (III) при нагревании:
2Fe(OH)3
→ Fe2O3 +
3H2O
Химические свойства
Оксид железа (III) – амфотерный.
1. При
взаимодействии оксида железа (III) с кислотными
оксидами и кислотами образуются соли.
Например,
оксид железа (III) взаимодействует с азотной кислотой:
Fe2O3
+ 6HNO3 →
2Fe(NO3)3
+ 3H2O
2. Оксид железа
(III) взаимодействует с щелочами и основными
оксидами. Реакция протекает в расплаве, при этом
образуется соответствующая соль (феррит).
Например,
оксид железа (III) взаимодействует с гидроксидом натрия:
Fe2O3
+ 2NaOH → 2NaFeO2
+ H2O
3. Оксид
железа (III) не взаимодействует с водой.
4. Оксид железа
(III) окисляется сильными окислителями до соединений железа (VI).
Например, хлорат
калия в щелочной среде окисляет оксид железа (III) до феррата:
Fe2O3
+ KClO3 + 4KOH → 2K2FeO4
+ KCl + 2H2O
Нитраты и нитриты в щелочной среде также
окисляют оксид железа (III):
Fe2O3
+ 3KNO3 + 4KOH → 2K2FeO4
+ 3KNO2 + 2H2O
5. Оксид железа
(III) проявляет окислительные свойства.
Например,
оксид железа (III) реагирует с угарным газом при нагревании.
При этом возможно восстановление как до чистого железа, так и до оксида железа
(II):
Fe2O3
+ 3СO → 2Fe + 3CO2
Также
оксид железа (III) восстанавливается водородом:
Fe2O3
+ 3Н2 → 2Fe
+ 3H2O
Железом можно
восстановить оксид железа только до оксида железа (II):
Fe2O3
+ Fe → 3FeO
Оксид железа (III) реагирует
с более активными металлами.
Например,
с алюминием (алюмотермия):
Fe2O3
+ 2Al → 2Fe + Al2O3
Оксид
железа (III) реагирует также с некоторыми другими сильными
восстановителями.
Например,
с гидридом натрия:
Fe2O3
+ 3NaH → 3NaOH + 2Fe
6. Оксид железа
(III) – твердый, нелетучий и амфотерный. А следовательно, он вытесняет
более летучие оксиды (как правило,
углекислый газ) из солей при
сплавлении.
Например,
из карбоната натрия:
Fe2O3
+ Na2CO3 → 2NaFeO2 +
CO2
Оксид железа (II, III)
Оксид железа (II, III) (железная
окалина, магнетит) – это твердое, нерастворимое в воде вещество черного цвета.
Способы получения
Оксид железа (II, III) можно
получить различными методами:
1. Горение железа
на воздухе:
3Fe + 2O2
→ Fe3O4
2. Частичное
восстановление оксида железа (III) водородом
или угарным газом:
3Fe2O3
+ Н2 → 2Fe3O4
+ H2O
3. При высокой
температуре раскаленное железо реагирует с водой, образуя двойной
оксид железа (II, III):
3Fe + 4H2O(пар) → Fe3O4
+ 4H2
Химические свойства
Свойства оксида железа (II, III)
определяются свойствами двух оксидов, из которых он состоит: основного оксида
железа (II) и амфотерного оксида
железа (III).
1. При
взаимодействии оксида железа (II, III) с кислотными
оксидами и кислотами образуются соли железа
(II) и железа (III).
Например,
оксид железа (II, III) взаимодействует с соляной кислотой. При
это образуются две соли – хлорид железа (II) и хлорид железа (III):
Fe3O4
+ 8HCl → FeCl2
+ 2FeCl3
+ 4H2O
Еще пример: оксид
железа (II, III) взаимодействует с разбавленной серной кислотой.
Fe3O4
+ 4H2SO4(разб.)
→ Fe2(SO4)3
+ FeSO4 + 4Н2О
2. Оксид железа
(II, III) взаимодействует с
сильными кислотами-окислителями (серной-концентрированной и азотной).
Например,
железная окалина окисляется концентрированной азотной кислотой:
Fe3O4
+ 10HNO3(конц.) →
NO2↑ + 3Fe(NO3)3
+ 5H2O
Разбавленной
азотной кислотой окалина окисляется при нагревании:
3Fe3O4
+ 28HNO3(разб.) →
9Fe(NO3)3 + NO + 14H2O
Также оксид железа (II, III)
окисляется концентрированной серной кислотой:
2Fe3O4
+ 10H2SO4(конц.)
→ 3Fe2(SO4)3
+ SO2 + 10H2O
Также
окалина окисляется кислородом воздуха:
4Fe3O4
+ O2(воздух)
→ 6Fe2O3
3. Оксид
железа (II, III) не взаимодействует с водой.
4. Оксид железа
(II, III) окисляется сильными окислителями до соединений железа (VI), как и
прочие оксиды железа (см. выше).
5. Железная
окалина проявляет окислительные свойства.
Например,
оксид железа (II, III) реагирует с угарным газом при
нагревании. При этом возможно восстановление как до чистого железа, так и до
оксида железа (II):
Fe3O4
+ 4CO → 3Fe + 4CO2
Также
железная окалина восстанавливается водородом:
Fe3O4
+ 4H2 → 3Fe
+ 4H2O
Оксид железа (II, III) реагирует
с более активными металлами.
Например,
с алюминием (алюмотермия):
3Fe3O4
+ 8Al → 9Fe + 4Al2O3
Оксид
железа (II, III) реагирует также с некоторыми другими сильными
восстановителями (йодидами и сульфидами)
Например,
с йодоводородом:
Fe3O4
+ 8HI → 3FeI2
+ I2
+ 4H2O
Гидроксид железа (II)
Способы получения
1. Гидроксид
железа (II) можно получить действием раствора аммиака на соли
железа (II).
Например,
хлорид железа (II) реагирует с водным раствором аммиака с
образованием гидроксида железа (II) и хлорида аммония:
FeCl2 +
2NH3 + 2H2O
→ Fe(OH)2 + 2NH4Cl
2. Гидроксид
железа (II) можно получить действием щелочи на соли
железа (II).
Например, хлорид
железа (II) реагирует с гидроксидом калия с
образованием гидроксида железа (II) и хлорида калия:
FeCl2 +
2KOH → Fe(OH)2↓
+ 2KCl
Химические свойства
1. Гидроксид
железа (II) проявляется основные свойства,
а именно реагирует с кислотами.
При этом образуются соответствующие соли.
Например,
гидроксид железа (II) взаимодействует с азотной кислотой с
образованием нитрата железа (II):
Fe(OH)2 +
2HNO3 → Fe(NO3)2 +
2H2O
Fe(OH)2
+ 2HCl → FeCl2
+ 2H2O
Fe(OH)2
+ H2SO4 → FeSO4
+ 2H2O
Fe(OH)2
+ 2HBr → FeBr2
+ 2H2O
2. Гидроксид
железа (II) взаимодействует с кислотными
оксидами сильных кислот.
Например,
гидроксид железа (II) взаимодействует с оксидом серы (VI) с
образованием сульфата железа (II):
Fe(OH)2 +
SO3 → FeSO4 +
2H2O
3. Гидроксид
железа (II) проявляет сильные восстановительные свойства,
и реагирует с окислителями. При
этом образуются соединения железа (III).
Например,
гидроксид железа (II) взаимодействует с кислородом в присутствии воды:
4Fe(OH)2
+ O2 + 2H2O
→ 4Fe(OH)3↓
Гидроксид железа (II) взаимодействует
с пероксидом водорода:
2Fe(OH)2
+ H2O2 → 2Fe(OH)3
При растворении Fe(OH)2 в азотной
или концентрированной серной кислотах образуются соли железа (III):
2Fe(OH)2
+ 4H2SO4(конц.)
→ Fe2(SO4)3
+ SO2 + 6H2O
4. Гидроксид
железа (II) разлагается при
нагревании:
Fe(OH)2
→ FeO + H2O
Гидроксид железа (III)
Способы получения
1. Гидроксид
железа (III) можно получить действием раствора аммиака на соли
железа (III).
Например,
хлорид железа (III) реагирует с водным раствором аммиака с образованием гидроксида
железа (III) и хлорида аммония:
FeCl3 +
3NH3 + 3H2O =
Fe(OH)3 + 3NH4Cl
2. Окислением
гидроксида железа (II) кислородом или пероксидом водорода:
4Fe(OH)2
+ O2 + 2H2O
→ 4Fe(OH)3↓
2Fe(OH)2
+ H2O2 → 2Fe(OH)3
3. Гидроксид
железа (III) можно получить действием щелочи на раствор
соли железа (III).
Например, хлорид
железа (III) реагирует с раствором гидроксида калия с
образованием гидроксида железа (III) и хлорида калия:
FeCl3 +
3KOH → Fe(OH)3↓
+ 3KCl
Видеоопыт получения
гидроксида железа (III) взаимодействием хлорида железа (III) и гидроксида
калия можно посмотреть здесь.
4. Также гидроксид
железа (III) образуется при взаимодействии растворимых солей железа
(III) с растворами карбонатов и сульфитов.
Карбонаты и сульфиты железа (III) необратимо
гидролизуются в водном растворе.
Например: бромид
железа (III) реагирует с карбонатом натрия. При этом
выпадает осадок гидроксида железа (III), выделяется углекислый газ и образуется
бромид натрия:
2FeBr3
+ 3Na2CO3 + 3H2O
= 2Fe(OH)3↓ + CO2↑
+ 6NaBr
Хлорид железа (III) реагирует
с сульфитом натрия с образованием гидроксида алюминия,
сернистого газа и хлорида натрия:
2FeCl3
+ 3Na2SO3 + 6H2O
= 2Fe(OH)3 + 3SO2↑
+ 6NaCl
Химические свойства
1. Гидроксид
железа (III) проявляет слабовыраженные амфотерные свойства, с
преобладанием основных. Как основание, гидроксид железа (III) реагирует с растворимыми кислотами.
Например,
гидроксид железа (III) взаимодействует с азотной кислотой с
образованием нитрата железа (III):
Fe(OH)3 +
3HNO3 → Fe(NO3)3 +
3H2O
Fe(OH)3
+ 3HCl → FeCl3
+ 3H2O
2Fe(OH)3
+ 3H2SO4 → Fe2(SO4)3
+ 6H2O
Fe(OH)3
+ 3HBr → FeBr3
+ 3H2O
2. Гидроксид железа
(III) взаимодействует с кислотными оксидами
сильных кислот.
Например,
гидроксид железа (III) взаимодействует с оксидом серы (VI) с
образованием сульфата железа (III):
2Fe(OH)3 +
3SO3 → Fe2(SO4)3 +
3H2O
3. Гидроксид
железа (III) взаимодействует с растворимыми
основаниями (щелочами). При этом в расплаве образуются соли—ферриты, а
в растворе реакция практически не идет. При
этом гидроксид железа (III) проявляет кислотные свойства.
Например,
гидроксид железа (III) взаимодействует с гидроксидом калия в
расплаве с образованием феррита калия и воды:
KOH + Fe(OH)3
→ KFeO2 + 2H2O
4. Гидроксид
железа (III) разлагается при
нагревании:
2Fe(OH)3 →
Fe2O3 +
3H2O
Видеоопыт взаимодействия
гидроксида железа (III) с соляной кислотой можно
посмотреть здесь.
Соли железа
Нитраты железа
Нитрат железа (II) при
нагревании разлагается на оксид железа (III), оксид азота
(IV) и кислород:
4Fe(NO3)2 → 2Fe2O3
+ 8NO2
+ O2
Нитрат железа (III) при
нагревании разлагается также на оксид железа (III), оксид
азота (IV) и кислород:
4Fe(NO3)3 → 2Fe2O3
+ 12NO2
+ 3O2
Гидролиз солей железа
Растворимые соли железа, образованные
кислотными остатками сильных кислот гидролизуются по катиону.
Гидролиз протекает ступенчато и обратимо, т.е. частично:
I
ступень: Fe3+ +
H2O
↔ FeOH2+ +
H+
II
ступень: FeOH2+ +
H2O ↔
Fe(OH)2+ + H+
III
ступень: Fe(OH)2+ + H2O ↔ Fe(OH)3 + H+
Однако сульфиты и карбонаты железа
(III) и их кислые соли гидролизуются необратимо, полностью,
т.е. в водном растворе не существуют, а разлагаются водой:
Fe2(SO4)3
+ 6NaHSO3 → 2Fe(OH)3
+ 6SO2 + 3Na2SO4
2FeBr3
+ 3Na2CO3 + 3H2O →
2Fe(OH)3↓ + CO2↑
+ 6NaBr
2Fe(NO3)3
+ 3Na2CO3 + 3H2O →
2Fe(OH)3↓ + 6NaNO3
+ 3CO2↑
2FeCl3
+ 3Na2CO3 + 3H2O →
2Fe(OH)3↓ + 6NaCl + 3CO2↑
Fe2(SO4)3
+ 3K2CO3 + 3H2O →
2Fe(OH)3↓ + 3CO2↑
+ 3K2SO4
При
взаимодействии соединений железа (III) с сульфидами протекает ОВР:
2FeCl3
+ 3Na2S
→ 2FeS + S + 6NaCl
Окислительные свойства железа
(III)
Соли железа (III) под
проявляют довольно сильные окислительные свойств. Так, при взаимодействии
соединений железа (III) с сульфидами протекает
окислительно-восстановительная реакция.
Например:
хлорид железа (III) взаимодействует с сульфидом натрия. При этом
образуется либо черный осадок сульфида железа (II) (в избытке
сульфида натрия), либо хлорид железа (II) (в избытке хлорида
железа (III)), сера и хлорид натрия:
2FeCl3
+ 3Na2S → 2FeS + S + 6NaCl
2FeCl3
+ H2S → 2FeCl2
+ S + 2HCl
По
такому же принципу соли железа (III) реагируют с сероводородом:
2FeCl3
+ H2S
→ 2FeCl2
+ S + 2HCl
Соли
железа (III) также вступают в окислительно-восстановительные
реакции с йодидами.
Например,
хлорид железа (III) взаимодействует с йодидом калия. При этом
образуются хлорид железа (II), молекулярный йод и хлорид калия:
2FeCl3
+ 2KI → 2FeCl2
+ I2
+ 2KCl
Интерес представляет также реакция солей
железа (III) с металлами. Мы знаем, что более
активные металлы вытесняют из солей менее активные металлы.
Иначе говоря, металлы, которые стоят в электрохимическом
ряду левее, могут взаимодействовать с солями металлов, которые расположены в
этом ряду правее. Исходя из этого правила, соли железа
могут взаимодействовать только с металлами, которые расположены до железа. И
они взаимодействуют.
Однако, соли железа со степенью
окисления +3 в этом ряду являются небольшим исключением. Ведь для железа
характерны две степени окисления: +2 и +3. И железо со степенью окисления +3
является более сильным окислителем. Таким образом, условно говоря, железо со
степенью окисления +3 расположено в ряду активности после меди. И
соли железа (III) могут реагировать еще и с металлами, которые расположены
правее железа! Но до меди, включительно. Вот такой парадокс.
И еще один момент. Соединения железа
(III) с этими металлами реагировать будет, а вот соединения железа
(II) с ними реагировать не будет. Таким образом, металлы,
расположенные в ряду активности между железом и медью (включая медь) при
взаимодействии с солями железа (III) восстанавливают железо до степени
окисления +2. А вот металлы, расположенные до железа в ряду активности, могут
восстановить железо и до простого вещества.
Например,
хлорид железа (III) взаимодействует с медью. При этом
образуются хлорид железа (II) и хлорид меди (II):
2FeCl3
+ Cu → 2FeCl2
+ CuCl2
А вот реакция нитрата железа (III)
с цинком протекает уже по привычному механизму. И железо
восстанавливается до степени окисления 0:
2Fe(NO3)3
+ 3Zn → 2Fe + 3Zn(NO2)2
Желе́зо — элемент побочной подгруппы восьмой группы четвёртого периода периодической системы химических элементов Д. И. Менделеева с атомным номером 26. Обозначается символом Fe (лат. Ferrum). Один из самых распространённых в земной коре металлов (второе место после алюминия). Металл средней активности, восстановитель.
Основные степени окисления — +2, +3
Простое вещество железо — ковкий металл серебристо-белого цвета с высокой химической реакционной способностью: железо быстро корродирует при высоких температурах или при высокой влажности на воздухе. В чистом кислороде железо горит, а в мелкодисперсном состоянии самовозгорается и на воздухе.
Химические свойства простого вещества — железа:

Ржавление и горение в кислороде
1) На воздухе железо легко окисляется в присутствии влаги (ржавление):
4Fe + 3O
2
+ 6H
2
O → 4Fe(OH)
3
Накалённая железная проволока горит в кислороде, образуя окалину — оксид железа (II, III):
3Fe + 2O
2
→ Fe
3
O
4
3Fe+2O
2
→(Fe
II
Fe
2
III
)O
4
(160 °С)
2) При высокой температуре (700–900°C) железо реагирует с парами воды:
3Fe + 4H
2
O –
t°
→ Fe
3
O
4
+ 4H
2
3) Железо реагирует с неметаллами при нагревании:
2Fe+3Cl
2
→2FeCl
3
(200 °С)
2Fe + 3Br
2
–
t°
→ 2FeBr
3
Fe + S –
t°
→ FeS (600 °С)
Fe+2S → Fe
+2
(S
2
-1
) (700°С)
4) В ряду напряжений стоит левее водорода, реагирует с разбавленными кислотами НСl и Н
2
SO
4
, при этом образуются соли железа(II) и выделяется водород:
Fe + 2HCl → FeCl
2
+ H
2
(реакции проводятся без доступа воздуха, иначе Fe
+2
постепенно переводится кислородом в Fe
+3
)
Fe + H
2
SO
4
(разб.) → FeSO
4
+ H
2
В концентрированных кислотах–окислителях железо растворяется только при нагревании, оно сразу переходит в катион Фе
3+
:
2Fe + 6H
2
SO
4
(конц.) –
t°
→ Fe
2
(SO
4
)
3
+ 3SO
2
+ 6H
2
O
Fe + 6HNO
3
(конц.) –
t°
→ Fe(NO
3
)
3
+ 3NO
2
+ 3H
2
O
(на холоде концентрированные азотная и серная кислоты
пассивируют
железо).

Железный гвоздь, погруженный в голубоватый раствор медного купороса, постепенно покрывается налетом красной металлической меди
5) Железо вытесняет металлы, стоящие правее его в
ряду напряжений
из растворов их солей.
Fe + CuSO
4
→ FeSO
4
+ Cu
6)
Амфотерность железа проявляется только в концентрированных щелочах при кипячении:
Fе + 2NaОН
(50 %)
+ 2Н
2
O= Nа
2
[Fе(ОН)
4
]↓+ Н
2
↑
и образуется осадок тетрагидроксоферрата(II) натрия.
Техническое железо
— сплавы железа с углеродом: чугун содержит 2,06-6,67 % С,
сталь
0,02-2,06 % С, часто присутствуют другие естественные примеси (S, Р, Si) и вводимые искусственно специальные добавки (Мn, Ni, Сr), что придает сплавам железа технически полезные свойства — твердость, термическую и коррозионную стойкость, ковкость и др
.
Доменный процесс производства чугуна
Доменный процесс производства чугуна составляют следующие стадии:
а) подготовка (обжиг) сульфидных и карбонатных руд — перевод в оксидную руду:
FeS
2
→Fe
2
O
3
(O
2
,800°С, -SO
2
) FeCO
3
→Fe
2
O
3
(O
2
,500-600°С, -CO
2
)
б) сжигание кокса при горячем дутье:
С
(кокс)
+ O
2 (воздух)
→СO
2
(600—700°С) СO
2
+ С
(кокс)
⇌ 2СО (700—1000 °С)
в) восстановление оксидной руды угарным газом СО последовательно:
Fe
2
O
3
→(CO)
(Fe
II
Fe
2
III
)O
4
→(CO)
FeO
→(CO)
Fe
г) науглероживание железа (до 6,67 % С) и расплавление чугуна:
Fе
(т
)
→(
C
(
кокс)
900—1200°С)
Fе
(ж)
(чугун, t
пл
1145°С)
В чугуне всегда в виде зерен присутствуют цементит Fe
2
С и графит.
Производство стали
Передел чугуна в сталь проводится в специальных печах (конвертерных, мартеновских, электрических), отличающихся способом обогрева; температура процесса 1700-2000 °С. Продувание воздуха, обогащенного кислородом, приводит к выгоранию из чугуна избыточного углерода, а также серы, фосфора и кремния в виде оксидов. При этом оксиды либо улавливаются в виде отходящих газов (СО
2
, SО
2
), либо связываются в легко отделяемый шлак — смесь Са
3
(РO
4
)
2
и СаSiO
3
. Для получения специальных сталей в печь вводят легирующие добавки других металлов.
Получение
чистого железа в промышленности — электролиз раствора солей железа, например:
FеСl
2
→ Fе↓ + Сl
2
↑ (90°С) (электролиз)
(существуют и другие специальные методы, в том числе восстановление оксидов железа водородом).
Чистое железо применяется в производстве специальных сплавов, при изготовлении сердечников электромагнитов и трансформаторов, чугун — в производстве литья и стали, сталь — как конструкционный и инструментальный материалы, в том числе износо-, жаро- и коррозионно-стойкие.
Оксид железа(II)
F
еО
. Амфотерный оксид с большим преобладанием основных свойств. Черный, имеет ионное строение Фе
2+
O
2-
. При нагревании вначале разлагается, затем образуется вновь. Не образуется при сгорании железа на воздухе. Не реагирует с водой. Разлагается кислотами, сплавляется со щелочами. Медленно окисляется во влажном воздухе. Восстанавливается водородом, коксом. Участвует в доменном процессе выплавки чугуна. Применяется как компонент керамики и минеральных красок. Уравнения важнейших реакций:
4FеО ⇌(Fe
II
Fe
2
III
) + Fе (560—700 °С , 900—1000°С)
FеО + 2НС1
(разб.)
= FеС1
2
+ Н
2
O
ФеО + 4ННО
3 (
конц
.)
= Fе(NO
3
)
3
+NO
2
↑ + 2Н
2
O
FеО + 4NаОН =2Н
2
O +
N
а
4
F
е
O
3(красн
.)
триоксоферрат(II)
(400—500 °С)
FеО + Н
2
=Н
2
O + Фе (особо чистое) (350°С)
FеО + С
(кокс)
= Фе + СО (выше 1000 °С)
ФеО + СО = Фе + СО
2
(900°С)
4FеО + 2Н
2
O
(влага)
+ O
2
(воздух)
→4FеО(ОН) (t)
6ФеО + O
2
= 2(Fe
II
Fe
2
III
)O
4
(300—500°С)
Получение
в
лаборатории
: термическое разложение соединений железа (II) без доступа воздуха:
Fе(ОН)
2
= FеО + Н
2
O (150-200 °С)
FеСОз = FеО + СO
2
(490-550 °С)
Оксид дижелеза (III) – железа(
II
) (
Fe
II
Fe
2
III
)O
4
. Двойной оксид. Черный, имеет ионное строение Fe
2+
(Fе
3+
)
2
(
O
2-
)
4
. Термически устойчив до высоких температур. Не реагирует с водой. Разлагается кислотами. Восстанавливается водородом, раскаленным железом. Участвует в доменном процессе производства чугуна. Применяется как компонент минеральных красок (
железный сурик
), керамики, цветного цемента. Продукт специального окисления поверхности стальных изделий (
чернение, воронение
). По составу отвечает коричневой ржавчине и темной окалине на железе. Применение брутто-формулы Fe
3
O
4
не рекомендуется. Уравнения важнейших реакций:
2(Fe
II
Fe
2
III
)O
4
= 6ФеО + O
2
(выше 1538 °С)
(Fe
II
Fe
2
III
)O
4
+ 8НС1
(разб.)
= FеС1
2
+ 2FеС1
3
+ 4Н
2
O
(Fe
II
Fe
2
III
)O
4
+10НNO
3 (конц.)
=3Fе(NO
3
)
3
+ NO
2
↑+ 5Н
2
O
(Fe
II
Fe
2
III
)O
4
+ O
2 (воздух)
= 6Fе
2
O
3
(450-600°С)
(Fe
II
Fe
2
III
)O
4
+ 4Н
2
= 4Н
2
O + 3Фе (особо чистое, 1000 °С)
(Fe
II
Fe
2
III
)O
4
+ СО =ЗФеО + СО
2
(500—800°C)
(Fe
II
Fe
2
III
)O4 + Fе ⇌4FеО (900—1000 °С , 560—700 °С)
Получение:
сгорание железа (см.) на воздухе.
В природе — оксидная руда железа
магнетит.
Оксид железа(III)
F
е
2
О
3
. Амфотерный оксид с преобладанием основных свойств. Красно-коричневый, имеет ионное строение (Фе
3+
)
2
(O
2-
)
3.
Термически устойчив до высоких температур. Не образуется при сгорании железа на воздухе. Не реагирует с водой, из раствора выпадает бурый аморфный гидрат Фе
2
O
3
nН
2
О. Медленно реагирует с кислотами и щелочами. Восстанавливается монооксидом углерода, расплавленным железом. Сплавляется с оксидами других металлов и образует двойные оксиды —
шпинели
(технические продукты называются ферритами). Применяется как сырье при выплавке чугуна в доменном процессе, катализатор в производстве аммиака, компонент керамики, цветных цементов и минеральных красок, при термитной сварке стальных конструкций, как носитель звука и изображения на магнитных лентах, как полирующее средство для стали и стекла.
Уравнения важнейших реакций:
6Fе
2
O
3
= 4(Fe
II
Fe
2
III
)O
4
+O
2
(1200—1300 °С)
Fе
2
O
3
+ 6НС1
(разб.)
→2FеС1
3
+ ЗН
2
O (t) (600°С,р)
Fе
2
O
3
+ 2NaОН
(конц.)
→Н
2
O+
2
N
а
F
е
O
2
(красн.)
диоксоферрат(III)
Fе
2
О
3
+ МО=(М
II
Fе
2
II
I
)O
4
(М=Сu, Мn, Fе, Ni, Zn)
Fе
2
O
3
+ ЗН
2
=ЗН
2
O+ 2Фе (особо чистое, 1050—1100 °С)
Fе
2
O
3
+ Fе = ЗFеО (900 °С)
3Fе
2
O
3
+ СО = 2(Fe
II
Fе
2
III
)O
4
+ СO
2
(400—600 °С)
Получение
в лаборатории — термическое разложение солей железа (III) на воздухе:
Fе
2
(SO
4
)
3
= Fе
2
O
3
+ 3SO
3
(500-700 °С)
4{Fе(NO
3
)
3
9 Н
2
O} = 2Fе
a
O
3
+ 12NO
2
+ 3O
2
+ 36Н
2
O (600-700 °С)
В природе — оксидные руды железа
гематит
Fе
2
O
3
и
лимонит
Fе
2
O
3
nН
2
O
Гидроксид железа (II)
F
е(ОН)
2
.
Амфотерный гидроксид с преобладанием основных свойств. Белый (иногда с зеленоватым оттенком), связи Фе — ОН преимущественно ковалентные. Термически неустойчив. Легко окисляется на воздухе, особенно во влажном состоянии (темнеет). Нерастворим в воде. Реагирует с разбавленными кислотами, концентрированными щелочами. Типичный восстановитель. Промежуточный продукт при ржавлении железа. Применяется в изготовлении активной массы железоникелевых аккумуляторов.
Уравнения важнейших реакций:
Fе(OН)
2
= FеО + Н
2
O (150-200 °С, в атм.N
2
)
Fе(ОН)
2
+ 2НС1
(разб.)
=FеС1
2
+ 2Н
2
O
Fе(ОН)
2
+ 2NаОН
(> 50%)
= Nа
2
[Fе(ОН)
4
] ↓
(сине-зеленый)
(кипячение)
4Fе(ОН)
2 (суспензия)
+ O
2 (воздух)
→4FеО(ОН)↓ + 2Н
2
O (t)
2Fе(ОН)
2 (суспензия)
+Н
2
O
2 (разб.)
= 2FеО(ОН)↓ + 2Н
2
O
Fе(ОН)
2
+ КNO
3
(конц.)
= FеО(ОН)↓ + NO↑+ КОН (60 °С)
Получение
: осаждение из раствора щелочами или гидратом аммиака в инертной атмосфере:
Fе
2+
+ 2OH
(разб.)
=
F
е(ОН)
2
↓
Fе
2+
+ 2(NH
3
Н
2
O) =
F
е(ОН)
2
↓
+ 2NH
4
Метагидроксид железа
F
еО(ОН).
Амфотерный гидроксид с преобладанием основных свойств. Светло-коричневый, связи Фе — О и Фе — ОН преимущественно ковалентные. При нагревании разлагается без плавления. Нерастворим в воде. Осаждается из раствора в виде бурого аморфного полигидрата Фе
2
O
3
nН
2
O, который при выдерживании под разбавленным щелочным раствором или при высушивании переходит в ФеО(ОН). Реагирует с кислотами, твердыми щелочами. Слабый окислитель и восстановитель. Спекается с Фе(ОН)
2
. Промежуточный продукт при ржавлении железа. Применяется как основа желтых минеральных красок и эмалей, поглотитель отходящих газов, катализатор в органическом синтезе.
Соединение состава Fе(ОН)
3
не известно (не получено).
Уравнения важнейших реакций:
Fе
2
O
3
.
nН
2
O→(
200-250 °С, —
H
2
O
)
FеО(ОН)→(
560-700° С на воздухе , -H2O)
→Fе
2
О
3
FеО(ОН) + ЗНС1
(разб.)
=FеС1
3
+ 2Н
2
O
FeO(OH)→
Fe
2
O
3
.
nH
2
O
-коллоид
(NаОН
(конц.)
)
FеО(ОН)→
N
а
3
[
F
е(ОН)
6
]
белый
, Nа
5
[Fе(OН)
8
желтоватый
(75 °С, NаОН
( т)
)
2FеО(ОН) + Fе(ОН)
2
=( Fe
II
Fe
2
III
)O
4
+ 2Н
2
O (600—1000 °С)
2FеО(ОН) + ЗН
2
= 4Н
2
O+ 2Фе (особо чистое, 500—600 °С)
2FеО(ОН) + ЗВr
2
+ 10КОН = 2К
2
FеO
4
+ 6Н
2
O + 6КВr
Получение:
осаждение из раствора солей железа(Ш) гидрата Фе
2
О
3
nН
2
O и его частичное обезвоживание (см. выше).
В природе — оксидная руда железа
лимонит
Fе
2
O
3
nН
2
О и минерал
гётит
FеО(ОН).
Феррат калия К
2
F
еО
4
. Оксосоль. Красно-фиолетовый, разлагается при сильном нагревании. Хорошо растворим в концентрированном растворе КОН, реагирует с кипящей водой, неустойчив в кислотной среде. Сильный окислитель.
Качественная реакция
— образование красного осадка феррата бария. Применяется в синтезе ферритов — промышленно важных двойных оксидов железа (III) и других металлов.
Уравнения важнейших реакций:
4К
2
FеO
4
= 4КФеО
2
+ 3O
2
+ 2К
2
O (700 °С)
4К
2
FеO
4
+ 6Н
2
O
(гор.)
=4ФеО(ОН)↓ + 8КОН + 3O
2
↑
FеО
4
2-
+ 2OН
+
(разб.)
=4Fе
3+
+ 3O
2
↑+10Н
2
O
FеО
4
2-
+ 2(NH
3
.
Н
2
O) →2FеО(ОН)↓ + N
2
↑+ 2Н
2
O+ 4OН
—
FеО
4
2-
+ Ва
2+
= ВаFеO
4
(красн.)↓ (в конц. КОН)
Получение
: образуется при окислении соединений железа, например метагидроксида ФеО(ОН), бромной водой, а также при действии сильных окислителей (при спекании) на железо
Fе + 2КОН + 2КNO
3
=
К
2
F
е
O
4
+ 3КNO
2
+ H
2
O (420 °С)
и электролизе в растворе:
электролиз
Fе + 2КОН
(конц.)
+ 2Н
2
O→ЗН
2
↑ +
К
2
F
е
O
4
( электролиз)
(феррат калия образуется на аноде).
Качественные реакции на ионы
F
е
2+
и
F
е
3+
Обнаружение ионов Фе
2+
и Fе
3+
в водном растворе проводят с помощью реактивов К
3
[Fе(СN)
6
] и К
4
[Fе(СN)
6
] соответственно; в обоих случаях выпадает синий продукт одинакового состава и строения, КФе
III
[Fе
II
(СN)
6
]. В лаборатории этот осадок называют
берлинская лазурь
, или
турнбуллева синь
:
Fе
2+
+ К
+
+ [Fе(СN)
6
]
3-
= КFе
III
[Fе
II
(СN)
6
]↓
Fе
3+
+ К
+
+ [Fе(СN)
6
]
4-
= КFе
III
[Fе
II
(СN)
6
]↓
Химические названия исходных реактивов и продукта реакций:
К
3
Fе
III
[Fе(СN)
6
]- гексацианоферрат (III) калия
К
4
Fе
III
[Fе (СN)
6
]- гексацианоферрат (II) калия
КFе
III
[Fе
II
(СN)
6
]- гексацианоферрат (II) железа (Ш) калия
Кроме того, хорошим реактивом на ионы Фе
3+
является тиоцианат-ион НСС
—
, железо (III) соединяется с ним, и появляется ярко-красная («кровавая») окраска:
Fе
3+
+ 6NСS
—
= [Фе(НСС)
6
]
3-
Этим реактивом (например, в виде соли КНСС) можно обнаружить даже следы железа (III) в водопроводной воде, если она проходит через железные трубы, покрытые изнутри ржавчиной.